一种中药注射剂颜色定量检测方法与流程
本发明涉及中药检测技术领域,尤其涉及一种中药注射剂颜色定量检测方法。
背景技术:
中药注射剂最早产生于上世纪四十年代,由钱信忠等学者开创,现已广泛应用于临床。经过近百年的发展,高峰时最多有近800个品种,经市场和临床筛选淘汰,目前有批文可以上市的中药注射剂约142个品种,是我国医药市场独特的一个组成部分。我国从1977年版《中华人民共和国药典》(简称《药典》)起,就一直收录有中药注射剂品种。
中药注射剂能提升药效、使某些中药的疗效得到更好地发挥,在推进中药剂型发展,拓展中药的应用范围,服务广大人民健康等方面的确功不可没。从第一支中药注射剂柴胡注射液的发明至今,中药注射剂大体经历了诞生、发展、整顿、提高的阶段。从技术上来讲,业界大体上已经解决了中药注射剂的有效性问题(尽管作用机制尚不完全清除),安全性依然是业界难题。
随着中药注射剂的广泛应用,不良反应不断发现,甚至致死性不良反应也屡有报道。前几年发生的“清开灵注射液事件”、“双黄连注射液事件”、“鱼腥草注射液事件”等说明中药注射剂的安全性不容忽视,受到业界甚至公众的广泛关注。目前中药注射剂处于一个严控阶段,国家层面逐步启动了中药注射剂再评价活动,许多专家也在大力呼吁还应推动中药注射剂“再提高”。
中药注射剂按所含成分的复杂程度,可分为单体成分注射剂(如灯盏花素注射液)、有效部位注射剂(如血塞通注射液和柴胡注射液)、单方注射剂(如丹参注射液)和复方注射液(清开灵注射液);其中单方注射剂和复方注射剂具有中药总提取物的特征,既是反映中药用药、配伍理论的代表性剂型,也是问题较多较严重的剂型。已有的资料表明,中药注射剂的成分越复杂,不良反应也越复杂。对于静脉用中药注射剂而言,产生重大安全性事件的几乎都是成分复杂的注射液,如刺五加注射液、双黄连注射液、鱼腥草注射液等,几乎未见单体成分注射液的严重不良反应。
在实际工作中,也的确发现,成分越复杂的中药注射剂,颜色往往越深,而单方和复方制剂往往颜色较深,为棕红色或棕黄色等,参见表1。颜色性状是中药注射剂的重要内容,但各种质量标准的描述都较为宏观,不甚准确。即使部分制剂有针对该性状描述的检查内容,也是用标准色卡进行肉眼比对或只用仪器进行单波长检查。因此,在质量标准的实际执行中,要么覆盖面不全,要么存在很大的主观误差,导致这种性状描述几乎无实际性的执行力。
表1药注射剂质量标准中的颜色描述(部分)
因此,中药注射剂颜色性状的描述一直是中药注射剂质量检查的短板,特别是具有总提取物特征的单方、复方制剂,其颜色性状表述在质量标准里也是五花八门(见表1)。安全性问题目前已成为中药注射剂社会广为关注的问题,由于中药注射剂的颜色性状是内在物质的综合反映,重视该性状的定量描述和客观定量检查有利于提升中药注射剂的内在质量标准,监控其内在质量变化。实践证明,过期失效的中药注射剂颜色较深,变色(主要是颜色加深)也是中药注射剂重要的早期变质表现;但这种表现一直被学术界和技术界忽视。
技术实现要素:
针对现有技术的不足,本发明提供了一种中药注射剂颜色定量检测方法。本发明既可以采用全部紫外-可见区吸收光谱曲线下面积进行判断,也可采用包含部分紫外区特定波长区的吸收曲线下面积进行判断。本发明为中药注射剂颜色性状的检查提供了准确方法,特别适用于具有总提取物特征的单方、复方中药注射剂颜色性状检查。
本发明的技术方案如下:一种中药注射剂颜色定量检测方法,其特征在于,所述检测方法包括以下步骤:
步骤1)将中药注射剂制备成溶液,如果是中药注射液则直接进行步骤(2);
所述中药注射剂为具有总提取物特征的单方或复方中药注射液或注射用粉针剂。
步骤2)将中药注射剂溶液或中药注射液加入到多孔板或比色皿中;置于酶标仪或分光光度计扫描设定波长范围内的吸收光谱;为了避免饱和吸收,可以将中药注射剂溶液或中药注射液稀释1-128倍。
所述的多孔板为平底紫外透明96孔板或384孔板。
所述波长范围为200-800nm的部分或全部波长并同时至少包含部分紫外区波长,步进波长为0.5-2nm。200-800nm包括紫外光和可见光的波长范围。可以根据实验需要进行选择波长范围,如选择400-800nm的可见光、200-400nm的紫外光、或者既包含紫外光又包含可见光的200-600nm,使用包含紫外区的波长范围检测效果更好。
步骤3)计算吸收光谱曲线下面积;将曲线下面积与对照品或规定值进行比较,进行结果判断。
结果判断中,对以总提取物为特征的中药注射剂,规定波长范围内的吸收光谱曲线下面积大于对照品或规定值应判定为不符合要求。具体的规定值根据中药注射剂品种视情况确定。
结果判断中,对以单体成分或活性部位为特征的中药注射剂,活性成分主吸收区的吸收光谱曲线下面积小于对照品或规定值应判定为不符合要求;而非活性成分主吸收区的吸收光谱曲线下面积大于对照品或规定值应判定为不符合要求。规定值由根据中药注射剂品种视情况的情况确定。
《药典》中有规定采用单波长比色的方法检测中药注射液颜色的方法,由于中药注射剂所含成分复杂,往往在可见区波长区缺乏具有特征性的吸收波长,这种检测往往比较片面。《药典》也有用标准色卡肉眼比对的检查方法,但肉眼色卡比对的主观误差较大,结果准确率不高。为解决上述问题,本发明利用吸收曲线下面积的原理,定量检查中药注射剂的颜色。将中药注射剂制备成规定体积的液体,如果已是中药注射液则可以直接用于检查。检查时,将中药注射剂溶液置于紫外透明容器,如96孔板或比色皿中,在200-800nm扫描吸光度(光经为1cm时)或光密度(多孔板检测,光经不为1cm时),计算溶液200-800nm下的吸收曲线下面积。对于具有总提取物特征的单方或复方中药注射剂而言,颜色加深是反映中药注射剂稳定性下降、变质的重要指标,因此可与对照溶液或规定值进行比较,当吸收光谱曲线下面积大于一定值时可以判定该注射剂的颜色性状不符合要求。对于以单体成分或有效部位为特征的中药注射剂而言,当活性成分的主吸收区吸收光谱曲线下面积低于一定值,或非活性成分吸收区的吸收光谱曲线下面积超出一定值则可以明确判定颜色性状不符合要求。
与现有技术相比,本发明具有以下有益效果:本发明提供的方法检测出的颜色结果更加客观,更加准确,特别适用于中药注射剂颜色性状检查。由于该方法简便,也可作为中药注射剂内在质量变化的快速筛查方法。
本发明也可以用于中药液体制剂的颜色性状检查,将中药固体制剂溶解稀释后也可用本发明检查其颜色性状。鉴于中药注射剂的安全性问题较为突出,为增强本发明的针对性,故以中药注射剂为主要保护范围。
附图说明
图1去大分子和富含大分子的中药注射剂。Q、S、D、Dz分别为清开灵注射液、双黄连注射液、灯盏细辛注射液和丹参注射液。1-3分别表示经3k、10k和30k分子筛处理后获得的去大分子注射液;4为中药注射剂原液;5-7分别表示经3k、10k和30k分子筛处理后获得的富含大分子注射液,大分子物质得到10倍富集。
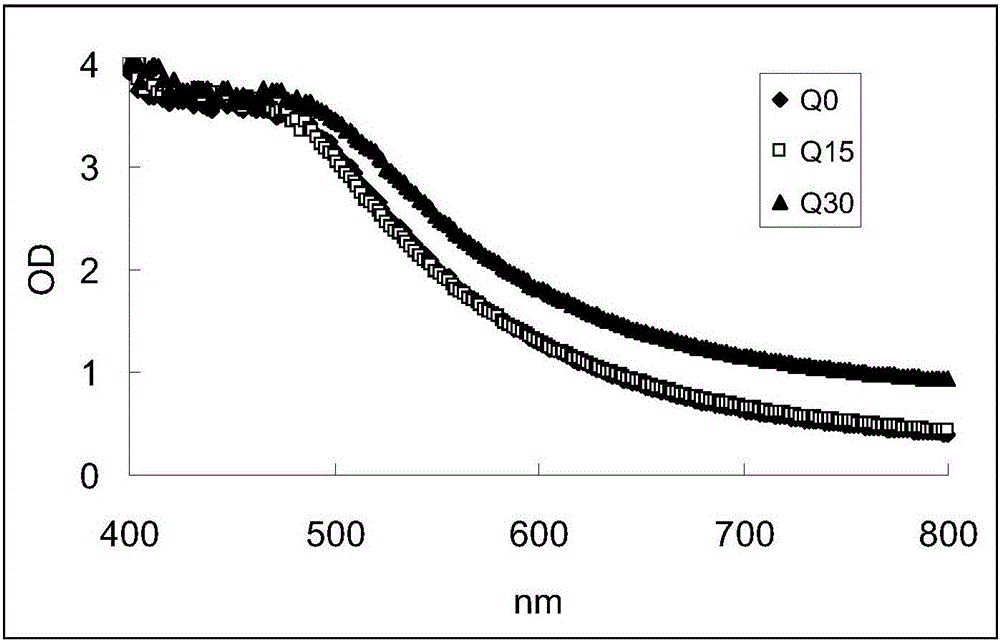
图2清开灵注射液原液未烘烤和60℃烘烤后的可见吸收光谱。Q0是烘烤前的吸收光谱,Q15和Q30分别是烘烤15、30天的吸收光谱。
图3清开灵注射液原液未烘烤(0D)和60℃烘烤15天(15D)和30天(30D)后的可见吸收光谱曲线下面积(400-800nm)。
图4双黄连注射液原液未烘烤和60℃烘烤后的可见吸收光谱。S0是烘烤前的吸收光谱,S15和S30分别是烘烤15、30天的吸收光谱。
图5双黄连注射液原液未烘烤(0D)和60℃烘烤15天(15D)和30天(30D)后的可见吸收光谱曲线下面积(400-800nm)。
图6丹参注射液原液未烘烤和60℃烘烤后的可见吸收光谱。D0是烘烤前的吸收光谱,D15和D30分别是烘烤15天和30天的吸收光谱。
图7丹参注射液原液未烘烤(0D)和60℃烘烤15天(15D)和30天(30D)后的可见吸收光谱曲线下面积(400-800nm)。
图8灯盏细辛注射液原液未烘烤和60℃烘烤后的可见吸收光谱。Dz0是烘烤前的吸收光谱,Dz15和Dz30分别是烘烤15天和30天的吸收光谱。
图9灯盏细辛注射液原液未烘烤(0D)和60℃烘烤15天(15D)和30天(30D)后的可见吸收光谱曲线下面积(400-800nm)。
图10清开灵注射液原液未烘烤和60℃烘烤后的紫外-可见吸收光谱。Q0是烘烤前的吸收光谱,Q15是烘烤15天的吸收光谱(230-800nm,稀释128倍后检测)。
图11清开灵注射液原液未烘烤(Q)和60℃烘烤15天(Q15)后的紫外-可见吸收光谱曲线下面积(230-800nm,稀释128倍后检测)。
图12双黄连注射液原液未烘烤和60℃烘烤后的紫外-可见吸收光谱。S0是烘烤前的吸收光谱,S15是烘烤15天的吸收光谱(230-800nm,稀释128倍后检测)。
图13双黄连注射液原液未烘烤(S0)和60℃烘烤15天(S15)后的紫外-可见吸收光谱曲线下面积(230-800nm,稀释128倍后检测)。
图14丹参注射液原液未烘烤和60℃烘烤后的紫外-可见吸收光谱。D0是烘烤前的吸收光谱,D15是烘烤15天的吸收光谱(230-800nm,稀释128倍后检测)。
图15丹参注射液原液未烘烤(D0)和60℃烘烤15天(D15)后的紫外-可见吸收光谱曲线下面积(230-800nm,稀释128倍后检测)。
图16灯盏细辛注射液原液未烘烤和60℃烘烤后的紫外-可见吸收光谱。Dz0是烘烤前的吸收光谱,Dz15是烘烤15天的吸收光谱(230-800nm,稀释128倍后检测)。
图17灯盏细辛注射液原液未烘烤(Dz0)和60℃烘烤15天(Dz15)后的紫外-可见吸收光谱曲线下面积(230-800nm,稀释128倍后检测)。
具体实施方式
实施例1中药注射剂的颜色与大分子有关。
清开灵注射液,规格10ml,批号1003272;双黄连注射液,规格20ml,批号20100324;丹参注射液,规格10ml,批号1005104;灯盏细辛注射液,规格10ml,批号20130533。四种注射液均从市场购得,由正规药厂生产,有国家食品药品监督管理局的批准文号,符合药典规定。
将上述四种中药注射液分别加入到3k、10k、30k无菌超滤离心管(规格50ml)中,于4℃3000rpm离心截留制备超滤液,即得各种去大分子注射液,同时也获得富含大分子注射液。富含大分子注射液为10倍富集,即取10份注射液原液制备成1份富含大分子液。为了便于比较,各注射液原野液置于1.5ml离心管中进行拍照。获得的样品保存在-40℃备用。
经不同分子筛截留后得到不同的去大分子注射液,以3k截留的去大分子注射液颜色较浅,透明度较高;其次是10k截留和30k截留获得的去大分子注射液(见图1)。对富含大分子注射液来说,虽未见沉淀但颜色似酱油不透明(见图1)。表明大分子物质是颜色的主要来源。
实施例2清开灵注射液可见吸收光谱曲线下面积与颜色性状和稳定性变化的有关,但尚不灵敏。
清开灵注射液,规格10ml,批号1003272,购自市场,由正规药厂生产,有国家食品药品监督管理局的批准文号,符合药典规定。
取清开灵注射液原液10ml,置于15ml无菌带盖试管中,于60℃恒温烘箱30天。测定正常原液和烘烤15天和30天后的400-800nm吸收光谱(步进波长为1nm),测定时取50μl加入到平底透明384孔板中,用Tecan酶标仪进行扫描。以吸收光谱的曲线下面积来反映样品颜色的总体变化,曲线下面积采用梯形法进行计算,即,将曲线下面积根据波长间隔分割成多个梯形,先计算出每个梯形的面积然后将各个梯形的面积进行累加。
在该热稳定实验中,清开灵注射液的吸收光谱发生增强(未烘烤、烘烤15天和30天的可见吸收曲线参见图2),吸收光谱曲线下面积参见图3。经吸收曲线下面积计算,清开灵注射液烘烤30天后的曲线下面积明显增加,增加率约24%,但烘烤15天的曲线下面积增加率很小(1.08%),见表2。
根据质量标准要求,清开灵注射液的颜色性状为棕黄色或棕红色。从肉眼看,不管是未经烘烤的原液还是经过60℃烘烤15天或30天的原液,该注射液的颜色还是合符规定。显然,清开灵注射液经过60℃15天或30天烘烤,内在质量应该已经发生重大变化,甚至烘烤15天也出现了明显深色沉淀,说明颜色性状已经发生了一定程度的改变,但仍为棕红色,用宏观描述的方法不能区别,而用可见吸收光谱曲线下面积则有利于反映出来,但灵敏性偏低(与实施例6对比)。
表2清开灵注射液、双黄连注射液、丹参注射液和灯盏细辛注射液热稳定性实验的可见光谱曲线下面积变化
实施例3双黄连注射液可见吸收光谱曲线下面积与颜色性状和稳定性有关,但不够灵敏。
双黄连注射液,规格20ml,批号20100324,购自市场,由正规药厂生产,有国家食品药品监督管理局的批准文号,符合药典规定。
取双黄连注射液原液10ml,置于15ml无菌带盖试管中,于60℃恒温烘箱30天。测定正常原液和烘烤15天和30天后的400-800nm吸收光谱(步进波长为1nm),测定时取50μl加入到平底透明384孔板中,用Tecan酶标仪进行扫描。以吸收光谱的曲线下面积来反映样品颜色的总体变化,曲线下面积采用梯形法进行计算,即,将曲线下面积根据波长间隔分割成多个梯形,先计算出每个梯形的面积然后将各个梯形的面积进行累加。
在该热稳定实验中,双黄连注射液的吸收光谱发生较弱程度的增强(未烘烤、烘烤15天和30天的可见吸收曲线参见图4),吸收光谱曲线下面积参见图5。经吸收光谱曲线下面积计算,双黄连注射液的曲线下面积增加,烘烤15天增加约8%,烘烤30天增加率约为20%,见表2。
根据质量标准要求,双黄连注射液的颜色性状为棕红色。从肉眼看,不管是未经烘烤的原液还是经过60℃烘烤15天或30天的原液,双黄连注射液的颜色还是保持着本色。显然,该注射液经过60℃15天和30天的烘烤,内在质量应该已经发生重大变化,且烘烤到15天可见小量深色沉淀,但液体仍为棕红色,因此用宏观描述的方法不能区别,而用吸收曲线下面积有利于反映颜色差别,但烘烤15天吸收曲线下面积只增加了约8%。虽然该法具有进步意义,但尚不够灵敏,因为在实际工作中,波动5-10%的范围常常属于正常波动范围。
实施例4丹参注射液可见吸收光谱曲线下面积与颜色性状和稳定性有关,但不够灵敏。
丹参注射液,规格10ml,批号1005104,购自市场,由正规药厂生产,有国家食品药品监督管理局的批准文号,符合药典规定。
取丹参注射液原液10ml,置于15ml无菌带盖试管中,于60℃恒温烘箱30天。测定正常原液和烘烤15天和30天后的400-800nm吸收光谱(步进波长为1nm),测定时取50μl加入到平底透明384孔板中,用Tecan酶标仪进行扫描。以吸收光谱的曲线下面积来反映样品颜色的总体变化,曲线下面积采用梯形法进行计算,即将曲线下面积根据波长间隔分割成多个梯形,先计算出每个梯形的面积然后将各个梯形的面积进行累加。
在该热稳定实验中,丹参注射液的吸收光谱发生微量程度的增加(未烘烤原液、烘烤15天和30天的可见吸收曲线参见图6),吸收光谱曲线下面积参见图7。经吸收曲线下面积计算,丹参注射液的吸收光谱曲线下面积还是增加的,但烘烤15天的增加率不到10%,烘烤30天的增加率也约为11%,见表2。
根据质量标准要求,丹参注射液的颜色性状应为棕色至棕红色。从肉眼看,不管是未经烘烤的原液还是经过60℃烘烤15天或30天的原液,该注射液的颜色还是保持着本色。显然,该注射液经过60℃15天和30天烘烤,内在质量应该已经发生变化,均可见小量深色沉淀,但液体颜色几乎无变化,仍为棕红色,因此用宏观描述的方法不能区别,而用吸收光谱曲线下面积有利于反映出颜色变深改变,但吸收曲线下面积只增加程度较小。
实施例5灯盏细辛注射液可见吸收光谱曲线下面积与颜色性状和稳定性变化有关,但不够灵敏。
灯盏细辛注射液,规格10ml,批号20130533,购自市场,由正规药厂生产,有国家食品药品监督管理局的批准文号,符合药典规定。
取灯盏细辛注射液原液10ml,置于15ml无菌带盖试管中,于60℃恒温烘箱30天。测定正常原液和烘烤15天和30天后的400-800nm吸收光谱(步进波长为1nm),测定时取50μl加入到平底透明384孔板中,用Tecan酶标仪进行扫描。以可见吸收光谱的曲线下面积来反映样品颜色的总体变化,曲线下面积采用梯形法进行计算,即将曲线下面积根据波长间隔分割成多个梯形,先计算出每个梯形的面积然后将各个梯形的面积进行累加。
在该热稳定实验中,灯盏细辛注射液的吸收光谱发生较弱程度的增强(未烘烤原液、烘烤15天和30天的可见吸收曲线参见图8),吸收光谱曲线下面积参见图9。经吸收光谱曲线下面积计算,该注射液的曲线下面积烘烤15天增加约2%,烘烤30天增加约为3%,见表2。
根据质量标准要求,灯盏细辛注射液的颜色性状为棕色。从肉眼看,不管是未经烘烤的原液还是经过60℃烘烤30天的原液,该注射液的颜色还是保持着本色。显然,该注射液经过60℃15天和30天烘烤,内在质量应该已经发生重大变化,也均可见小量深色沉淀,但颜色变化不明显,仍为棕色,用宏观描述的方法不能区别,而用吸收光谱曲线下面积有利于反映该变化,但吸收曲线下面积只增加较小。因此,该法尚不够灵敏,因为在实际工作中,波动5-10%的范围常常属于正常波动范围。
实施例6清开灵注射液紫外-可见吸收光谱曲线下面积能灵敏地反映颜色性状变化。
清开灵注射液,规格10ml,批号1003272,购自市场,由正规药厂生产,有国家食品药品监督管理局的批准文号,符合药典规定。
取清开灵注射液原液10ml,置于15ml无菌带盖试管中,于60℃恒温烘箱15天。测定正常原液和烘烤15天后的230-800nm吸收光谱(步进波长为1nm),测定时先稀释到128倍再取160μl加入到平底紫外透明96孔板中,用Tecan酶标仪进行扫描。分别计算吸收曲线紫外区(230-400nm)、可见区(400-800nm)和紫外-可见区(230-800nm)的曲线下面积。即,将曲线下面积根据波长间隔分割成多个梯形,先计算出每个梯形的面积然后将各个梯形的面积进行累加。
在该热稳定实验中,清开灵注射液的吸收光谱发生明显的增强(未烘烤和烘烤15天的紫外-可见吸收曲线参见图10),吸收光谱曲线下面积参见图11。经吸收曲线下面积计算,清开灵注射液的紫外区和可见区吸收光谱曲线下面积均增加,但紫外区吸收曲线下面积增加较可见区明显(紫外区增加82%,紫外-可见区综合增加76%),见表3。
根据质量标准要求,清开灵注射液的颜色性状为棕黄色或棕红色。从肉眼看,不管是未经烘烤的原液还是经过60℃烘烤15天的原液,该注射液的颜色还是合符规定。显然,清开灵注射液经过60℃15天烘烤,内在质量应该已经发生重大变化,甚至出现了深色沉淀,且颜色性状已经发生了一定程度的改变,但液体仍为棕红色,用宏观描述的方法不能区别,用可见吸收光谱曲线下面积不灵敏,而用紫外-可见吸收光谱曲线下面积则能够灵敏地反映出来。表明用紫外-可见吸收光谱曲线下面积来评价颜色性状变化更具有进步意义。
表3清开灵注射液、双黄连注射液、丹参注射液和灯盏细辛注射液热15天稳定性实验的可见、紫外和紫外-可见区吸收光谱曲线下面积的变化率。
实施例7双黄连注射液紫外-可见吸收光谱曲线下面积能灵敏地反映颜色性状变化。
双黄连注射液,规格20ml,批号20100324,购自市场,由正规药厂生产,有国家食品药品监督管理局的批准文号,符合药典规定。
取双黄连注射液原液10ml,置于15ml无菌带盖试管中,于60℃恒温烘箱15天。测定正常原液和烘烤15天后的230-800nm吸收光谱(步进波长为1nm),测定时先稀释到128倍取160μl加入到平底紫外透明96孔板中,用Tecan酶标仪进行扫描。以吸收光谱的曲线下面积来反映样品颜色的总体变化,分别计算紫外区(230-400nm)、可见区(400-800nm)和紫外-可见区(230-800nm)吸收光谱曲线下面积,即,将曲线下面积根据波长间隔分割成多个梯形,先计算出每个梯形的面积然后将各个梯形的面积进行累加。
在该热稳定实验中,双黄连注射液的紫外和可见吸收光谱发生一定程度的增加(未烘烤原液和烘烤15天的紫外-可见吸收曲线参见图12),吸收光谱曲线下面积参见图13。经吸收光谱曲线下面积计算,双黄连注射液紫外区和可见区吸收光谱的曲线下面积均增加,但可见区增加的值较小,而紫外区增加的值要大得多(46%),紫外-可见区综合增加43%,见表3。
根据质量标准要求,双黄连注射液的颜色性状为棕红色。从肉眼看,不管是未经烘烤的原液还是经过60℃烘烤15天的原液,双黄连注射液的颜色还是保持着本色。显然,该注射液经过60℃15天烘烤,底部出现小量深色沉淀,说明内在质量已经发生重大变化,但液体仍为棕红色,用宏观描述的方法不能区别,而用可见吸收光谱曲线下面积也不能灵敏地反映出来,但用包括紫外区吸收光谱曲线下面积能够明显地反映出来。显然,用包含紫外区的吸收曲线下面积来评价颜色性状变化则更有进步意义。
实施例8丹参注射液紫外-可见吸收光谱曲线下面积能灵敏地反映颜色性状变化。
丹参注射液,规格10ml,批号1005104,购自市场,由正规药厂生产,有国家食品药品监督管理局的批准文号,符合药典规定。
取丹参注射液原液10ml,置于15ml无菌带盖试管中,于60℃恒温烘箱15天。测定正常原液和烘烤15天后的230-800nm吸收光谱(步进波长为1nm),测定时先稀释128倍再取160μl加入到平底紫外透明96孔板中,用Tecan酶标仪进行扫描。以吸收光谱的曲线下面积来反映样品颜色的总体变化,计算紫外区(230-400nm)、可见区(400-800)和紫外-可见区(230-800nm)吸收曲线下面积,即,将曲线下面积根据波长间隔分割成多个梯形,先计算出每个梯形的面积然后将各个梯形的面积进行累加。
在该热稳定实验中,丹参注射液的吸收光谱在紫外区发生明显增加(50%),而在可见区只发生微量程度增加,紫外-可见区综合增加37%(见表3,未烘烤原液和烘烤15天的紫外-可见吸收曲线参见图14),各吸收光谱曲线下面积参见图15。
根据质量标准要求,丹参注射液的颜色性状应为棕色至棕红色。从肉眼看,不管是未经烘烤的原液还是经过60℃烘烤15天的原液,该注射液的颜色还是保持着本色。显然,该注射液经过60℃15天烘烤,底部出现小量深色沉淀,但仍为棕红色,用宏观描述的方法不能区别,用可见吸收光谱曲线下面积也不能够灵敏地反映,而用包含紫外区的吸收光谱曲线下面积则可反映出颜色性状的改变。因此,用包含紫外区吸收光谱曲线下面积来检查该中药注射剂的颜色性状具有进步意义。
实施例9灯盏细辛注射液紫外-可见吸收光谱曲线下面积能灵敏地反映颜色性状变化。
灯盏细辛注射液,规格10ml,批号20130533,购自市场,由正规药厂生产,有国家食品药品监督管理局的批准文号,符合药典规定。
取灯盏细辛注射液原液10ml,置于15ml无菌带盖试管中,于60℃恒温烘箱15天。测定正常原液和烘烤15天后的230-800nm吸收光谱(步进波长为1nm),测定时先稀释128倍再取160μl加入到平底紫外透明96孔板中,用Tecan酶标仪进行扫描。以吸收光谱的曲线下面积来反映样品颜色的总体变化,计算紫外区(230-400nm)、可见区(400-800)和紫外-可见区(230-800nm)吸收曲线下面积,即将曲线下面积根据波长间隔分割成多个梯形,先计算出每个梯形的面积然后将各个梯形的面积进行累加。
在该热稳定实验中,灯盏细辛注射液的紫外-可见吸收光谱发生一定程度的增加(未烘烤原液和烘烤15天的紫外-可见吸收曲线参见图16),吸收光谱曲线下面积参见图17。以紫外区吸收光谱曲线下面积增加明显(42%),可见区增加较小,紫外-可见区综合增加也明显(34%),见表3。
根据质量标准要求,灯盏细辛注射液的颜色性状为棕色。从肉眼看,不管是未经烘烤的原液还是经过60℃烘烤15天的原液,该注射液的颜色还是保持着本色。该注射液经过60℃15天烘烤,底部出现小量深色沉淀,但液体仍为棕色。因此,用宏观描述的方法不能区别,用可见吸收光谱曲线下面积也不好灵敏地反映,而用紫外-可见吸收光谱曲线下面积则可以明显地反映出来,表明用包含紫外区的吸收光谱曲线下面积变化检查中药注射剂的颜色性状具有进步意义。
以上四种中药注射液均是市场较常用的中药注射剂,两种为复方、两种为单方,在总提物中药注射剂中具有一定的代表性。存在或新产生的大分子物质是中药注射剂颜色的重要来源,颜色变深是中药注射剂重要的稳定性变化表现。按理,中药注射剂应该严控颜色性状变化。在上述的实施例中发现,只有清开灵注射液和双黄连注射液在60℃条件30天有肉眼可辨的颜色加深,其他两种因变色程度小,即使用可见吸收光谱曲线下面积也不好判断;但用紫外或紫外-可见吸收光谱曲线下面积则能很好地进行判断。无一例外的是,这四种中药注射剂在60℃烘烤15天时,均可见沉淀,表明内在质量发生了明显变化,但增加的可见吸收光谱曲线下面积均在10%以下,而用包含紫外区的吸收光谱曲线下面积来衡量,增加率均在30%以上。这也说明,在中药注射剂颜色性状的改变中,紫外区的改变早于可见区,包含紫外区的检测更灵敏。
对于大多仪器而言,吸光度或光密度(OD)的理论最大值为4,接近该值即表示出现饱和吸收。为了能真实地反映光谱吸收,光谱吸收中最好不要出现较多接近4的值。因此,有必要对检测对象进行适当的稀释,稀释后的溶液在吸收光谱中应存在有超过1但小于3的值,这样有利于提高检测的灵敏性。对于结果的判断,可以用绝对值或相对值。用绝对值,就是规定待测样品某个波长范围内的吸收光谱曲线下面积不得大于某个值,或不得大于对照样品的值。用相对值的话,就是规定待测样品某个波长范围内的吸收光谱曲线下面积不得高出一定的比例。
对于具有总提取物特征的中药注射剂,一般紫外区吸收光谱曲线下面积和可见区具有较好的相关性。但是,如果只采用可见区吸收光谱曲线下面积,检测的灵敏性则较差,绝对值变化小,相对值变化也小,导致结果不好判断。为了让吸收曲线下面积具有更大的应用范围,本发明用创造性的劳动发现,如果光谱区间包含紫外区则可以大大提高检测灵敏性,甚至单用紫外区的吸收光谱曲线下面积也能很大程度地提高相对值和绝对值评判的灵敏度,而用紫外-可见吸收光谱的曲线下面积则能进一步提高绝对值评判的灵敏度。
检测紫外-可见吸收光谱的仪器是实验室常规仪器,除酶标仪外,在实验室广为普及的国产75-2分光光度计等也可方便地实现检测。计算紫外-可见吸收光谱曲线下面积也容易实现,光谱扫描时,如果以1nm步进,则将各吸收值(当光经为1cm时)或OD值(当光经不为1cm时,如用多孔板检测)加起来则可认定为是吸收光谱曲线下面积。
对于具有总提取物特征的单方或复方中药注射剂而言,由于颜色变深是反映中药注射剂稳定问题的共性现象,但颜色加深的程度可能因不同中药注射剂品种而不同。针对具体的中药注射剂溶液,可以规定在特定波长范围内的吸收光谱曲线下面积为某个值,大于该值则可以判定为不符合规定。
除了用于总提取物特征的单方或复方中药注射剂,对于以单体或有效部位为特征的中药注射剂而言,吸收光谱变化也能反映其内在质量变化。这类中药注射剂的活性成分相对清楚,多为同系物,具有一定的共性光谱吸收,这些区域则构成活性成分主吸收区,这些区域以外的吸收则为非活性成分吸收区。针对具体的中药注射剂溶液,可以规定在某一特定波长范围内的吸收光谱曲线下面积为某个值,大于该值则可以判定为不符合规定(相当于监控有色杂质的吸收光谱);也可规定在某一特定波长范围内的吸收光谱曲线下面积为某个值,小于该值则可以判定为不合格(相当于监控活性成分的吸收光谱)。在判定时也可根据需要设定相应的具体范围。
- 还没有人留言评论。精彩留言会获得点赞!