一种HOCs的被动加标方法及其在效应导向分析中的应用与流程
本发明涉及一种hocs的被动加标方法及其在效应导向分析中的应用,属于有机污染物毒性测定技术领域。
背景技术:
水污染严重威胁水生生态系统平衡和人类健康,亟需开展水生生态风险评价的研究,制定相应的水质基准;准确可靠的毒性数据是建立有效水质基准的前提,而毒性数据主要通过加标目标污染物到水体,利用模式生物进行毒性测试来获取。
传统的溶剂加标方法将待测化合物配制成目标浓度的有机溶液,然后加入水体;对于疏水性有机污染物(hydrophobicorganiccontaminants,hocs),由于其挥发降解、容器壁吸附、毒性测试中生物体的摄取等因素,毒性测试过程中污染物水体浓度逐渐降低。这导致水体暴露浓度变化大,污染物的剂量-效应关系不明,直接影响毒性测试数据的准确性。
另外,环境污染因素复杂,多种污染物共存,鉴定主要致毒物是关键也是难点;效应导向分析(effect-directedanalysis,eda)结合化学分离分析方法和生物毒性测试技术,以有机污染物为筛选对象,可确定主要毒性贡献者;针对当前hocs污染严重、对水生生物毒性强的特点,有必要发展并完善eda在毒性鉴定评价中的方法,发展能够有效维持毒性测试过程中hocs水浓度,同时考虑污染物生物可利用性的加标方法是有效开展eda的基础。
本发明以聚二甲基硅氧烷(polydimethylsiloxane,pdms)为聚合物,hocs为目标污染物,水为测试介质,烧杯为测试体系;基于平衡分配理论,使提前载入聚合物的hocs不断释放进入水体,弥补水体中hocs随时间的损耗,有效克服溶剂加标方法在hocs水毒性测试中浓度不稳定的问题,并考虑毒性测试中污染物的生物可利用性。
技术实现要素:
为解决上述问题,本发明提出了一种hocs的被动加标方法及其在效应导向分析中的应用,能够有效维持相对恒定的hocs水浓度,同时考虑hocs的生物可利用性,为开展eda中生物毒性测试提供保障。
本发明的hocs的被动加标方法及其在效应导向分析中的应用,包括以下步骤:
步骤一,pdms膜的制备,
第一步,将硅酮前聚物和固化剂充分混合,以一定厚度均匀涂布在干净的不锈钢板上,涂布厚度为0.1~0.5mm,去除其中气泡,保持710mm汞柱30~40min;
第二步,23~25℃固化72~96h后,将膜揭下,裁剪成一定大小的片状;
第三步,用丙酮超声3~4次去除杂质,超声时间为15~30min;
第四步,用纯净水超声3~4次去除丙酮,自然风干,得到pdms膜,所得pdms膜的密度为1.15~1.20g/ml;
步骤二,被动加标载样,
第一步,取一片步骤一制备的空白pdms膜浸泡于含有目标hocs的甲醇溶液,在23~25℃水平摇动,控制水平摇动速率为200~220rpm,每隔一段时间加入纯净水,至少加8次,促使hocs转移到pdms膜中,至48~72h完成载样;
第二步,取出pdms膜,用纯净水洗净甲醇,在23~25℃自然风干,得到载样pdms膜;
步骤三,效应导向分析,
第一步,沉积物中有机污染物的提取,
根据沉积物中的有机碳含量来计算沉积物的提取量,沉积物用量为3~4倍pdms量的有机碳等量提取物,并用正己烷和丙酮混合液提取;沉积物样品冷冻干燥后,研磨过筛,称取一定量的干沉积物,加入一定量的有机溶剂(如正己烷、丙酮等),萃取沉积物中的有机污染物氮吹浓缩并置换溶剂为二氯甲烷;
第二步,凝胶渗透色谱分离、被动加标和毒性测试,
采用gpc,色谱柱为s-x3,流动相为二氯甲烷,流速为5~8ml/min;收集4~6个组分,氮气浓缩并置换溶剂为1ml甲醇;按照步骤二所述被动加标载样方法,将gpc分离得到的各组分分别载入pdms膜,得到载样pdms膜,用于水体生物毒性测试;
生物毒性测试体系为400ml玻璃烧杯,加入300~400ml中等硬水、10~15g干净细砂平铺于烧杯底部、一片载样pdms膜悬浮于水中,盖上锡纸避光,磁力搅拌,促使pdms中有机污染物释放进入水体并达到平衡;搅拌完后,取下锡纸,加入生物,开始静置的生物毒性实验;实验期间每天监测电导率、ph、溶氧和温度等水质参数,并观察记录其存活情况和筑巢行为;暴露结束后,筛出存活的生物,记录致死性,并将存活的生物保存于-80℃,用于酶活性等指标测定;对毒性测试表现出致毒效应的组分,进一步利用反相色谱柱分离;
第三步,反相色谱柱分离、被动加标和毒性测试,
合并第二步中对模式生物表现出毒性的组分,进行c18反相柱的分离,流动相为甲醇和水,进行全组分分组收集,经正己烷反萃取后,溶剂浓缩转换为甲醇;通过被动加标,将各个组分加载入pdms膜,根据第二步所述的被动加标和生物毒性测试方法进行生物毒性测试;
第四步,毒性组分中有机污染物的定性与定量分析,
对于上述经反相色谱柱分离后表现出生物毒性的组分,利用气相色谱-质谱联用仪中未知污染物专用筛查软件进行定性和半定量分析;根据浓度与组分毒性之间的相关性,并结合反相柱洗脱时间等信息,筛选可能的致毒物质;对于筛查难度大的组分,可重复进行第三步的分离、被动加标和毒性测试过程,不断缩小致毒组分的范围,直至获得可筛查毒性组分,进行定性定量分析;
第五步,毒性确认,
通过化学鉴定和毒性确认等途径,对第四步筛选获得的致毒物质进行确定;化学鉴定通过毒性组分初筛的污染物需要标准品的核实,通过进一步的仪器分析验证,方能确认;毒性确认采用剂量-效应曲线法,通过贡献化合物标准品的剂量-效应曲线,计算组分中污染物相应浓度的理论毒性,根据其在组分总体毒性的贡献确定其是否为主要致毒物。
进一步地,所述硅酮前聚物由硅氧烷聚合物和催化剂组成,硅酮为生物医用级。
进一步地,所述加水间隔时间为2~8h,其间隔时间设置方法为开始时加水间隔时间短,临近结束时加水间隔时间长;且每次加入纯净水的量为1~2ml。
进一步地,所述载样pdms膜利用不锈钢丝悬挂,使其悬浮于生物毒性测试体系中。
进一步地,所述载样pdms膜中目标hocs的解吸通过磁力搅拌实现,搅拌速率为300~900rpm,搅拌时间为24~96h。
进一步地,所述毒性测试为活体生物毒性测试,包括致死性和亚致死性毒性终点,测试时间为1~10d。
本发明与现有技术相比较,本发明的hocs的被动加标方法及其在效应导向分析中的应用,pdms膜的制备方法简单、快速,可根据实际需要调整膜厚度,比商品化pdms膜价格低廉,成本较低;pdms膜的载样效率可达53%~73%,实际应用过程中可根据要求适当提高载样体系中水的比例而提高载样效率;在考虑疏水性有机污染物生物可利用性的同时,维持生物暴露过程中污染物水浓度的相对稳定,为效应导向分析中生物测试提供有效保障。
附图说明
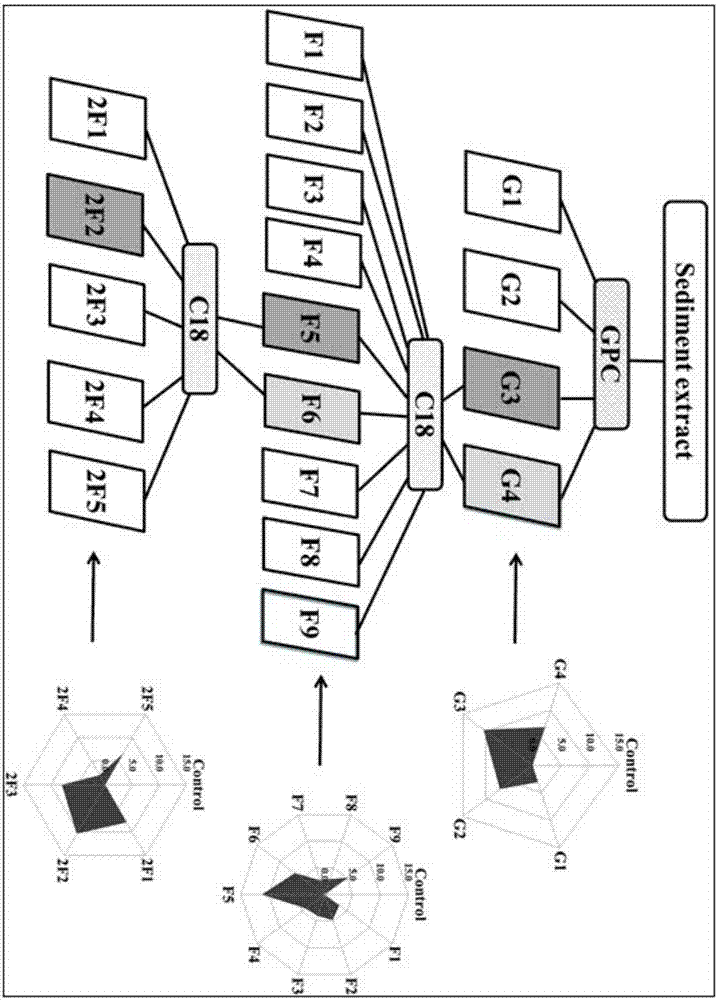
图1为本发明的包含被动加标的沉积物效应导向分析流程图。
图2为本发明的实施例1结果示意图。
图3为本发明的实施例1通过gc-ms筛选出的主要化合物信息示意图。
具体实施方式
实施例1:
本发明的hocs的被动加标方法及其在效应导向分析中的应用,包括以下步骤:
步骤一,pdms膜的制备,
第一步,本实施例使用的pdms膜由美国道康宁公司生产的生物医用级硅酮制备,使用前将硅酮前聚物和固化剂充分混合(质量比10:1),将硅酮前聚物和固化剂充分混合,以0.25mm的厚度均匀涂布在干净的不锈钢板上,保持710mm汞柱30min,去除其中气泡;
第二步,23℃固化72h后,将膜揭下,裁剪成一定2×4cm大小的片状;
第三步,用丙酮超声3次去除杂质,超声时间为15min;
第四步,用纯净水超声3次去除丙酮,自然风干,得到pdms膜,所得pdms膜的密度为1.15g/ml;
步骤二,被动加标载样,
第一步,取一片步骤一制备的空白pdms膜浸泡于含有目标hocs的甲醇溶液,在23℃水平摇动,控制水平摇动速率为200rpm,每隔一段时间加入纯净水,加水8次,促使hocs转移到pdms膜中,至48h完成载样;
第二步,取出pdms膜,用纯净水洗净甲醇,在23℃自然风干,得到载样pdms膜;
步骤三,效应导向分析,
第一步,沉积物中有机污染物的提取,
本实施例中使用的沉积物采自广州市内河道,前期研究表明该区域沉积物对底栖动物摇蚊幼虫具有较高的致死性和亚致死性毒性,有必要进一步鉴定其中主要的致毒污染物。根据沉积物中的有机碳含量,即有机碳等量提取物,来计算沉积物的提取量。为了校正分离过程中的损失,沉积物用量为3倍pdms量的有机碳等量提取物,用正己烷和丙酮混合液提取。沉积物样品冷冻干燥后,研磨过筛,称取5g的干沉积物,加入100ml正己烷和丙酮混合液(1:1,v/v),利用超声微波协同萃取仪(新拓cw-2000,中国上海)提取沉积物中的有机污染物;微波和超声功率分别设定为100w和50w,超声时间为6min,氮吹浓缩并置换溶剂为1ml二氯甲烷;
第二步,凝胶渗透色谱分离、被动加标和毒性测试,
采用lab&tech公司凝胶渗透色谱(gpc),色谱柱为s-x3(300×20mm,200-400目,排阻极限:2000),流动相为二氯甲烷,流速为5ml/min;收集时间段为1~4min、4~8min、8~18min和18~27min四个组分,分别记录为g1、g2、g3和g4组分氮气浓缩并置换溶剂为1ml甲醇;
取上述步骤一制备得到的空白pdms膜,按照上述步骤二的方法,将gpc分组得到的四个组分分别加载至pmds膜中,得到载样pdms膜;生物毒性测试体系为400ml玻璃烧杯,加入300ml中等硬水、15g干净细砂平铺于烧杯底部、载样pdms膜悬浮于水中,盖上锡纸,磁力搅拌(660rpm),促使pdms中有机污染物释放进入水体并达到平衡;搅拌48h后,取下锡纸,加入10只三龄摇蚊幼虫,开始静置的生物毒性实验;实验期间每天监测电导率、ph、溶氧和温度等水质参数,并观察记录其存活情况和筑巢行为;暴露96h后,筛出存活的摇蚊幼虫,记录致死性,并将存活的摇蚊幼虫保存于-80℃,用于酶活性等指标测定;如图2所示为广州河道沉积物提取液在效应导向分析中的分馏组分,以及摇蚊幼虫暴露于各组分后的综合生物标志物响应(ibr)指数结果示意图,图中灰色标注组分对摇蚊幼虫表现出显著的毒性效应,图2表明摇蚊幼虫存活率为100%,无死亡现象;但在g3(8~18min)组分观察到摇蚊在4天水体暴露期间,一直没有筑巢,推测其原因可能是在毒害污染物的暴露下,其行为受限,丧失筑巢能力;暴露结束后,收集虫体,进行生物标志物的测定,其表达情况如下:相对于空白对照,在g1组分,所有酶活性均无显著性影响;在g2组分,乙酰胆碱酯酶和羧酸酯酶表现出显著性的变化,其余无显著性差异;在g3组分,谷胱甘肽s转移酶、乙酰胆碱酯酶和羧酸酯酶都表现出显著性的变化,只有过氧化氢酶含量无显著性差异;在g4组分,羧酸酯酶和过氧化氢酶表现出显著性的变化,其余无显著性差异;其ibr指数也在g3组分最高,g4组分次之,因此,将g3和g4组分合并,进行c18反相柱的分离;
第三步,反相柱分离、被动加标和毒性测试,
合并上述对摇蚊幼虫表现出毒性的g3和g4组分,进行c18反相柱的分离,流动相为甲醇和水,进行全组分收集,5min为间隔,共收集9个组分;经正己烷反萃取后,溶剂浓缩转换为甲醇;通过被动加标,将各个组分加载入pdms膜,根据第二步所述的被动加标和生物毒性测试方法进行96h的三龄摇蚊幼虫的毒性测试;结果显示,摇蚊存活率为100%,无死亡现象;但在f5组分观察到摇蚊在4天水体暴露期间,一直没有筑巢;暴露结束后,收集虫体,进行生物标志物的测定,其表达情况如下:相比于空白对照,谷胱甘肽s转移酶在f5组分有显著性升高,羧酸酯酶在f5、f6和f9组分有显著性升高,乙酰胆碱酯酶在f5组分有显著性抑制,过氧化氢酶在f3、f4和f6组分有显著性升高,脂质过氧化酶含量在f1、f4和f6组分有显著性升高,其余无显著性差异;其ibr指数也在f5组分最高,f6组分次之;因此,将f5和f6组分合并,进行第二次c18反相柱的分离;在第一次分离时f5和f6的出峰时间段,以2min间隔收集组分,共收集5个组分;将此组分经正己烷萃取,浓缩溶剂转换为甲醇,再通过被动加标进行4天的摇蚊水体暴露测试;结果显示:摇蚊存活率为100%,无死亡现象;暴露结束后,收集虫体,进行生物标志物的测定,其表达情况如下:相比于空白对照,谷胱甘肽s转移酶在2f3和2f4组分有显著性升高,羧酸酯酶在2f2组分有显著性升高,乙酰胆碱酯酶在2f1、2f2和2f3组分有显著性抑制,过氧化氢酶在2f1、2f2、2f3和2f5组分有显著性升高,脂质过氧化酶在2f5组分有显著性升高,其余无显著性差异;ibr指数也在2f2组分最高,2f1和2f3组分次之;因此,将2f1、2f1和2f3表现出毒性的组分,进行gc-ms定性和半定量分析;
第四步,毒性组分中有机污染物的定性与定量分析,
将上述2f1、2f1和2f3表现出毒性的组分,利用shimadzuqp-2010plusgc-ms中compoundcomposer专用筛查软件进行定性和半定量分析,软件及数据库包括7大类942种化合物;定性扫描共检出上百种化合物,包括正构烷烃、酚类、多环芳烃、邻苯二甲酸酯类、农药等;所检出的化合物信息量大,干扰多;因此,将c18两次分离的所有组分,包括f1至f9、以及2f1至2f6,进行gc-ms半定量分析,根据浓度与组分毒性之间的相关性,筛选出15种化合物,如图3所示为广州城市河道沉积物提取物毒性组分(2f2)通过gc-ms筛选出的主要化合物信息,表现毒性的化合物其logkow值主要在2.5到5之间,符合其在c18柱上的洗脱时间;
第五步,致毒污染物的确认,
经过化合物纯品确认,测定其在广州河道沉积物中的浓度,探讨其与摇蚊幼虫毒性之间的关系进行风险确认,结果发现测试沉积物中烯酰吗啉、克草丹和三唑醇对摇蚊幼虫的慢性亚致死毒性有作用。
上述实施例,仅是本发明的较佳实施方式,故凡依本发明专利申请范围所述的构造、特征及原理所做的等效变化或修饰,均包括于本发明专利申请范围内。
- 还没有人留言评论。精彩留言会获得点赞!