生物分选系统及应用生物分选系统的生物分选方法与流程
本发明涉及一种生物分选系统及使用此生物分选系统的进行微粒子分选的方法。
背景技术:
医学检验是利用各种医学分析仪器来进行微粒子或生物分子的分析,并以分析结果来辅助生物体生理状态的评估。若仅需对单一微粒子进行分析。则需先将包含不同微粒子的流体进行分选。若是微粒子分选的结果不佳,则将造成后续的分析受到严重影响而降低分析的正确性。另一方面,公知生物分选仪器的硬件成本较高,且其进行分选处理的所需时间长达数小时甚至是数十小时。如何克服上述缺点,已为相关领域技术人员所致力的目标之一。
技术实现要素:
本发明的目的即在于提供一种生物分选系统及使用此生物分选系统进行微粒子分选的方法,其至少具有高筛选率、低硬件成本和低分选处理时间等优点。
本发明的一方面是在提供一种生物分选系统,此生物分选系统包含光诱导介电泳晶片、承载平台、注入单元和投影模块。光诱导介电泳晶片用以产生内部电场以对包含第一微粒子和第二微粒子的流体进行分选处理。承载平台用以承载光诱导介电泳晶片,且其具有开口区。注入单元用以将流体注入至光诱导介电泳晶片中。投影模块设置于承载平台下,其用以朝向该光诱导介电泳晶片投射图案化光源,此图案化光源穿过开口区并照射光诱导介电泳晶片的投射区域,使得光诱导介电泳晶片产生光激发效应而改变其内部电场,借以分选出第一微粒子和第二微粒子。
依据本发明的一实施例,上述投影模块包含用以产生光源的发光元件和用以将光源转换为图案化光源的光调变器。光调变器包含数字微型反射镜元件(digitalmicromirrordevice;dmd)或硅基液晶(liquidcrystalonsilicon;lcos)元件。
依据本发明的又一实施例,上述投影模块通信连接计算机设备,且上述投影模块用以依据计算机设备提供的图像数据产生图案化光源。
依据本发明的又一实施例,上述投射区域的尺寸大约介于1毫米×1毫米与10毫米×10毫米之间。
依据本发明的又一实施例,上述生物分选系统还包含影像观测模块,其用以观测流体在光诱导介电泳晶片中的分选情形且据以产生分析结果。
依据本发明的又一实施例,上述光诱导介电泳晶片包含第一电极层、第二电极层、半导体层和流道层。第二电极层与第一电极层相对设置,且第二电极层与第一电极层之间受到电压差的作用而产生内部电场。半导体层设置于第一电极层上,且流道层设置于第二电极层与半导体层之间,其流道层定义注入区、第一收集区及第二收集区。注入区、第一收集区与第二收集区交会于投射区域中,其中注入区用以导引流体至投射区域,而第一收集区和第二收集区分别用以导引分选出的第一微粒子和第二微粒子。
依据本发明的又一实施例,上述生物分选系统还包含电能供应单元,其用以提供电能至光诱导介电泳晶片,且其产生的电压的峰值和频率分别大约为1伏特至50伏特和1千赫兹至1亿赫兹。
依据本发明的又一实施例,上述流道层的高度大约为30微米至100微米。
本发明的另一方面是在提供一种生物分选方法,此生物分选方法适用于生物分选系统,且其包含:通过注入单元将包含第一微粒子和第二微粒子的流体以2微升/分至200微升/分的速率注入至光诱导介电泳晶片中;提供电压差至光诱导介电泳晶片,使光诱导介电泳晶片据以产生内部电场;以及配置投影模块,使投影模块产生图案化光源并将图案化光源穿过开口区投射至光诱导介电泳晶片的投射区域以改变内部电场,使得第一微粒子和第二微粒子受到内部电场的作用而被分选出来。
依据本发明的一实施例,上述生物分选方法还包含依据影像观测模块的分析结果改变流体注入至光诱导介电泳晶片的速率或图案化光源的图案。
本发明的优点在于,本发明的生物分选系统及其进行的分选方法具有高筛选率。此外,相较于公知生物分选仪器,本发明的生物分选系统具有低硬件成本的优势,且可在较短时间内分选出具高纯度的微粒子,因此非常适合用于生物和医学领域的应用,例如生化处理和检验医学等。
附图说明
为了更完整了解实施例及其优点,现参照结合附图做下列描述,其中:
图1绘示依据本发明实施例的生物分选系统的示意图;
图2a绘示图1的光诱导介电泳晶片的结构图;
图2b绘示图2a的流道层的平面图;
图3a绘示图2a的光诱导介电泳晶片中未受到图案化光源的照射下的电场分布示意图;
图3b绘示图2a的光诱导介电泳晶片中受到图案化光源的照射下的内部电场分布示意图;
图4a至图4c绘示图1的投影模块投射的图案化光源的平面投影图案示意图;
图5绘示使用图1的生物分选系统进行分选方法的流程图;
图6a绘示图2a的光诱导介电泳晶片中未受到图案化光源的照射下的微粒子分布示意图;以及
图6b绘示图2a的光诱导介电泳晶片中受到图案化光源的照射下的微粒子分布示意图。
具体实施方式
以下仔细讨论本发明的实施例。然而,可以理解的是,实施例提供许多可应用的概念,其可实施于各式各样的特定内容中。所讨论、揭示的实施例仅供说明,并非用以限定本发明的范围。
可被理解的是,虽然在本文可使用“第一”、“第二”和“第三”等用语来描述各种元件、零件、区域、层和/或部分,但此些用语不应限制此些元件、零件、区域、层和/或部分。这些用语仅用以区别一个元件、零件、区域、层和/或部分与另一个元件、零件、区域、层和/或部分。
请参照图1,图1绘示依据本发明实施例的生物分选系统100的示意图。生物分选系统100包含光诱导介电泳晶片110、承载平台120、投影模块130、注入单元140、收集单元150a、150b和影像观测模块160。光诱导介电泳晶片110用以对不同微粒子进行分选处理。在本文中,微粒子可以是生物细胞、生物分子、空气微粒、水中杂质或介电粉末等。在一些实施例中,进行分选处理的微粒子为微米等级的微粒子。光诱导介电泳晶片110用以产生内部电场,且利用介电泳力(dielectrophoresisforce;depforce)原理,使不同的微粒子受到不同的介电泳力(dielectrophoresisforce;depforce)作用而移动至不同处。如此一来,不同微粒子可被光诱导介电泳晶片110分选出。
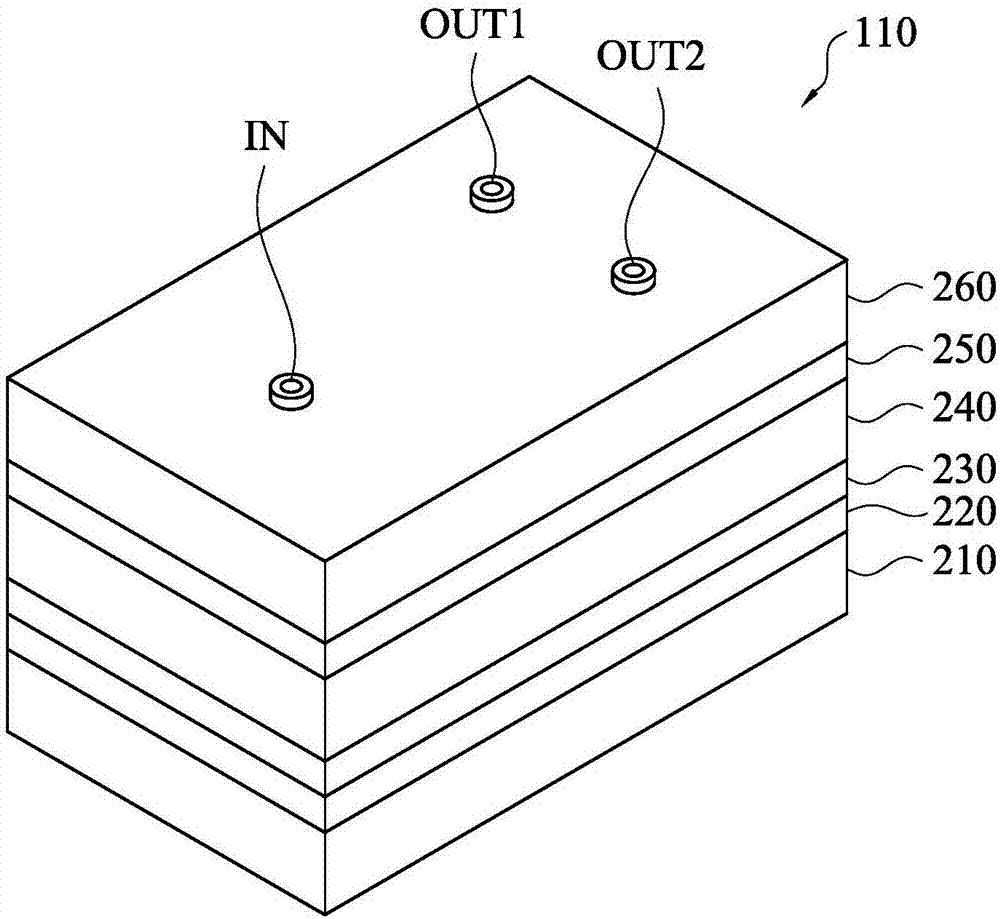
光诱导介电泳晶片110的结构如图2a所示。光诱导介电泳晶片110包含下基板210、第一电极层220、半导体层230、流道层240、第二电极层250和上基板260。下基板210为可透光的透明基板,例如玻璃基板或塑胶基板等,但不限于此。
第一电极层220设置于下基板210上,且其包含透明导电材料,例如氧化铟锡(indiumtinoxide;ito)、氧化铟锌(indiumzincoxide;izo)或其他类似的导电材料。
半导体层230设置于第一电极层220上,其可包含间接能隙(indirectbandgap)材料,例如硅、锗或其他类似的材料。此外,半导体层230的结晶型态可为非晶硅(amorphoussilicon)、单晶硅(monocrystallinesilicon)、微晶硅(nanocrystallinesilicon)、多晶硅(polycrystallinesilicon)或上述组合。
流道层240设置于半导体层230上。请一并参照图2b,图2b绘示流道层240的平面示意图。如图2所示,流道层240定义出注入开口272、注入区273、第一流出开口274、第一收集区275、第二流出开口276和第二收集区277,且注入区273、第一收集区275、第二收集区277交会于投射区域280中。流体经由注入开口272而注入至流道层240中。注入区273用以导引注入的流体至投射区域280。若投射区域280受到图案化光源的照射,第一电极层220与第二电极层250之间的内部电场产生改变,使得流体中的第一微粒子和第二微粒子往不同的方向移动,则第一收集区275可导引第一微粒子经由第一流出开口274而流出至光诱导介电泳晶片110外,且第二收集区277可导引第二微粒子经由第二流出开口276而流出至光诱导介电泳晶片110外。
第二电极层250设置于流道层240上。在一些实施例中,第二电极层250透明导电材料,例如氧化铟锡、氧化铟锌或其他类似的导电材料。在此实施例中,第一电极层220和第二电极层250外接电源,以在第一电极层220与第二电极层250之间提供电压差,从而在第一电极层220与第二电极层250之间产生内部电场。
上基板260设置于第二电极层250上,其为可透光的透明基板,例如玻璃基板或塑胶基板等,但不限于此。此外,在上基板260上具有注入接口in和流出接口out1、out2,其中注入接口in用以提供流体注入至注入开口272的途径,流出接口out1用以提供第一微粒子由流出开口274流出至光诱导介电泳晶片110外的途径,且流出接口out2用以提供第二微粒子由第二流出开口276流出至光诱导介电泳晶片110外的途径。
在一些实施例中,下基板210和上基板260的厚度约为0.7毫米,第一电极层220和第一电极层250的厚度约为50纳米至500纳米,半导体层230的厚度约为1微米至2微米,流道层240的厚度大约为30微米至100微米。此外,在一些实施例中,注入区273与第一收集区275之间的夹角约为169度,第一收集区275与第二收集区277之间的夹角约为22度,注入区273、第一收集区275和第二收集区277的宽度为大约0.8毫米至大约20毫米,注入开口272、第一流出开口274和第二流出开口276的口径约为1.1毫米。在一些实施例中,且投射区域280的尺寸大约介于1毫米×1毫米与10毫米×10毫米之间。光诱导介电泳晶片110中各部分的厚度、宽度及夹角等数值可根据实际需求对应调整,并不以上述数值为限。
请回到图1,承载平台120用以承载光诱导介电泳晶片110,且其具有开口区120a,使得光源可通过开口区120a而投射至光诱导介电泳晶片110。另外,在一些实施例中,承载平台120具有容置结构,以容置并固定光诱导介电泳晶片110的位置。容置结构可为环形凸出结构、矩形凹陷结构、卡榫结构或任何其他可固定光诱导介电泳晶片110的位置的结构。
投影模块130用以产生图案化光源,且将图案化光源通过承载平台120的开口区120a投射至光诱导介电泳晶片110。投影模块130的光出射度(luminousexitance)和其产生的图案化光源的波长范围可分别介于9万勒克斯(lux)与12万勒克斯之间和介于280纳米与1400纳米之间。投影模块130包含发光元件132和光调变器134。发光元件132用以产生光源,其可以是例如灯泡、发光二极管或激光器等,但不限于此。举例而言,发光元件132可以是发光二极管,其用以发射出包含可见光波长的光源。光调变器134将发光元件132产生的光源转换为图案化光源,且将图案化光源投射至如图2b所示的投射区域280。在一些实施例中,光调变器134为数字微型反射镜元件(digitalmicromirrordevice;dmd)或硅基液晶(liquidcrystalonsilicon;lcos)元件,其接收发光元件132发出的光源,且依据图像数据将接收到的光源转换为图案化光源。投影模块130可通信连接计算机设备pc,以从计算机设备pc接收图像数据,且通过接收到的图像数据来决定输出的图案化光源。详细而言,投影模块130可通过有线通信(例如vga、hdmi、edp、usb)或无线通信(例如wifi、蓝牙)等方式通信连接计算机设备pc,且计算机设备pc传输图像数据至投影模块130,接着再经由光调变器134的处理,依据图像数据将发光元件132发出的光源转换为图案化光源。投影模块130还可包含透镜和/或反射镜等元件,其用以调整图案化光源的焦距和/或平面范围等。
注入单元140连接至光诱导介电泳晶片110的注入接口in,其用以将包含第一微粒子和第二微粒子的流体注入至光诱导介电泳晶片110中。注入单元140可包含泵浦或其他可控制流体注入至光诱导介电泳晶片110中的速率的元件。在一些实施例中,注入单元140以2微升/分至200微升/分的速率将流体注入至光诱导介电泳晶片110中。收集单元150a、150b分别连接至光诱导介电泳晶片110的流出接口out1、out2,其分别用以收集由光诱导介电泳晶片110流出的第一微粒子和第二微粒子。
影像观测模块160设置于光诱导介电泳晶片110的上方,其可供使用者观测在光诱导介电泳晶片110中的分选情形。在一些实施例中。影像观测模块160可包含影像处理单元,其可对撷取到的分选情形画面进行影像分析处理以产生分析结果,且可根据分析结果来即时调整生物分选系统100的参数,例如投影模块130产生的图案化光源的平面投影图案、强度和/或波长、光诱导介电泳晶片110与投影模块130之间的距离、投射区域280的尺寸和注入单元140的注入速率等。在其他实施例中,影像观测模块160可耦接具有影像分析功能的实体(例如计算机设备pc),且上述影像分析处理的步骤可在此实体中进行。
另外,生物分选系统100还可包含透镜(图未绘示),其设置于光诱导介电泳晶片110与投影模块130之间,以调整光诱导介电泳晶片110的投射区域大小。透镜(图未绘示)的调整倍数可依据生物分选系统100的架构来决定,例如光诱导介电泳晶片110与投影模块130之间的距离、光诱导介电泳晶片110中流道层240的结构和/或投影模块130的光出射度等。透镜(图未绘示)可配置于承载平台120的开口区120a中、光诱导介电泳晶片110与开口区120a之间或者开口区120a与投影模块130之间。
图3a和3b分别绘示光诱导介电泳晶片110中未受到图案化光源的照射下及受到图案化光源的照射下的电场分布示意图。如图3a所示,在光诱导介电泳晶片110中未受到图案化光源的照射下,第一电极层220和第二电极层250分别电性连接至电能供应单元ac的两端,使得第一电极层220和第二电极层250之间产生均匀电场,此时微粒子c1和c2不会受到不均匀电场的影响而往特定的方向移动。电能供应单元ac产生的电压的峰值和频率可分别为1伏特至50伏特和1千赫兹至1亿赫兹,优选分别为15伏特至25伏特和10万赫兹至100万赫兹。如图3b所示,在受到图案化光源的照射下,光诱导介电泳晶片110产生光激发效应而改变第一电极层220和第二电极层250之间的电场分布,使得微粒子c1受到正介电泳力(positivedepforce)d1的作用而移动至图案化光源的照射处,且微粒子c2受到负介电泳力(negativedepforce)d2的作用而移动至图案化光源的照射处外。
图4a至图4c绘示投影模块130投射图案化光源至投射区域280的平面投影图案示意图,其分别为网状图案、介电泳捕捉图案和诱发图案。应注意的是,图4a至图4c所绘示的平面投影图案仅为例示,而在实际的操作上,可依据各操作因素来控制投影模块130投射对应的图案化光源至投射区域280,且投射至投影区域280上的平面投影图案不以图4a至图4c所绘示的图案为限。
请参照图5,图5绘示使用生物分选系统100进行分选方法500的流程图。分选方法500包含下列步骤。首先,进行步骤510,通过注入单元140以2微升/分至200微升/分的速率将包含微粒子c1、c2的流体注入至注入区273中。接着,进行步骤520,提供电压差至光诱导介电泳晶片110的第一电极层220和第二电极层250,以在第一电极层220和第二电极层250之间产生内部电场。然后,进行步骤530,配置投影模块130,使投影模块130产生图案化光源并将此图案化光源投射至光诱导介电泳晶片110的投射区域280。在受到图案化光源的投射下,第一电极层220与第二电极层250之间的内部电场由均匀电场转变为不均匀电场,使得微粒子c1以电性驱动方式由注入区273进入至第一收集区275,且使微粒子c2以电性驱动方式由注入区273进入至第二收集区277。通过上述分选方法500,可分别经由流出接口out1、out2来收集分选后的微粒子c1、c2。
以下以白血球细胞和癌症细胞(包含大肠癌细胞、肺癌细胞和乳癌细胞)的分选为例说明。图6a和6b分别对应步骤510和步骤520,其中图6a绘示光诱导介电泳晶片110中未受到图案化光源的照射下的微粒子分布示意图,而图6b绘示光诱导介电泳晶片110中受到图案化光源的照射下的微粒子分布示意图。为方便说明,在图6a和6b中未将上基板210、下基板260和流道层240中的结构绘示出。首先,将包含癌症细胞(即微粒子c1)和白血球细胞(即微粒子c2)的流体注入至流道层240。在光诱导介电泳晶片110未受到图案化光源的照射下,如图6a所示,癌症细胞和白血球细胞在流道层240中为均匀分布。在光诱导介电泳晶片110受到图案化光源的照射下,如图6b所示,图案化光源的照射处具有较强电场,使得癌症细胞受到正介电泳力作用而移动至图案化光源的照射处,且白血球细胞受到负介电泳力作用而移动至图案化光源的照射处外。通过受到图案化光源的照射而产生的非均匀电场,癌症细胞受到电性驱动的作用而逐渐接近流出接口out1且最后经由流出接口out1流出。
通过本发明的生物分选系统及其进行的分选方法,可使分选出微粒子的纯度可高达85%以上(即具有高筛选率)。此外,相较于公知生物分选仪器,本发明的生物分选系统具有低硬件成本的优势,且可在较短时间内分选出具高纯度的微粒子,因此非常适合用于生物和医学领域的应用,例如生化处理和检验医学等。
虽然本发明已以实施例公开如上,然其并非用以限定本发明,任何所属技术领域的技术人员,在不脱离本发明的精神和范围内,当可作些许的更动与润饰,故本发明的保护范围当视权利要求所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!