一种中空核壳纳米颗粒及制备方法、试纸条及测试方法与流程
本发明涉及生物医学检测领域,具体来说,涉及一种中空核壳纳米颗粒及制备方法、试纸条及测试方法。
背景技术:
基于金纳米颗粒(aunps)的免疫层析检测技术是在单克隆抗体技术和新型纳米材料技术上发展起来的基于膜的体外检测诊断方法,目前已在众多领域获得广泛应用,包括敏感症、早孕、心梗标志物、传染病、环境污染物、毒品等。仅以早孕检测为例,每年所需要的试剂盒/试纸条用量已经达到107个。基于aunps的免疫层析检测原理如下:将特异性捕获抗体固定在硝酸纤维素(nitrocellulose,nc)膜上,形成条带;将结合了识别抗体的aunps复合物负载在nc膜样品端的玻璃纤维垫上,制成金标垫;利用nc膜微孔的毛细作用,使样品溶液从试纸条一端的向另一端移动;滴加在样品垫上待测溶液流经金标垫处时,溶液中待测物与aunps表面的识别抗体结合,形成“aunps-识别抗体-待测物”复合物,当该复合物流经测试区时,被固定在硝酸纤维素膜上的捕获抗体所捕获,形成双抗夹心结构。随着该结构在测试区的逐渐累积,在膜上的检测线t处就会出现红色条带,而质控线c则用以检测免疫探针aunps上包被的蛋白是否有活性。基于aunps的免疫层析检测技术简便快速,只用肉眼即可判断结果,在过去10年中日益确立了其在床旁检测(point-of-caretesting,poct)中的地位。但是,目前该技术依然存在着两个方面的挑战:首先是如何实现高灵敏度检测,目前免疫层析检测灵敏度远小于酶联免疫和免疫荧光等方法;其次,通过肉眼观测条带显色只是一个定性结果,而且不同人的眼睛对于颜色的敏感性差异较大,灵敏度低。
以急性心肌损伤(acutemyocardialinfarction,ami)诊断为例,心电图检查必须结合外周血中心肌肌钙蛋白i(cardiactroponini,ctni)含量检测才能给出最终明确诊断。ctni是构成肌钙蛋白复合物的三亚基之一,具有高度的心肌特异性,其血液水平含量不受骨骼肌损伤、剧烈运动、肾病等其他疾病的影响。健康人群外周血中ctni的含量一般低于0.06ng/ml,而对于急性心肌梗死的患者,在心肌细胞受损后,心肌细胞中不同种类的蛋白释放到血液中,在发生ami后2.2~6.8h以内,外周血ctni的浓度快速上升,11.2h后达到顶峰195.9ng/ml,并可持续4~10天。ctni浓度由正常值上升到顶峰这段时间是检测心肌梗死的最佳时间。对于临床中发生心肌梗死的患者中,有大约25%的患者在心肌梗死早期症状不明显,近一半的患者在心电图检测中不会出现心肌坏死的特征。因此,心肌坏死后,心肌标志物的检测对心肌梗死早期诊断有着至关重要的意义。目前,传统酶联免疫法(elisa)虽然能够实现高灵敏检测,但是检测步骤比较繁琐,无法实现快速检测要求。而基于金纳米颗粒的免疫层析法可以实现快速体外诊断已被广泛应用于ctni检测,其检测范围为5ng/ml~1μg/ml,可检测的最低浓度为5ng/ml。在免疫层析法基础上,xu等人报道了以超顺磁性纳米颗粒替换金纳米颗粒用于ctni免疫层析快速检测,使用磁性分析仪对检测线上磁信号进行了检测,实现了ctni定量检测,最低检测浓度可以达到0.01ng/ml。cui小组选用goldmag金磁微粒作为载体,同样实现了ctni的快速定性或定量检测。但基于磁性的免疫层析法在检测时容易受到地球及周围环境磁场的干扰。
技术实现要素:
技术问题:本发明所要解决的技术问题是:提出一种中空核壳纳米颗粒及制备方法、试纸条及测试方法,可以定量地检测样品溶液中待测物的浓度,提高检测灵敏度。
技术方案:为解决上述技术问题,本发明实施例采用如下技术方案:
一种中空核壳纳米颗粒,包括核体和壳体,所述壳体位于核体外侧,壳体和核体之间有间距,所述壳体的外表面和内表面分别标记有拉曼分子,所述核体的外表面标记有拉曼分子;所述壳体为金银合金制成,所述核体为金制成。
作为优选例,所述中空核壳纳米颗粒用于表面增强拉曼散射免疫层析试纸条。
一种中空核壳纳米颗粒的制备方法,所述方法包括:
步骤10)利用水热法制备出金种子:
步骤20)通过种子生长-熟化法制备得到金颗粒:
步骤30)通过种子生长法制备au@ag金银核壳纳米颗粒:
步骤40)以步骤30)制备的au@ag金银核壳纳米颗粒为牺牲模板,制备au@au-ag中空核壳纳米颗粒。
作为优选例,所述步骤10)包括:将水加热至沸腾后,依次加入氯金酸溶液和柠檬酸钠溶液,制备出金种子;金种子的尺寸为10~15nm。
作为优选例,所述步骤20)包括:将水加热至沸腾后,依次加入柠檬酸钠溶液、氯金酸溶液、对苯二酚溶液和步骤10)制备的金种子,制备得到金颗粒;金颗粒的尺寸为30~100nm;向溶液中加入尼罗蓝溶液,通过静电吸附原理,在金颗粒表面修饰一层拉曼分子。
作为优选例,所述步骤30)包括:将步骤20)制备的金颗粒为种子,常温搅拌下,依次加入抗坏血酸溶液和硝酸银溶液,在金颗粒表面生长成银壳,搅拌下加入nba溶液,通过静电吸附在银表面修饰上拉曼分子,制成au@ag金银核壳纳米颗粒。
作为优选例,所述步骤40)包括:将步骤30)制备的au@ag金银核壳纳米颗粒溶液加热至沸腾后,逐滴加入aucl2-溶液,反应结束后,过滤得到au@au-ag纳米颗粒溶液,再加入nba溶液,在颗粒表面修饰一层拉曼分子,制得au@au-ag中空核壳纳米颗粒。
一种含有所述的中空核壳纳米颗粒的试纸条,所述试纸条包括底衬、样品垫、纳米颗粒结合垫、层析膜和吸水垫;层析膜上设有相互平行的检测线和质控线;样品垫、纳米颗粒结合垫、层析膜、吸水垫依次紧密相连并附着在底衬上;其中,纳米颗粒结合垫上附着抗体标记的中空核壳纳米颗粒;检测线上附着捕获抗体。
作为优选例,所述中空核壳纳米颗粒包括核体和壳体,所述壳体位于核体外侧,壳体和核体之间有间距,所述壳体的外表面和内表面分别标记有拉曼分子,所述核体的外表面标记有拉曼分子;所述壳体为金银合金制成,所述核体为金制成。
一种利用所述试纸条进行临床标志物的检测方法,该方法包括:将含有待测物的样品溶液通过加样孔滴加在样品垫上,静置后,利用拉曼光谱仪采集试纸条检测线位置的拉曼光谱,根据拉曼光谱的相对强度,获得待测物浓度。
有益效果:与现有sers免疫层析技术使用球形金纳米颗粒或者au@ag金银核壳纳米颗粒相比,本发明使用au@au-ag中空核壳纳米颗粒具有以下有益效果:
1.相对于传统试纸条所使用的球形au或者au@ag金银核壳纳米颗粒,au@au-ag中空核壳纳米颗粒具有更强的sers活性,大大提高了试纸条检测灵敏度。
2.au@au-ag中空核壳纳米颗粒核壳间距可调,拥有更强的sers活性。当au@au-ag核壳间距减小,颗粒的sers活性则呈指数级增加,当小于2nm时,其增加尤为显著。通过改变au@ag纳米颗粒ag壳层厚度,au@au-ag核壳间距在2nm范围内可调,有利于获得sers活性最优异的免疫层析检测探针。
3.对于球形金纳米颗粒,拉曼分子修饰在颗粒表面,在后续制备试纸条的过程中容易从颗粒表面脱落。本实施例中,au@au-ag中空核壳纳米颗粒的核壳内外表面及其间距均可修饰拉曼分子,且拉曼分子受到壳层保护,免受外界干扰,在后续试纸条制备过程中始终保持稳定。拉曼分子保持稳定,能够保证试纸条的制备和检测具有很高的重复性。
4.au@ag核壳纳米颗粒和au@au-ag中空核壳纳米颗粒因壳层含有银元素都具有较强的sers活性,但au@ag壳层由纯银构成,在制备试纸条步骤中需要负载于聚酯纤维膜上并干燥,在后续保存中易于氧化失效,而au@au-ag的壳层为金银合金壳层,在氧化腐蚀等恶劣环境中依旧能够保持稳定,制作的试纸条易于保存。
5.以往制备方法只能获得表面活性剂(十六烷基三甲基溴化铵)或者聚合物分子(聚乙烯吡咯烷酮)等包覆的au-ag合金纳米颗粒,在后续应用中,颗粒表面难以修饰抗体等其他分子。本发明制备的au@au-ag纳米颗粒同样是由柠檬酸钠稳定,易于表面修饰,后续试纸条的制备过程与以柠檬酸钠稳定的au纳米颗粒为探针的传统免疫层析试纸条一致,拥有现成的制备工艺,无需做额外改进,降低了生产成本。
以au@au-ag中空核壳纳米颗粒为材料,更够制备出更加稳定、信号更强的表面增强拉曼散射免疫层析试纸条,实现临床标志物的快速、高灵敏、半定量检测。
附图说明
图1是本发明实施例的au@au-ag中空核壳纳米颗粒的结构示意图;
图2是本发明实施例的试纸条的结构示意图;
图3是金纳米颗粒(au)、金银核壳纳米颗粒(au@ag)与au@au-ag中空核壳纳米颗粒sers性能对比图;
图4是本发明实施例中,试纸条检测不同浓度ctni后获得的光学照片;
图5是本发明实施例中,试纸条检测不同浓度ctni获得的拉曼光谱图;
图6是本发明实施例中,试纸条以图5中拉曼光谱主峰592cm-1强度建立起来的标准曲线图(已对数转化)。
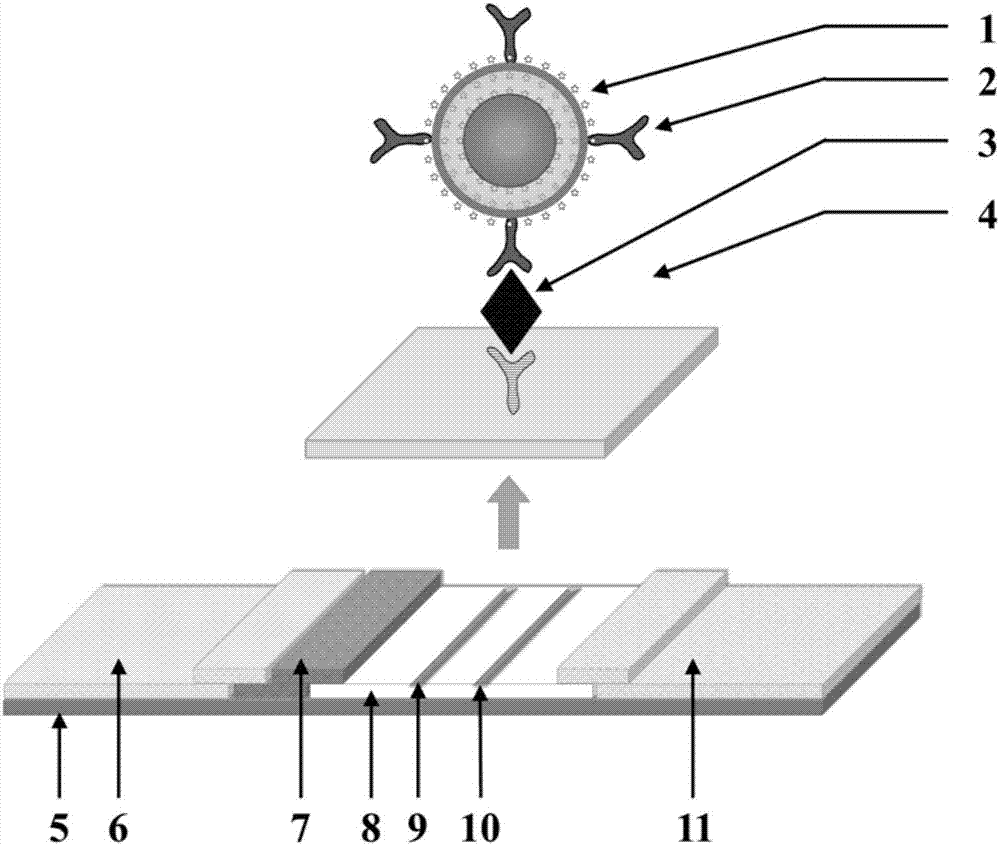
图中有:中空核壳纳米颗粒1、识别抗体2、待测物3、捕获抗体4、底衬5、样品垫6、纳米颗粒结合垫7、层析膜8、检测线9、质控线10、吸水垫11、核体101、壳体102、拉曼分子103。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲述的内容之后,本领域技术人员对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求所限定的范围。
如图1所示,本发明实施例提供一种中空核壳纳米颗粒,包括核体和壳体。壳体位于核体外侧,壳体和核体之间有间距。壳体的外表面和内表面分别标记有拉曼分子。核体的外表面标记有拉曼分子。壳体为金银合金制成,核体为金制成。该中空核壳纳米颗粒用于表面增强拉曼散射免疫层析试纸条。
该实施例中的中空核壳纳米颗粒,核体和壳体之间有间距,并可调,核壳之间些许小尺寸不规则金银合金梁柱桥接,因此,核壳可以保持相对固定。
在壳体的外表面和内表面分别标记有拉曼分子,核体的外表面标记有拉曼分子。单个颗粒尽可能多地修饰拉曼分子,从而提高检测信号强度。壳体为金银合金制成,核体为金制成,化学性质稳定,不易被氧化,有利于试纸条的保存。
上述实施例的中空核壳纳米颗粒的制备方法,包括:
步骤10)利用水热法制备出金种子:将水加热至沸腾后,依次加入氯金酸溶液和柠檬酸钠溶液,制备出金种子。
步骤20)通过种子生长-熟化法制备得到金颗粒:将水加热至沸腾后,依次加入柠檬酸钠溶液、氯金酸溶液、对苯二酚溶液和步骤10)制备的金种子,制备得到金颗粒;向溶液中加入尼罗蓝(应为全称:nilebluea,文中简称:nba)溶液,通过静电吸附原理,在金颗粒表面修饰一层拉曼分子。
步骤30)通过种子生长法制备au@ag金银核壳纳米颗粒:将步骤20)制备的金颗粒为种子,常温搅拌下,依次加入抗坏血酸溶液和硝酸银溶液,在金颗粒表面生长成银壳,搅拌下加入nba溶液,通过静电吸附在银表面修饰上拉曼分子,制成au@ag金银核壳纳米颗粒。
步骤40)以步骤30)制备的au@ag金银核壳纳米颗粒为牺牲模板,制备au@au-ag中空核壳纳米颗粒:将步骤30)制备的au@ag金银核壳纳米颗粒溶液加热至沸腾后,逐滴加入aucl2-溶液,反应结束后,过滤得到au@au-ag纳米颗粒溶液,再加入nba溶液,在颗粒表面修饰一层拉曼分子,制得au@au-ag中空核壳纳米颗粒。
上述实施例中,所述步骤10)中,金种子的尺寸为10~15nm;所述步骤20)中,金颗粒的尺寸为30~100nm。
如图2所示,本发明实施例还提供一种含有上述中空核壳纳米颗粒的试纸条,包括底衬5、样品垫6、纳米颗粒结合垫7、层析膜8和吸水垫11。层析膜8上设有相互平行的检测线9和质控线10;样品垫6、纳米颗粒结合垫7、层析膜8、吸水垫11依次紧密相连并附着在底衬5上;其中,纳米颗粒结合垫7上附着抗体和中空核壳纳米颗粒;检测线9上附着捕获抗体。
该实施例中,中空核壳纳米颗粒1包括核体101和壳体102。壳体102位于核体101外侧,壳体102和核体101之间有间距。壳体102的外表面和内表面分别标记有拉曼分子103。核体101的外表面标记有拉曼分子103。壳体102为金银合金制成,核体101为金制成。
上述试纸条进行临床标志物的检测方法,包括:将含有待测物3的样品溶液通过加样孔滴加在样品垫6上,静置后,利用拉曼光谱仪采集试纸条检测线9位置的拉曼光谱,根据拉曼光谱的相对强度,获得待测物3的浓度。静置时间可以为10—20min,例如15min。
纳米颗粒结合垫7上设有纳米颗粒标记的识别抗体2。纳米颗粒结合垫7由聚酯纤维膜制成。样品垫6由玻璃纤维膜制成。层析膜8由硝酸纤维素膜制成。检测线9抗体为捕获抗体4,纳米颗粒标记的抗体为识别抗体。捕获抗体4与识别抗体2为2株可互相配对形成夹心结构的单克隆抗体。
本发明实施例以au@au-ag中空核壳纳米颗粒制备免疫层析试纸条,通过拉曼光谱检测,实现临床标志物的快速、高灵敏、半定量检测。利用拉曼光谱技术对样品进行检测和鉴别具有非接触、无破坏等优点,无需特殊样品制备步骤,并且由于水对拉曼光谱的影响非常小,所以拉曼光谱可以被广泛地应用于生物体系中具备生物活性样品的检测。拉曼散射光谱的强度仅为入射光强的10-10,信号太弱以致难以收集检测。表面增强拉曼散射光谱技术(surfaceenhancedramanscattering,sers)的出现极大的提高了拉曼光谱技术的检测灵敏度。当具有拉曼活性的分子与金属纳米结构接触时,通过金属纳米结构的电磁增强和化学增强效应作用,能够使分子的拉曼光谱得到极大增强,增强能力达104~107。在待检测物浓度较低的情况下,要实现高灵敏检测,而金、银纳米颗粒能够使其表面拉曼分子的信号强度获得极大的增强,且拉曼光谱的强度与金、银纳米颗粒的数量具有正相关性,因而将金、银纳米颗粒的sers特性应用于免疫层析检测,即可实现快速、高灵敏、定量化的检测要求。
下面例举一具体实例:
针对ctni的快速检测制备au@au-ag中空核壳纳米颗粒标记的sers免疫层析试纸条的步骤及结果分析:
(1)制备拉曼分子尼罗蓝(nba)标记的au@au-ag中空核壳纳米颗粒:a)首先利用传统水热法制备15nm的金种子:将96ml水加热至沸腾后依次加入1ml浓度为25mm的氯金酸溶液和3ml浓度为1%柠檬酸钠溶液;b)通过种子生长-熟化法制备得到均匀的50nm金颗粒:将93ml水加热至沸腾后,依次加入1ml浓度为15mm柠檬酸钠溶液、1ml浓度为25mm氯金酸溶液、1ml浓度为25mm对苯二酚溶液和4ml上述15nm金种子,制备得到50nm金颗粒溶液,向金颗粒溶液中加入0.5ml浓度为10-4m的nba溶液,通过静电吸附原理在表面修饰一层拉曼分子;c)再次通过种子生长法制备au@ag金银核壳纳米颗粒:以50ml上述制备的50nm金颗粒为种子,常温搅拌下,依次加入0.25ml浓度为0.1m的抗坏血酸溶液和1.25ml浓度为10mm的硝酸银溶液,在金纳米颗粒表面生长成银壳,搅拌下加入0.5ml浓度为10-4m的nba溶液,通过静电吸附在银表面修饰上拉曼分子;d)以au@ag为牺牲模板制备au@au-ag中空核壳纳米颗粒:将50ml上述au@ag纳米颗粒溶液加热至沸腾后,加入24ml浓度为1mm的aucl2-溶液,反应结束后过滤得到au@au-ag纳米颗粒溶液,再加入0.5ml浓度为10-4m的nba溶液,在颗粒表面修饰一层拉曼分子。
(2)上述au@au-ag中空核壳纳米颗粒制备过程中所涉及到三个不同阶段的产物为50nm金纳米颗粒、au@ag核壳纳米颗粒和au@au-ag中空核壳纳米颗粒,因各自结构分别修饰了一层、两层、三层nba拉曼分子,通过拉曼光谱仪检测相同颗粒浓度下三种纳米颗粒溶液的拉曼光谱,结果如图3所示。从图3可以看出:au@au-ag中空核壳纳米颗粒拥有最强的sers活性,远大于金纳米颗粒和au@ag核壳纳米颗粒强度的二倍和三倍。
(3)调节上述修饰了nba分子的au@au-ag中空核壳纳米颗粒溶液ph至8.5,加入识别抗体(一株抗人h-ctni单克隆抗体a)与au@au-ag中空核壳纳米颗粒溶液反应,离心得沉淀,将沉淀重悬,得识别抗体标记的au@au-ag中空核壳纳米颗粒溶液。
(4)将聚酯纤维膜用0.05m、ph9.0的tris-hcl缓冲液(含质量分数为1%牛血清白蛋白、质量分数为0.02%nan3、质量分数为0.1%pva、质量分数为0.9%nacl、质量分数为10%蔗糖和质量分数为0.1%tritonx-100)浸泡后,烘干,使用上述识别抗体标记的au@au-ag中空核壳纳米颗粒溶液喷印,放置于37℃干燥箱中干燥后备。
(5)用捕获抗体(一株抗人h-ctni单克隆抗体b)在已活化硝酸纤维膜上喷划检测线,真空干燥;然后用羊抗鼠igg在已活化硝酸纤维膜上喷划质控线,真空干燥;
(6)按照样品垫、au@au-ag纳米颗粒标记垫、硝酸纤维素膜、吸水垫的顺序粘贴在单面压敏胶的塑料板上,切割,装入塑料卡;
(7)试纸条使用:将样品溶液通过加样孔滴加的样品垫上,静置15min;
(8)检测结果读取:a)使用肉眼观察检测线颜色,检测线能够显色,则可定性判断样品溶液中含有待测物;b)使用拉曼光谱仪在试纸条检测线位置检测拉曼信号,根据拉曼信号强度定量分析待测物在样品溶液中的浓度。
图4是试纸条检测不同浓度ctni后获得的光学照片。与传统方法一致,用肉眼观察不同浓度ctni免疫层析检测结果,只能够分辨出5ng/ml及以上浓度试纸条上的检测线。
图5是使用拉曼光谱仪检测试纸条检测线所获得的拉曼光谱,可以看出,随着ctni浓度的增加,拉曼光谱的强度逐渐增加。以拉曼分子nba光谱的主峰592cm-1强度为纵坐标,ctni的浓度为横坐标,进行对数转换后作出标准曲线,如图6所示。从图6中可以看出:nba光谱的强度与ctni浓度呈线性关系,检测限可以达到0.09ng/ml,较肉眼观察结果提升了50倍。
本发明使用au@au-ag中空核壳纳米颗粒代替目前常用的球形金纳米颗粒和金银核壳纳米颗粒,提高了表面增强拉曼散射免疫层析试纸条的检测灵敏度和保存稳定性,实现了人血清标志物简单快速、高灵敏、半定量检测。
以上显示和描述了本发明的基本原理、主要特征和优点。本领域的技术人员应该了解,本发明不受上述具体实施例的限制,上述具体实施例和说明书中的描述只是为了进一步说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护的范围由权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!