包括对西地尼布进行固定的间歇给药的方法与流程
本文披露了减少提供有效的vegf抑制所需的西地尼布的总剂量的新方法以及减少由于西地尼布给予引起的不良事件和毒性的方法,这些方法包括根据固定的间歇给药方案给予包含西地尼布的组合物的重复周期。
所披露的方法尽管降低了西地尼布的总剂量,但是可以维持对vegf途径的覆盖,并且因此还可以提供改善西地尼布的总体治疗指数的方法。此外,这些披露提供了在使用组合疗法治疗癌症期间增加对健康的、非癌组织的修复的新方法。
血管生成是新血管形成的过程,在各种过程中起关键作用,包括胚胎发育、伤口愈合和雌性生殖功能的若干部件。不希望的或病理性的血管生成已经与疾病状态相关,包括糖尿病性视网膜病、银屑病、癌症、类风湿性关节炎、粥样斑、卡波西氏肉瘤和血管瘤(范(fan)等人,1995,药物科学趋势(trendspharmacol.sci.)16:57-66;福克曼(folkman),1995,自然医学(naturemedicine)1:27-31)。的确,血管生成对于肿瘤生长和转移是必不可少的。(福克曼(folkman)肿瘤血管生成:治疗意义(tumorangiogenesis:therapeuticimplications),新英格兰医学杂志(n.engl.j.med.)1971;285:1182-6;卡利南-波夫(cullinan-bove)等人,1993,内分泌学(endocrinology)133:829-837;森杰(senger)等人,1993,癌症与转移综述(cancerandmetastasisreviews),12:303-324)。
因此,对血管生成的抑制是治疗癌症的可能性。在血管生成过程中的几个阶段可能破坏血管形成。由于已知血管内皮生长因子(vegf)是重要的促血管生成因子(费拉拉(ferraran.)血管内皮生长因子的分子和生物学性质(molecularandbiologicalpropertiesofvascularendothelialgrowthfactor),分子医学杂志(j.mol.med.)1999;77:527-43;费拉拉(ferraran.)vegf和对肿瘤血管生成因子的需求(vegfandthequestfortumorangiogenesisfactors),自然评论癌症(naturereviewscancer)2002;2:795-803),vegf及其受体(vegfr)是抑制血管生成的靶标(金(kim)等人,1993,自然(nature)362:841-844)。
受体酪氨酸激酶(rtk)在穿过细胞质膜的生化信号的传输中是重要的。这些跨膜分子特征性地由通过质膜中的区段连接到细胞内酪氨酸激酶结构域的细胞外配体结合结构域组成。配体与受体的结合导致受体相关的酪氨酸激酶活性的刺激,其导致受体和其他细胞内分子两者之上的酪氨酸残基的磷酸化。酪氨酸磷酸化的这些变化启动信号级联,导致多种细胞响应。迄今为止,已经鉴定了由氨基酸序列同源性定义的至少十九个不同的rtk亚家族。目前,这些亚家族之一由fms样酪氨酸激酶受体flt-1、含激酶插入结构域的受体kdr(也称为flk-1)和另一种fms样酪氨酸激酶受体flt-4构成。这些相关的rtk中的两种,即flt-1和kdr,已经显示以高亲和力结合vegf(德·弗里斯(devries)等人,1992,科学(science)255:989-991;特曼(terman)等人,1992,生物化学与生物物理研究通讯(biochem.biophys.res.comm.)1992,187:1579-1586)。vegf与在异源细胞中表达的这些受体的结合已经与细胞蛋白质和钙流的酪氨酸磷酸化状态的变化相关。
抑制vegf作用的化合物在治疗与血管生成和/或增加的血管通透性相关的以下疾病状态中有价值:例如癌症(包括白血病、多发性骨髓瘤和淋巴瘤)、糖尿病、银屑病、类风湿性关节炎、卡波西氏肉瘤、血管瘤、急性和慢性肾病、粥样斑、动脉再狭窄、自身免疫性疾病、急性炎症、过度瘢痕形成和粘连、子宫内膜异位、淋巴水肿、功能障碍性子宫出血和包括黄斑变性的具有视网膜血管增殖的眼部疾病。
已经在人血管内皮上鉴定了具有相关酪氨酸激酶活性的vegf的两种高亲和力受体:vegfr-1和vegfr-2。vegfr-3是vegfr基因家族的第三个成员,在调节启动新血管形成的内皮顶端细胞中起关键作用,并且被认为对淋巴管生成很重要。vegfr-3被配体vegf-c和vegf-d激活,并且具有与vegfr-2交流的潜力。虽然它们在介导肿瘤进展中的相对贡献尚未得到解决,但一些研究表明vegfr-2可能具有主导作用(费拉拉(ferraran.)血管内皮生长因子的分子和生物学性质(molecularandbiologicalpropertiesofvascularendothelialgrowthfactor),分子医学杂志(j.mol.med.)1999;77:527-43)。
如本文使用,西地尼布是指具有iupac名称为4-[(4-氟-2-甲基-1h-吲哚-5-基)氧基]-6-甲氧基-7-[3-(吡咯烷-1-基)丙氧基]喹唑啉马来酸酯(也称为azd2171马来酸酯)的化合物,并且具有以下结构:
如本文使用,西地尼布包括其盐、酯、前药、水合物和溶剂合物。
游离碱4-[(4-氟-2-甲基-1h-吲哚-5-基)氧基]-6-甲氧基-7-[3-(吡咯烷-1-基)丙氧基]喹唑啉示例于wo00/47212(和美国专利号7,074,800)中,例如作为实例240。其马来酸盐,西地尼布,被披露并示例于美国专利号8,859,570中。
西地尼布是所有三种vegf受体(vegfr-1、-2、-3)的口服活性vegf受体酪氨酸激酶(rtk)抑制剂,其充当vegf-a、vegf-b、vegf-c和vegf-d的受体。靶向所有三种vegfr导致vegf信号传导途径的综合抑制。通过vegfr-2的信号传导的抑制降低血管生成、新生血管存活和血管通透性。另外,通过vegfr-3的信号传导的抑制降低淋巴管生成,有助于减少转移性扩散。据报道,西地尼布在一系列临床前模型中以剂量依赖性方式抑制肿瘤的生长,与微血管密度和转移的减少相关。总之,这些变化表明,西地尼布通过抑制vegfr家族来抑制肿瘤生长、转移和血管通透性(布雷夫(brave)等人,评估作为vegfr-2/3酪氨酸激酶抑制剂的西地尼布对vegfr-1和结构相关的pdgfr家族的成员的活性(assessingtheactivityofcediranib,vegfr-2/3tyrosinekinaseinhibitor,againstvegfr-1andmembersofthestructurallyrelatedpdgfrfamily),分子癌症治疗(mol.cancerther.)2011,10(5):861-73;赫克曼(heckman)等人,酪氨酸激酶抑制剂西地尼布阻断配体诱导的血管内皮生长因子受体-3活性和淋巴管生成(thetyrosinekinaseinhibitorcediranibblocksligand-inducedvascularendothelialgrowthfactorreceptor-3activityandlymphangiogenesis),癌症研究(cancerres.)2008,68(12):4754-62;史密斯(smith)等人,血管内皮生长因子信号传导抑制剂azd2171在calu-6人肺肿瘤异种移植物中的急性药效和抗血管作用(acutepharmacodynamicandantivasculareffectsofthevascularendothelialgrowthfactorsignalinginhibitorazd2171incalu-6humanlungtumorxenografts.)分子癌症治疗(mol.cancerther.)2007,6(8):2198-208;韦奇(wedge)等人,azd2171:高度强效的、口服生物可利用的、血管内皮生长因子受体-2酪氨酸激酶抑制剂用于癌症的治疗(azd2171:ahighlypotent,orallybioavailable,vascularendothelialgrowthfactorreceptor-2tyrosinekinaseinhibitorforthetreatmentofcancer)癌症研究(cancerres.)2005,65:4389-400)。
已经在包括单一疗法和组合疗法的宽的临床程序中,在多种肿瘤类型(包括例如结肠直肠癌、恶性胶质瘤、非小细胞肺癌(nsclc)、小细胞肺癌(sclc)、肾细胞癌(rcc)、软组织腺泡状肉瘤(asps)和卵巢癌)中,以及在一系列其他肿瘤类型中的大量信号搜索研究中评估了西地尼布。已经探索了西地尼布与卡铂和紫杉醇(劳里(laurie)等人,在晚期非小细胞肺癌患者中每日口服血管内皮生长因子酪氨酸激酶抑制剂azd2171与卡铂和紫杉醇的组合的i期药代动力学研究:加拿大国家癌症研究所临床试验组(phaseipharmacokineticstudyofdailyoralazd2171,aninhibitorofvascularendothelialgrowthfactortyrosinekinases,incombinationwithcarboplatinandpaclitaxelinpatientswithadvancednon-smallcelllungcancer:thenationalcancerinstituteofcanadaclinicaltrialsgroup),临床肿瘤学杂志(j.clin.oncol.)2008,26(11):1871-78)以及顺铂和吉西他滨(戈斯(goss)等人,在晚期非小细胞肺癌患者中每日口服血管内皮生长因子酪氨酸激酶抑制剂西地尼布与顺铂和吉西他滨的组合的i期药代动力学研究:加拿大国家癌症研究所临床试验组的研究(欧洲癌症杂志(eur.j.cancer)2009,45(5):782-8)组合的可行性、活性和药代动力学(pk)。
本文披露了在对其有需要的温血动物(例如人类)中产生抗血管生成和/或血管通透性降低作用的方法,并且这些方法包括根据固定的间歇给药方案给予包含西地尼布的组合物的重复周期。在另一个方面,披露了在对其有需要的温血动物(例如人类)中产生抗血管生成和/或血管通透性降低作用的方法,并且这些方法包括根据固定的间歇给药方案给予包含西地尼布的组合物的至少两个周期。本文还披露了在对其有需要的温血动物(例如人类)中治疗至少一种与血管生成相关的疾病状态的方法,所述方法包括根据固定的间歇给药方案给予包含西地尼布的组合物的重复周期。本文还披露了在对其有需要的温血动物(例如人类)中治疗至少一种与血管生成相关的疾病状态的方法,所述方法包括根据固定的间歇给药方案给予包含西地尼布的组合物的至少两个周期。固定的间歇给药方案包括在周期的一天或连续多天(例如至少连续两天)给予有效量的包含西地尼布的组合物,接着在停止的一天或连续多天(例如至少连续两天)不给予所述组合物。这些方法包括仅使用包含西地尼布的组合物,并且因此可以用于单一疗法,抑或可以进一步包括给予一种或多种伴侣药物,并且因此可以用于组合疗法。
本文披露了减少提供有效的vegf抑制所需的西地尼布的总剂量的新方法以及减少由于西地尼布给予引起的不良事件和毒性的方法,这些方法包括根据固定的间歇给药方案给予包含西地尼布的组合物的重复周期(例如至少两个周期)。对西地尼布鉴定的风险不良事件和毒性的非限制性实例包括腹泻、严重疲劳、严重中性粒细胞减少和发热性中性粒细胞减少、高血压、gi穿孔、瘘管、动脉血栓栓塞和后部可逆性脑病综合征(pres)。
所披露的方法尽管降低了西地尼布的总剂量,但是可以维持对vegf途径的覆盖,并且因此还可以提供改善西地尼布的总体治疗指数的方法。此外,这些披露提供了在使用组合疗法治疗癌症期间增加对健康的、非癌组织的修复的新方法。
不同于涉及从西地尼布停药7天的给药方案,并且还不同于以前的涉及从在患者中必然伴随不良事件的连续给药方案的计划外给药停止日的研究,包括根据固定的间歇给药方案给予包含西地尼布的组合物的新方法令人惊讶地可以导致肿瘤控制的维持。因此,新方法允许给予提供有效vegf抑制所需的减少的西地尼布总剂量。相应地,新的给药方案的使用还提供了减少由于西地尼布给予导致的不良事件和/或毒性同时保持对vegf途径的覆盖的方法。此外,这提供了在使用组合疗法治疗癌症期间增加对健康的、非癌组织的修复的方法。
附图的简要说明
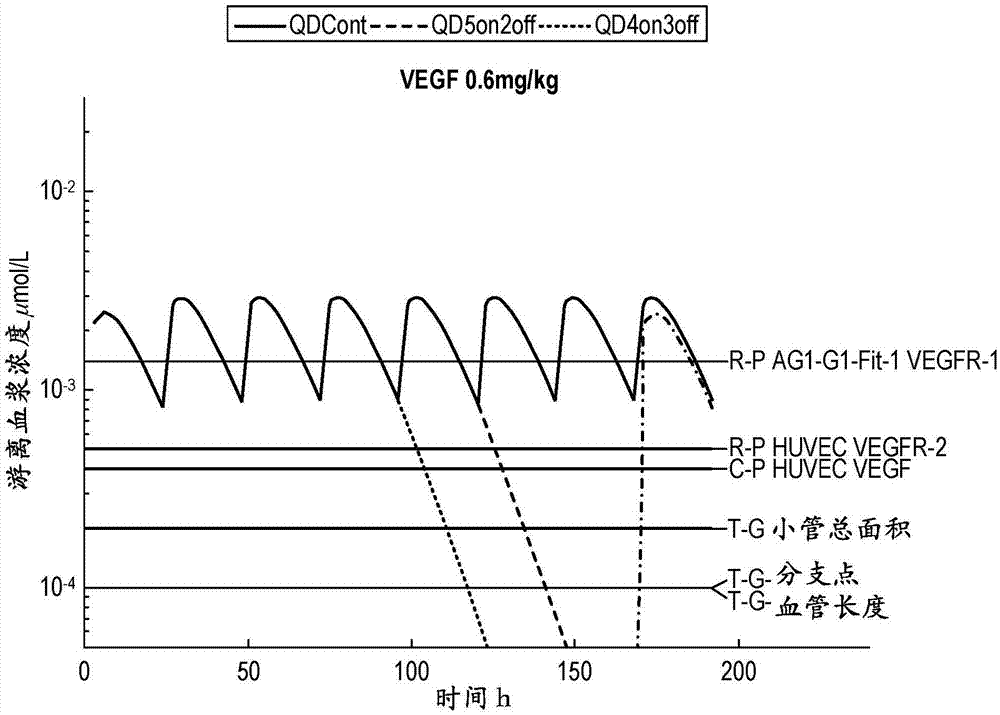
图1(a)-(p)显示按照每日一次连续给予(qdcont)、每日一次给予5天停止2天(qd5on2off)或每日一次给予4天(qd4on3off),分别在a)0.6mg/kg(图1a-1d),b)1.2mg/kg(图1e-1h),c)2.4mg/kg(图11-l)或d)4.8mg/kg(图1m-1p)下给药的西地尼布在临床前模型中随时间的模拟平均游离血浆浓度,其中水平线显示在体外产生的对所指示的pvegfr、pkit、ppdgfrα和ppdgfrβ的抑制的细胞ic50值。对于示例性vegfr和kit覆盖的曲线图,r-p代表基于细胞的试验中的受体磷酸化;c-p代表细胞增殖;对于vegfr曲线图,t-g代表内皮成纤维细胞共培养试验中的小管生长。指示了相关的细胞系。对于描绘pdgfrα和β覆盖的图,与相关细胞系一起显示pdgfrα的抑制和pdgfrβ磷酸化以及pdgfbb或pdgfaa驱动的增殖。
图2显示了对于20mg和15mg剂量的西地尼布,在人中对于西地尼布(黑线)的游离药物暴露与时间的模拟平均值。
图3显示了三项功效研究(在calu6、a498和sw620肿瘤异种移植物中进行)各自使用四个口服给药方案组(第1组(运载体每日一次持续21天)、第2组(1.5mg/kg西地尼布每日一次持续21天)、第3组(3mg/kg西地尼布每日一次持续21天)和第6组(3个7天周期的1.5mg/kg西地尼布每日一次持续5天,接着运载体每日一次持续2天)的平均肿瘤体积与时间。数据显示为平均值(+/-平均值的标准误差)。n表示在相关日期终止的动物数量。
图4显示了三项功效研究(在calu6、a498和sw620肿瘤异种移植物中)各自使用四个口服给药方案组(第1组(运载体每日一次持续21天)、第2组(1.5mg/kg西地尼布每日一次持续21天)、第3组(3mg/kg西地尼布每日一次持续21天)和第7组(3个7天周期的3mg/kg西地尼布每日一次持续5天,接着运载体每日一次持续2天)的平均肿瘤体积与时间。数据显示为平均值(+/-平均值的标准误差)。n表示在相关日期终止的动物数量。
图5显示了三项功效研究(calu6、a498和sw620)各自使用四个口服给药方案组(第1组(运载体每日一次持续21天)、第2组(1.5mg/kg西地尼布每日一次持续21天)、第3组(3mg/kg西地尼布每日一次持续21天)和第8组(3个7天周期的1.5mg/kg西地尼布每日一次持续3天,接着运载体每日一次持续4天)的平均肿瘤体积与时间。数据显示为平均值(+/-平均值的标准误差)。n表示在相关日期终止的动物数量。
图6显示了三项功效研究(calu6、a498和sw620)各自使用四个口服给药方案组(第1组(运载体每日一次持续21天)、第2组(1.5mg/kg西地尼布每日一次持续21天)、第3组(3mg/kg西地尼布每日一次持续21天)和第9组(3个7天周期的3mg/kg西地尼布每日一次持续3天,接着运载体每日一次持续4天)的平均肿瘤体积与时间。数据显示为平均值(+/-平均值的标准误差)。n表示在相关日期终止的动物数量。
图7显示了在ov2022(卵巢癌)患者衍生的肿瘤异种移植模型中进行的功效研究的平均肿瘤体积与时间。这项研究比较了西地尼布与奥拉帕尼组合,其中西地尼布每日一次给予或每日一次给予5天停止2天。第1组-对照,第2组-3mg/kg西地尼布每日一次,第3组-3mg/kg西地尼布每日一次给予5天停止2天,第4组-100mg/kg奥拉帕尼每日一次,第5组-3mg/kg西地尼布每日一次加100mg/kg奥拉帕尼每日一次,第6组-3mg/kg西地尼布每日一次给予5天停止2天加100mg/kg奥拉帕尼每日一次。
图8显示了研究中每组带瘤动物的体重变化。这项研究比较了西地尼布与奥拉帕尼组合,其中西地尼布每日一次给予或每日一次给予5天停止2天。第1组-对照,第2组-3mg/kg西地尼布每日一次,第3组-3mg/kg西地尼布每日一次给予5天停止2天,第4组-100mg/kg奥拉帕尼每日一次,第5组-3mg/kg西地尼布每日一次加100mg/kg奥拉帕尼每日一次,第6组-3mg/kg西地尼布每日一次给予5天停止2天加100mg/kg奥拉帕尼每日一次。
图9显示了对于在不同给药方案群组(如在实例5中所述的dl1、dl2和dl3)中的每个患者,在试验期间观察到的肿瘤尺寸(从基线)的最大响应(即,在试验期间的任何时间点可能已经观察到的最大响应)。黑色十字指示根据在数据锁处接受治疗的患者。
图10显示对于在不同给药方案群组(如在实例5中所述的dl1、dl2和dl3)中每个患者的患者肿瘤尺寸随时间从基线的变化。
如本文使用,“治疗”(treating和treatment)是指疾病状态、失调、血管生成和/或血管通透性作用的进展、严重程度和/或持续时间的减轻或改善,或前述任一者的至少一种症状的改善。在一些实施例中,“治疗”(treating)是指无进展生存期的增加。
在一些实施例中,本文披露的方法导致肿瘤控制的维持。在一些实施例中,本文披露的方法允许给予提供有效vegf抑制所需的减少的西地尼布总剂量。在一些实施例中,本文披露的方法是减少由于给予西地尼布引起的不良事件和/或毒性同时维持对vegf途径的覆盖的方法。在一些实施例中,本文披露的方法治疗患有铂敏感性复发性卵巢癌的温血动物。在一些实施例中,本文披露的方法改善患者的无进展生存期。在一些实施例中,患者的无进展生存期的改善是统计学显著的。在一些实施例中,患者的无进展生存期的统计学显著改善是当p<0.05时。在一些实施例中,患者的无进展生存期的统计学显著改善是当p<0.01时。
在一些实施例中,本文披露的方法改善患者的总体生存期。在一些实施例中,患者的总体生存期的改善是统计学显著的。在一些实施例中,患者的总体生存期的统计学显著改善是当p<0.05时。在一些实施例中,患者的总体生存期的统计学显著改善是当p<0.01时。
在另一个实施例中,披露了包含西地尼布的组合物用于在温血动物(例如人类)中产生抗血管生成和/或血管通透性降低作用,其中该包含西地尼布的组合物是根据固定的间歇给药方案给予的。在另一个实施例中,披露了包含西地尼布的组合物用于在温血动物(例如人类)中产生抗血管生成和/或血管通透性降低作用,其中该包含西地尼布的组合物的至少两个周期是根据固定的间歇给药方案给予的。
在另一个实施例中,本文披露了包含西地尼布的组合物用于在温血动物(例如人类)中治疗至少一种与血管生成相关的疾病状态,其中该包含西地尼布的组合物是根据固定的给药方案给予的。本文还披露了包含西地尼布的组合物用于在温血动物(例如人类)中治疗至少一种与血管生成相关的疾病状态,其中该包含西地尼布的组合物的至少两个周期是根据固定的给药方案给予的。
在另一个实施例中,披露了包含西地尼布的组合物用于降低在温血动物(例如人类)中提供有效vegf抑制所需的西地尼布的总剂量,其中该包含西地尼布的组合物是根据固定的给药方案给予的。本文还披露了包含西地尼布的组合物用于降低在温血动物(例如人类)中提供有效vegf抑制所需的西地尼布的总剂量,其中该包含西地尼布的组合物的至少两个周期是根据固定的给药方案给予的。
在另一个实施例中,披露了包含西地尼布的组合物用于在温血动物(例如人类)中减少由于西地尼布给予引起的不良事件和/或毒性,其中该包含西地尼布的组合物是根据固定的给药方案给予的。本文还披露了包含西地尼布的组合物用于在温血动物(例如人类)中减少由于西地尼布给予引起的不良事件和/或毒性,其中该包含西地尼布的组合物的至少两个周期是根据固定的给药方案给予的。
在另一个实施例中,披露了包含西地尼布的组合物用于在温血动物(例如人类)中癌症的组合疗法治疗期间增加对健康的、非癌组织的修复,其中该包含西地尼布的组合物是根据固定的给药方案给予的。本文还披露了包含西地尼布的组合物用于在温血动物(例如人类)中癌症的组合疗法治疗期间增加对健康的、非癌组织的修复,其中该包含西地尼布的组合物的至少两个周期是根据固定的给药方案给予的。
在另一个实施例中,披露了包含西地尼布的组合物用于治疗具有铂敏感性复发性癌症的温血动物(例如人类),其中该包含西地尼布的组合物是根据固定的给药方案给予的。本文还披露了包含西地尼布的组合物用于治疗具有铂敏感性复发性癌症的温血动物(例如人类),其中该包含西地尼布的组合物的至少两个周期是根据固定的给药方案给予的。
在另一个实施例中,披露了包含西地尼布的组合物用于肿瘤控制的维持。在另一个实施例中,披露了包含西地尼布的组合物用于降低提供有效vegf抑制所需的西地尼布的总剂量。在另一个实施例中,披露了包含西地尼布的组合物用于减少由于给予西地尼布引起的不良事件和/或毒性同时维持对vegf途径的覆盖。在另一个实施例中,本文披露的组合物改善患者的无进展生存期。在一些实施例中,患者的无进展生存期的统计学显著改善是当p<0.05时。在一些实施例中,患者的无进展生存期的统计学显著改善是当p<0.01时。
在另一个实施例中,披露了包含西地尼布的组合物在制造用于在温血动物(例如人类)中产生抗血管生成和/或血管通透性降低作用的药物中的用途,其中该包含西地尼布的组合物是根据固定的间歇给药方案给予的。在另一个实施例中,披露了包含西地尼布的组合物在制造用于在温血动物(例如人类)中产生抗血管生成和/或血管通透性降低作用的药物中的用途,其中该包含西地尼布的组合物的至少两个周期是根据固定的间歇给药方案给予的。
在另一个实施例中,本文披露了包含西地尼布的组合物在制造用于治疗温血动物(例如人类)中至少一种与血管生成相关的疾病状态的药物中的用途,其中该包含西地尼布的组合物是根据固定的给药方案给予的。本文还披露了包含西地尼布的组合物在制造用于治疗温血动物(例如人类)中至少一种与血管生成相关的疾病状态的药物中的用途,其中该包含西地尼布的组合物的至少两个周期是根据固定的给药方案给予的。
在另一个实施例中,披露了包含西地尼布的组合物在制造用于减少在温血动物(例如人类)中提供有效vegf抑制所需的西地尼布总剂量的药物中的用途,其中该包含西地尼布的组合物是根据固定的给药方案给予的。在一个实施例中,维持了对vegf途径的覆盖。本文还披露了包含西地尼布的组合物在制造用于降低在温血动物(例如人类)中提供有效vegf抑制所需的西地尼布总剂量的药物中的用途,其中该包含西地尼布的组合物的至少两个周期是根据固定的给药方案给予的。
在另一个实施例中,披露了包含西地尼布的组合物在制造用于在温血动物(例如人类)中减少由于西地尼布给予引起的不良事件和/或毒性的药物中的用途,其中该包含西地尼布的组合物是根据固定的给药方案给予的。本文还披露了包含西地尼布的组合物在制造用于在温血动物(例如人类)中减少由于西地尼布给予引起的不良事件和/或毒性的药物中的用途,其中该包含西地尼布的组合物的至少两个周期是根据固定的给药方案给予的。
在另一个实施例中,披露了包含西地尼布的组合物在制造用于在温血动物(例如人类)中癌症的组合疗法治疗期间增加对健康的、非癌组织的修复的药物中的用途,其中该包含西地尼布的组合物是根据固定的给药方案给予的。本文还披露了包含西地尼布的组合物在制造用于在温血动物(例如人类)中癌症的组合疗法治疗期间增加对健康的、非癌组织的修复的药物中的用途,其中该包含西地尼布的组合物的至少两个周期是根据固定的给药方案给予的。
在另一个实施例中,披露了包含西地尼布的组合物在制造用于治疗具有铂敏感性复发性癌症的温血动物(例如人类)的药物中的用途,其中该包含西地尼布的组合物是根据固定的给药方案给予的。本文还披露了包含西地尼布的组合物在制造用于治疗具有铂敏感性复发性癌症的温血动物(例如人类)的药物中的用途,其中该包含西地尼布的组合物的至少两个周期是根据固定的给药方案给予的。
在另一个实施例中,披露了包含西地尼布的组合物在制造用于肿瘤控制的维持的药物中的用途。在另一个实施例中,披露了包含西地尼布的组合物在制造用于降低提供有效vegf抑制所需的西地尼布的总剂量的药物中的用途。在另一个实施例中,披露了包含西地尼布的组合物在制造用于减少由于给予西地尼布引起的不良事件和/或毒性同时维持对vegf途径的覆盖的药物中的用途。在另一个实施例中,本文披露的组合物改善患者的无进展生存期。在一些实施例中,患者的无进展生存期的统计学显著改善是当p<0.05时。在一些实施例中,患者的无进展生存期的统计学显著改善是当p<0.01时。
如本文使用的,术语“有效量”意指足以引起希望的生物响应的量。如本领域普通技术人员将认识到的,西地尼布的有效量可以取决于各种因素例如进行治疗的疾病状态、进行治疗的疾病状态的严重性、治疗希望的效果、对治疗有需要的温血动物、和给药途径而变化。
如本文使用,“至少一种与血管生成相关的疾病状态”包括以下非限制性实例:癌症、糖尿病、银屑病、类风湿性关节炎、卡波西氏肉瘤、血管瘤、淋巴水肿、急性和慢性肾病、粥样斑、动脉再狭窄、自身免疫性疾病、急性炎症、过度瘢痕形成和粘连、子宫内膜异位、功能障碍性子宫出血和包括年龄相关性黄斑变性的具有视网膜血管增殖的眼部疾病。
如本文使用,术语“癌症”包括以异常细胞的不受控制生长为特征的一类疾病的任何成员。如本文使用的癌症可以影响任何组织,包括软组织或实体,并且包括白血病、多发性骨髓瘤和淋巴瘤。该术语包括所有已知的癌症和肿瘤病症,无论被描述为恶性的还是良性的,无论是原发还是复发的,任何阶段或分级,并且与临床病理、形态和/或对化疗的敏感性无关。癌症的非限制性实例包括肺癌(例如非小细胞肺癌(nsclc)和小细胞肺癌(sclc));消化道和胃肠道癌症,例如结肠直肠癌、胃肠道间质瘤、胃肠道类癌瘤、结肠癌、直肠癌、肛门癌、胆道癌、小肠癌和胃(stomach或gastric)癌;食道癌;胆囊癌;肝癌;胰腺癌;阑尾癌;乳腺癌;卵巢癌;肾癌(例如肾细胞癌);前列腺癌;中枢神经系统癌症;皮肤癌;淋巴瘤;恶性胶质瘤;间皮瘤;绒毛膜癌;胆管细胞癌;软组织腺泡状肉瘤(asps);头颈癌(包括甲状腺癌);骨原性肉瘤;和血癌。卵巢癌的非限制性实例包括铂敏感性卵巢癌、铂敏感性复发性卵巢癌、铂不敏感性卵巢癌(耐药性和难治性)、高级别浆液性卵巢癌、高级别子宫内膜卵巢癌、透明细胞卵巢癌、粘液性卵巢癌等。如本文使用,卵巢癌包括输卵管癌和腹膜癌,包括原发性腹膜癌。
如本文使用,“抗血管生成和/或血管通透性降低作用”可以通过本领域普通技术人员已知的各种试验和测试来进行评估,包括(例如)测量与vegf受体(例如flt和/或kdr)相关的酪氨酸激酶活性的抑制的那些。这些特性可以例如通过以下各项中的一个或多个来进行评估:(a)体外受体酪氨酸激酶抑制测试,(b)体外huvec增殖试验,(c)体内实体肿瘤疾病模型。此类试验的非限制性实例列于下面,但是普通技术人员将认识到其他程序同样是合适的。
如本文使用,术语“固定的间歇给药方案”是指预先计划的药物给予的重复周期,其中该药物在一天或连续多天被给予(“给予天数”),接着是一天或连续多天不给予药物(“停止天数”)。
在一些实施例中,周期是有规律的,因为给予天数和停止天数的模式在每个周期中是相同的。在一些实施例中,周期是不规律的,因为给予天数和停止天数的模式从一个周期到下一个周期不同。然而,在一些实施例中,每个重复周期是预先计划的,因为它不是仅响应于一个或多个不良事件的出现而确定的。
在一些实施例中,将包含西地尼布的组合物的给予重复进行一至十个周期,例如像一个周期、两个周期、三个周期、四个周期、五个周期、六个周期、七个周期、八个周期、九个周期或十个周期。
在一些实施例中,一个周期包含3天至60天。在一些实施例中,一个周期包含7至50天,例如7至30天、7至21天、或7至14天。在一些实施例中,一个周期由7天组成。
在一些实施例中,固定的间歇给药方案包括在连续的1至5天(例如连续2至5天)给予有效量的所述包含西地尼布的组合物,接着6至2天停止(例如5至2天停止)的重复周期。在一些实施例中,固定的间歇给药方案包括连续5天给予有效量的所述包含西地尼布的组合物接着停止2天的重复周期。在一些实施例中,固定的间歇给药方案包括连续4天给予有效量的所述包含西地尼布的组合物接着停止3天的重复周期。在一些实施例中,固定的间歇给药方案包括连续3天给予有效量的所述包含西地尼布的组合物接着停止4天的重复周期。
在一些实施例中,固定的间歇给药方案包括在连续的1至5天(例如连续2至5天)给予有效量的所述包含西地尼布的组合物,接着6至2天停止(例如5至2天停止)的重复周期。在一些实施例中,在所述停止天数给予安慰剂。
在一些实施例中,固定的间歇给药方案包括以20mg的剂量每日一次口服给予西地尼布持续7天周期中的5天,接着2天给予安慰剂。在一些实施例中,固定的间歇给药方案包括以20mg的剂量每日一次口服给予西地尼布持续7天周期中的4天,接着3天给予安慰剂剂量。在一些实施例中,固定的间歇给药方案包括以30mg的剂量每日一次口服给予西地尼布持续7天周期中的5天,接着2天给予安慰剂。在一些实施例中,固定的间歇给药方案包括以30mg的剂量每日一次口服给予西地尼布持续7天周期中的4天,接着3天给予安慰剂剂量。在一些实施例中,可以通过待治疗的温血动物的需要来确定给予周期接着停止周期的选择。例如,可以选择给予天数接着停止天数的任意重复进行1至10个周期,其中每个周期包括3-60天。
适合用于本披露方法的包含西地尼布的组合物可以是适合于口服给予的形式(例如,作为片剂、锭剂、硬或软胶囊剂、水性或油性悬浮液、乳剂、可分散粉剂或颗粒剂、糖浆剂或酏剂),适合于通过吸入给予(例如,作为细分散的粉末或液体气溶胶),适合于通过吹入给予(例如,作为细分散的粉末),适合于肠胃外注射(例如,作为无菌溶液、悬浮液或乳液用于静脉内、皮下、肌内、血管内或输注给药),适合于局部给予(例如作为乳膏剂、软膏剂、凝胶剂、或水性或油性溶液或悬浮液),或适合于直肠给予(例如作为栓剂)。在一些实施例中,口服给予包含西地尼布的组合物。
在一些实施例中,包含西地尼布的组合物可以使用至少一种常规赋形剂以常规方式来制备。在一些实施例中,包含西地尼布的组合物由西地尼布组成。在一些实施例中,包含西地尼布的组合物进一步包含至少一种药学上可接受的赋形剂或载体。在一些实施例中,包含西地尼布的组合物包含作为唯一药物活性成分的西地尼布。在一些实施例中,包含西地尼布的组合物进一步包含至少一种另外的药物活性成分。
西地尼布的剂量可以根据治疗需要而变化。在一个实施例中,包含西地尼布的组合物是处于单位剂型。在一些实施例中,将包含西地尼布的组合物以单位剂量给予至温血动物,所述单位剂量在每平方米动物体表面积1-50mg的范围内,例如在人中大约0.03mg/kg至1.5mg/kg。在一些实施例中,单位剂量范围例如为从0.01mg/kg至1.5mg/kg,进一步例如为从0.05mg/kg至0.75mg/kg,并且进一步例如为从0.03mg/kg至0.5mg/kg。
在一些实施例中,包括西地尼布的组合物以0.6mg/kg的剂量给予。在一些实施例中,包括西地尼布的组合物以1.2mg/kg的剂量给予。在一些实施例中,包括西地尼布的组合物以2.4mg/kg的剂量给予。在一些实施例中,包括西地尼布的组合物以4.8mg/kg的剂量给予。
在一些实施例中,固体剂型包含如按西地尼布游离碱的重量测量的范围为从0.5mg至90mg的量的西地尼布。在一些实施例中,固体剂型包含如按西地尼布游离碱的重量测量的范围为从1mg至50mg的量的西地尼布。在一些实施例中,固体剂型包含如按西地尼布游离碱的重量测量的范围为从5mg至50mg,例如从10mg至40mg,例如从15mg至35mg,以及进一步例如从20mg至30mg的量的西地尼布。在一些实施例中,固体剂型包含如按西地尼布游离碱的重量测量的30mg的量的西地尼布。在一些实施例中,固体剂型包含如按西地尼布游离碱的重量测量的20mg的量的西地尼布。在一些实施例中,固体剂型包含如按西地尼布游离碱的重量测量的15mg的量的西地尼布。
在一些实施例中,西地尼布的日剂量范围为如按西地尼布游离碱的重量测量的从5mg至50mg,例如从15mg至35mg,并且进一步例如为从20mg至30mg。在一些实施例中,西地尼布的日剂量为如按西地尼布游离碱的重量测量的30mg。在一些实施例中,西地尼布的日剂量为如按西地尼布游离碱的重量测量的20mg。在一些实施例中,西地尼布的日剂量为如按西地尼布游离碱的重量测量的15mg。在一些实施例中,西地尼布的日剂量为如按西地尼布游离碱的重量测量的10mg。
在一些实施例中,西地尼布以固体剂型(例如片剂)给予,其包含相当于30mg的西地尼布的游离碱(其为37.8mg的西地尼布马来酸盐)的重量。在一些实施例中,西地尼布以固体剂型(例如片剂)给予,其包含相当于20mg的西地尼布的游离碱(其为25.2mg的西地尼布马来酸盐)的重量。在一些实施例中,西地尼布以固体剂型给予,其包含相当于15mg的西地尼布的游离碱(其为18.9mg的西地尼布马来酸盐)的重量。
在一些实施例中,每日一次地给予西地尼布。在一些实施例中,每日两次地给予西地尼布。在一些实施例中,每日三次地给予西地尼布。在一些实施例中,每日四次地给予西地尼布。在一些实施例中,每日五次地给予西地尼布。
在一些实施例中,将西地尼布给予至空腹(例如像在餐前1小时或餐后至少2小时)的温血动物,例如人类。
在一些实施例中,例如在温血动物难以吞咽片剂的情况下,将西地尼布片剂分散在非碳酸饮用水中。在一些实施例中,西地尼布分散剂通过鼻胃或胃造口管给予。
如上所披露,这些方法可以使用西地尼布作为单一疗法或作为组合疗法的一部分,所述组合疗法除了西地尼布之外,可以涉及选自伴侣药物的至少一种其他组分和其他治疗。这种组合疗法可以通过同时、顺序和/或分别给予治疗的单个组分(西地尼布组合物和至少一种其他组分)来实现。在一些实施例中,单个组分同时给予。在一些实施例中,单个组分分别给予。在一些实施例中,单个组分依次给予。
血管生成和vegr2介导的维持血管功能以及控制高血压对许多正常组织是重要的,并且vegfr信号传导的长期抑制可以导致正常组织中的压力,其可以表现为临床观察,例如疲劳、甲状腺功能的改变和腹泻。当与还可对正常组织具有显著影响的至少一种其他组分(例如特别是可导致需要修复的损伤的那些)组合时,那么西地尼布的连续给药可延迟和/或阻止正常组织的修复。相应地,在时间表中使用本文披露的具有规律的短暂的间歇性中断的固定的间歇给药方案(作为单一疗法或组合)给予西地尼布可允许正常组织的修复但不允许肿瘤恢复。此外,短暂的中断可以确保没有共同药物例如像抗高血压药物的问题。
在医学肿瘤学领域中,通常使用不同形式的治疗的组合来治疗患有癌症的患者。在医学肿瘤学中,除给予西地尼布之外,此类组合疗法治疗的至少一种其他组分可以选自手术、放射疗法和化学疗法。这样的化学疗法可以包括至少一种伴侣药物。对于对正常组织具有更大影响的伴侣药物,例如化学疗法,适用相同的策略。在损伤最大的时候,那么稍微更长的预先计划的剂量中断可能是适当的,例如,中断4-5天。伴侣药物的非限制性实例包括:
dna损伤响应抑制剂(例如像parp抑制剂(例如,奥拉帕尼(olaparib或lynparza))、wee-1抑制剂、atr抑制剂、atm抑制剂、和dnapk抑制剂),
免疫检查点调节剂(例如像,抗pd-1抗体、抗pd-l1抗体(例如像medi4736(杜伐鲁单抗(durvalumab)))、抗ctla4抗体、tlr7激动剂、cd40激动剂、lag-3拮抗剂和ox40激动剂),
肿瘤细胞靶向治疗剂(例如像egfr、her2、mapk/raf、met、pi3k、mtor、akt、雌激素拮抗剂、雄激素靶向治疗剂、fgfr、mct-1和mct-4抑制剂),以及
化学治疗剂(例如像基于铂的化学疗法、基于紫杉烷的化学疗法、和伊曲康(irotecan)),包括:
(i)其他抗血管生成剂例如烷化剂(例如,顺铂、奥沙利铂、卡铂、环磷酰胺、氮芥、美法仑、苯丁酸氮芥、白消安、苯达莫司汀、替莫唑胺、亚硝基脲和噻替派);抗代谢药(例如,吉西他滨和抗叶酸剂,例如氟嘧啶如5-氟尿嘧啶和喃氟啶、雷替曲塞、甲氨蝶呤、阿糖胞苷、羟基脲和嘌呤类似物例如氟达拉滨、和腺苷类似物);抗肿瘤抗生素(例如,蒽环类药物如阿霉素、博来霉素、多柔比星、道诺霉素、表柔比星、伊达比星、丝裂霉素c、更生霉素和光神霉素);抗有丝分裂剂(例如,长春花生物碱如长春新碱、长春花碱、长春地辛和长春瑞滨,紫杉烷类如紫杉醇和泰素帝,和polokinase抑制剂);和拓扑异构酶抑制剂(例如,表鬼臼毒素如依托泊苷和替尼泊苷、安吖啶、拓扑替康、喜树碱和伊立替康);酶(例如天冬酰胺酶);和胸苷酸合酶抑制剂(例如雷替曲塞);
(ii)细胞生长抑制剂,例如抗雌激素(例如它莫昔芬、托瑞米芬,雷洛昔芬、屈洛昔芬和碘米芬(iodoxyfene)),雄激素受体减量调节剂(例如氟维司群),防止雄激素受体核转位及其结合至dna或共激活蛋白的拮抗剂mdv3100或arn-509,cyp17a1的抑制剂如阿比特龙[zytigatm],以及雄激素受体功能和cyp17a1的混合抑制剂(例如tok-001(galeterone),lhrh拮抗剂和lhrh激动剂(例如戈舍瑞林、醋酸戈舍瑞林、luprolide、亮丙瑞林和布舍瑞林),孕激素(例如醋酸甲地孕酮),芳香酶抑制剂(例如阿那曲唑、来曲唑、伏罗唑(vorazole)和依西美坦),抗孕激素,抗雄激素(例如氟他胺、尼鲁米特、比卡鲁胺和醋酸环丙孕酮)以及5α-还原酶抑制剂(例如非那雄胺),
(iii)抗侵入剂(例如c-src激酶家族抑制剂如4-(6-氯-2,3-亚甲基二氧基苯胺基)-7-[2-(4-甲基哌嗪-1-基)乙氧基]-5-四氢吡喃-4-基氧基喹唑啉(azd0530;国际专利申请wo01/94341),n-(2-氯-6-甲基苯基)-2-{6-[4-(2-羟基乙基)哌嗪-1-基]-2-甲基嘧啶-4-基氨基}噻唑-5-甲酰胺(达沙替尼,bms-354825;药物化学杂志(j.med.chem.),2004,47,6658-6661)和博舒替尼(ski-606),金属蛋白酶抑制剂如马立马司他,尿激酶纤溶酶原激活剂受体功能抑制剂,和乙酰肝素酶的抗体),
(iv)生长因子功能抑制剂,例如血小板衍生生长因子抑制剂和肝细胞生长因子抑制剂,例如生长因子抗体和生长因子受体抗体(例如抗erbb2抗体曲妥珠单抗[herceptintm]、抗egfr抗体帕尼单抗、抗erbb1抗体西妥昔单抗[爱必妥(erbitux),c225])和任何其他生长因子抗体或其他生长因子受体抗体的抑制剂,例如法呢基转移酶抑制剂(例如斯特恩(stern)等人,肿瘤学/血液学关键评论(criticalreviewsinoncology/haematology),2005,第54卷,p.11-29);这样的抑制剂还包括酪氨酸激酶抑制剂,例如表皮生长因子家族的抑制剂(例如egfr家族酪氨酸激酶抑制剂,例如n-(3-氯-4-氟苯基)-7-甲氧基-6-(3-吗啉代丙氧基)喹唑啉-4-胺(吉非替尼,azd1839),n-(3-乙炔基苯基)-6,7-双(2-甲氧基乙氧基)喹唑啉-4-胺(厄洛替尼,osi-774)和6-丙烯酰胺基-n-(3-氯-4-氟苯基)-7-(3-吗啉代丙氧基)喹唑啉-4-胺(ci1033))和丝氨酸/苏氨酸激酶抑制剂),erbb2酪氨酸激酶抑制剂(例如拉帕替尼);肝细胞生长因子家族抑制剂;胰岛素生长因子家族抑制剂;血小板衍生生长因子家族抑制剂如伊马替尼和/或尼罗替尼(amn107);丝氨酸/苏氨酸激酶抑制剂激酶的抑制剂(例如ras/raf信号传导抑制剂,例如法呢基转移酶抑制剂,例如索拉非尼(bay43-9006),替吡法尼(r115777)和azd9291(tagrisso);洛那法尼(lonafarnib)(sch66336)),通过mek和/或akt激酶的细胞信号传导的抑制剂,c-kit抑制剂,abl激酶抑制剂,pi3激酶抑制剂,plt3激酶抑制剂,csf-1r激酶抑制剂,igf受体(胰岛素样生长因子)激酶抑制剂;极光激酶抑制剂(例如azd1152、ph739358、vx-680、mln8054、r763、mp235、mp529、vx-528和ax39459)和细胞周期蛋白依赖性激酶抑制剂例如cdk2和/或cdk4抑制剂;
(v)其他抗血管生成剂,例如通过与上文定义的那些机制不同的机制起作用的那些(例如ang-2(例如medi-3617)和dll4(例如medi-0639)),并且包括血管靶向剂(例如考布他汀磷酸盐(combretastatina4)和国际专利申请公开号wo99/02166、wo00/40529、wo00/41669、wo01/92224、wo02/04434和wo02/08213中披露的化合物和描述于国际专利申请公开号wo99/02166中的血管损伤剂(例如n-乙酰醇醌醇-o-磷酸酯));以及
(vi)内皮素受体拮抗剂(例如齐泊腾坦(zd4054)和阿曲生坦);
生物响应调节剂(例如,干扰素);
抗体(例如依决洛单抗);
反义疗法(例如针对以上列出的靶标的那些疗法,例如isis2503,抗-ras反义);
基因治疗方法,包括例如替换异常基因的方法,例如异常p53或异常brca1或brca2、gdept(基因定向酶前药物治疗)方法,例如使用胞嘧啶脱氨酶、胸苷激酶或细菌硝基还原酶酶的那些方法和增加对于化学疗法或放射疗法患者耐受性的方法,例如多抗药性基因疗法;以及
免疫治疗方法,包括例如增加患者肿瘤细胞的免疫原性的离体和体内方法,例如用细胞因子例如白细胞介素2、白细胞介素4或粒细胞-巨噬细胞集落刺激因子的转染,降低t细胞能量的方法,使用转染的免疫细胞例如细胞因子转染的树突细胞的方法,使用细胞因子转染的肿瘤细胞系的方法和使用抗独特型抗体的方法,包括ctla4抗体的t细胞增强方法,以及针对cd137、pd-1或b7-h1的抗体,toll-受体激动剂;针对cd40的激动性抗体例如sgn-40(dacetuzumab)或针对tweak受体的激动性抗体例如pdl-192;针对fas的激动性抗体;使用针对肿瘤相关抗原的抗体的方法和消耗靶细胞类型的抗体(例如未轭合的抗cd20抗体,例如利妥昔单抗、奥法木单抗、奥比珠单抗、抗cd19抗体例如medi-551、抗cd52抗体例如阿仑单抗,抗cd37抗体例如tru-016,抗cd22抗体例如伊珠单抗(inotuzumab),放射性标记的抗cd20抗体百克沙(bexxar)和泽娃灵(zevalin),以及抗cd54抗体坎帕斯(campath);免疫毒素例如莫西莫单抗(moxetumumab)pasudotox),使用抗独特型抗体的方法,增强自然杀伤细胞功能的方法,以及利用抗体-毒素轭合物(例如抗cd33抗体麦罗塔(mylotarg))的方法和免疫调节剂例如雷利米得(来那度胺)。
在某些实施例中,“抗pd-l1抗体”意指选择性结合pd-l1多肽的抗体。示例性抗pd-l1抗体描述于例如us8,779,108和us9,493,565,其通过引用在此结合。medi4736是示例性的抗pd-l1抗体。其他抗pd-l1抗体包括bms-936559(百时美施贵宝公司(bristol-myerssquibb))和mpdl3280a(罗氏公司(roche))。
medi4736vl(seqidno:1)
eivltqspgtlslspgeratlscrasqrvsssylawyqqkpgqaprlliydassratgipdrfsgsgsgtdftltisrlepedfavyycqqygslpwtfgqgtkveik
medi4736vh(seqidno:2)
evqlvesggglvqpggslrlscaasgftfsrywmswvrqapgkglewvanikqdgsekyyvdsvkgrftisrdnaknslylqmnslraedtavyycareggwfgelafdywgqgtlvtvss
medi4736vhcdr1(seqidno:3)
rywms
medi4736vhcdr2(seqidno:4)
nikqdgsekyyvdsvkg
medi4736vhcdr3(seqidno:5)
eggwfgelafdy
medi4736vlcdr1(seqidno:6)
rasqrvsssyla
medi4736vlcdr2(seqidno:7)
dassrat
medi4736vlcdr3(seqidno:8)
qqygslpwt
所述至少一种伴侣药物能以一个或多个推荐的剂量并根据一个或多个推荐的给药方案给予。例如,medi4736(杜伐鲁单抗)可以按每2周3mg/kg或10mg/kgiv的剂量或以每4周1500mg的固定剂量给予。此外,例如,奥拉帕尼(olaparib或lynparza)可以按150mg或200mg或300mg片剂bid的形式口服给予。
在一些实施例中,温血动物是患有复发性卵巢癌、输卵管癌或原发性腹膜癌的人类。在一些实施例中,根据固定的间歇给药方案,向所述人类给予西地尼布与选自(a)基于铂的化学疗法、(b)奥拉帕尼(olaparib或lynparza)和(c)杜伐鲁单抗中的至少一种伴侣药物的组合,各自任选地接着进行西地尼布单一疗法维持。在一些实施例中,根据固定的间歇给药方案,向所述人类给予西地尼布,与选自(a)基于铂的化学疗法、(b)奥拉帕尼(olaparib或lynparza)和(c)杜伐鲁单抗中的至少两种伴侣药物组合,各自任选地接着进行西地尼布单一疗法维持。在一些实施例中,根据固定的间歇给药方案,向所述人类给予西地尼布,与基于铂的化学疗法、奥拉帕尼(olaparib或lynparza)和杜伐鲁单抗组合,各自任选地接着进行西地尼布单一疗法维持。在一些实施例中,根据固定的间歇给药方案,向所述人类给予西地尼布,与奥拉帕尼(olaparib或lynparza)和杜伐鲁单抗组合,各自任选地接着进行西地尼布单一疗法维持。
在一些实施例中,根据固定的间歇给药方案,西地尼布与基于铂的化学疗法组合给予,并且接着进行单一疗法维持,用于治疗患有铂敏感性复发性(psr)卵巢癌(包括输卵管癌、高级别子宫内膜癌、透明细胞癌、高级别浆液性癌或原发性腹膜癌)的成人患者。在一些实施例中,根据固定的间歇给药方案,西地尼布与基于铂的化学疗法组合给予,并且接着进行单一疗法维持,用于治疗患有铂敏感性复发性(psr)卵巢癌(包括输卵管癌或原发性腹膜癌)的成人患者。在一些实施例中,治疗患有铂敏感性复发性卵巢癌的温血动物的方法包括根据固定的间歇给药方案给予包含西地尼布的组合物的至少两个周期,所述固定的间歇给药方案包括在周期的至少连续两天给予有效量的所述组合物,接着在周期的至少连续两天不给予所述组合物,并且进一步包括给予基于铂的化学疗法。在一些实施例中,铂敏感性复发性卵巢癌选自输卵管癌、高级别子宫内膜癌、透明细胞癌、高级别浆液性癌和原发性腹膜癌。在一些实施例中,铂敏感性复发性卵巢癌选自输卵管癌和原发性腹膜癌。在一些实施例中,该方法进一步包括西地尼布的单一疗法维持。在一些实施例中,西地尼布的单一疗法维持包括根据固定的间歇给药方案给予包含西地尼布的组合物。
在一些实施例中,根据连续给药方案给予西地尼布,接着根据固定的间歇给药方案给予西地尼布。连续给药方案包括在一天或连续多天给予有效量的包含西地尼布的组合物。固定的间歇给药方案包括在周期的一天或连续多天(例如至少连续两天)给予有效量的包含西地尼布的组合物,接着在停止的一天或连续多天(例如至少连续两天)不给予所述组合物。这些方法包括仅使用包含西地尼布的组合物,并且因此可以用于单一疗法,或可以进一步包括给予一种或多种伴侣药物,并且因此可以用于组合疗法。
目前正在计划使用本文披露的方法的临床试验。
例如,一项计划的临床试验是随机的、双盲的、平行组、国际研究,以便评估西地尼布与基于铂的化学疗法组合的2个方案在患有铂敏感性复发性上皮性卵巢癌、原发性腹膜癌和/或输卵管癌患者中的安全性、耐受性和功效。所提议的方案涉及随机化受试者以在2个阶段期间接受以下2个治疗方案中的1个,组合化学疗法期(多达6个周期)和维持期(直到进展):(1)每日一次口服20mg西地尼布(“连续”方案)或(2)以固定的间歇方案在七天周期的连续五天每日一次口服给予20mg西地尼布,接着给予连续2天的安慰剂剂量。所有受试者还将同时接受6个周期的基于铂的化学疗法。在组合化学疗法期间将用卡铂方案治疗受试者。卡铂方案的非限制性实例包括:
·经30至60分钟的浓度时间曲线5下的卡铂面积(auc5;测量的肾小球滤过率[gfr]),与经3小时的紫杉醇175mg/m2组合,每3周一次(1个周期)持续6个周期(q3wx6),
·经30至60分钟的卡铂auc5(测量的gfr),与经3小时的pld30mg/m2组合,每4周一次(1个周期)持续6个周期(q4wx6),和
·经30至60分钟的卡铂auc4(gfr)(在第1天),与经3小时的吉西他滨1000mg/m2(在第1天和第8天)组合,每3周一次(1个周期)持续6个周期。
与连续方案相比,固定的间歇性西地尼布方案的安全性和耐受性将通过由任何不良事件定义的毒性或受试者决定导致在随机化的6个月内中止西地尼布引起的西地尼布中止率测量。本研究的主要终点是在随机化的6个月内由于不良事件或受试者决定而中止西地尼布治疗的受试者的比例。一旦所有受试者达到6个月的治疗或中止,将使用由所有随机受试者组成的完整分析集进行分析。在筛选(随机化的28天内)和随机化后每12周(±1周)直到客观的放射性疾病进展,所有受试者将具有实体肿瘤响应评价标准(recist1.1版)肿瘤评估。
在一些实施例中,与连续方案相比,固定的间歇方案降低了由于毒性引起的中止率。与连续方案相比,固定的间歇西地尼布方案的功效可以使用以下终点中的一个或多个来测量:无进展生存期、总体生存期、治疗失败的时间和客观响应率。
无进展生存期(pfs)被定义为从随机化到首次记录通过独立放射学检查确定的客观疾病进展或由于任何原因而在研究中死亡(无论哪个先发生)的时间。
总体生存期(os)被定义为从随机化到由于任何原因死亡的日期的时间。对于在分析时仍然活着的受试者,将在已知受试者活着的最后日期检查os时间。
治疗失败的时间(ttf)被定义为从随机化到治疗失败的时间。
客观响应率(orr)被定义为相对于所有随机化受试者的总群体,根据recist具有完全响应(cr)或部分响应(pr)的受试者的百分比(如通过独立放射学检查确定的)。
另一个计划的临床试验是抗程序化死亡配体-1抗体medi4736(杜伐鲁单抗)与西地尼布组合用于晚期实体瘤和晚期或复发性卵巢癌、三阴性乳腺癌、肺癌、前列腺癌和结肠直肠癌的i/ii期研究。剂量方案显示于表1和表2中。
表1:杜伐鲁单抗+西地尼布每日时间表剂量递增表
表2:杜伐鲁单抗+西地尼布间歇时间表剂量递增表
对于杜伐鲁单抗+西地尼布组,符合条件的患者将被诊断为晚期或复发性卵巢癌(群组1)、nsclc(群组2)、或crc(群组3)。在使用连续给药方案用于给予西地尼布的i期中,2名dl1患者由于肺血栓栓塞需要提早中止西地尼布,并且1名dl1患者由于周期2的反复2级疲劳而将剂量减少至每日15mg西地尼布。由于在2-3周期期间反复性2级疲劳、2级腹痛和2级腹泻,4名dl2患者中的3名也将西地尼布剂量减少至每日20mg。
本披露的发明人发现,与每日西地尼布方案相比,临床前体内数据显示与间歇性西地尼布方案(给予5天/停止2天)在抗肿瘤活性上没有差异。因此,使用根据本披露的间歇性西地尼布方案(给予5天/停止2天)和使用每28天1500mg的固定剂量杜伐鲁单抗的新的杜伐鲁单抗+西地尼布剂量水平,用于临床试验以确定是否存在例如耐受性的改善。具体地,研究了根据本披露的间歇性西地尼布给药方案,并且目前开启了杜伐鲁单抗+西地尼布在卵巢癌、nsclc和crc中的ii期研究。
实例
实例1:体内实体瘤疾病模型试验。这项试验可以测量化合物抑制实体瘤生长的能力。
以下是可以使用的典型程序的实例。
可通过在无血清培养基中100pu的50%(v/v)基底膜基质(matrigel)溶液中皮下注射1x10calu-6细胞/小鼠,在雌性无胸腺瑞士nulnu小鼠的侧腹中建立calu-6肿瘤异种移植物。在细胞植入后10天,可将小鼠分配到8-10组,以便获得可比较的组平均体积。肿瘤可以使用游标卡尺测量并且体积可以计算为:(ixw)xi(lxw)x(z/6),其中i是最长直径,并且w是垂直于最长直径的直径。测试化合物可以每日口服给予至少21天,并且对照动物接受化合物稀释剂。肿瘤可以每周测量两次。可以通过使用学生t检验和/或曼-惠特尼(mann-whitney)秩和检验比较对照组与治疗组的平均肿瘤体积来计算生长抑制的水平。当p<0.05时,化合物治疗的抑制作用可认为是显著的。
实例2:评估靶标覆盖。为了建立在临床前模型中用西地尼布实现的靶标覆盖,在一系列化合物剂量下确定了时间依赖性pk曲线。计算基于0.6、1.2、2.4和4.8mg/kg的多次给药模型化的西地尼布的平均游离药物谱,并与针对vegfr-1、vegfr-2、c-kit和pdgfr的效力的ic50进行比对。
图1a-p显示按照每日一次连续给予(qdcont)、每日一次给予5天停止2天(qd5on2off)或每日一次给予4天(qd4on3off),在a)0.6mg/kg(图1a-1d),b)1.2mg/kg(图1e-1h),c)2.4mg/kg(图11-1l)或d)4.8mg/kg(图1m-1p)下给药的西地尼布在临床前模型中随时间的模拟平均游离血浆浓度。另外,显示在2或3天中断后重新给药后的西地尼布的pk。如所指示的,在药物的最后一次剂量(在4或5天给药)后显示pk的减少,并且在每个图(水平线)上叠加的是在体外产生的抑制pvegfr-1、pvegfr-2、pkit、ppdgfrα和ppdgfrβ的细胞ic50值。对于示例性vegfr和kit覆盖的曲线图,r-p代表基于细胞的试验中的受体磷酸化;c-p代表细胞增殖;对于vegfr曲线图,t-g代表内皮成纤维细胞共培养试验中的小管生长。指示了相关的细胞系。对于描绘pdgfrα和β覆盖的图,与相关细胞系一起显示pdgfrα的抑制和pdgfrβ磷酸化以及pdgfbb或pdgfaa驱动的增殖。图1a-p中的曲线图示例了一系列剂量范围的西地尼布的临床前pk曲线,并且显示在最后一次剂量后靶标覆盖可以迅速丧失。这也确定了在高达2.4mg/kg的剂量下,西地尼布达到针对vegfr和c-kit的靶覆盖,但是针对pdgfr没有给出足够的覆盖。它还证明,在给定治疗周期中的最终剂量后,剂量中断可以减轻对vegfr信号传导的抑制。
为了建立在人中用西地尼布实现的靶标覆盖,绘制了来自群体pk分析的平均时间依赖性游离药物pk曲线,并且相对于与vegfr-1、vegfr-2、c-kit和pdgfr相同的ic50值进行类似比对。该分析证明20mg和30mg具有与在临床前1.2-2.4mg/kg范围内实现的相似的靶标覆盖。它还显示,当药物给药中断时,针对vegfr和c-kit的覆盖随时间损失,并且2天(或更久)的中断可以减轻对vegfr信号传导的抑制。
图2显示了对于20mg和15mg剂量的西地尼布,人对于西地尼布(黑线)的游离药物暴露与时间的模拟平均值。95%置信区间由灰色带表示。pk曲线显示在最终剂量的化合物之后西地尼布浓度的降低。在曲线图(水平线)上叠加的是在体外产生的对pvegfr、pkit、ppdgfr的抑制的细胞ic50值。该数据证实,在临床中观察到的游离药物水平在当西地尼布以临床前1.2-2.4mg/kg的剂量给药时观察到的暴露的范围内,并且pk曲线类似于在临床前观察到的曲线。
实例3:评估对抗肿瘤益处的维持。为了确定西地尼布的间歇给药是否能够维持抗肿瘤益处,使用了一系列皮下植入裸小鼠或重度联合免疫缺陷(scid)小鼠的肿瘤异种移植模型,其对西地尼布表现出不同的敏感性。当肿瘤体积达到大约0.2cm3时,选择肿瘤并随机分组。sw620(crc模型)、calu6(nsclc模型)和a498(肾癌模型)肿瘤每日一次口服给药1.2mg/kg和2.4mg/kg(相当于1.5和3mg/kg西地尼布马来酸盐)。为了测试间歇给药的影响,在每7天周期中每日一次口服给药西地尼布持续7天、5天或4天。使用10只动物的组,然而在最后周期中,在给药组之间去除5只动物的群组以支持肿瘤中的药效学生物标志物的评估。该数据表明,尽管减轻了vegfr抑制,但是给予5天停止2天时间表维持了作为单一疗法的抗肿瘤作用。此外,给予4天停止3天时间表也维持了抗肿瘤效果,虽然不如5/2时间表有效。该数据证实,特定的间歇给药策略可以维持西地尼布的抗肿瘤作用。这提供了在西地尼布治疗中作为单一疗法或使用靶向其他机制的药物(例如dna损伤剂、免疫治疗或肿瘤细胞靶向治疗)的组合疗法中给出短结构化中断的机会。(图3-6)。
图3显示了三项功效研究(在calu6、a498和sw620肿瘤异种移植物中进行)各自使用四个口服给药方案组(第1组(运载体每日一次持续21天)、第2组(1.5mg/kg西地尼布每日一次持续21天)、第3组(3mg/kg西地尼布每日一次持续21天)和第6组(3个7天周期的1.5mg/kg西地尼布每日一次持续5天,接着运载体每日一次持续2天)的平均肿瘤体积与时间。该数据表明,在5/2时间表下以1.5mg/kg的西地尼布的间歇给药维持功效。
图4显示了三项功效研究(在calu6、a498和sw620肿瘤异种移植物中)各自使用四个口服给药方案组(第1组(运载体每日一次持续21天)、第2组(1.5mg/kg西地尼布每日一次持续21天)、第3组(3mg/kg西地尼布每日一次持续21天)和第7组(3个7天周期的3mg/kg西地尼布每日一次持续5天,接着运载体每日一次持续2天)的平均肿瘤体积与时间。该数据表明,在5/2时间表下以3mg/kg的西地尼布的间歇给药维持功效。
图5显示了三项功效研究(calu6、a498和sw620)各自使用四个口服给药方案组(第1组(运载体每日一次持续21天)、第2组(1.5mg/kg西地尼布每日一次持续21天)、第3组(3mg/kg西地尼布每日一次持续21天)和第8组(3个7天周期的1.5mg/kg西地尼布每日一次持续3天,接着运载体每日一次持续4天)的平均肿瘤体积与时间。该数据表明,在三个模型中的2个中,在4/3时间表下以1.5mg/kg的西地尼布的间歇给药维持功效。
图6显示了三项功效研究(calu6、a498和sw620)各自使用四个口服给药方案组(第1组(运载体每日一次持续21天)、第2组(1.5mg/kg西地尼布每日一次持续21天)、第3组(3mg/kg西地尼布每日一次持续21天)和第9组(3个7天周期的3mg/kg西地尼布每日一次持续3天,接着运载体每日一次持续4天)的平均肿瘤体积与时间。该数据表明,在4/3时间表下以3mg/kg的西地尼布的间歇给药维持功效。
实例4:为了测试西地尼布与奥拉帕尼组合使用间歇时间表的益处,间歇性(给予5天停止2天)每日剂量的西地尼布组合奥拉帕尼与恒定每日剂量的西地尼布组合奥拉帕尼一样有效。
为了确定给予间歇剂量的单独的西地尼布或与奥拉帕尼组合的西地尼布不降低抗肿瘤功效,ov2022肿瘤(卵巢癌)异种移植物用单独的或与100mg/kg奥拉帕尼组合的3mg/kg西地尼布以每天给予或以给予5天停止2天的时间表处理。西地尼布的间歇时间表给出与恒定剂量的西地尼布相同的功效,因此表明可以有效地使用间歇剂量的西地尼布。
图7显示了在ov2022(卵巢癌)患者衍生的肿瘤异种移植模型中进行的功效研究的平均肿瘤体积与时间。这项研究比较了西地尼布与奥拉帕尼组合,其中西地尼布每日一次给予或每日一次给予5天停止2天。第1组-对照,第2组-3mg/kg西地尼布每日一次,第3组-3mg/kg西地尼布每日一次给予5天停止2天,第4组-100mg/kg奥拉帕尼每日一次,第5组-3mg/kg西地尼布每日一次加100mg/kg奥拉帕尼每日一次,第6组-3mg/kg西地尼布每日一次给予5天停止2天加100mg/kg奥拉帕尼每日一次。
图8显示了研究中每组带瘤动物的体重变化。这项研究比较了西地尼布与奥拉帕尼组合,其中西地尼布每日一次给予或每日一次给予5天停止2天。第1组-对照,第2组-3mg/kg西地尼布每日一次,第3组-3mg/kg西地尼布每日一次给予5天停止2天,第4组-100mg/kg奥拉帕尼每日一次,第5组-3mg/kg西地尼布每日一次加100mg/kg奥拉帕尼每日一次,第6组-3mg/kg西地尼布每日一次给予5天停止2天加100mg/kg奥拉帕尼每日一次。
实例5:1期临床试验结果-间歇剂量的西地尼布与medi4736(杜伐鲁单抗)组合。
在组合试验中临床上测试了间歇性时间表的益处,其中使用连续或间歇性的西地尼布时间表检查了西地尼布与杜伐鲁单抗组合的能力。该试验表明,尽管连续剂量耐受性差,但是间歇时间表是耐受的并且导致可观察的临床益处。数据呈现如下。
研究设计和患者
合格患者具有无先前的免疫检查点抑制剂治疗的复发性或转移性recistv1.1可测量的实体恶性肿瘤,对不超过3种抗高血压药的可控高血压,以及良好的终末器官功能;在登记时要求种系brca突变状态。所有患者在登记前均提供书面知情同意书。该试验由国家癌症研究所癌症研究中心的机构审查委员会批准。clinicaltrials.gov标识符:nct02484404。
符合条件的患者根据表3以3+3剂量递增形式接受杜伐鲁单抗+西地尼布。群组同时登记患者。根据ctcaev4评估患者的毒性。使用recistv1.1标准通过成像每两个周期评价临床响应。对于在14天内没有恢复至≤1级的疾病进展、并发疾病、不良事件,或患者撤回同意书时中止研究治疗。
表3:剂量水平(dl)
*一名dl1患者在第一周期撤回同意书,一名dl2患者在第一周期期间服用20mg西地尼布而不是30mg持续一周,并且一名dl3患者在第一周期发展了4级高血压并停止治疗。
剂量限制性毒性(dlt)和最大耐受剂量(mtd)的定义
该1期研究的主要终点是确定杜伐鲁单抗+西地尼布组合的建议的2期剂量(rp2d),由mtd或在dlt不存在时最高方案定义的剂量来定义。dlt被定义为与在第一周期(28天)期间发生的研究药物相关的3级或4级非血液学和4级血液学不良事件(ae)。以下是例外:在3级或更高级别中性粒细胞减少不存在的情况下的3级淋巴细胞减少或白细胞减少,用抗高血压治疗控制的3级高血压,或具有在3天内降级至1级或更好的最佳补充的3级无症状电解质不平衡,在事件发生后7天内降级至1级或更好的淀粉酶或脂肪酶的3级无症状增加,或在有或没有全身性皮质类固醇治疗和/或激素替代疗法的情况下管理的3级无症状内分泌病。mtd被定义为六个患者中的一个或更少患者经历dlt的最高剂量水平。如果观察到的ae特异性归因于仅一种药物,那么在患者继续接受与所观察到的ae不相关的药物时保持该药物。报告了最后一次剂量的研究药物后90天或更长时间出现的治疗相关的严重ae。
结果
患者特征
登记了14名妇女。表4显示基线患者特征。卵巢癌是最常见的肿瘤类型(9/14[64%])。
表4:基线特征
数据是患者数量(总%)或中值(范围)。ecog=东部肿瘤协作组。
剂量优化和毒性
将建议的2期剂量(rp2d)确定为20mg西地尼布给予5天/停止2天和每4周1500mg的杜伐鲁单抗。使用杜伐鲁单抗的每日西地尼布的耐受性不良,虽然它不符合第一个治疗周期中剂量限制性毒性(dlt)的正式标记。每日西地尼布由于在7/8患者中的复发性2级或非dlt3级或4级不良事件(ae)而中止或剂量减少;两名dl1患者在研究中由于新的肺血栓栓塞(pe)而中止西地尼布,并且一名dl1患者在第二周期减少剂量,其中四名dl2患者由于在后期周期(第二、三和五周期)中复发性2级腹痛、腹泻、疲劳而减少剂量。由于由3级结肠炎(第六周期)和3级肺动脉高压(第五周期)组成的治疗出现的ae(teae),将两名患者从治疗中去除。患者用全身性皮质类固醇治疗,无症状改善。患有肺动脉高压的患者也具有pe,并且在中止治疗后约一个月死亡;尸检发现显示疾病进展包括心包积液和肺、甲状腺、淋巴结和其他器官的浸润。方案修改添加了使用20mg西地尼布给予5天/停止2天的新的剂量水平。间歇性时间表中的一名患者在第一周期具有4级高血压的dlt,并且五名其他患者耐受所有给予周期的治疗。所有患者具有至少一种任何等级的teae,总结于表5中。
表5:按每位病人的最大级别计的杜伐鲁单抗+奥拉帕尼和杜伐鲁单抗+西地尼布治疗相关的不良事件
数据是数字。患者可以在多于一个优选项下计数。alt=丙氨酸转氨酶。ast=天冬氨酸转氨酶。杜伐鲁单抗+每日西地尼布的一名dl1患者在第一周期第15天撤回了她的同意书并且没有报告任何ae。一名杜伐鲁单抗+每日西地尼布的dl1患者在第二周期将剂量减少到每日15mg西地尼布,所有四名杜伐鲁单抗+每日西地尼布dl2患者在第二周期(2名患者)、第三周期(1名患者)和第五周期(1名患者)由于复发性2级腹痛、腹泻、疲劳将剂量减少到每日20mg西地尼布。*两名杜伐鲁单抗+每日西地尼布的患者在第一周期(dl1)和第五周期(dl2)接受打包rbc输液。
临床活性
对14名杜伐鲁单抗+西地尼布的患者中的12名进行肿瘤响应评估;两名由于药物毒性或在第一周期中撤回同意书而无法评价,没有证实进展。12名患者中的6名达到pr(5+-8+个月,50%orr),其中3名进行dl3治疗,表明使用间歇性西地尼布时间表没有减弱响应。在试验期间观察到的患者肿瘤尺寸(从基线)的最大响应显示在图9中(即,在试验期间的任何时间点可能已经观察到的最大响应)。图10显示了每名患者随时间的肿瘤尺寸从基线的变化。
间歇性西地尼布时间表导致改善的耐受性并维持在每日时间表中观察到的临床益处。
实例6:1期临床试验-西地尼布与(medi4736)杜伐鲁单抗和奥拉帕尼的间歇给药
在组合试验中临床上进一步检测间歇方案的益处,其中使用西地尼布的间歇时间表(给予5天/停止2天)检查西地尼布与杜伐鲁单抗和奥拉帕尼组合的能力。该研究的目的是确定杜伐鲁单抗+奥拉帕尼+间歇性西地尼布(nct02484404)的推荐的2期剂量(rp2d)。该试验显示间歇性给予西地尼布与杜伐鲁单抗和奥拉帕尼的组合在复发性妇女癌症中是可耐受的和有活性的。
研究设计:
具有0至1的性能状态(ps)和良好的末端器官功能的合格患者接受杜伐鲁单抗+奥拉帕尼+间歇性西地尼布。患者接受15mg或20mg(给予5天/停止2天)的西地尼布,每隔28天的1500mgiv杜伐鲁单抗和300mg的奥拉帕尼片剂bid。剂量限制性毒性期为一个28天的周期。安全性由ctcaev4.0评估并通过recistv1.1反应。所有患者在登记之前提供书面知情同意书。
结果:
使用杜伐鲁单抗+奥拉帕尼+间歇性西地尼布治疗9名年龄中值为51岁[范围44-73]且先前治疗中值为2[范围2-6]的妇女。7名患者有卵巢癌,1名患者有子宫内膜癌,1名患者有三阴性乳腺癌(tnbc)。两名患者经历了3/4级不良事件(淋巴细胞减少)。没有毒性相关的剂量减少或中止。在5名可评价患者中观察到两名患者的部分响应(5+、2+月)和三名患者的稳定性疾病(2+-7+月)。
序列表
<110>阿斯利康(瑞典)有限公司
国立健康研究所
<120>包括对西地尼布进行固定的间歇给药的方法
<130>09963.0087-00304
<150>62/295421
<151>2016-02-15
<160>8
<170>patentin3.5版
<210>1
<211>108
<212>prt
<213>智人
<400>1
gluilevalleuthrglnserproglythrleuserleuserprogly
151015
gluargalathrleusercysargalaserglnargvalserserser
202530
tyrleualatrptyrglnglnlysproglyglnalaproargleuleu
354045
iletyraspalaserserargalathrglyileproaspargpheser
505560
glyserglyserglythraspphethrleuthrileserargleuglu
65707580
progluaspphealavaltyrtyrcysglnglntyrglyserleupro
859095
trpthrpheglyglnglythrlysvalgluilelys
100105
<210>2
<211>121
<212>prt
<213>智人
<400>2
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserargtyr
202530
trpmetsertrpvalargglnalaproglylysglyleuglutrpval
354045
alaasnilelysglnaspglyserglulystyrtyrvalaspserval
505560
lysglyargphethrileserargaspasnalalysasnserleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaarggluglyglytrppheglygluleualapheasptyrtrpgly
100105110
glnglythrleuvalthrvalserser
115120
<210>3
<211>5
<212>prt
<213>智人
<400>3
argtyrtrpmetser
15
<210>4
<211>17
<212>prt
<213>智人
<400>4
asnilelysglnaspglyserglulystyrtyrvalaspservallys
151015
gly
<210>5
<211>12
<212>prt
<213>智人
<400>5
gluglyglytrppheglygluleualapheasptyr
1510
<210>6
<211>12
<212>prt
<213>智人
<400>6
argalaserglnargvalsersersertyrleuala
1510
<210>7
<211>7
<212>prt
<213>智人
<400>7
aspalaserserargalathr
15
<210>8
<211>9
<212>prt
<213>智人
<400>8
glnglntyrglyserleuprotrpthr
15
- 还没有人留言评论。精彩留言会获得点赞!