消化道癌的判定方法与流程
胰腺癌的患病数正在逐年增加,具有相对患病数的死亡率较高的问题。在图像诊断已经很发达的当今医学中,如肝癌那样,首先通过检体检查圈定高危群体,在消化道癌(大肠癌、胰腺癌)的诊断中,也是重要的一点。但是,至今还未确立一种针对胰腺癌的早期诊断的有效的检查方法。
另一方面,通过岩藻糖进行的糖链修饰被称作岩藻糖基化,其是在癌中增加的代表性的糖链变化之一。带有岩藻糖基化糖链的蛋白之一的岩藻糖基化触珠蛋白,被当作胰腺癌、大肠癌等消化道癌的生物标志物,正在对其测定方法、使用其进行癌的判定方法进行各种探讨。但是,为了确立对消化道癌的检查方法,需要更高准确度的方法。
现有技术文献
专利文献
专利文献1:日本特许5358952号。
技术实现要素:
发明要解决的课题
鉴于上述状况,本发明人等进行了潜心研究,结果发现,通过对有β链且s-s键未被切断的人触珠蛋白进行测定,从而能获得胰腺癌患者、大肠癌患者与健康者间的显著差异。进一步,通过对有α链的人触珠蛋白的测定结果与有β链且s-s键未被切断的人触珠蛋白的测定结果进行比较,从而能够以高准确度测定出胰腺癌、大肠癌等消化道癌患者,至此完成了本发明。
也就是说,本发明的课题在于提供高准确度的消化道癌的判定方法。
解决课题的技术方案
本发明涉及以下的方法。
“一种消化道癌的判定方法,
(1)使检体、识别人触珠蛋白的α链的抗体1、和识别人触珠蛋白的β链且不识别s-s键被切断的人触珠蛋白的抗体2接触而形成复合体1;或者,
使检体、和从识别人触珠蛋白的β链且不识别s-s键被切断的人触珠蛋白的抗体2中选出的2种抗体接触而形成复合体2;
(2)测定复合体1或2;
(3)基于该测定值进行判定。”
“一种消化道癌的判定方法,
(1)使检体、识别人触珠蛋白的α链的抗体1、和识别人触珠蛋白的β链且不识别s-s键被切断的人触珠蛋白的抗体2接触而形成复合体1;或者,
使检体、和从识别人触珠蛋白的β链且不识别s-s键被切断的人触珠蛋白的抗体2中选出的2种抗体接触而形成复合体2;
(2)使检体、和从识别人触珠蛋白的α链的抗体1中选出的2种抗体接触而形成复合体3;
(3)测定复合体1以及复合体3、或复合体2以及复合体3;
(4)通过比较复合体1或2的测定结果与复合体3的测定结果来进行判定。”
“用于获得判定消化道癌所用的数据的方法,其特征在于,
(1)使检体、识别人触珠蛋白的α链的抗体1、和识别人触珠蛋白的β链且不识别s-s键被切断的人触珠蛋白的抗体2接触而形成复合体1;或者,
使检体、和从识别人触珠蛋白的β链且不识别s-s键被切断的人触珠蛋白的抗体2中选出的2种抗体接触而形成复合体2;
(2)测定复合体1或2。”
“用于获得判定消化道癌所用的数据的方法,其特征在于,
(1)使检体、识别人触珠蛋白的α链的抗体1、和识别人触珠蛋白的β链且不识别s-s键被切断的人触珠蛋白的抗体2接触而形成复合体1;或者,
使检体、和从识别人触珠蛋白的β链且不识别s-s键被切断的人触珠蛋白的抗体2中选出的2种抗体接触而形成复合体2;
(2)使检体、和从识别人触珠蛋白的α链的抗体1中选出的2种抗体接触而形成复合体3;
(3)测定复合体1以及复合体3、或复合体2以及复合体3。”
发明效果
基于本发明的方法,能够进行更高准确度的消化道癌的判定、特别是更高准确度的胰腺癌以及大肠癌的判定。
附图说明
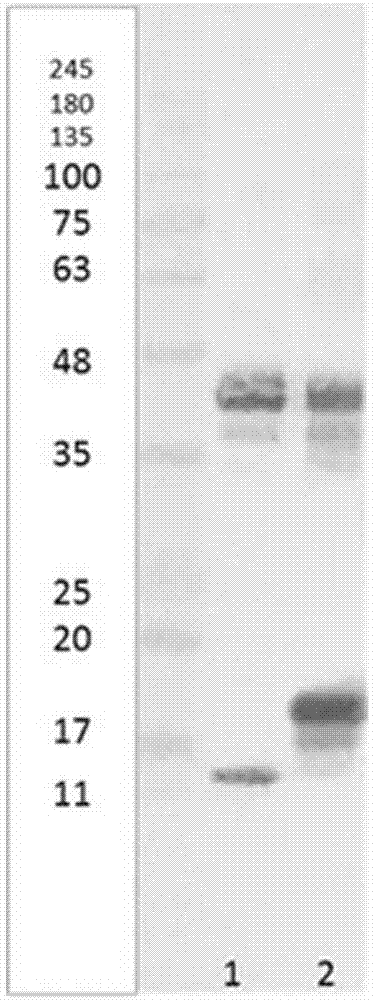
图1表示实验例1中的使用抗人触珠蛋白多克隆抗体[抗人hpt抗体(poly)]通过蛋白免疫印迹法测定人触珠蛋白1-1型纯化品和2-2型纯化品的结果。
图2表示实验例2中的使用10-7抗体通过蛋白免疫印迹法测定人触珠蛋白1-1型纯化品和2-2型纯化品的结果。
图3表示实验例3中的使用3-1抗体通过蛋白免疫印迹法测定人触珠蛋白1-1型纯化品和2-2型纯化品(未切断s-s键)的结果。
图4表示实验例3中的使用3-5抗体通过蛋白免疫印迹法测定人触珠蛋白1-1型纯化品和2-2型纯化品(未切断s-s键)的结果。
图5表示实验例3中的使用3-1抗体通过蛋白免疫印迹法测定人触珠蛋白1-1型纯化品和2-2型纯化品(切断s-s键)的结果。
图6表示实验例3中的使用3-5抗体通过蛋白免疫印迹法测定人触珠蛋白1-1型纯化品和2-2型纯化品(切断s-s键)的结果。
图7表示实施例1中的使用健康者(正常者)、大肠癌患者以及胰腺癌患者的血清以10-7抗体和3-1抗体获得的复合体的浓度(hpt浓度1)的分布图。
图8表示实施例2中的使用健康者、大肠癌患者以及胰腺癌患者的血清,以10-7抗体和3-5抗体获得的复合体的浓度(hpt浓度2)的分布图。
图9表示实施例3中的使用健康者、大肠癌患者以及胰腺癌患者的血清,以抗人hpt抗体(poly)和3-1抗体获得的复合体的浓度(hpt浓度3)的分布图。
图10表示实施例4中的使用健康者、大肠癌患者以及胰腺癌患者的血清,以抗人hpt抗体(poly)和3-5抗体获得的复合体的浓度(hpt浓度4)的分布图。
图11表示实施例5中的使用健康者、大肠癌患者以及胰腺癌患者的血清,以3-1抗体和3-1抗体获得的复合体的浓度(hpt浓度5)的分布图。
图12表示实施例6中的使用健康者、大肠癌患者以及胰腺癌患者的血清,以3-1抗体和3-5抗体获得的复合体的浓度(hpt浓度6)的分布图。
图13表示实施例7中的使用健康者、大肠癌患者以及胰腺癌患者的血清,以10-7抗体和3-1抗体获得的复合体的浓度与以抗人hpt抗体(poly)和10-7抗体获得的复合体的浓度的比率的分布图。
图14表示实施例8中的使用健康者、大肠癌患者以及胰腺癌患者的血清,以10-7抗体和3-5抗体获得的复合体的浓度与以抗人hpt抗体(poly)和10-7抗体获得的复合体的浓度的比率的分布图。
图15表示实施例9中的使用健康者、大肠癌患者以及胰腺癌患者的血清,以抗人hpt抗体(poly)和3-1抗体获得的复合体的浓度与以抗人hpt抗体(poly)和10-7抗体获得的复合体的浓度的比率的分布图。
图16表示实施例10中的使用健康者、大肠癌患者以及胰腺癌患者的血清,以抗人hpt抗体(poly)和3-5抗体获得的复合体的浓度与以抗人hpt抗体(poly)和10-7抗体获得的复合体的浓度的比率的分布图。
图17表示实施例11中的使用健康者、大肠癌患者以及胰腺癌患者的血清,以3-1抗体和3-1抗体获得的复合体的浓度与以抗人hpt抗体(poly)和10-7抗体获得的复合体的浓度的比率的分布图。
图18表示实施例12中的使用健康者、大肠癌患者以及胰腺癌患者的血清,以3-1抗体和3-5抗体获得的复合体的浓度与以抗人hpt抗体(poly)和10-7抗体获得的复合体的浓度的比率的分布图。
图19表示实施例13中的使用健康者、大肠癌患者以及胰腺癌患者的血清,以10-7抗体和3-1抗体获得的复合体的浓度与以抗人hpt抗体(poly)和抗人hpt抗体(poly)获得的复合体的浓度的比率的分布图。
图20表示实施例14中的使用健康者、大肠癌患者以及胰腺癌患者的血清,以10-7抗体和3-5抗体获得的复合体的浓度与以抗人hpt抗体(poly)和抗人hpt抗体(poly)获得的复合体的浓度的比率的分布图。
图21表示实施例15中的使用健康者、大肠癌患者以及胰腺癌患者的血清,以抗人hpt抗体(poly)和3-1抗体获得的复合体的浓度与以抗人hpt抗体(poly)和抗人hpt抗体(poly)获得的复合体的浓度的比率的分布图。
图22表示实施例16中的使用健康者、大肠癌患者以及胰腺癌患者的血清,以抗人hpt抗体(poly)和3-5抗体获得的复合体的浓度与以抗人hpt抗体(poly)和抗人hpt抗体(poly)获得的复合体的浓度的比率的分布图。
图23表示实施例17中的使用健康者、大肠癌患者以及胰腺癌患者的血清,以3-1抗体和3-1抗体获得的复合体的浓度与以抗人hpt抗体(poly)和抗人hpt抗体(poly)获得的复合体的浓度的比率的分布图。
图24表示实施例18中的使用健康者、大肠癌患者以及胰腺癌患者的血清,以3-1抗体和3-5抗体获得的复合体的浓度与以抗人hpt抗体(poly)和抗人hpt抗体(poly)获得的复合体的浓度的比率的分布图。
图25表示使用阶段不同的大肠癌患者以及健康者的血清,以10-7抗体和3-1抗体获得的复合体的浓度与以抗人hpt抗体(poly)和10-7抗体获得的复合体的浓度的比率的分布图。
图26表示使用阶段不同的大肠癌患者以及健康者的血清,以抗人hpt抗体(poly)和3-1抗体获得的复合体的浓度与以抗人hpt抗体(poly)和10-7抗体获得的复合体的浓度的比率的分布图。
图27表示使用阶段不同的大肠癌患者以及健康者的血清,以抗人hpt抗体(poly)和3-5抗体获得的复合体的浓度与以抗人hpt抗体(poly)和10-7抗体获得的复合体的浓度的比率的分布图。
具体实施方式
本发明的消化道癌的判定方法是测定检体中的有β链且s-s键未被切断的人触珠蛋白并且基于该测定结果进行判定的(本发明的消化道癌的判定方法1)。另外,是通过(1)测定检体中的有β链且s-s键未被切断的人触珠蛋白,(2)测定同一个检体中的有α链的人触珠蛋白,(3)比较(1)和(2)中得到的测定结果,判定该比较结果来进行的(本发明的消化道癌的判定方法2)。任一种方法都是有用的判定消化道癌、特别是胰腺癌以及大肠癌的方法,本发明的消化道癌的判定方法2能够以比本发明的消化道癌的判定方法1更高的准确度判定消化道癌,特别是在大肠癌方面,基于本发明的消化道癌的判定方法2的判定方法很有用。
1.本发明的消化道癌的判定方法1
人触珠蛋白由α链和β链这两个子单元构成,被分为触珠蛋白1-1型、2-1型以及2-2型这3种类型。另外,如下图所示,人触珠蛋白经由s-s键连接着α链和β链。
人触珠蛋白
在本发明的消化道癌的判定方法1中,测定具有上述s-s键未被切断的β链的人触珠蛋白,基于该测定值进行癌的判定即可。另外,本发明的方法还包括用于获得判定消化道癌所用的数据的方法,其特征在于,如上述那样测定带有s-s键未被切断的β链的人触珠蛋白。
[本发明的带有s-s键未被切断的β链的人触珠蛋白]
本发明的带有s-s键未被切断的β链的人触珠蛋白(以下,有时简写为本发明的含s-s键β链的hpt),如上述示意图所示,带有s-s键未被切断的β链的人触珠蛋白,也就是说,只要是α链与β链以s-s键连接着的人触珠蛋白即可。
[本发明的检体]
作为本发明的检体,可列举来自人的胰脏组织、血浆、血清、胰液、唾液、淋巴液、髄液等组织或体液、或由这些制备而成的检体等。其中,优选血清、血浆。
[消化道癌]
作为本发明的消化道癌,具体地可列举食道癌、胃癌、小肠癌、大肠癌、肝脏癌、胆嚢癌、胰腺癌等,优选大肠癌、胰腺癌,更优选大肠癌。
[本发明的含s-s键β链的hpt的测定方法]
0015本发明的测定含s-s键β链的hpt的方法,具体地可列举,例如,使用对带有s-s键未被切断的β链的人触珠蛋白有亲和性的物质的方法,更具体而言,使用对人触珠蛋白的β链有亲和性而对s-s键被切断的人触珠蛋白没有亲和性的物质等的方法。作为上述的有亲和性的物质,具体地可列举,例如,抗体、凝集素、多糖类、dna、酶底物、蛋白质、各种受体、各种配体等,特别优选抗体。另外,也可以适当组合使用上述有亲和性的物质。作为使用了上述有亲和性的物质的方法,例如,可举出酶免疫测定法(eia)、放射免疫测定法(ria)、酶结合免疫吸附测定法(elisa)、荧光免疫测定法(fia)、基于简易免疫层析法进行的测定法、高效液相色谱法(hplc)、电泳法、毛细管电泳法、毛细管芯片电泳法、质谱分析法、免疫浊度法、免疫比浊法等以免疫凝集法为基准进行的测定法、免疫印迹法等,其中,优选酶免疫测定法(eia)、放射免疫测定法(ria)、酶结合免疫吸附测定法(elisa)、荧光免疫测定法(fia)、免疫浊度法、免疫比浊法,更优选酶免疫测定法(eia)。它们的测定原理可列举例如夹心法、竞争法、双抗体法等,优选夹心法。
[使用夹心法进行的本发明的含s-s键β链的hpt的测定方法]
作为上述本发明的含s-s键β链的hpt的测定方法中使用夹心法的方法,具体地,可列举的方法如,使检体、识别人触珠蛋白的α链的抗人触珠蛋白抗体(以下,有时简写为抗体1)和识别人触珠蛋白的β链且不识别s-s键被切断的人触珠蛋白的抗人触珠蛋白抗体(以下,有时简写为抗体2)接触,形成抗体1-人触珠蛋白-抗体2的复合体(以下,有时简写为复合体1),测定该复合体1。另外,还可列举的方法如,使检体和从识别人触珠蛋白的β链且不识别s-s键被切断的人触珠蛋白的抗体(以下,有时简写为抗体2)中选出的2种抗体接触,形成复合体2,检测复合体2。此处,抗体2中的2种抗体可以是识别部位相同的抗体,也可以是识别部位不同的抗体。具体而言,可列举:使检体和2种相同的抗体2接触,形成抗体2-人触珠蛋白-抗体2的复合体2,测定该复合体2的方法;使抗体2、该抗体2以外的其它的识别人触珠蛋白的β链且不识别s-s键被切断的人触珠蛋白的抗人触珠蛋白抗体(抗体2’)与检体接触,形成抗体2-人触珠蛋白-抗体2’的复合体2,测定该复合体2的方法等。
作为本发明的含s-s键β链的hpt的测定方法,虽然列举了如上所述的形成复合体1来测定复合体1的方法和形成复合体2来测定复合体2的方法,但是优选形成复合体2来测定复合体2的方法,因为其对hpt浓度的灵敏度较高。
作为上述抗体1,只要是识别人触珠蛋白的α链的抗体即可,多克隆抗体或单克隆抗体均可,也可以是f(ab')2、fab'或fab。具体地,优选识别α链的多克隆抗体、识别α链的单克隆抗体。
作为上述抗体2,只要是识别人触珠蛋白的β链且不识别s-s键被切断的人触珠蛋白的抗人触珠蛋白抗体即可,优选无论有无糖链都能识别β链的抗体,多克隆抗体或单克隆抗体均可,也可以是f(ab')2、fab'或fab。
上述抗体1以及抗体2,能够通过采集使用常规方法在动物内免疫上述抗原而产生于生物体内的抗体再进行纯化而得到。此外,成为抗原的人触珠蛋白,能够通过常规方法例如使用抗触珠蛋白抗体柱子的方法从癌细胞株的培养液或培养上清提取而得到,使用市售品也无妨。另外,抗体1以及2也可以使用市售品。
使用上述夹心法的方法中,优选通过标记物质等标记抗体1和/或抗体2。例如,当抗体1是被标记物质进行了标记的抗体1(标记抗体1)时,基于标记抗体1的标记物质的量测定复合体1即可;例如,当抗体2是被标记物质进行了标记的抗体2(标记抗体2)时,基于标记抗体2的标记物质的量测定复合体1或2即可。在测定复合体1的情况下,优选抗体2被标记物质进行了标记。
作为对本发明的抗体1或抗体2进行标记所用的标记物质,可列举:例如通常的免疫测定法等中使用的过氧化物酶、微过氧化物酶、碱性磷酸酶、β-半乳糖苷酶、葡萄糖氧化酶、葡萄糖-6-磷酸脱氢酶、乙酰胆碱酶、苹果酸脱氢酶、荧光素酶等酶类;例如放射免疫测定法(radioimmuneassay、ria)中使用的99mtc、131i、125i、14c、3h、32p、35s等放射性同位素;例如荧光免疫测定法(fluoroimmunoassay、fia)中使用的荧光素、丹磺酰、荧光胺、香豆素、萘胺、异硫氰酸荧光素(fitc)、罗丹明、罗丹明x异硫氰酸酯、磺基罗丹明101、荧光黄(luciferyellow)、吖啶、吖啶异硫氰酸酯、核黄素或它们的衍生物等荧光性物质;例如虫荧光素、异鲁米诺、鲁米诺、双(2,4,6-三氟苯基)草酸酯等发光性物质;例如苯酚、萘酚、蒽或它们的衍生物等在紫外区域有吸收的物质;例如4-氨基-2,2,6,6-四甲基哌啶-1-氧自由基、3-氨基-2,2,5,5-四甲基吡咯烷-1-氧自由基、2,6-二叔丁基-α-(3,5-二叔丁基-4-氧代-2,5-环己二烯-1-亚基)-对甲苯氧自由基等有氧自由基的化合物所代表的具有作为自旋标记物的性质的物质等标记物质;例如hilytefluor647、hilytefluor488、hilytefluor555、hilytefluor680、hilytefluor750等hilyte系列色素(都是希利特生物科学公司(hilytebioscience,inc.)的商品名);例如alexafluordye350、alexafluordye430、alexafluordye488、alexafluordye532、alexafluordye546、alexafluordye555、alexafluordye568、alexafluordye594、alexafluordye633、alexafluordye647、alexafluordye660、alexafluordye680、alexafluordye700、alexafluordye750等alexa系列色素(都是分子探针公司(molecularprobes)的商品名);例如cy3、cy3.5、cy5、cy5.5、cy7等cydye系列色素(都是安发玛西亚生物技术公司(amershambiosciences)的商品名);例如考马斯亮蓝r250,甲基橙等色素等;通常在该领域使用的标记物质。其中,优选过氧化物酶、微过氧化物酶、碱性磷酸酶、β-半乳糖苷酶、葡萄糖氧化酶、葡萄糖-6-磷酸脱氢酶、乙酰胆碱酶、苹果酸脱氢酶、荧光素酶等酶类,更优选过氧化物酶。
另外,如上所述地使标记物质结合于本发明的抗体1或抗体2(进行标记)时,例如,只要适当利用本已公知的eia、ria、fia等免疫测定法等中一般实施的本已公知的标记方法来进行即可。
在对如上所述的抗体1和/或抗体2进行标记时,需要将游离的通过标记物质进行了标记的抗体(标记抗体)和复合体分离。因此,例如在形成复合体1的情况下,优选,通过标记物质对抗体1和抗体2的任一个抗体进行标记,将未标记而留下的抗体1或抗体2固定化于不溶性载体。此情况下,优选,将抗体1固定于不溶性载体,通过标记物质对抗体2进行标记。另外,例如在形成复合体2的情况下,优选对任意的一者抗体2进行标记而将其它的抗体2固定化于不溶性载体。游离的标记抗体和复合体的分离能够通过公知的b/f分离法进行分离。
作为本发明的固定化抗体1或抗体2的不溶性载体,例如只要是通常的免疫学的测定法等中使用的载体则都能使用。具体可列举:例如聚苯乙烯、聚丙烯、聚丙烯酸、聚甲基丙烯酸、聚丙烯酰胺、聚甲基丙烯酸缩水甘油酯、聚氯乙烯、聚乙烯、聚氯碳酸酯、硅树脂、硅橡胶等合成高分子化合物;例如多孔性玻璃、磨砂玻璃、陶瓷、氧化铝、硅胶、活性炭、金属氧化物等无机物质等。另外,这些不溶性载体可以以微量滴定板、珠子、管、许多管一体成型的专用托盘、碟状片、微粒子(胶乳粒子)等各种各样的方式来使用。其中,出于洗涤的难易度以及同时处理许多检体(试样)时的操作性等方面的考虑,优选微孔板、珠子。使本发明的抗体1或抗体2固定化于不溶性载体的方法,按照通常该领域内利用的方法进行即可。
另外,如上所述的固定化本发明的抗体1或2的不溶性载体,也能够使用本已公知的免疫比浊法、免疫浊度法。
作为在不固定化于不溶性载体的情况下使游离的标记抗体和复合体分离的方法,可列举例如色谱法、高效液相色谱法、电泳法、毛细管电泳法、毛细管芯片电泳法、使用例如libasys(岛津制作所(株)制)等自动免疫分析装置的方法等。其具体条件可以设定,只要能使得到的复合体1以及2与未形成复合体的游离的(标记)抗体1和/或抗体2分离即可,其它的条件按照本已公知的方法即可。例如,使用hplc进行分离时,按照《anal.chem.》65,5,613-616(1993)、日本特开平9-301995号中记载的方法进行即可;使用毛细管电泳法时,按照《j.chromatogr.》593,253-258,(1992)、《anal.chem.》64,1926-1932,(1992)、wo2007/027495等中记载的方法进行即可。另外,作为自动免疫分析装置,例如使用libasys时,按照《生物试料分析》,第22卷4号303-308(1999)中记载的方法进行即可。
作为使用上述标记抗体1或2测定复合体中的标记量的方法,根据标记物质的种类而有所不同,根据标记物质具有的利用某种方法能够检测得出的性质,按照各自规定的方法实施即可。例如,当标记物质是酶的情况下,按照免疫测定法的常规方法,例如《酶免疫测定法》(蛋白质、核酸、酶、附册,no.31,北川常广、南原利夫、辻章夫、石川荣治编,51~63,共立出版(株),1987)等记载的方法进行测定即可;当标记物质是放射性物质的情况下,例如按照ria中实施的常规方法,根据该放射性物质放出的放射线的种类以及强度,适当选择使用液浸型gm计数器、液体闪烁计数器、井型闪烁计数器、hplc用计数器等的测定设备,进行测定即可行(例如,参照《医化学实验讲座》,第8卷,山村雄一监制,第1版,中山书店,1971等)。另外,当标记物质是荧光性物质的情况下,例如可以使用荧光光度计等测定设备的fia中实施的常规方法,例如按照“《图说荧光抗体》,川生明著,第1版,(株)softscience公司,1983”等记载的方法进行测定即可;在标记物质是发光性物质的情况下,按照使用光子计数器等测定设备的常规方法,例如《酶免疫测定法》(蛋白质、核酸、酶、附册,no.31,北川常广、南原利夫、辻章夫、石川荣治编,252~263,共立出版(株),1987)等记载的方法进行测定即可。此外,当标记物质为在紫外区有吸收的物质的情况下,通过使用分光光度计等的测定设备的常规方法进行测定即可;当标记物质具有自旋性质的情况下,按照使用电子自旋共振装置的常规方法,例如《酶免疫测定法》(蛋白质、核酸、酶、附册,no.31,北川常广、南原利夫、辻章夫、石川荣治编,264~271,共立出版(株),1987)等记载的方法,进行各自的测定即可。
例如,在标记物质是酶的情况下,可列举使其与显色试剂反应而引入显色反应,通过分光光度计等测定反应结果生成的色素量的方法等本已公知的方法。此外,为了停止显色反应,可以利用通常在该领域使用的停止反应的方法,例如在反应液中添加1~6n的硫酸等酶活性抑制剂或试剂盒附带的反应停止剂等。
作为上述显色试剂,可列举例如四甲基联苯胺(tmb)、邻苯二胺、邻硝基苯-β-d-半乳糖苷、2,2’-联氨-双(3-乙基苯并噻唑啉-6-磺酸)(abts)、n-乙基-n-磺丙基-间甲氧基苯胺(adps)、对硝基苯基磷酸等通常在该领域使用的显色试剂。另外,它们的使用浓度从通常在该领域使用的浓度范围内适宜设定即可。
作为本发明的含s-s键β链的hpt的测定法的具体例,在使用过氧化物酶(pod)作为标记物,使用固定化于不溶性载体的本发明的抗体1和通过pod标记的本发明的抗体2,测定检体中的本发明的含s-s键β链的hpt时的方法,如以下所述。
即,使检体中的本发明的含s-s键β链的hpt与固定化了本发明的抗体1的不溶性载体(含有0.1ng~0.1mg的本发明的抗体1)接触,在4~40℃反应3分钟~20小时,从而在不溶性载体上生成抗体1和本发明的含s-s键β链的hpt的复合体。接着,与含有通过pod标记的本发明的抗体2的溶液50~100μl(含有0.1ng~0.1mg的本发明的抗体2)在4~40℃反应3分钟~20小时,从而在不溶性载体上生成固定化抗体1-本发明的含s-s键β链的hpt-标记抗体2的复合体。接着,例如添加适当浓度的tmb溶液后,反应一定的时间,加入1m磷酸等反应停止液使反应停止,测定450nm的吸光度。另一方面,针对已知浓度的本发明的含s-s键β链的hpt,使用与上述相同的试剂进行同样的操作,制作测定值与浓度之间的检量线。通过将由上述测定所得到的测定值应用于该检量线,从而求出本发明的含s-s键β链的hpt的量。
需要说明的是,本发明不限于手动方法,也能充分利用于使用自动分析装置的测定体系,能够容易又迅速地进行测定。此外,对使用手动方法或自动分析装置进行测定时的试剂类等的组合等没有特别限定,适当选择使用根据应用的自动分析装置的环境、仪器种类而定的或者再加上考虑其它因素而认为最好的试剂类等的组合即可。
[判定方法]
本发明的消化道癌的判定法1中的消化道癌的判定方法,是通过上述测定方法测定检体中的本发明的含s-s键β链的hpt并基于该测定结果进行判定的。
即,例如预先设定基准值,在本发明的含s-s键β链的hpt的测定结果(测定值)高于该基准值的情况下,可判定为提供检体的受检者有消化道癌(例如胰腺癌、大肠癌)的风险或受检者有消化道癌(胰腺癌、大肠癌)的风险高。而且,还能够与该检体中的本发明的含s-s键β链的hpt的量或其量的范围相对应地设定复数个判定区段,[例如(1)没有消化道癌(胰腺癌、大肠癌)的风险,(2)消化道癌(胰腺癌、大肠癌)的风险低,(3)有消化道癌(胰腺癌、大肠癌)的征兆,(4)消化道癌(胰腺癌、大肠癌)的风险高等],从而判定测定结果落入哪个判定区段。
关于上述基准值,使用消化道癌(胰腺癌、大肠癌)患者和非消化道癌(非胰腺癌、非大肠癌)患者的检体,通过上述测定方法测定检体中的本发明的含s-s键β链的hpt,以该值的界限值等为基础来设定即可。
进而,当本发明的含s-s键β链的hpt的测定结果(测定值)高于使用非消化道癌(非胰腺癌、非大肠癌)患者的检体而来的基准值(例如平均值)的情况下,能判定为提供检体的受检者有消化道癌(胰腺癌、大肠癌)的风险,或者有消化道癌(胰腺癌、大肠癌)的风险高等。而且,还能够与该本发明的含s-s键β链的hpt的测定值或其测定值的范围相对应地设定复数个判定区段,[例如没有(1)消化道癌(胰腺癌、大肠癌)的风险,(2)消化道癌(胰腺癌、大肠癌)的风险低,(3)有消化道癌(胰腺癌、大肠癌)的征兆,(4)消化道癌(胰腺癌、大肠癌)的风险高等],从而判定测定结果落入哪个判定区段。
进一步,通过使用同一受检者的检体,将某时刻测定的来自受检者的检体中的本发明的含s-s键β链的hpt的测定结果与不同时刻的本发明的含s-s键β链的hpt的测定结果相比较,评价测定结果(测定值)的增减和/或增减的程度,从而能够判定出现了消化道癌(胰腺癌、大肠癌)的风险,或者消化道癌(胰腺癌、大肠癌)的风险变高等。另外,在没有看到该本发明的含s-s键β链的hpt的测定值的变化的情况下,能判定为没有消化道癌(胰腺癌、大肠癌)的可能性或病情没有变化。
2.本发明的消化道癌的判定方法2
在本发明的消化道癌的判定方法2中,通过(1)测定检体中的本发明的含s-s键β链的hpt,(2)测定同一个检体中的有α链的人触珠蛋白(以下,有时简写为本发明的含α链的hpt),(3)比较(1)和(2)中得到的测定结果,判定其比较结果,由此进行癌的判定即可。另外,本发明的方法还包括用于获得判定消化道癌所用的数据的方法,其特征在于,如上所述地测定检体中的本发明的含s-s键β链的hpt,测定同一个检体中的本发明的含α链的hpt。
[本发明的含s-s键β链的hpt以及本发明的含α链的hpt]
在本发明的消化道癌的判定方法2中测定的本发明的含s-s键β链的hpt与上述本发明的消化道癌的判定方法1项中记载的相同。
本发明的消化道癌的判定方法2中测定的本发明的含α链的hpt只要是有α链的人触珠蛋白无论那种都可以,s-s键被切断以及未被切断的都包括在内。
[本发明的检体]
可举出与上述本发明的消化道癌的判定方法1项中记载的相同的检体。
[消化道癌]
可举出与上述本发明的消化道癌的判定方法1项中记载的相同的癌。
[本发明的本发明的含s-s键β链的hpt的测定方法]
通过与上述本发明的消化道癌的判定方法1项中记载的相同的方法,测定本发明的含s-s键β链的hpt。
[本发明的含α链的hpt的测定方法]
本发明的测定含α链的hpt的方法,可列举例如,使用对含α链的hpt有亲和性的物质、对人触珠蛋白的α链有亲和性的物质、对人触珠蛋白有亲和性的物质等的方法,作为有该亲和性的物质,具体可列举例如抗体、凝集素、多糖类、dna、酶底物、蛋白质、各种受体、各种配体等,特别优选抗体。而且,有上述亲和性的物质还可以适当组合2~3种来使用。作为使用有该亲和性的物质的方法,可列举所有的与上述本发明的消化道癌的判定方法1的[本发明的具有s-s键未被切断的β链的触珠蛋白的测定方法]项中记载的方法相同的方法,优选的方法也是相同的。
[使用夹心法的本发明的含α链的hpt的测定方法]
本发明的测定含α链的hpt的方法优选利用了夹心法的测定原理的方法。作为该夹心法的具体方法,可列举例如,使检体和从识别人触珠蛋白的α链的抗体(抗体1)中选出的2种抗体接触而形成复合体3再测定该复合体3的方法。此处使用的2种抗体可以是识别部位相同的抗体也可以是识别部位不同的抗体,但是优选识别部位不同的抗体。具体而言,可列举使检体与2种相同的抗体1接触而形成抗体1-人触珠蛋白-抗体1的复合体3再测定该复合体3的方法,使抗体1、与该抗体1以外的其它识别人触珠蛋白的α链的抗人触珠蛋白抗体(抗体1’)、和检体接触而形成抗体1-人触珠蛋白-抗体1’的复合体2再测定该复合体3的方法等,后者的方法为优选方法。
使用了上述夹心法的方法中的抗体1优选是由标记物质等进行了标记的抗体。此情况下,只要通过标记物质标记抗体1的任一者,基于该标记抗体1的标记物质的量来测定复合体3即可。
作为标记上述抗体1所用的标记物质以及其结合方法,可列举与上述本发明的消化道癌的判定方法1的[使用夹心法进行的本发明的含s-s键β链的hpt的测定方法]项中记载的相同的物质及方法,优选的也是相同的。
在对抗体1进行标记的情况下,需要将游离的由标记物质进行了标记的抗体(标记抗体)与复合体分离。因此,优选,通过标记物质对2种抗体1中的任一种抗体进行标记,将未标记而残留的抗体1固定化于不溶性载体。游离的标记抗体与复合体的分离,能够通过公知的b/f分离法进行分离。作为该情况下的固定化抗体1的不溶性载体以及其固定化方法,可列举与上述[使用夹心法进行的本发明的含s-s键β链的hpt的测定方法]项中记载的那些相同的载体及方法。另外,分离未固定化于不溶性载体的情况下的游离的标记抗体与复合体的方法、使用标记抗体1测定复合体中的标记量的方法也可列举与上述[使用夹心法进行的本发明的含s-s键β链的hpt的测定方法]项中记载的那些相同的方法。
作为本发明的含α链的hpt的测定法的具体例,在使用过氧化物酶(pod)作为标记物,使用固定化于不溶性载体的本发明的抗体1和通过pod进行了标记的本发明的抗体1,来测定来自生物体的试样中的本发明的含α链的hpt量的情况下,如以下所述。
即,使检体与固定化了本发明的抗体1的不溶性载体(含有0.1ng~0.1mg的本发明的抗体1)接触,在4~40℃反应3分钟~20小时而在不溶性载体上生成抗体1和本发明的含α链的hpt的复合体。接着,与含有通过pod进行了标记的本发明的抗体1的溶液50~100μl(含有0.1ng~0.1mg的本发明的抗体1)在4~40℃反应3分钟~16小时。此外,优选,pod标记的抗体1与固定化于不溶性载体的抗体1不同。通过反应在不溶性载体上生成固定化抗体1-本发明的含α链的hpt-标记抗体1的复合物。接着,例如,添加适当浓度的tmb溶液后,反应一定时间,加入1m磷酸等反应停止液,使反应停止。测定450nm的吸光度。另一方面,针对已知浓度的本发明的含α链的hpt使用与上述相同的试剂进行相同的操作来制作测定值与浓度之间的检量线。通过将由上述测定得到的测定值应用于该检量线,从而求出本发明的含α链的hpt量。
需要说明的是,本发明不限于手动方法,也能充分利用于使用自动分析装置的测定体系,能够容易又迅速地进行测定。此外,对使用手动方法或自动分析装置进行测定时的试剂类等的组合等没有特别限定,适当选择使用根据应用的自动分析装置的环境、仪器种类而定的或者再加上考虑其它因素而认为最好的试剂类等的组合即可。
[判定方法]
本发明的消化道癌的判定方法2中的判定方法是通过上述测定方法测定检体中的本发明的含s-s键β链的hpt,并通过上述测定方法测定检体中的本发明的含α链的hpt,基于它们的测定值的比率进行判定的。
即,首先求出本发明的含α链的hpt的测定值相对于本发明的含s-s键β链的hpt的测定值的比率、或本发明的含s-s键β链的hpt的测定值相对于本发明的含α链的hpt的测定值的比率,然后预先设定该比率的基准值,当求得的比率高于或低于该基准值时,能判定提供检体的受检者有消化道癌(例如胰腺癌、大肠癌等)的风险,或者受检者有消化道癌(胰腺癌、大肠癌等)的风险高等。而且,与该检体中的前述比率(求得的比率)或其比率的范围相对应地设定复数个判定区段,[例如(1)没有消化道癌(胰腺癌、大肠癌等)的风险,(2)消化道癌(胰腺癌、大肠癌等)的风险低,(3)有消化道癌(胰腺癌、大肠癌等)的征兆,(4)消化道癌(胰腺癌、大肠癌等)的风险高等],还能够判定测定结果落入哪个判定区段。
关于上述基准值,可以使用消化道癌(胰腺癌、大肠癌等)患者和非消化道癌(胰腺癌、大肠癌等)患者的检体通过上述测定方法求出检体中的前述比率,基于上述值的界限值等来设定即可。优选,基于本发明的含s-s键β链的hpt的测定结果相对于本发明的含α链的hpt的测定结果的比率来进行判定。
另外,在前述比率高于或低于使用非消化道癌(胰腺癌、大肠癌等)患者的检体求得的比率(例如平均值)的情况下,能判定提供检体的受检者有消化道癌(胰腺癌、大肠癌等)的风险,或者消化道癌(胰腺癌、大肠癌等)的风险高等。而且,与前述比率或其比率的范围相对应地设定复数个判定区段,[例如(1)没有消化道癌(胰腺癌、大肠癌等)的风险,(2)消化道癌(胰腺癌、大肠癌等)的风险低,(3)有消化道癌(胰腺癌、大肠癌等)的征兆,(4)消化道癌(胰腺癌、大肠癌等)的风险高等],从而还能够判定求得的比率落入哪个判定区段。
进一步,通过使用同一受检者的检体,将某时刻测定的来自受检者的检体中的前述比率与不同时刻的前述比率进行比较,评价比率的增减和/或增减的程度,从而能够判定出现了消化道癌(胰腺癌、大肠癌等)的风险或消化道癌(胰腺癌、大肠癌等)的风险变高等。另外,在没有看到前述比率的变动的情况下,能判定没有消化道癌(胰腺癌、大肠癌等)的可能性或病情没有变化。
3.用于判定消化道癌的试剂盒
本发明包括用于判定消化道癌的试剂盒(本发明的试剂盒1),该试剂盒包括:含有本发明的抗体1(识别人触珠蛋白的α链的抗体)和本发明的抗体2(识别人触珠蛋白的β链且不识别s-s键被切断的人触珠蛋白的抗体)的试剂;或者,含有从本发明的抗体2中选出的2种抗体的试剂。
进一步,本发明还包括用于判定消化道癌的试剂盒(本发明的试剂盒2),该试剂盒包括:(1)含有本发明的抗体1和本发明的抗体2的试剂或者含有从本发明的抗体2中选出的2种抗体的试剂;以及(2)含有从本发明的抗体1选出的2种抗体的试剂。
上述本发明的试剂盒1以及2中的抗体1以及2与本发明的消化道癌的判定方法1中叙述的相同,优选的抗体也是相同的。本发明的试剂盒1中的从本发明的抗体2中选出的2种抗体可以是相同的抗体也可以是不同的抗体,但是优选是不同的抗体。本发明的试剂盒2中的从本发明的抗体1选出的2种抗体可以是相同的抗体也可以是不同的抗体,但是优选是不同的抗体。具体而言,优选,识别α链的多克隆抗体和识别α链的单克隆抗体的组合。
另外,上述本发明的试剂盒1以及2中的试剂中的抗体1以及抗体2的浓度,只要根据测定方法在通常该领域使用的范围内适当设定即可。另外,这些试剂中也可以含有通常该领域中使用的试剂类、例如缓冲剂、反应促进剂、糖类、蛋白质、盐类、表面活性剂等稳定剂、防腐剂等。它们不妨碍共存试剂的稳定性,也不妨碍本发明的抗体1以及抗体2的反应。另外,它们的浓度从通常该领域常用的浓度范围适当选择即可。
本发明的试剂盒1以及2还可以是进一步组合了制作检量线用的触珠蛋白的标准品的试剂盒。该标准品可以使用市售的标准品,也可以使用按照公知的方法制造的标准品。
以下,基于实施例具体地说明本发明,但是本发明不受这些实施例的任何限定。
实验例1抗人触珠蛋白多克隆抗体(兔子)的识别部位
使用50mm磷酸缓冲液,分别配制100μg/ml的触珠蛋白表型1-1(hpt1-1,西格玛奥德里奇公司制)和触珠蛋白表型2-2(hpt2-2,西格玛奥德里奇公司制),以3:1混合试样用缓冲液1(0.25mtris-hcl(三羟甲基氨基甲烷-氯化氢),ph6.8,8%sds,40%丙三醇,0.02%bpb,20%2-巯基乙醇)制成试样。
其后,以12.5%聚丙烯酰胺凝胶对试样4μl进行电泳。使用bio-rad公司的印迹系统按照使用方案将得到的电泳凝胶以半干式印迹至pvdf膜。通过含有封闭液(blockace)(ds制药生物技术公司(dsファーマバイオメディカル株式会社)制)4%的磷酸缓冲液,对转印后的pvdf膜进行封闭。
在用含封闭液4%的磷酸缓冲液将抗人触珠蛋白多克隆抗体(兔子)[抗人hpt抗体(poly),免疫学顾问实验室公司(immunologyconsultantslaboratory)制]稀释500倍而成的溶液中,浸渍该膜,在室温反应1小时。其后,用含有0.05%聚氧乙烯(20)脱水山梨糖醇单月桂酸酯(吐温20)的磷酸缓冲液洗涤反应后的该膜3次。
进一步,在用含封闭液(blockace)4%的磷酸缓冲液将过氧化物酶(pod)标记抗兔子ig抗体(山羊)(dako公司制)稀释500倍而成的液体中,浸渍该膜,在室温反应1小时。其后,用含0.05%吐温20的磷酸缓冲液洗涤3次。洗涤后,将该膜在溶解了3,3'-二氨基联苯胺四盐酸盐(dab)显色剂(和光纯药工业(株)制)10mg和30%过氧化氢溶液10μl的tris缓冲液(50mmtris-hcl,ph7.6)50ml中浸渍10~30分钟,使其显色。此外,显色后,用纯化水洗涤该膜而使反应停止。
使用由试样用缓冲液1制备的试样所得的结果如图1所示。需要说明的是,图中泳道1表示使用hpt1-1作为试样的结果,泳道2表示使用hpt2-2作为试样的结果。
根据图1可观察到hpt1-1的α1链(10kda附近的条带)以及hpt2-2的α2链(18kda附近hpt1-1以及hpt2-2的β链(39kda附近的条带)。其结果可知,抗人hpt抗体(poly)是与α链(α1链、α2链)以及β链有反应性的抗体。
此外,编码人触珠蛋白的基因存在于16q22.3,已知2个等位基因(基因座)hpt1和hpt2。人触珠蛋白基因编码α链(轻链)和β链(重链),在hpt2产生α链的基因内重复。因此,在hpt1和hpt2中β链相同,而hpt2的α链比hpt1的更长。基因型存在hpt1/hpt1、hpt1/hpt2、hpt2/hpt2这3类。产生与此对应的3类蛋白hpt1-1,hpt2-1,hpt2-2,可在血中检测出。分别形成αβ的二聚体(αβ)2,β链为39kda、hpt1的α链(α1链)为10kda、hpt2的α链(α2链)为18kda,因此计算的分子量为98~114kda。(文献:《febsjournal》,275(2008)5648-5656)。
实验例2对α链有反应性的抗人触珠蛋白单克隆抗体(10-7抗体)的获取
(1)触珠蛋白的制作
通过添加了10%胎牛血清(fbs,生物工业(biologicalindustries),以色列)、100u/ml青霉素以及100μg/ml链霉素的rpmi以及l-谷氨酰胺和nahco3(西格玛奥德里奇公司制)在37℃、5%co2条件下培养人大肠癌细胞株hct116(actt)。培养板使用的是iwaki培养板10cm以及15cm(iwaki公司,东京,日本)。将得到的培养液分成2份,一份用于获得不含有岩藻糖的触珠蛋白(hpt(-))而进行非岩藻糖培养,而另一份用于获得含有岩藻糖的触珠蛋白(hpt(+))而添加岩藻糖进行培养。也就是说,一份在回收培养上清时使用不添加fbs的rpmi来培养细胞96小时后,回收。而另一份在回收培养上清时在未添加fbs的rpmi中进一步添加1mm的l-岩藻糖,培养细胞96小时后,回收。
使用perista生物迷你型泵(atto公司,日本,东京)将上述各个培养上清供给至人触珠蛋白抗体柱子(0.5ml/min,4℃,一晩)。需要说明的是,人触珠蛋白抗体柱子是使抗人触珠蛋白多克隆抗体(dako公司制)7.5mg耦合至hi-trap-nhs-activatedhp(gehealthcare公司制)而成的。其后,将柱子洗涤缓冲液(50mmna2hpo4,50mmnah2po4,0.5mnacl,ph7.4)以1.0ml/min供给至抗体柱子15分钟,去除非特异的蛋白。进一步,将洗脱缓冲液(elutionbuffer)(0.1m甘氨酸,ph2.7)以0.5ml/min供给至抗体柱子20分钟,将hpt(-)或hpt(+))从抗体柱子洗脱。进一步,添加中和缓冲液(neutralizationbuffer)(2mtris-hcl,ph8.0)1.0ml,对洗脱液进行中和。使用amiconcolumn(millipore公司,马萨诸塞州,美国)将洗脱液浓缩约200倍,进一步,进行脱盐,纯化。上述处理均在4℃进行。
(2)抗人触珠蛋白单克隆抗体的制作
将由上述制作的hpt(+)200μg与费氏完全佐剂一起在balb/c小鼠上免疫,间隔2周进行hpt(+)50μg2次免疫,最后免疫hpt(+)100μg。其后,通过使用聚乙二醇的常规方法(记载于日本特开平5-244983)使摘取的脾脏细胞和骨髓瘤细胞(sp2/0)融合,用git培养基(和光纯药工业(株)制)对其进行培养。
(3)抗人触珠蛋白单克隆抗体的一次筛选
将抗小鼠igg抗体(兔子)(西格玛奥德里奇公司制)在微孔板的每1个孔中固定0.25μg。其后,通过牛血清白蛋白(bsa)、酪蛋白等进行封闭。
接着,将细胞培养液的上清或者培养液50μl加入孔中,静置60分钟。其后,通过在pbs中添加了0.1%吐温20的洗涤液(pbs-吐温)洗涤孔3次。
进一步,将在pbs中溶解了250ng/ml的hpt(+)或hpt(-)50μl加入孔中,静置60分钟。其后,用pbs-吐温洗涤孔3次。
接着,加入pod标记抗触珠蛋白多克隆抗体[多克隆抗体是从dako公司购入,通过常规方法(石川荣治著,《酶标记法》,学会出版中心,1991年,p.62的方法)用pod进行了标记],静置30分钟。其后,用pbs-吐温洗涤孔3次。
进一步,加入底物溶液(邻苯二胺(opd)(和光纯药工业(株)制))50μl,显色30分钟,添加1m硫酸溶液100μl,使反应停止。其后,用吸光度计(492nm)测定得到的溶液的吸光度。根据该结果,分选出hpt(+)发光、hpt(-)不发光的抗人触珠蛋白抗体。
(4)抗人触珠蛋白单克隆抗体的二次筛选
使用由(3)得到的多种类的抗人触珠蛋白单克隆抗体,进行下述免疫印迹处理,从中分选出对人触珠蛋白α链有反应性的抗体。
即,首先,使用50mm磷酸缓冲液,分别配制成100μg/ml的hpt1-1以及hpt2-2,以3:1混合与实验例1相同的试样用缓冲液1制成试样。
其后,通过12.5%聚丙烯酰胺凝胶对该试样4μl进行电泳。使用bio-rad公司的印迹系统按照使用方案以半干式将得到的电泳凝胶印迹至pvdf膜。通过含封闭液(ds制药生物技术公司制)4%的磷酸缓冲液对印后的pvdf膜进行封闭。在用含封闭液4%的磷酸缓冲液稀释pod标记的抗人触珠蛋白单克隆抗体200倍而成的液体中,浸渍该膜,在室温反应1小时。用含0.05%吐温20的磷酸缓冲液洗涤反应后的该膜3次。洗涤后,将该膜在溶解了dab显色剂(和光纯药工业(株)制)10mg以及30%过氧化氢溶液10μl的tris缓冲液(50mmtris-hcl,ph7.6)50ml中浸渍10~30分钟,显色。此外,显色后,用纯化水洗涤该膜而使反应停止。
根据该结果选出与hpt1-1的α1链(10kda附近的条带)以及hpt2-2的α2链(18kda附近的条带)这两者有反应性的抗体(10-7抗体)。也就是说,获取对α链有结合能的抗体。使用10-7抗体时的泳动结果示于图2。需要说明的是,图2中的泳道1表示使用hpt1-1作为试样的结果,泳道2表示使用hpt2-2作为试样的结果。
实验例3对β链有反应性而与s-s键被切断的人触珠蛋白不反应的抗人触珠蛋白单克隆抗体(3-1抗体以及3-5抗体)的获取
使用由实验例2(3)得到的多种的抗人触珠蛋白单克隆抗体,进行下述免疫印迹处理,分选出对β链有反应性而与s-s键被切断的人触珠蛋白不反应的抗体。
即,首先,使用50mm磷酸缓冲液,分别配制成100μg/ml的hpt1-1和hpt2-2,以3:1混合试样用缓冲液2(0.25mtris-hcl,ph6.8,8%sds,40%丙三醇,0.02%bpb),制成试样。另外,同样地将配制成100μg/ml的hpt1-1以及hpt2-2以3:1和与实验例1相同的试样用缓冲液1混合,制成试样。
其后,通过7.5%聚丙烯酰胺凝胶分别对用试样用缓冲液2配制的试样4μl进行电泳。使用bio-rad公司的印迹系统,按照使用方案以半干式将得到的电泳凝胶印迹至pvdf膜。通过含封闭液(ds制药生物技术公司制)4%的磷酸缓冲液对转印后的pvdf膜进行封闭。
其后,在用含封闭液4%的磷酸缓冲液稀释pod标记的抗触珠蛋白单克隆抗体200倍的液体中,浸渍该膜,在室温反应1小时。将反应后的该膜用含0.05%吐温20的磷酸缓冲液洗涤3次。
洗涤后,将该膜在溶解了dab显色剂10mg以及30%过氧化氢溶液10μl的tris缓冲液(50mmtris-hcl,ph7.6)50ml中浸渍10~30分钟,显色。此外,显色后,用纯化水洗涤该膜而使反应停止。另外,使用通过试样用缓冲液1制备的试样4μl和12.5%聚丙烯酰胺凝胶,同样地进行了实验。
使用通过试样用缓冲液2制备的试样的结果中,使用3-1抗体以及3-5抗体时的结果示于图3以及图4,使用通过试样用缓冲液1制备的试样的结果中,使用3-1抗体以及3-5抗体时的结果示于图5以及图6。需要说明的是,图中泳道1是使用hpt1-1作为试样的结果,泳道2是使用hpt2-2作为试样的结果。
根据图3以及图4,使用3-1抗体以及3-5抗体时的任一种情况下都可在hpt1-1中在100kda附近看到条带,在hpt2-2中,在135kda以上看到复数个条带。另外,对于试样用缓冲液2,使用3-1抗体、3-5抗体没有看到条带。
在试样用缓冲液2中s-s键未被切断,而在试样用缓冲液1中在还原剂(2-巯基乙醇)作用下s-s键被切断。
因此,根据该结果,作为识别有s-s键的结构但不识别s-s键被切断的人触珠蛋白的抗体,选定3-1抗体以及3-5抗体。
实验例43-1抗体以及3-5抗体的识别部位
为了确定由实验例3得到的3-1抗体以及3-5抗体的识别部位,进行3-1抗体或3-5抗体自身的竞争评价。作为参照,进行识别α链的10-7抗体自身的竞争评价。
(1)3-1抗体的竞争评价
将3-1抗体0.6μg固定于1个聚苯乙烯珠子。其后,通过bsa、酪蛋白进行封闭,制成抗体珠子。另外,使用3-1抗体通过pod进行标记,用含2%bsa的mes缓冲液进行稀释,制成酶标记3-1抗体液(0.2nmol/l)。将含5mmol/l鲁米诺的溶液作为底物液,以含0.02%过氧化氢的溶液作为过氧化氢液。另外,使用含2%bsa的mops缓冲液,分别稀释成1μg/ml的hpt1-1、hpt2-2,制成试样。另外,使用含2%bsa的mops缓冲液作为对照。
测定时,使用自动化学发光酶免疫分析装置(spherelightwako),如下所述地进行测定。也就是说,在置入1个抗体珠子的反应槽中加入含试样10μl和2%bsa的mops缓冲液130μl,在37℃反应约7分钟,用磷酸缓冲液进行洗涤。然后,加入酶标记3-1抗体液140μl,在37℃反应约7分钟,用磷酸缓冲液进行洗涤。进一步,加入底物液70μl和过氧化氢液70μl,测定发光量。使用各个试样时的结果示于表1。
(2)3-5抗体的竞争评价
将3-5抗体0.6μg固定于1个聚苯乙烯珠子。其后,通过bsa、酪蛋白进行封闭,制成抗体珠子。另外,使用3-5抗体通过pod进行标记,通过含2%bsa的mes缓冲液进行稀释,制成酶标记3-5抗体液(2.4nmol/l)。
使用上述抗体珠子和酶标记3-5抗体液,除此以外,以与上述(1)记载的方法同样地测定发光量。使用各个试样时的结果与(1)的结果一起示于表1。
(3)10-7抗体的竞争评价
将10-7抗体0.6μg固定于1个聚苯乙烯珠子。其后,通过bsa、酪蛋白进行封闭,制成抗体珠子。另外,使用10-7抗体通过pod进行标记,通过含2%bsa的mes缓冲液进行稀释,制成酶标记10-7抗体液(8.2nmol/l)。
使用上述抗体珠子和酶标记10-7抗体液,除此以外,以与上述(1)记载的方法同样地测定发光量。使用各个试样时的结果与(1)(2)的结果一起示于表1。
[表1]
对于3-1抗体自身以及3-5抗体自身的组合结果,与对照(缓冲液)的值相比较,hpt1-1以及hpt2-2的发光量上升,但是对于10-7抗体自身的组合结果,没有看到发光量的上升。该结果意味着,在邻接的二聚体以上的hpt中,难以结合识别α链的2个抗体。这被认为是hpt1-1以及hpt2-2是结合了α链的复合体的原因(参照下述hpt1-1模型以及hpt2-2模型:表中的数字表示个数)。
需要说明的是,在10-7抗体自身的竞争反应中,将hpt1-1的浓度设为5μg/ml、50μg/ml时,发光量是3124、14944;将hpt2-2的浓度设为5μg/ml、50μg/ml时,发光量是121512、1522718。也就是说,10-7抗体在竞争作用下结合量下降,但是确认了有结合。
另一方面,在3-1抗体或3-5抗体自身的竞争评价中,可知因为对于hpt1-1、hpt2-2,发光量都大大上升,所以没有识别α链。也就是说,意味着这些抗体识别β链。
进一步,对于3-1抗体、3-5抗体,hpt2-2的发光量都比hpt1-1的更大。hpt1-1属于(αβ)2方式,最多只能结合2个抗体(参照下述hpt1-1模型),而hpt2-2属于(αβ)n方式,只要是β链即能结合复数个抗体(参照下述hpt2-2模型)。因此,对于3-1抗体、3-5抗体均一致的是,相比于hpt1-1,hpt2-2的发光量都上升。
因此,根据实验例3和4的结果,可断定3-1抗体以及3-5抗体的识别部位是有s-s键的β链。也就是说,可断定3-1抗体以及3-5抗体是识别β链但不识别s-s键被切断的人触珠蛋白的抗人触珠蛋白单克隆抗体。
hpt1-1模型
hpt2-2模型
实施例1-6使用两种抗体进行的hpt的测定
使用由实验例1确定了识别部位的抗人hpt抗体(poly)以及由实施例2-4得到的3种抗人触珠蛋白单克隆抗体(10-7抗体、3-1抗体、3-5抗体),通过组合各个抗体,探讨可否进行癌的判定。具体而言,通过下述抗体的组合,进行大肠癌以及胰腺癌的判定。
组合1:10-7抗体或抗人hpt抗体(poly)与3-1抗体或3-5抗体的组合
组合2:3-1抗体或3-5抗体与3-1抗体或3-5抗体的组合
首先,将10-7抗体0.6μg固定于1个聚苯乙烯珠子后,通过bsa、酪蛋白进行封闭,得到了抗体珠子。同样地,将抗人hpt抗体(poly)0.3μg固定于1个聚苯乙烯珠子后,通过bsa、酪蛋白进行封闭,得到了抗体珠子。另外,将3-1抗体0.6μg固定于1个聚苯乙烯珠子后,通过bsa、酪蛋白进行封闭,得到了抗体珠子。
另一方面,通过pod标记3-1抗体以及3-5抗体,通过含2%bsa的mes缓冲液进行稀释,分别得到酶标记3-1抗体液(0.2nmol/l)、酶标记3-5抗体液(2.4nmol/l)。
其后,将含5mmol/l鲁米诺的溶液作为底物液,将含0.02%过氧化氢的溶液作为过氧化氢液。另外,使用含2%bsa的mops缓冲液,将大肠癌患者、胰腺癌患者、健康者的血清稀释51~1071倍,制成试样。
测定时,使用自动化学发光酶免疫分析装置(spherelightwako),如下所述地进行测定。
在放入了1个10-7抗体、抗人hpt抗体(poly)、3-1抗体中的任一者的抗体珠子的反应槽中,加入含试样10μl和2%bsa的mops缓冲液130μl,在37℃反应约7分钟,用磷酸缓冲液进行洗涤。然后,加入酶标记3-1抗体液或酶标记3-5抗体液140μl,在37℃反应约7分钟,用磷酸缓冲液进行洗涤。进一步,加入底物液70μl和过氧化氢液70μl,测定发光量。
另一方面,使用hpt2-2,通过含2%bsa的mops缓冲液稀释成0、0.05、0.1、0.5、1、5、10μg/ml,与上述方法同样地进行测定,制作检量线。将上述测定结果应用于该检量线,算出复合体1的人触珠蛋白(hpt)浓度。
将这些结果绘制成图,示于图7-12。实施例和图、图的内容以及使用的抗体的关系如下。此外,由实施例1~6得到的人触珠蛋白浓度分别定为hpt浓度1~6。
实施例1:图7:hpt浓度1的分布图:10-7抗体和3-1抗体
实施例2:图8:hpt浓度2的分布图:10-7抗体和3-5抗体
实施例3:图9:hpt浓度3的分布图:抗人hpt抗体(poly)和3-1抗体
实施例4:图10:hpt浓度4的分布图:抗人hpt抗体(poly)和3-5抗体
实施例5:图11:hpt浓度5的分布图:3-1抗体和3-1抗体
实施例6:图12:hpt浓度6的分布图:3-1抗体和3-5抗体。
另外,将实施例1~6的测定结果示于表2,将大肠癌患者与健康者的显著性差异检验结果、胰脏癌患者与健康者的显著性差异检验结果、以及胰腺癌患者与大肠癌患者的显著性差异检验结果示于表3。需要说明的是,显著性差异检验表示是通过斯迪如-多斯(steel-dwass)检验进行的均是两两的非参数化比较。
[表2]
[表3]
根据实施例1~6的结果可知,当通过10-7抗体或抗人hpt抗体(poly)与3-1抗体或3-5抗体的组合、以及3-1抗体与3-1抗体或3-5抗体的组合,来测定hpt的浓度时,能看到健康者与大肠癌患者、健康者与胰腺癌患者间的显著性差异。另外,在各个hpt浓度下全部是大肠癌患者以及胰腺癌患者比健康者的值更高,可知,基于该结果能够进行癌的判定。
实施例7~18基于浓度比率进行的癌的判定
使用抗人hpt抗体(poly)和10-7抗体,测定复合体浓度(hpt浓度7),算出由上述实施例1~6得到的hpt浓度1~6与hpt浓度7的比率,进行大肠癌以及胰腺癌的判定。另外,同样地使用抗人hpt抗体(poly)和抗人hpt抗体(poly),测定复合体浓度(hpt浓度8),算出hpt浓度1~6与hpt浓度8的比率,进行大肠癌以及胰腺癌的判定。具体地进行如下的实验。
(1)hpt浓度7以及hpt浓度8的测定
将抗人hpt抗体(poly)0.3μg固定于1个聚苯乙烯珠子后,通过bsa、酪蛋白进行封闭,得到了抗体珠子。
另一方面,通过pod对10-7抗体以及抗人hpt抗体(poly)进行标记,通过含2%bsa的mes缓冲液进行稀释,得到了酶标记10-7抗体液(4.0nmol/l)、酶标记hpt(poly)抗体液(0.2nmol/l)。
其后,以含5mmol/l鲁米诺的溶液作为底物液,以含0.02%过氧化氢的溶液作为过氧化氢液。另外,使用含2%bsa的mops缓冲液,将大肠癌患者、胰腺癌患者、健康者的血清稀释51~1071倍,制成试样。
测定时,使用自动化学发光酶免疫分析装置(spherelightwako),如下所述地进行测定。
在放入1个抗体珠子的反应槽中加入含试样10μl和2%bsa的mops缓冲液130μl,在37℃反应约7分钟,用磷酸缓冲液进行洗涤。接着,加入酶标记10-7抗体液或酶标记hpt(poly)抗体液140μl,在37℃反应约7分钟,用磷酸缓冲液进行洗涤。然后,加入底物液70μl和过氧化氢液70μl,测定发光量。
另一方面,使用hpt2-2,通过含2%bsa的mops缓冲液稀释成0、0.05、0.1、0.5、1、5、10μg/ml,与上述方法同样地进行测定,制作检量线。将上述测定结果应用于该检量线来算出hpt浓度。
此处,算出的使用抗人hpt抗体(poly)和10-7抗体而得到的复合体的浓度(hpt浓度)作为hpt浓度7,将使用抗人hpt抗体(poly)和抗人hpt抗体(poly)而得到的复合体的浓度(hpt浓度)作为hpt浓度8。
(2)hpt浓度1~6
hpt浓度1~6使用的是在上述实施例1~6中算出的浓度。
(3)hpt浓度1~6与hpt浓度7以及8的比率
用hpt浓度1~6除以通过上述(1)算出的hpt浓度7以及hpt浓度8,分别算出各个比率。
将这些结果绘制成图,示于图13-24。实施例与图的关系如下述表4所述。
[表4]
将这些实施例的测定结果总汇于表5。并且,将与各实施例的结果相关的大肠癌患者与健康者的显著性差异检验结果、胰脏癌患者与健康者的显著性差异检验结果、以及胰腺癌患者与大肠癌患者的显著性差异检验结果示于表6。需要说明的是,显著性差异检验表示是通过斯迪如-多斯(steel-dwass)检验进行的均是两两的非参数化比较。
[表5]
[表6]
根据这些结果可知,将通过10-7抗体或抗人hpt抗体(poly)与3-1抗体或3-5抗体的组合得到的复合体1的浓度或者通过3-1抗体或3-5抗体与3-1抗体或3-5抗体的组合得到的复合体2的浓度,与通过3-1抗体或3-5抗体与3-1抗体或3-5抗体的组合得到的复合体3的浓度进行比较时,可看到健康者与胰腺癌患者、或健康者与大肠癌患者之间的显著性差异。而且,对于复合体1的浓度1/复合体3的浓度的比率、或复合体2的浓度/复合体3的浓度的比率,大肠癌患者和胰腺癌患者两者相比健康者的癌上升,因此能够进行癌的判定。
实施例19各种实验结果的诊断效率
使用在实施例1~6中得到的hpt浓度以及由实施例7~18得到的hpt浓度的比率当中的健康者与胰腺癌患者的结果,算出基于roc曲线的auc值、截止值(cutoff)、灵敏度、特异度以及诊断效率。其结果示于表7。
[表7]
在胰腺癌的判定中,在实施例1~6中得到的hpt浓度和在实施例7~11中得到的hpt比率,auc值为0.8以上,是良好的值。因此,可知,在胰腺癌的判定中,通过使用hpt浓度1~6,或者,通过使用hpt浓度1~6与hpt浓度7(抗人hpt抗体(poly)和10-7抗体)之间的比率,能够高精度地判定癌。
而且,在实施例1~6中得到的hpt浓度,其灵敏度0.600~0.640、特异度0.923~1、诊断效率81.3~85.9%而特异度较高,对胰腺癌的判定特别有用。
(2)健康者和大肠癌患者
使用在实施例1~6中得到的hpt浓度以及由实施例7~18得到的hpt浓度的比率当中的健康者与胰腺癌患者的癌结果,将基于roc曲线的auc值、截止值、灵敏度、特异度、诊断效率示于表8。
[表8]
在大肠癌的判定中,在实施例1以及3~6中得到的hpt浓度和在实施例7~13中得到的hpt比率,auc值为0.8以上,是良好的值。
在它们当中,在实施例7~11中得到的hpt比率,诊断效率在80%以上,是良好。因此,可知,在大肠癌的判定中,相对于仅以hpt浓度进行判定而言,使用hpt浓度7(使用抗人hpt抗体(poly)和10-7抗体而得到hpt浓度)来算出比率的结果进行判定的话,诊断效率更高。
进一步,以hpt比率的方式,抗体一方为3-1抗体的hpt浓度1、3与hpt浓度7的组合(实施例7、9)、抗体一方为抗人hpt抗体(poly)的hpt浓度3、4与hpt浓度7的组合(实施例9、10),不仅特异度良好(0.795~0.821)而且灵敏度(0.878~1)比特异度更高,诊断效率为85.0~90.0%,因此特良好。
特别是,作为hpt浓度3(抗人hpt抗体(poly)和3-1抗体)和hpt浓度7(抗人hpt抗体(poly)和10-7抗体)的组合的实施例9的比率最好,诊断效率为90.0%。
此外,上述实施例7、9、10中的大肠癌的阶段分布图示于图25~27。其结果可知,无论大肠癌处于哪个阶段,都能检测出来,对早期大肠癌的检测也有用。
- 还没有人留言评论。精彩留言会获得点赞!