一种离子液体诱导的CIK细胞及其应用的制作方法
本发明属于细胞免疫领域,具体涉及一种离子液体诱导的cik细胞及其应用。
背景技术:
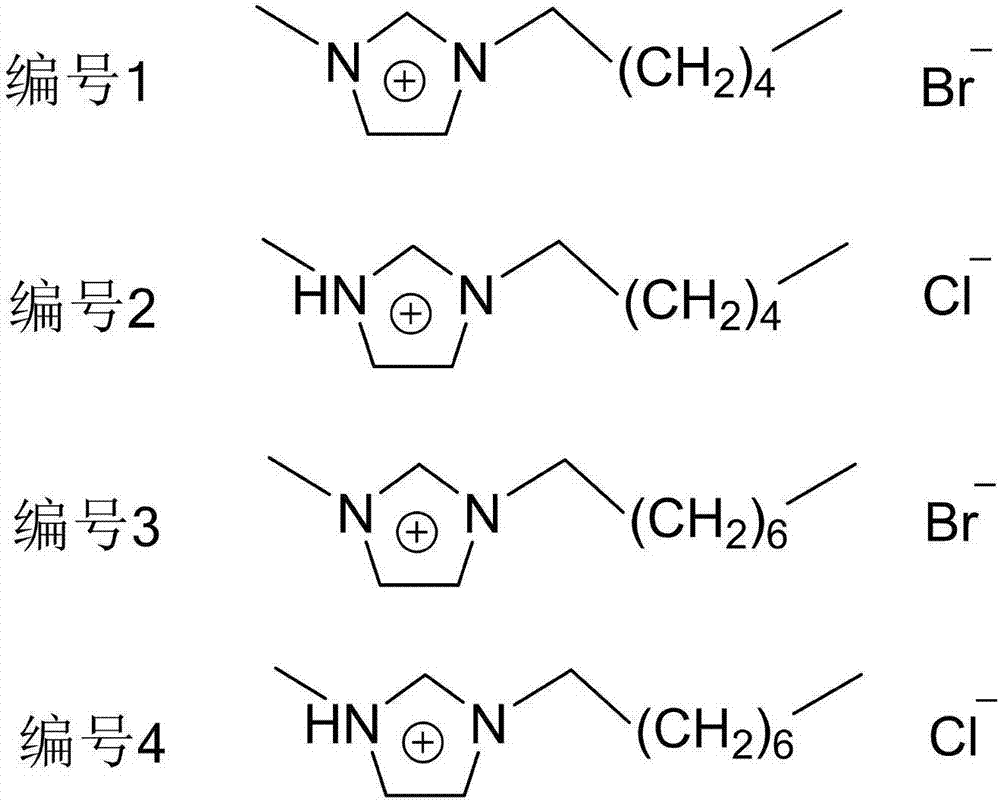
:胃癌是世界上排名第四的恶性肿瘤,全球每年约有70多万人死于胃癌,占全部恶性肿瘤死亡人数的10%左右。我国最新公布的肿瘤数据显示,胃癌的发病率和死亡率分别位居全国第二和第三。胃癌常好发于50岁以上的中老年人并逐渐呈现年轻化的趋势。因此,研发胃癌新型治疗技术,解决胃癌相关的重大科学问题,是保障人口健康、维持社会经济高速稳定发展、保障战略顺利实施的迫切需求。生物治疗是继手术、化疗及放疗3种传统模式之后的第4大肿瘤治疗模式,前3种模式或毒副作用较大,或不能清除体内残存肿瘤细胞,大部分肿瘤患者终因复发或难治而导致死亡。细胞免疫治疗技术在肿瘤的生物治疗中占有重要地位,显示出良好的应用前景,并逐渐成为胃癌治疗的重要手段之一。细胞因子诱导的杀伤细胞(cytokine-inducedkillercell,cik)是近年来发现的一种非常有前景的过继免疫细胞,具有增殖迅速、杀瘤活性广谱且高效、毒副作用微小等优点,已经成为肿瘤生物免疫治疗的主力军。cik细胞的主要效应细胞为cd3+cd56+表型t淋巴细胞,兼有nk细胞和t细胞的特征。在功能上,cik一方面拥有t淋巴细胞强大抗肿瘤活性,另一方面拥有nk细胞非mhc限制性的杀伤肿瘤的特点,其增殖迅速、对正常造血影响轻微。因此,如何提高细胞免疫治疗中效应细胞的数量与活性对胃癌治疗具有重要意义。技术实现要素:本发明旨在提供一种离子液体诱导的cik细胞及其应用,该cik细胞具有更强的杀伤肿瘤活性;本发明提供的离子液体可以显著提高cik细胞的增殖力,提高其杀瘤活性。本发明通过如下技术方案得以实现:一种离子液体用于cik细胞培养以提高cik细胞增殖活力和肿瘤杀伤活性的用途,所述离子液体为咪唑类离子液体,其阳离子的化学结构式如下:其中,m取4或6。优选地,所述咪唑类离子液体的阴离子为溴离子或氯离子,离子液体的化学结构式如下:优选地,所述肿瘤为胃癌。一种cik细胞,经上述离子液体诱导获得。一种细胞制剂,含有上述的cik细胞。上述的cik细胞在肿瘤治疗方面的应用。优选地,所述肿瘤为胃癌。本发明优点:本发明提供了一种咪唑类离子液体用于cik细胞培养以提高cik细胞增殖活力和肿瘤杀伤活性,该离子液体与cik细胞诱导培养后可以显著提高cik细胞增殖活力和肿瘤杀伤活性。附图说明图1为离子液体的化学结构式;图2为各组cik细胞培养12天后的增殖倍数;图3为各组cik细胞对mgc-803细胞的体外杀伤率(%);图4为各组cik细胞对胃癌mgc-803移植瘤的体内抑瘤率(%)。具体实施方式为了更好地解释本发明的技术方案,下面结合具体实施例进一步介绍。实施例中未特别强调的实验材料均为常规实验材料,属于本领域技术人员易于获得的范畴。一、实验材料10%胎牛血清和rpmi-1640培养液购于gibco公司,淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司(tbd),il-2购自北京双鹭药业股份有限公司,抗人cd3单抗购自gibco公司,ifn-γ购自美国peprotec公司,il-1α购自美国peprotec公司,cck-8试剂购自上海碧云天生物技术有限公司;编号1-4的离子液体由公司合成部合成,结果如图1。balb/c裸鼠,均选用雌性裸鼠,鼠龄6-7周,体重18-23g,在spf条件下的裸鼠室内饲养,由南京大学实验动物中心提供。胃癌mgc-803细胞购自上海歌凡生物细胞库。二、实验方法1、cik细胞的分离和培养(1)单个核细胞的分离:采集健康志愿者外周血,预冷的pbs1:1稀释,缓慢加入淋巴细胞分离液上层,650g,4℃离心20min,收集白色细胞层,分离单个核细胞,rpmi-1640培养基重悬细胞后置于37℃,5%co2孵箱中孵育2h。(2)cik细胞的培养:收集单核细胞中的悬浮细胞,调整细胞密度至2.5×106/ml,均分为五组进行培养,分组及培养方法如下:常规组:0天时,在完全培养基(rpmi-1640+10%fbs)中加入inf-γ(1000u/ml),放入5%co2、37℃培养箱中孵育24h后,添加il-2(500u/ml)、il-1α(l00u/ml)和抗人cd3单抗(20μg/ml)。每2-3d进行换液,并补充等量的细胞因子,在培养过程中,添加新鲜培养基前用台盼蓝染色检测细胞的活率,统计细胞的绝对数目;连续培养12天,收集细胞;诱导a组:0天时,在完全培养基(rpmi-1640+10%fbs)中加入inf-γ(1000u/ml)和编号1的咪唑类离子液体(40nm),放入5%co2、37℃培养箱中孵育24h后,按照常规组后续方法培养,统计细胞的绝对数目,收集细胞;诱导b组:0天时,在完全培养基(rpmi-1640+10%fbs)中加入inf-γ(1000u/ml)和编号2的咪唑类离子液体(50nm),放入5%co2、37℃培养箱中孵育24h后,按照常规组后续方法培养,统计细胞的绝对数目,收集细胞;诱导c组:0天时,在完全培养基(rpmi-1640+10%fbs)中加入inf-γ(1000u/ml)和编号3的咪唑类离子液体(40nm),放入5%co2、37℃培养箱中孵育24h后,按照常规组后续方法培养,统计细胞的绝对数目,收集细胞;诱导d组:0天时,在完全培养基(rpmi-1640+10%fbs)中加入inf-γ(1000u/ml)和编号4的咪唑类离子液体(50nm),放入5%co2、37℃培养箱中孵育24h后,按照常规组后续方法培养,统计细胞的绝对数目,收集细胞。2、cik细胞的体外肿瘤杀伤活性使用cck-8法检测体外各组cik细胞对胃癌mgc-803细胞的杀瘤活性,以对数生长期的mgc-803细胞作为靶细胞,待贴壁培养24h后,分别以培养12天的各组cik细胞作为效应细胞,分别置于37℃、5%co2、饱和湿度下的细胞培养箱中,待贴壁24h后,按效靶比为10:1加入效应细胞,设效应细胞对照与靶细胞对照,每组3个复孔,效应细胞与靶细胞共培养24h后,每孔按10%的体积加入cck-8溶液,置于培养箱中继续孵育培养4h后,酶联免疫捡测仪选择波长为450nm测定各孔光吸光值,并按照下式计算杀伤活性(杀伤率):杀伤率=[1-(实验组od值-效应细胞组od值)/靶细胞组od值]×l00%。3、cik细胞的体内肿瘤杀伤活性将balb/c裸鼠右腋皮下接种0.2ml1×106/mlmgc-803胃癌细胞后,再随机分成6组:对照组、常规组、诱导a-d组,每组20只。10d后常规组、诱导a-d组的每只裸鼠在接种肿瘤细胞部位处注射0.2ml1×107/ml的cik细胞(分别对应按照上述常规组、诱导a-d组诱导培养12天),对照组裸鼠注射0.2ml生理盐水,连续注射5d。15d后每组剥离肿瘤块并称重,按照如下公式计算抑瘤率(%):抑瘤率=(对照组瘤质量-实验组瘤质量)/对照组瘤质量×100%4、统计学分析使用spss20.0统计学软件进行t检验,p<0.05认为差异显著。三、实验结果1、各组cik细胞的增殖与活率接种时各组都为2.5×106个细胞,培养至第12天时,常规组的细胞绝对数目为(452.46±28.29)×106个,增殖倍数约为181倍左右;诱导a-d组的细胞绝对数目分别为(712.38±42.36)×106、(694.55±40.28)×106、(676.86±45.28)×106、(788.28±45.96)×106个,增殖倍数分别约为284、278、271、318倍左右,与常规组相比具有显著性差异(p<0.05)。每次补液前采用台盼蓝染色细胞活率检测,且都保持在95%左右,培养至第12天时,常规组培养制备的细胞活率为(95.02±1.43)%,诱导a-d组培养制备的细胞活率分别为(94.85±1.77)%、(95.64±1.82)%、(94.18±1.48)%、(95.84±1.89)%。各组cik细胞培养12天后的增殖倍数如图1所示。2、体外各组cik细胞对胃癌mgc-803细胞的杀瘤活性分别取培养至第12天时各组cik细胞对mgc-803细胞进行杀伤实验,在效靶比为10:1时,各组cik细胞均表现出明显的杀瘤活性,其中诱导a-d组制备的cik细胞比常规组制备的cik细胞具有更强的杀瘤活性,且差异显著(p<0.05)。各组cik细胞对mgc-803细胞的杀伤率如表1和图3所示。表1体外各组cik细胞对胃癌mgc-803细胞的杀伤率常规组诱导a组诱导b组诱导c组诱导d组杀伤率(%)38.46±2.1356.27±3.0854.86±2.7960.36±3.5358.25±2.963、体内各组cik细胞对胃癌移植瘤的杀瘤活性全部实验裸鼠在接种第7天时在接种部位均有肿瘤形成,直径为0.8-1cm。cik细胞干预15天后,常规组、诱导a-d组所有裸鼠的肿块均有所缩小,而对照组所有裸鼠的肿块均增大。解剖时发现,与对照组相比,常规组、诱导a-d组的肿瘤块较小且局限,而对照组的肿瘤块大且有肿瘤局部浸润现象。各组肿瘤块质量以及常规组、诱导a-d组抑瘤率见表2和图4。表2各组肿瘤块质量以及常规组、诱导a-d组抑瘤率肿瘤块质量(g)抑瘤率(%)对照组2.64±0.32/常规组1.39±0.2047.3诱导a组0.86±0.1167.4诱导b组0.92±0.1965.2诱导c组0.81±0.1469.3诱导d组0.85±0.1267.8从上表可以看出,诱导a-d组比常规组具有更优的体内抑瘤率,差异显著(p<0.05)。综上可以看出,本发明提供了一种咪唑类离子液体用于cik细胞培养以提高cik细胞增殖活力和肿瘤杀伤活性,该离子液体与cik细胞诱导培养后可以显著提高cik细胞增殖活力和肿瘤杀伤活性。上述实施例仅用于进一步解释本发明的技术方案,本领域技术人员应当明白,任何简单替换或修改均不脱离本发明,本发明的保护范围并不受限于上述具体实施例。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1