用于分析含脂蛋白样品之NMR谱的方法与流程
本发明涉及根据权利要求1的前序部分用于分析含脂蛋白样品之nmr谱的方法。
在现有技术中已知的用于分析nmr谱的方法中,通常使用包含单线或组合以希尔(hill)拟合到样品的nmr谱中的少量单独线的单独拟合函数以将样品的单独成分的浓度分配至所测量的nmr谱。为了降低那些拟合函数的复杂性,通常只拟合特定的谱区,例如ch2或ch3区。
如果要确定脂蛋白类或脂蛋白亚类的浓度,则必须提供相应的参考谱或参考模型(参考值)。其先决条件是通过物理地分离样品中的类或亚类并随后定量地分析这些参考类或参考亚类的脂蛋白颗粒来产生限定的参考脂蛋白类或参考脂蛋白亚类。由于这样的分离技术的固有不准确性,参考类或参考亚类以及与此相关的参考值也不准确。
如果要将某些拟合算法应用于所测量的nmr谱,则必须以最佳的可能的方式对nmr谱进行去卷积(deconvolve)以将单独的信号或线彼此分开。另外,必须限定待应用的拟合函数以便反映特定的脂蛋白类或脂蛋白亚类。
在现有技术中已知的旨在确定某些脂蛋白类或脂蛋白亚类浓度的分析方法中,选择拟合函数以使其表示独立于其具体颗粒组成的粒度。举例来说,已使用了基于所测量的脂蛋白(亚)级分已分离的nmr谱的函数,所述脂蛋白(亚)级分先前已通过对样品进行超速离心获得。在现有技术中,钟形曲线已用于模拟单独脂蛋白(亚)级分的这样的谱。尽管如此,在这两种情况下,单独脂蛋白(亚)级分的恒定组成是强制性的。
如已经提到的,在现有技术中仅已分析了非常窄的谱范围以降低拟合函数的复杂性。已经证明,高强度的信号(例如归属于ch3和ch2基团的信号)仅具有非常低的重叠,使得它们已优选用于拟合操作。然而,这些信号需要非常复杂的去卷积,因为它们存在于所有脂质以及与此相关的所有脂蛋白类和脂蛋白亚类中。
本发明的一个目的是提供用于分析nmr谱的新方法,该方法比现有技术中已知的方法更可靠并且适合于确定所测量的样品中单独脂蛋白类或脂蛋白亚类的浓度或量。
该目的通过具有权利要求1之特征的方法来实现。用于分析含脂蛋白样品之nmr谱的该方法包括在以下中说明的步骤。
首先,限定待分析的谱范围。该谱范围延伸跨越含脂蛋白样品的nmr谱的至少0.5ppm的化学位移。
然后,将第一单独脂质组分的第一谱函数(spectralfunction)和另外的单独脂质组分的至少一个另外的谱函数拟合到待分析的全谱范围(wholespectralrange)中。与现有技术方法相反,通过第一谱函数不仅拟合了单独信号(位于例如ch2或ch3区中),还拟合了更宽的谱范围。因此,该第一谱函数不表示脂蛋白颗粒的nmr谱或限定的脂蛋白类或脂蛋白亚类的脂蛋白颗粒的nmr谱,而是表示脂蛋白的单独脂质组分的至少一部分nmr谱。以相同的方式,另外的谱函数表示脂蛋白的单独脂质组分。这意味着,使用小的多的化学实体(即代替脂蛋白的脂质)来进行拟合操作。第一谱函数不仅表示第一单独脂质组分的至少一部分nmr谱,而且还考虑了在脂蛋白颗粒周围环境(surroundings)(或环境)中第一脂质组分的行为。这同样适用于至少一个另外的谱函数。由此,该脂蛋白颗粒属于第一限定的脂蛋白类或第一限定的脂蛋白亚类。
在一个实施方案中,术语“至少一部分nmr谱”在所考虑的谱范围内不涵盖该函数仅涉及单条nmr线的可能性,而总是表示至少两条nmr线,特别是多条nmr线。
由于脂蛋白不是由单个单独脂质组分而是由许多不同的脂质组分构成,因此考虑了在相同的脂蛋白颗粒中不同脂质的不同谱函数。
在一个实施方案中,各函数表示相应脂质组分的全nmr谱。
如果与第一限定的脂蛋白类或脂蛋白亚类的单独脂质组分相关的所有谱函数已被拟合到含脂蛋白样品的nmr谱中,则可将单独脂质组分的浓度并且由此确定该第一限定的脂蛋白类或脂蛋白亚类的脂蛋白颗粒的浓度分配至所测量的样品。
最后,基于先前说明的拟合操作来确定第一限定的脂蛋白类或脂蛋白亚类的浓度或量以及任选地还有每种其他限定的脂蛋白类或脂蛋白亚类的浓度或量。
这种用于分析nmr谱的新方法与现有技术中已知的分析方法之间的一个区别在于,使用与单独脂质组分相关的拟合函数而不是与脂蛋白类或脂蛋白亚类相关的拟合函数。另外,一次拟合了更宽的谱范围,因此显著增强所应用的拟合的可靠性和稳健性。通过本发明要求保护的方法,完全克服基于病态谱去卷积和病态线分离的不准确性和基于单独谱线的拟合操作以及基于不足以产生适合的参考值之单独脂蛋白(亚)级分的物理分离的不准确性。此外,所获得的结果不是针对参考而是基于校准函数建模,并因此被认为是更“直接”的结果。
在一个更广泛的方面,本发明要求保护的发明基于这样的想法:可通过构成成分的单独组分的此种nmr谱的单独谱函数来限定通过nmr波谱法测量的样品的所有成分。这些组分可以是例如不同浓度和比例的蛋白质、脂质和代谢物。因此,本发明要求保护的发明专注于样品中脂蛋白浓度的分析。
本发明人已发现,位于脂蛋白内的蛋白质(所谓的载脂蛋白)的nmr信号可被忽略,因为载脂蛋白要么不与脂蛋白颗粒紧密结合并可如此分配至溶液中的蛋白质(例如血清蛋白,在血清样品的情况下),要么与脂蛋白颗粒如此紧密地结合以致其迁移率及与此相关的所得nmr信号相对小。因此,脂质组分的nmr信号完全足以确定样品中特定脂蛋白类或脂蛋白亚类的浓度。
在一个实施方案中,还可进行先前说明的拟合步骤以用于与另一些限定的脂蛋白类或脂蛋白亚类的单独脂质组分相关的拟合函数。这样做时,用单独脂质组分的谱函数来完成拟合,其中每个谱函数表示单独脂质组分的nmr谱或至少一部分nmr谱。因此,考虑了在其他限定的脂蛋白类或脂蛋白亚类的脂蛋白颗粒周围环境中该脂质组分的行为。在用于描述各nmr谱的函数中,可省略nmr谱的某些nmr信号。这样做时,可进行相应的拟合操作而不考虑可能不分配至特定脂质组分但可能具有非唯一起源的某些谱特征。
虽然可以以时间交错(timelystaggered)(连续)方式进行拟合操作,但是在一个实施方案中,它们同时进行。因此,第一谱函数的拟合受第二谱函数的拟合的影响,且反之亦然。
如上说明的,函数的校准引出特定脂蛋白类或脂蛋白亚类的脂质的浓度。然后,在一个实施方案中由此计算这个其他限定的脂蛋白类或脂蛋白亚类的浓度或量。
在一个实施方案中,待分析的谱范围在至少0.6ppm、特别是至少0.7ppm、特别是至少0.8ppm、特别是至少0.9ppm、特别是至少1ppm、特别是至少1.5ppm、特别是至少2ppm、特别是至少2.5ppm、特别是至少3ppm、特别是至少3.5ppm、特别是至少4ppm、特别是至少5ppm、特别是至少6ppm、特别是至少7ppm、特别是至少8ppm、特别是至少9ppm、并且非常特别的是至少10ppm中延伸。另外,可从前面提到的谱范围的较低阈值构建的任何合适的范围也适合于限定待分析的谱范围。举例来说,可使用3ppm至10ppm、特别是4ppm至9ppm等的谱范围来限定待分析的谱范围。
在一个实施方案中,待分析的谱范围涵盖其中观察到nmr信号的全测量谱范围。因此,如果所分析样品的nmr谱显示出0ppm至10ppm的谱范围内的nmr信号,则待分析的谱范围也涵盖0ppm至10ppm的谱范围。在这样的情况下,其将是10ppm宽。这样做时,通过单独脂质组分的谱函数可实现非常稳健的nmr谱拟合,从而为随后基于各脂质组分的浓度或量计算相应脂蛋白类或脂蛋白亚类的浓度或量提供可靠的结果。
在一个实施方案中,所述含脂蛋白样品是体液样品。在一个特别合适的实施方案中,所述含脂蛋白样品是血清样品(bloodserumsample)(也简称为血清样品(serumsample))。在血清中,所有溶解的蛋白质可很好地描述为不同白蛋白和球蛋白函数的组合。此外,缺乏脂蛋白血清(lipoproteindeficientserum,lpds)的nmr谱很好地描述了血清中的血清蛋白组分。血浆样品或尿样品(特别是如果尿中存在血液时)也可用作含脂蛋白样品。
在一个实施方案中,在进行上述拟合操作之前,从含脂蛋白样品的nmr谱中减去除脂蛋白或脂质之外的化合物的nmr谱。作为“真实的”nmr谱的替代,这样的nmr谱的函数同样可很好地用于相应的减法运算。减去除脂蛋白或脂质之外的化合物的影响使得后续拟合操作更容易并且增强了相应拟合操作的准确性。举例来说,可从待分析样品的nmr谱中减去蛋白质和/或糖的nmr信号。
在一个实施方案中,待减去的nmr谱是缺乏脂蛋白血清(lpds)的nmr谱。如果通过nmr波谱法分析的样品是血清样品,则该实施方案是合适的。在这样的情况下,从血清样品的nmr谱中减去溶解的蛋白质的所有影响,以使只有由脂蛋白产生的信号仍然存在于nmr谱中。由代谢物(例如氨基酸或糖)产生的信号可像背景信号一样被减去或者可被抑制。举例来说,通过将扩散排序谱法(diffusion-orderedspectroscopy)应用于相应的样品,可在nmr波谱法中高效地抑制快速扩散的代谢物的信号。作为替代或补充,其他蛋白质依赖性谱可用于从含脂蛋白样品的nmr谱中减去以补偿蛋白质依赖性信号。
所有脂蛋白通常由相同的脂质组分构建。构建脂蛋白的这些脂质组分是胆固醇、胆固醇酯、甘油三酯、磷脂(例如磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰乙醇胺和/或磷脂酰肌醇)、鞘磷脂以及脂肪酸(后者主要以结合形式存在)。脂肪酸(无论是否是以分离的分子的形式还是以通过酯键与脂质分子结合的脂肪酸残基的形式存在)的链长通常可以不同。对于脂肪酸或脂肪酸残基中存在的双键的量同样如此。在一个实施方案中,第一脂质组分和/或另外的脂质组分选自胆固醇、胆固醇酯、甘油三酯、磷脂酰胆碱、鞘磷脂和脂肪酸。因此,链长为10、12、14、16、18、20或22、24、26个碳原子以及具有0、1、2、3、4、5或6个双键的脂肪酸或脂肪酸残基是特别适合的。特别适合的脂肪酸是具有16个碳原子和零个双键(16∶0)、18个碳原子和零个双键(18∶0)、18个碳原子和一个双键(18∶1),以及18个碳原子和2个双键(18∶2)的那些。
在一个实施方案中,用于拟合操作的任何谱函数(即,第一单独脂质组分的第一谱函数、另外的单独脂质组分的另外的谱函数和/或单独脂质组分的谱函数)基于各脂质组分的nmr谱来获得。这样的nmr谱可通过例如在有机溶剂中的测量或通过测量水或水性介质中的脂质胶束来获得。因此,所测量的脂质组分的nmr信号不应受来自不同组分的其他nmr信号干扰。类似类型的nmr信号(即,不同脂质组分的nmr信号)的干扰将是可接受的。因此,可同时测量不同的脂质(例如不同磷脂的混合物或至少一种磷脂和至少一种脂质的混合物)并且仍然获得各脂质组分(即所测量的脂质或脂质的混合物)的合适的nmr谱。
由于纯的形式的脂质组分的行为不同于在脂蛋白颗粒的(内部)周围环境中相同脂质组分的行为,因此所测量的nmr谱(或其衍生物)必须通过数学上移位、增宽和/或调整其相对高度来进行调整,使得所得函数表示在所讨论的脂蛋白类或脂蛋白亚类的脂蛋白颗粒周围环境中相应脂质组分的nmr行为。虽然脂质组分可以以其纯的形式自由移动,但是所述移动局限于脂蛋白颗粒的周围环境中。nmr信号改变主要是由于不同的颗粒组成、不同的粒度和不同的颗粒结构而发生。这些nmr改变可能涵盖信号损失、信号增宽和信号移位。除将用于拟合操作的谱函数基于所测量的nmr谱之外,还可依赖于模拟的谱。
在先前说明的方法中,通过考虑脂质组分的扩散行为,将有机溶剂中的脂质组分的nmr谱转移到水性介质中的nmr谱中。每种脂质组分显示出与其所位于的脂蛋白颗粒相同的扩散行为。如上面已经提到的,任何谱函数(即第一单独脂质组分的第一谱函数、另外的单独脂质组分的另外的谱函数和/或单独脂质组分的谱函数)在待分析的全谱范围中延伸。在一个实施方案中,任何谱函数包含至少2条nmr线、特别是至少3条nmr线、特别是至少4条nmr线、特别是至少5条nmr线、特别是至少6条nmr线、特别是至少7条nmr线、特别是至少8条nmr线、特别是至少9条nmr线、特别是至少10条nmr线、特别是至少20条nmr线、特别是至少50条nmr线、特别是至少100条nmr线、特别是至少200条nmr线、特别是至少300条nmr线、特别是至少400条nmr线、特别是至少500条nmr线、特别是至少600条nmr线、特别是至少700条nmr线、特别是至少800条nmr线、特别是至少900条nmr线、特别是至少1000条nmr线。在一个实施方案中,各谱函数包含2至1000条线或可从前面提到的各谱函数的nmr线的阈值构建的任何其他线范围(例如,4至700条线等)。
在一个实施方案中,任何谱函数(即,第一单独脂质组分的第一谱函数、另外的单独脂质组分的另外的谱函数和/或单独脂质组分的谱函数)不仅用于拟合待分析的nmr谱的单nmr线,而且还用于含脂蛋白样品的nmr谱的至少2个、特别是至少3个、特别是至少4个、特别是至少5个、特别是至少6个、特别是至少7个、特别是至少8个、特别是至少9个、并且非常特别的是至少10个信号。含脂蛋白样品的nmr谱的信号的具体形式取决于由具体脂质组分产生的信号的数量。具有非常均一化学结构的脂质组分比更不均一和复杂形成的脂质组分具有更尖锐的nmr线。
在一个实施方案中,通过在脂蛋白类或亚类的限定扩散行为的基础上将其对齐,实现了第一单独脂质组分的第一谱函数、另外的单独脂质组分的另外的谱函数和/或单独脂质组分的谱函数的合适对齐。
将根据一些示例性实施方案和附图更详细地说明本发明描述的发明的一些方面和一些细节。在图中:
图1a示出了第一组标准1hnmr谱,其包含含有脂质的血清的nmr谱;
图1b示出了与图1a中相同样品的第一组扩散加权nmr谱;
图2a示出了血清和单独脂质组分的nmr谱的第一细节;
图2b示出了与图2a中所示的相同组的nmr谱的第二细节;
图3示出了不依赖于梯度强度的扩散排序nmr谱中的信号衰减;以及
图4示出了用于拟合nmr谱的不同方法。
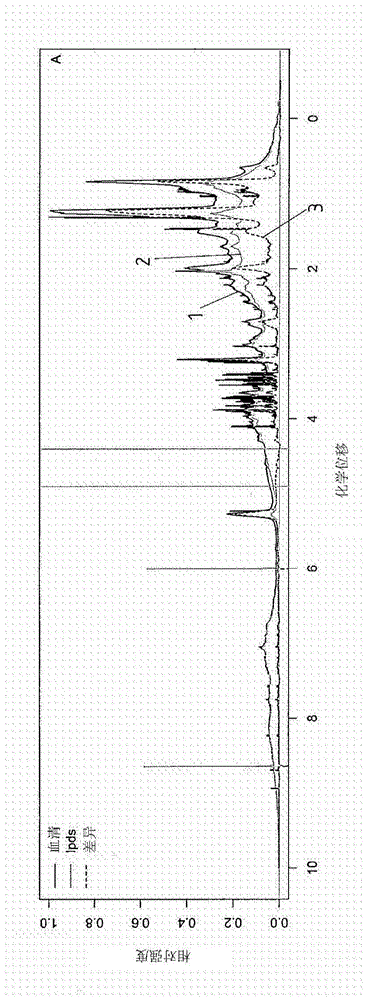
图1a示出了血清样品的nmr谱1(黑线)。为了减去源自缺乏脂蛋白血清(lpds)的所有nmr信号,记录了相应的lpdsnmr谱2(灰线)并从血清谱1中将其减去。所得差异谱3也描绘在图1a中(虚线)。在该所得差异谱3中,仅可看到不是源自缺乏脂蛋白血清中存在的组分的nmr信号。这些基本上只是脂蛋白和小的代谢物。因此,图1a描绘了标准1hnmr谱。在该图和所有下图中都描绘了灰色条,该灰色条指示在其中可观察到由溶剂(水或有机溶剂)产生的信号的谱范围,在所述溶剂中各个样品已经被溶解以便记录相应的nmr谱。
图1b示出了与图1a中相同样品的扩散加权nmr谱。因此,任何与来自代谢物的信号的叠加都在血清谱1(黑线)和lpds谱2(灰线)中受到抑制。由于代谢物通常非常快速地扩散,因此其信号在这样的扩散谱中被高效抑制。这使得差异谱3(虚线)的质量更好。如果有的话,代谢物信号在扩散加权nmr谱中作为非常窄的线出现,并且可通过将血清谱1与有规律地作为血清中代谢物出现的不同物质的nmr谱进行比较而容易地将其分配至特定物质。因此,代谢物应在与血清非常相似的环境中被记录以允许在血清谱1中准确分配相应的nmr线。还可将代谢物直接添加至血清。
对于主要由脂蛋白的nmr信号构成的所得差异谱3,应当注意的是,脂蛋白包含不同尺寸的颗粒。另外,脂蛋白颗粒内不同脂蛋白的脂质和蛋白质组成可以不同。
根据本发明要求保护的发明并且在本示例性实施方案的框架内,假设位于脂蛋白内的蛋白质的信号可被忽略,因为那些蛋白质要么不与脂蛋白颗粒紧密结合(并因此属于血清蛋白质),要么在其他情况下与脂蛋白颗粒如此紧密地结合以致其迁移率并因此nmr信号强烈降低。在6至8ppm可见到相应的信号。
因此,差异谱3可用作后续拟合操作的起始谱以用于与脂质组分的单独nmr谱进行拟合操作。
图2a示出了通过从血清样品的扩散加权1h-nmr谱中减去脂质缺乏血清的nmr信号获得的差异谱4(连续黑色曲线)的0.5ppm至3.0ppm的化学位移。因此,已像图1b的差异谱3一样产生差异谱4。此外,图2a中示出了可存在于血清中的不同脂质的nmr信号,即磷脂的1h-nmr谱5(连续灰色曲线)、甘油三酯的1h-nmr谱6(虚黑色曲线)和胆固醇的1h-nmr谱7(虚灰色曲线)。因此,图2a描绘了在每种情况下这些谱的0.5ppm至3.0ppm的化学位移。
图2b示出了与图2a相同的nmr谱4、5、6、7,但化学位移为3.0ppm至5.5ppm。已经在有机溶剂中记录了图2a和2b的脂质谱5、6、7。
nmr谱5、6、7用作用于限定表示这些谱或其至少一部分的函数的基础。例如,在限定相应的函数时可不考虑单独的nmr信号,例如在磷脂nmr谱5的约1.6ppm处的信号。该信号主要由脂肪酸引起。这些脂肪酸在磷脂以及甘油三酯二者中均以不同程度存在。为了补偿这种不同程度,脂肪酸的nmr贡献通过单独的拟合函数来考虑,不依赖于脂肪酸是否是磷脂或甘油三酯的一部分。脂肪酸的相应nmr谱未示于图2a和2b中。对于不同的磷脂,磷脂的nmr谱5的其他nmr信号没有强差异,并且因此更适合于在nmr谱中鉴定这些类的脂质。
为了将单独脂质组分的nmr谱从基于有机溶剂的参考系统转移至基于水性介质的参考系统,考虑了不同脂蛋白颗粒的扩散行为。每种脂质组分必须显示出与由该脂质组分构成的脂蛋白颗粒相同的扩散行为。
图3示出了扩散排序nmr谱中的信号衰减并因此说明了不同脂蛋白颗粒、蛋白质和代谢物的不同扩散行为。因此,特定nmr信号的相对强度设定成与所施加梯度强度的相对强度相关。所得vldl(具有极低密度的脂蛋白颗粒)扩散曲线10、所得ldl(具有低密度的脂蛋白颗粒)扩散曲线11、所得hdl(具有高密度的脂蛋白颗粒)扩散曲线12、所得蛋白质扩散曲线13和所得低分子代谢物扩散曲线14表明:a)随着各脂蛋白颗粒密度的提高和b)随着各组分分子量的降低,nmr信号的强度降低得更强。本发明人已经表明,窄nmr信号的强度随着梯度强度提高而降低得更快,而随着梯度强度提高,宽nmr信号显示出显著更低的信号损失。
通常可将vldl、ldl和hdl进行进一步细分为大、中型和小vldl,大、中型和小ldl,以及大、中型和小hdl的级分。因此,vldl10、ldl11和hdl12的扩散曲线仅被理解为梯度强度对不同脂蛋白颗粒的影响的一个实例。
图4示出了根据现有技术和根据本发明要求保护的发明拟合nmr谱的不同方法。由此,最上面的曲线示出了血清样品的nmr谱16,并且从顶部开始的第二条曲线示出了说明蛋白质信号的nmr谱17,其可以容易地从血清样品的nmr谱16中减去。
根据现有技术,表示不同脂蛋白亚类的单独nmr线18的拟合函数已用于拟合血清样品的nmr谱16的单独线。因此,已将第一脂蛋白亚类的单独nmr线18(点虚曲线)、第二脂蛋白亚类的单独nmr线18(虚曲线)和第三脂蛋白亚类的单独nmr线18(连续曲线)用于拟合。
根据本发明描述的实施方案,将第一单独脂质组分的nmr谱19的函数用于拟合血清样品的nmr谱16。因此,表示第一单独脂质组分的nmr谱19的函数描述了在其中观察到nmr信号的全谱范围中的各nmr谱。在该情况下(如图4中所示),该谱范围从0ppm延伸至10ppm。通过不使用描述脂蛋白亚类的nmr谱18的单独线的单独函数,而是通过使用描述在全谱范围中或特定切出段(cut-out)中的第一脂质组分的nmr谱19的函数,可实现稳定且良态的拟合。由于脂蛋白包含多于一种脂质,因此将描述另外的脂质的nmr谱20的函数(再次在其中观察到nmr线的全谱范围中)另外用于进行血清样品的nmr谱16的拟合。
如上说明的,单独脂质的nmr行为因其具体环境而不同。这通过以如第一脂质的第一经调节函数21所示的不同方式来调节第一脂质的nmr谱19的函数来说明。第一经调节函数21的一个函数涉及第一脂蛋白亚类(点虚曲线)中的第一脂质。第一经调节函数21的第二函数涉及第二脂蛋白亚类(虚曲线)中的第一脂质。第一经调节函数21的第三函数涉及第三脂蛋白亚类(连续曲线)中的第一脂质。
用第二脂质的nmr谱20的函数进行同样的调整。于是,产生了第二经调整函数22,其中第二经调节函数22的第一函数涉及第一脂蛋白亚类(点虚曲线)中的第二脂质,第二经调节函数22的第二函数涉及第二脂蛋白亚类(虚曲线)中的第二脂质,并且第二经调节函数22的第三函数涉及第三脂蛋白亚类(连续曲线)中的第二脂质。
通过将单独的经调节函数21、22应用于血清样品的nmr谱16的拟合操作(任选地在已从血清样品的该nmr谱16中减去蛋白质组分的nmr谱17之后),可实现血清样品的该nmr谱16的合适的拟合。
然后,可将这样的因子用于计算脂质组分(例如,磷脂、甘油三酯和胆固醇)存在于血清谱16与蛋白质谱17之间的差异谱中的浓度,所述因子是缩放单独的经调节函数21、22以实现该差异谱的合适拟合所必需的。
- 还没有人留言评论。精彩留言会获得点赞!