通过受控样品蒸发制备无损冷冻载网的制作方法
近年来,玻璃化样本的透射电子显微镜(transmissionelectronmicroscopy,tem)(cryo-em;dubochet,j.,adrian,m.,chang,j.j.,homo,j.c.,lepault,j.,mcdowall,a.w.,schultz,p.,1988.cryo-electronmicroscopyofvitrifiedspecimens.q.rev.biophys.21,129-228)已经成为用于生物物质的高分辨率结构分析的强有力的技术(liao,m.,cao,e.,julius,d.,cheng,y.,2013.structureofthetrpv1ionchanneldeterminedbyelectroncryo-microscopy.nature504,107-112),并且现在越来越多地被认为是生物学中的主流工具(callaway,e.,2015.therevolutionwillnotbecrystallized:anewmethodsweepsthroughstructuralbiology.nature525,172-174;kuhlbrandt,w.,2014.biochemistry.theresolutionrevolution.science343,1443-1444;nogales,e.,2015.thedevelopmentofcryo-emintoamainstreamstructuralbiologytechnique.nat.methods13,24-27.)。一些技术成果使这种研究成为可能,最突出的是最近引入的直接电子检测(directelectrondetection,ded)相机,以及改进的数据处理算法的可用性(grigorieff,n.,2007.frealign:high-resolutionrefinementofsingleparticlestructures.j.struct.biol.157,117-125;lyumkis,d.,brilot,a.f.,theobald,d.l.,grigorieff,n.,2013.likelihood-basedclassificationofcryo-emimagesusingfrealign.j.struct.biol.183,377-388;scheres,s.h.w.,chen,s.,2012.preventionofoverfittingincryo-emstructuredetermination.nat.methods9,853-854)。
冷冻样品载网(冷冻电镜载网)制备和成像方法确保生物样本能够承受电子显微镜内的超高真空、减小辐射损伤的影响,并允许在受限于保存生物分子的结构布置的生理条件时对它们进行研究(baker,l.a.,rubinstein,j.l.,2010.chapterfifteen-radiationdamageinelectroncryomicroscopy.methodsenzymol;dubochet,j.,adrian,m.,chang,j.j.,homo,j.c.,lepault,j.,mcdowall,a.w.,schultz,p.,1988.cryo-electronmicroscopyofvitrifiedspecimens.q.rev.biophys.21,129-228;lepault,j.,booy,f.p.,dubochet,j.,1983.electronmicroscopyoffrozenbiologicalsuspensions.j.microsc.129,89-102)。
然而,这些制备方法在过去20年中没有被显著改善,而且具有一些主要缺点:特别地,由于大量吸干(blotting)步骤使用滤纸进行,所以在载网制备期间需要2-4μl的样品体积,且99.9%的样品体积损失(kemmerling,s.,ziegler,j.,schweighauser,g.,arnold,s.a.,giss,d.,muller,s.a.,ringler,p.,goldie,k.n.,goedecke,n.,hierlemann,a.,stahlberg,h.,engel,a.,braun,t.,2012.connectingμ-fluidicstoelectronmicroscopy.j.struct.biol.177,128-134)。
此外,用滤纸吸干会导致蛋白质聚集或变性。目前现有技术的样品制备方法被认为是冷冻电镜中最显著的限制之一(glaeser,r.m.,2016.howgoodcancryo-embecome?natmethods13,28-32)。
减少样品损耗的改进的冷冻电镜载网制备方法目前是一项基本要求。2012年提出了一种将喷墨皮升分配与插入式冷冻设备相结合的装置(jain,t.,sheehan,p.,crum,j.,carragher,b.,potter,c.s.,2012.spotiton:aprototypeforanintegratedinkjetdispenseandvitrificationsystemforcryo-tem.j.struct.biol.179,68-75),并且最近通过使用自吸干载网对该装置进行了改进,以允许冷冻载网制备与喷墨点样(测定点位)相结合(razinkov,i.,dandey,v.p.,wei,h.,zhang,z.,melnekoff,d.,rice,w.j.,wigge,c,potter,c.s.,carragher,b.,2016.anewmethodforvitrifyingsamplesforcryoem.j.struct.biol.195,190-198)。
特别地,现有技术的冷冻载网样品制备方法经常得到具有不同的厚度和质量的玻璃化样品膜,这导致图像质量降低或由不受控制的水蒸发引起的盐伪影。
因此,本发明的目的是提供一种用于制备样品的方法,所述方法关于现有技术的上述缺点得到改进。
该目的通过方法独立权利要求1的主题和系统独立权利要求10的主题来实现。从属权利要求2至9表示所述方法的实施方式,并且从属权利要求11至15表示所述系统的实施方式。以下详细描述本发明。
本发明的第一方面涉及一种用于在载体结构上制备样品的方法,其中
-在载体结构上将样品提供为具有膜厚度的薄膜;
-将载体结构的温度调节到高于环境露点温度的值,使得膜厚度减小;
-光指向载体结构;
-测量由载体结构透射的光的至少一个强度值;
-根据至少一个测量的强度值将载体结构自动插入液体冷冻剂中,使得样品冷却成无定形固体。
这具有以下优点:可以在不用纸吸干和点样,并且特别地,在仅需要几纳升(例如,3-20nl)的总样品体积的情况下,实现使载网上的样品膜变薄(薄化)。特别地,借助于该方法可以通过微毛细管将样品直接“写”在多孔碳电镜载网上,然后使沉积的液体玻璃化,从而在碳膜的孔中产生玻璃化样品的薄层。
有利地,在受控温度下蒸发样品与通过膜厚度测量来监测蒸发的结合允许自动制备具有限定的和可再现的膜厚度的样品,这改善了电子显微照片的图像质量,并且避免了由不受控制的水蒸发导致的盐伪影。
载体结构可以是或包括具有多孔碳膜或任何其他合适结构的已知电子显微镜(electronmicroscopy,em)载网。
根据样品的物理性质和化学性质,样品可以通过多种方式转移到载体结构上。(i)直接沉积纳升体积液滴,且随后通过表面张力效应将纳升体积液滴扩散到载体表面上。(ii)在载体表面上沉积纳升体积液滴,随后以小于初始沉积体积的体积再吸入样品。(iii)在载体结构表面上沉积纳升体积液滴,随后在载体结构和液体处理系统之间进行相对运动的同时还在两者之间建立液桥,以便将沉积的样品扩散在载体结构上。(iv)将纳升体积液滴沉积到载体结构表面上与在沉积期间将载体结构与液体处理系统之间的相对运动相结合,以便将沉积的样品扩散到载体结构上。
在本文中,nl(纳升)量或体积特别地是1nl至100nl的体积,更特别地是1nl至20nl。
在某些实施方式中,载体结构设置在温控平台上。
在某些实施方式中,在第一步骤中,将载体结构的温度调节至环境的露点温度,并且在第一步骤之后的第二步骤中,将载体结构的温度调节至高于环境的露点温度。
在某些实施方式中,当至少一个测量的强度值超过预定阈值时,载体结构自动插入液体冷冻剂中。
在某些实施方式中,将载体结构的温度调节至高于环境露点温度2°至8°的值。
特别地,升高载体结构的温度是指将目标温度设定在露点温度以上,特别是高于露点温度2°至8°,其中,在延迟时间期间,载体结构的温度从初始温度升高到目标温度。
在某些实施方式中,通过在将温度调节至高于环境露点温度的值之前进行吸干或再吸入来减小膜厚度。
这种预变薄步骤的优点在于,如果在受控蒸发之前样品膜已经是薄的,则在样品的受控蒸发过程中样品仅略微浓缩。
在某些实施方式中,光的波长在近红外范围内,其中特别地,波长为780nm或更长。
使用780nm的红外光以用于样品膜的厚度确定具有以下优点:光不会被水或生物材料显著吸收。
可替代地,例如也可以使用405nm的波长。
在某些实施方式中,指向样品的光至少包括第一波长的光和第二波长的光,所述第一波长的光特别地在600nm和900nm之间的范围内,更特别地在780nm和880nm之间的范围内或在630nm和670nm之间的范围内,所述第二波长的光特别地在350nm和500nm之间的范围内,更特别地在405nm和450nm之间的范围内。
换句话说,两种波长(例如405nm和780nm)的组合可用于同时照射样品。根据两个干涉峰的时间间隔,可以校准特定的样品蒸发速率。
例如,第一波长可以是780nm。例如,第二波长可以是405nm、445nm或450nm。
在某些实施方式中,第一波长和第二波长之间的距离为300nm至400nm。
在某些实施方式中,包括第一波长的第一光束和包括第二波长的第二光束指向样品,其中,由样品透射的第一光束的强度和由样品透射的第二光束的强度被单独检测。
在某些实施方式中,合并第一光束和第二光束,其中,合并的光束指向载体结构。
在某些实施方式中,在检测光强度之前,由样品透射的光被分成第一透射光束和第二透射光束。
在某些实施方式中,光沿着垂直于载体结构的表面的光路(l)指向载体结构。
特别地,这种垂直设备具有以下优点:光照射载体结构(例如,电镜载网)的位置,所述载体结构在随后的电子显微照片中成像。
此外,当使用垂直设备时,构成所测量的光强度信号的一部分的干涉图案的清晰度最佳。
在某些实施方式中,通过将预定量的样品吸入到毛细管并通过毛细管将样品分配到载体结构上来将样品提供在载体结构上。
在某些实施方式中,载体结构在插入液体冷冻剂之前被置于竖向位置(特别是通过枢转)。
在某些实施方式中,执行附加的校准步骤,其中,光指向没有样品的参比载体结构,并且其中,测量由参比载体结构透射的光的至少一个参考强度值,并且其中,根据至少一个测量强度值和至少一个参考强度值,特别是基于至少一个测量强度值和至少一个参考强度值的比率,将承载样品的载体结构自动插入液体冷冻剂中。另外,混合两种波长的系统能够实现层厚度的绝对校准。
这种参考信号,也称为“干信号”(因此也是在载网上具有样品膜的信号),取决于载网类型和网孔(网目)大小。因此,所述实施方式的优点在于,通过参考信号,可以独立于载网类型和网孔大小执行样品膜的厚度测量。
在某些实施方式中,将带有玻璃化样品的载体结构从液体冷冻剂中移除。
在某些实施方式中,在将样品提供到载体结构之前,将样品浸入调节缓冲液中。这允许扩散控制的样品调节,例如用于在沉积到载体结构之前对缓冲液进行脱盐或交换。
因为样品的盐浓度在蒸发期间增加,所以将在制备样品之前的扩散控制的样品调节与受控样品蒸发相结合是特别有利的。
本发明的第二方面涉及一种用于在载体结构上制备样品的系统,特别是用于应用根据本发明的第一方面的方法,包括
-载体结构,所述载体结构配置为容纳样品,
-温控平台,所述温控平台配置为当载体结构布置在温控平台上时,将载体结构保持在预定温度,
-转移机构,所述转移机构配置为将载体结构从温控平台移动到包含液体冷冻剂的容器中,使得载体结构上的样品接触冷冻剂,
其中,所述系统包括
-光源,所述光源配置为提供指向载体结构的光,
-光电检测器,所述光电检测器配置为测量由载体结构透射的光的至少一个强度值,
-控制装置,所述控制装置配置为从光电检测器接收所测量的强度值,并且根据至少一个测量的强度值触发转移机构,使得载体结构插入到包含
液体冷冻剂的容器中。
温控平台与由光源和光电检测器组成的光学测量装置的结合有利地允许受控样品蒸发,和以限定的且可再现的膜厚度制备冷冻载网。这改善了电子显微照片的图像质量,并避免了因不受控制的水蒸发导致的盐伪影。
在某些实施方式中,光源适于沿光路发射光,其中,载体结构和光电检测器沿光路布置,使得光的至少一部分沿光路从光源传播通过载体结构到达光电检测器,其中特别地,载体结构布置成垂直于光路。
在某些实施方式中,所述系统包括配置为保持载体结构的第一适配器,其中转移机构配置为连接到保持载体结构的第一适配器,并且将载体结构移动到包含液体冷冻剂的容器中,使得载体结构上的样品接触冷冻剂。
在某些实施方式中,第一适配器包括用于保持载体结构的镊子。
在某些实施方式中,转移机构配置为将第一适配器与载体结构一起枢转到容器上方的竖向位置,并且在枢转之后使第一适配器和载体结构向下移动,使得载体结构上的样品接触容器中的冷冻剂。
在某些实施方式中,所述系统包括配置为保持载体结构的第一适配器,其中转移机构配置为连接到保持载体结构的第一适配器,并且其中,转移机构配置为将第一适配器与载体结构一起枢转到容器上方的竖向位置,并且在枢转之后将第一适配器和载体结构向下移动,使得载体结构上的样品接触容器中的冷冻剂。
在某些实施方式中,所述系统包括液体处理系统,所述液体处理系统包括分配头,其中所述液体处理系统配置为通过分配头吸入和分配一定体积的样品。
在某些实施方式中,所述系统包括平移平台组件,所述平移平台组件配置为相对于液体处理系统移动温控平台,使得分配头和载体结构可以彼此靠近,以便将样品从液体处理系统转移到载体结构。
在某些实施方式中,平移平台组件可包括两个单独的平移平台,其中一个配置为在x和y方向(例如水平面)上移动温控平台或载体结构,而另一个配置为将分配头(例如毛细管或微毛细管)定位在z方向(竖直方向)上。
可替代地,在一种实施方式中,平移平台组件可以是xyz平台组件,所述xyz平台组件配置为相对于分配头(例如毛细管或微毛细管)在所有维度(x、y和z)中定位温控平台和载体结构。
在某些实施方式中,所述系统包括调节装置,所述调节装置配置为以可调节的方式相对于温控平台保持第一适配器。
在某些实施方式中,所述调节装置包括保持装置,特别地为电磁体的形式,所述电磁体配置为可释放地保持第一适配器,并且特别是当样品位于载体结构上时自动释放第一适配器,并且特别地包括预定义的温度。
在某些实施方式中,所述系统包括调节装置,所述调节装置配置为以可调节的方式相对于温控平台保持第一适配器,其中,所述调节装置包括保持装置,特别地为电磁体的形式,所述电磁体配置为可释放地保持第一适配器,并当样品位于载体结构上时自动释放第一适配器。
在某些实施方式中,所述转移机构包括第二适配器,其中第一适配器和第二适配器设计成当保持装置释放第一适配器时彼此接合。
在某些实施方式中,所述转移机构设计成当第一适配器与第二适配器接合并从保持装置释放时,将第二适配器在容器上方枢转。
在某些实施方式中,所述转移机构包括第二适配器,其中第一适配器和第二适配器设计成当保持装置释放第一适配器时彼此接合,并且其中转移机构设计成当第一适配器与第二适配器接合并从保持装置释放时,将第二适配器在容器上方枢转。
在某些实施方式中,所述转移机构包括移动发生装置,特别是包括螺线管,所述螺线管配置为当第一适配器和载体结构定位在竖向位置的容器上方时,向下移动第二适配器,使得载体结构上的样品接触容器中的冷冻剂。
在某些实施方式中,分配头由液体处理系统的端部处的毛细管特别是微毛细管形成,所述毛细管包括用于容纳所吸入的样品的尖端。
特别地,微毛细管的内径可以在1微米至900微米的范围内,更特别地在1微米至100微米的范围内。
在某些实施方式中,所述系统包括第一贮存器,含有纳升体积的样品的分配头可以浸入所述第一贮存器中,以允许扩散控制的样品调节。
在某些实施方式中,所述系统包括液体处理系统,所述液体处理系统包括分配头,其中所述液体处理系统配置为通过分配头吸入和分配一定体积的样品,其中,所述系统还包括第一贮存器,含有纳升体积的样品的分配头可以浸入所述第一贮存器中,以允许扩散控制的样品调节,例如用于在沉积到载体结构上之前,对缓冲液进行脱盐或交换。
因为样品的盐浓度在蒸发期间增加,所以将在样品制备之前的扩散控制的样品调节与受控样品蒸发相结合是特别有利的。
在某些实施方式中,所述系统包括第二贮存器,含有纳升体积的样品的分配头可从所述第二贮存器吸入小体积的含有可认知分子的样品。
在某些实施方式中,光源适于产生光,所述光至少包括:第一波长的光,特别地在600nm和900nm之间的范围内,更特别地在780nm和880nm之间的范围内或在630nm和670nm之间的范围内;第二波长的光,特别地在350nm和500nm之间的范围内,更特别地在405nm和450nm之间的范围内。
例如,第一波长可以是780nm。例如,第二波长可以是405nm、445nm或450nm。
在某些实施方式中,第一波长和第二波长之间的距离为300nm至400nm。
在某些实施方式中,所述系统包括:第一光源,所述第一光源适于产生第一波长的光,特别地在600nm和900nm之间的范围内,更特别地在780nm和880nm之间的范围内或在630nm和670nm之间的范围内;以及第二光源,所述第二光源适于产生第二波长的光,特别地在350nm和500nm之间的范围内,更特别地在405nm和450nm之间的范围内。
在某些实施方式中,所述系统包括:第一光电检测器,所述第一光电检测器定位成使得从第一光源发射并由载体结构(特别是载体结构上的样品)透射的光可以被第一光电检测器检测;以及第二光电检测器,所述第二光电检测器定位成使得从第二光源发射并由载体结构透射的光可以被第二光电检测器检测。
在某些实施方式中,所述系统包括第一分色镜,所述第一分色镜适于使第一波长的光通过并反射第二波长的光,其中所述第一分色镜定位成使得第一光源发射的光和第二光源发射的光由所述第一分色镜合并,并且指向载体结构,特别是垂直于载体结构的表面。
在某些实施方式中,所述系统包括第二分色镜,所述第二分色镜适于使第一波长的光通过并反射第二波长的光,其中所述第二分色镜定位成使得载体结构(特别是载体结构上的样品)透射的光分成第一透射光束和第二透射光束,其中所述第一透射光束指向第一光电检测器,并且所述第二透射光束指向第二光电检测器。
在某些实施方式中,所述系统包括:第一光源,所述第一光源适于产生第一波长的光,特别地在600nm和900nm之间的范围内,更特别地在780nm和880nm之间的范围内或在630nm和670nm之间的范围内;第二光源,所述第二光源适于产生第二波长的光,特别地在350nm和500nm之间的范围内,更特别地在405nm和450nm之间的范围内;第一光电检测器;第二光电检测器;第一分色镜和第二分色镜,其中第一分色镜和第二分色镜适于使第一波长的光通过并反射第二波长的光,并且其中第一分色镜定位成使得第一光源发射的光和第二光源发射的光被第一分色镜合并,并且指向载体结构,并且其中所述第二分色镜定位成使得载体结构(特别是载体结构上的样品)透射的光分成第一透射光束和第二透射光束,其中所述第一透射光束指向第一光电检测器,并且所述第二透射光束指向第二光电检测器。
将参考附图,通过详细描述实施方式来描述本发明进一步的特征和优点,在附图中
图1示出了根据本发明的冷冻载网制备系统的立体图;
图2示出了根据本发明的系统和方法的工作原理;
图3示出了从样品中水蒸发的实时监测数据,以控制玻璃态冰层的厚度;
图4示出了使用根据本发明的系统和方法进行冷冻载网制备的概念验证数据(沉积方案1);
图5示出了使用根据本发明的系统进行冷冻载网制备的概念验证数据(沉积方案2);
图6示出了使用根据本发明的系统制备用于高分辨率结构分析的样品;
图7示出了控制软件的屏幕截图;
图8示出了温控平台(露点平台)的温度/湿度数据;
图9示出了显示盐效应的电子显微照片;
图10示出了在amphipols中重构的200kda膜蛋白的电子显微照片;
图11示出了使用沉积方案2沉积的单细胞裂解物的电子显微照片;
图12示出了校正的傅立叶壳相关(傅里叶壳层关联函数,fsc)曲线;
图13示出了用于测量样品膜厚度的设备的示意图。
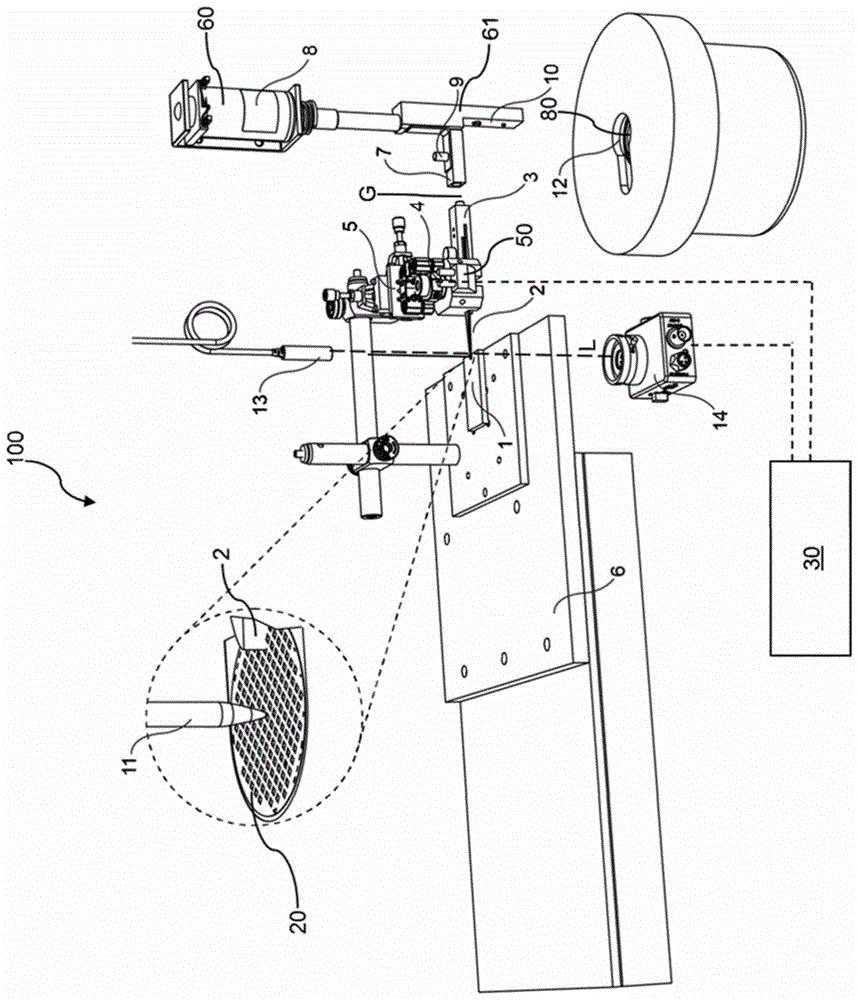
图1示出了根据本发明的系统100的实施方式。系统100,除了由例如微毛细管11形成的分配头11之外,包括:温控平台1;捏钳或镊子2,所述镊子保持载体结构20(例如电镜载网);保持镊子2的电磁体4;调节装置5,例如为xyz手动对准5(也称为“运动平台”)的形式,用于确保载体结构20平坦定位在温控平台1上,其中所述调节装置5安装在温控平台1上;第一适配器3,所述第一适配器安装在镊子2上,具有用于打开和关闭第一适配器3的镊子2的螺旋装置(螺钉),与转移机构60(也称为插入器组件)上的第二适配器7隔开间隙g。特别地,两个吸引永磁体(特别是nd磁体)插入适配器3的端部和适配器7的端部,第三永磁体9(特别是nd磁体)将第二适配器7保持在水平位置。
系统100还包括光源13,特别是激光二极管,更特别地是780nm红外激光二极管,其位于温控平台1的上方。光源13配置为沿光路l发射光束,其中载体结构20的表面与光路l相交,使得来自光源13的光指向载体结构。特别地,光源13和温控平台1定位成使得载体结构20的表面垂直于光路l。
此外,系统100包括光电检测器14,所述光电检测器位于温控平台1的下方,在光路l中,使得穿过温控平台1上的载体结构20的(即由载体结构20透射的)光指向光电检测器14,其中光电检测器14根据光电检测器14检测到的光的强度产生电信号。光电检测器14产生的信号被传输到系统100的控制装置30。所述控制装置30适于在指定的光强度值下触发转移机构60,以将带有样品的载体结构20移动到液体冷冻剂80中,从而产生玻璃化样品。特别地,如下文所述,转移机构60可通过控制装置30停用电磁体50来间接地被触发。
当载体结构20是具有多孔碳膜的电镜载网时,光源13发射的光束部分地透射通过电镜载网的间隙,所述电镜载网也含有薄的样品膜。特别地,透射光的光强度取决于液体样品的吸收,以及光散射和干涉现象,特别是由于在空气/液体界面处的反射。因此,特别地,在光电检测器14处产生的信号取决于载体结构20上的样品膜的膜厚度。
特别地,可以在样品沉积之前,借助在干燥的载体结构20上测量的参考信号来对信号进行归一化,以便校正单独的载体结构20的不同特性。
通常,在所有实施方式中,温控平台1可包括由帕尔贴(peltier)控制器控制的水冷帕尔贴元件。帕尔贴控制器从安装在平台1上的温度传感器获得平台温度。实际露点温度可由露点传感器提供,所述露点传感器测量实验室内的环境温度和相对湿度并连续计算露点温度,通过控制软件将所述露点温度反馈到帕尔贴控制器。
在根据本发明的方法中,通过温控平台1将载体结构20的温度设置在露点温度以上,以便以受控方式部分蒸发样品膜。在蒸发期间,可以通过光源13和光电检测器14监测样品层的膜厚度,使得样品玻璃化可以在指定的膜厚度处触发。
在下文中,详细说明了转移机构60的功能。
系统/转移机构60还包括:具有例如30mm毂的螺线管8;次级电路10,所述次级电路在镊子2击中开关时接通,这触发螺线管8并将载体结构20向下移动到容纳在容器12中的致冷剂80中。
载体结构20由适配器3的小的镊子2保持。镊子2通过例如两个螺旋装置牢固地安装在所述第一适配器3中。例如,第三螺旋装置允许通过在其上施加压力来打开和关闭镊子2。该第一适配器3的后端插有永磁体,特别是钕磁体。
载体结构20、镊子2和第一适配器3形成组件。该组件通过保持装置50保持在水平位置,所述保持装置为例如与镊子2接触的所述电磁体50的形式。电磁体50本身安装到所述调节装置5,所述调节装置允许在所有维度上手动对准,以将载体结构/载网20与温控平台1对准,其中载网20必须平放以实现良好的热接触和有效的样品沉积。
包括例如多个机动线性平台的组合的平移平台组件6使得微毛细管尖端11能够精确定位在温控平台1上的载体结构20的表面上方。将分配头11与载网20的表面极为靠近以将样品从分配头11转移到载体结构(例如载网)20。
特别地,当调节装置5安装在温控平台1上时,分配头11不连接到温控平台1,使得温控平台1可以通过平台组件6相对于分配头11移动,所述分配头可以通过图1中未示出的合适的保持装置保持。特别地,所述微毛细管尖端(分配头)11安装在单独的z轴平台上,所述z轴平台允许调节微毛细管相对于载体结构20的竖向位置。特别地,平台组件6允许在平台6延伸所沿的xy平面中自动移动温控平台。
根据样品的物理性质和化学性质,所述样品转移可以以多种方式进行。(i)直接沉积,且随后通过表面张力效应使纳升体积的液滴扩散在载体结构20(例如电镜载网)上。(ii)在载体结构20(例如电镜载网)上沉积纳升体积的液滴,随后以小于初始沉积体积的体积再吸入样品。(iii)在载体结构20(例如电镜载网)上沉积纳升体积的液滴,随后在电镜载网和微毛细管尖端11之间的液桥仍然建立的同时在这二者之间进行相对运动,以便将沉积的样品扩散到载体结构20(例如电镜载网)上。(iv)将纳升体积的液滴沉积到载体结构20(例如电镜载网)上,与在沉积期间将载体结构20(例如电镜载网)与微毛细管尖端11的相对移动相结合,以便将沉积的样品扩散到载体结构20上。
转移机构(移交机构)60包括第二适配器7,所述第二适配器也在其一端插有永磁体,特别是钕磁体,并且通过旋转铰链61与在另一端的大螺线管6连接。为了将该第二适配器7保持在水平位置,对应地放置第三永磁体,特别是钕磁体。第一适配器3和第二适配器7以小的间隙g分隔开。两个插入的磁体相互吸引,然而两者的连结受到电磁体50的阻碍,所述电磁体牢固地固定到组件20、2、3(例如镊子2)。
在样品沉积之后,将载体结构(例如电镜载网)20快速插入到冷冻液体80(通常是乙烷或乙烷/丙烷(40/60)的混合物)中,必须在载体结构20上的样品膜的期望厚度处进行。这是通过在由光电检测器14测量的由载体结构20透射的光的指定光强度值下借助于来自控制装置30的控制信号关闭(禁用)电磁体50来执行的。
关闭电磁体50使得两个适配器3、7能够咬合在一起并形成新的更重的组件。该新组件太重而不能通过第三永磁体(例如钕磁体)保持在原始位置。该新组件迅速下落至竖向位置(在第二适配器7的另一侧的铰链61)。如果该新组件到达竖向位置,则其由另一磁体保持就位以防止其来回弹跳。同时,电路通过下落的组件的金属部分(例如开关)而接通。这触发了控制螺线管控制器的次级电路10。结果,螺线管8被激活,并且30mm毂向下射出,最后将载体结构(例如电镜载网)20插入到容器12中的冷冻剂80中。从打开螺线管8直到载体结构20被投入冷冻剂80中的整个过程发生在三分之一秒时间内,并使沉积的液体膜能够玻璃化。
图2示出了根据本发明的系统和方法的工作原理。如图2a所示,标准多孔碳膜电镜载网(载体结构)20安装在镊子2的尖端之间并且平放(水平)在温控平台1(也称为露点平台)的槽中。平台温度设置为接近露点温度,并可以使用pid帕尔贴控制器进行调整。电镜载网20与平台1良好地热接触。露点平台1安装在机动xy轴上,以将载网20相对于微毛细管(分配头)11移动,所述微毛细管可以降低到载网20上方几微米。该微毛细管11沉积几纳升的样品,同时平台1以蜿蜒的模式移动,覆盖约0.5mm2的区域。
如图2b所示,在样品沉积之后,微毛细管11被抽出并移动平台1以将载网20定位在ir激光器(光源)13(λ=780nm)和光电二极管(光电检测器)14之间。载网上的薄的含水样品膜的光散射和干涉效应随水蒸发而发生变化(参见图3和图8)。
如图2c所示,当光电二极管14信号达到预限定的阈值水平时,触发器自动启动插入式冷冻。镊子2和载网20从平台1快速抽出,翻转90度到竖向位置并插入冷冻剂8中。整个抽取和插入过程需要几百毫秒。
图3示出了来自样品的水蒸发的实时监测数据,以控制玻璃态冰层的厚度。使用780nm激光的透射光来记录水层厚度的变化(参见图2b)。紫(静态)线是用干载网获得的信号(干信号)。红线是在样品沉积后水蒸发期间记录的传感器信号(平台温度高于露点2℃)。根据经验,发现当传感器信号约为干信号的95%(蓝线)时,获得可用的载网。当达到该阈值时(箭头指示)触发抽取和插入机构或机制,导致冷冻载网快速玻璃化(在几百毫秒内),并且当载网从光学激光路径移除时信号急剧增加。请注意,该图示出了样品蒸发时信号随时间的特性演变。选择该图是为了清楚起见,因为其示出了在距露点(2℃)较小的偏移处的长时间的大体积(20nl)蒸发。实际上,较少的样品被沉积(或预先再吸入),并且只能记录该图的最后几秒。
图4示出了使用根据本发明的系统和方法的冷冻载网制备的概念验证数据(沉积方案1,参见下面的示例)。将20nl的总样品体积施加到quantifoilr2/1,200目铜载网上;再吸入过量的液体以尽可能多地回收样品。露点平台的温度始终高于露点8℃,这导致样品快速变薄;在再吸入过量的样品后,立即自动触发载网抽取和插入机构或机制。
图4a示出了制备的载网的通常概貌,其示出了玻璃态冰的薄膜。黄色箭头指示样品边界。插图:对比度调整后四倍放大边界区域以提高可见度。注意玻璃态样品的均匀层。比例尺:100μm。
图4b示出了更高放大率的概貌图像,其展示了孔中的均匀样品层。比例尺:2μm。
图4c示出了通过该方法制备的tris-hcl缓冲液中的脱铁铁蛋白颗粒和噬菌体,并在高放大率下成像并散焦以增加对比度。插图:指示区域两倍放大,示出了噬菌体尾部和一些环状脱铁铁蛋白复合物。比例尺:80nm。
图5示出了使用根据本发明的系统和沉积方案2(参见下面的示例)进行冷冻载网制备的概念验证数据。在每种情况下,将3nl样品体积直接施加到载网;没有样品被再吸入。通过受控水蒸发使样品变薄后,载网被玻璃化。
图5a示出quantifoilr2/2,400目铜载网中间的3nl样品体积(pbs缓冲液中的脲酶)的概貌图像。对于图4,请注意层厚度在某些区域中具有梯度。玻璃态冰的外围用黄色箭头表示。比例尺:100μm。
图5b示出了在amphipols中重构的精细的200kda膜蛋白的图像。插图:指示区域两倍放大,清楚地示出了蛋白质颗粒。比例尺:80nm。
图5c示出了来自单个粘附真核细胞的裂解物的无损冷冻载网制备的示例。通过电穿孔裂解在功能化的ito光学显微镜载玻片上生长的单个hek细胞,并快速吸入3nl的总体积的裂解物。随后,使用方案2将裂解物分配在载网上并玻璃化。比例总体积尺:80nm。
图6示出了使用根据本发明的系统制备用于高分辨率结构分析的样品。使用沉积方案1(参见下面的示例)将20nl体积的pbs缓冲液中的脲酶沉积在quantifoilr1.2/1.3,200目铜载网上。
图6a:示出了包埋在玻璃态冰中的脲酶颗粒的漂移校正的冷冻电镜图像。插图:对比度增加的颗粒。比例尺:50nm。
图6b示出了2d类平均,包括最初选择的10000个颗粒中的~3400个。比例尺:5nm。
图6c示出了3d类平均,包括被确定用于进一步处理的8700个颗粒中的~5370个。比例尺:5nm。
图6d示出了分辨率为
图7示出了控制软件的屏幕截图,其示出了液体处理控制插件(右上)、样品沉积期间微毛细管和电镜载网的监测相机视图(右下)以及用于自动化的宏面板(左)。
图8a示出了在23℃的室温下针对八个不同房间的相对湿度(relativehumidity,rh)绘制的露点平台(dewpointstage,dp平台)温度vs平台/载网微环境的rh的数据。对于露点温度的小的正偏移(例如+2℃),曲线近似为线性并且对于所有的八种情况具有相似的斜率。
图8b示出了在露点平台产生三种不同的rh的微环境所需的露点温度的偏移vs在23℃室温下的rh的关系。当房间rh从20%变化到90%时,在dp平台上产生90%rh的微环境所需的偏移变化小于0.3度。
图8c示出了垂直于水层入射的理想相干蓝(405nm)或红外(780nm)激光光线的透射率的简单模拟。针对水层的厚度绘制透射率(concisemacleod软件,thinfilmcenterinc.,usa)。
图8d示出了用红外线(红线,λ=780nm)或蓝激光(蓝线,λ=405nm)测量的沉积在辉光放电电镜载网(quantifoilr2/1,200目铜载网)上的20nl水斑的完全蒸发的归一化幅度vs时间数据。载网保持在露点以上3℃。在不同载网上对于两种波长进行了若干独立实验(n=5;虚线),并计算了平均结果(实线)。注意,干涉图案的清晰度受到以下影响:(i)由于所使用的激光二极管的不佳的相干长度,(ii)激光相对于载网的不精确的倾斜几何形状,以及(iii)照明区域上的膜厚度不均匀。
图9示出了在样品变薄期间过多的水蒸发时发生的盐效应的演示。使用根据本发明的系统和沉积方案2(参见下面的示例)制备含有0.1%癸基-3-d-吡喃麦芽糖苷(decyl-3-d-maltopyranoside,dm)的pbs中的烟草花叶病毒(tobaccomosaicvirus,tmv)样品以用于冷冻电镜。
图9a示出了不正确的使样品变薄,太多样品留在载网上和/或在变薄之前没有足够广泛地扩散。结果,小的盐晶体(高对比度)在背景中可见,并且tmv的重复结构的分辨率降低。
图9b示出了正确的使样品变薄。tmv的
图10示出了在amphipols中重构的200kda膜蛋白的电子显微照片。以不同方式制备样品以用于显微镜检查。在同一天制备冷冻电镜载网。自始至终使用补充有5μm叠氮化钠的hepes缓冲液中的重构蛋白质的相同样品储液。
图10a示出了负染色载网(2%乙酸铀)的电子显微照片。
图10b示出了来自使用传统的vitrobot插入式冷冻机制备的冷冻电镜载网的电子显微照片。与vitrobot一起使用的方案如下:将300目微栅(蕾丝,花边,lacey)铜载网辉光放电60秒,并进给到vitrobot中以在液体乙烷中进行插入式冷冻:装载蛋白质样品的量,2.5μl;等待时间,5s;吸干力,1;吸干时间,3s;吸干纸,whatman#1定性;湿度100%,室在10℃下平衡。
图10c示出了来自使用根据本发明(方案2,参见下面的示例)的装置制备的冷冻载网(quantifoilr2/2,200目)的电子显微照片。3nl样品体积。插图:指示区域两倍放大。比例尺:80nm。
图11示出了用方案2(参见下面的示例)沉积的单细胞裂解物的电子显微照片。
图11a示出了来自具有附加的连续碳层的多孔碳载网(quantifoilr2/2,200目)的电子显微照片。注意连续碳层和其他均匀冰层的轻微褶皱。
图11b示出了来自没有连续碳膜的多孔碳载网(quantifoilr2/1,200目)的电子显微照片。注意孔内的梯度。插图示出了在单细胞样品中发现的典型膜片。比例尺2μm用于表示概貌,80nm用于插图。
图12示出了最终锐化脲酶图之后的校正的傅立叶壳相关(fsc)曲线。根据“金标准”,fsc=0.143处的频率表示3d重建的分辨率。这里,对应的空间频率为
图13示出了用于测量样品膜厚度的设备的示意图,其是根据本发明的用于在载体结构20上制备样品的系统100的一部分。所述设备包括第一光源13a和第二光源13b,所述第一光源配置为沿着光路l将第一波长的第一光束l1发射到载体结构20上,所述第二光源配置为垂直于光路l发射第二波长的第二光束l2。
特别地,第一波长和第二波长具有300nm至400nm的距离。例如,第一光束l1可以包括波长为780nm的光,第二光束可以包括波长为405nm的光。
第一光束l1和第二光束l2指向第一分色镜15a,所述第一分色镜配置为使得第一光束l1穿过第一分色镜15a,并且第二光束l2被第一分色镜15a反射。第一光束l1和第二光束l2通过第一分色镜15a合并,并且指向载体结构20,特别是沿着光路l,所述光路垂直于载体结构20的表面。合并的光束的至少一部分由包含样品的载体结构20透射,其中产生透射光束t。
例如,第一光束l1可以包括波长比第二光束l2长的光,并且第一分色镜15a可以是长通分色镜(用作长通滤光器),其适于使第一光束l1的光通过,其中第二光束l2的光不被允许通过而是由第一分色镜15a反射。可替代地,在第一光束l1包括波长比第二光束l2短的光的情况下,第一分色镜15a可以是短通分色镜(用作短通滤光器)。
所述设备还包括第二分色镜15b,其适于将透射光束t分成第一透射光束t1和第二透射光束t2。第二分色镜15b配置为使第一透射光束t1的光通过,并反射第二透射光束t2,使得第一透射光束t1指向第一光电检测器14a,并且第二透射光束t2指向第二光电检测器14b。通过第一孔径16a保护第一光电检测器14a免受入射光的影响,并且通过第二孔径16b保护第二光电检测器14b免受入射光的影响。
类似于第一分色镜15a,第二分色镜15b可以是长通分色镜或短通分色镜。
第一光电检测器14a和第二光电检测器14b适于产生信号,所述信号取决于(第一透射光束t1或第二透射光束t2各自的)检测光的强度。当第一光束l1和第二光束l2包括不同波长的光时,载体结构20上的样品膜的厚度可以通过由第一光电检测器14a和第二光电检测器14b产生的两个信号来确定。
通过以下示例进一步描述本发明。
示例-无吸干和无损冷冻电子显微镜载网
纳升级蛋白质样品和单细胞提取物的制备
材料与方法
本文介绍的仪器在本说明书中描述或先前已发表(arnold,s.a.,albiez,s.,opara,n.,chami,m.,schmidli,c,bieri,a.,padeste,c,stahlberg,h.,braun,t.,2016.totalsampleconditioningandpreparationofnanolitervolumesforelectronmicroscopy.acsnano10,4981-4988;kemmerling,s.,arnold,s.a.,bircher,b.a.,sauter,n.,escobedo,c,dernick,g.,hierlemann,a.,stahlberg,h.,braun,t.,2013.single-celllysisforvisualanalysisbyelectronmicroscopy.j.struct.biol.183,467-473)。图1提供了设备的详细描述,包括部件列表和方法的细节。图7示出了控制软件。
化学品和缓冲液
如果没有其他说明,所有化学品均从瑞士的sigma-aldrich订购。使用的缓冲液如下:pbs,dulbecco的磷酸盐缓冲盐水,2.7mmkcl,1.5mmkh2po4,136.9mmnacl,8.9mmna2hpo4·7h2o,ph值7.4;tris-hcl缓冲液,20mmtris-hcl,50mmnacl(ph值7.4);hepes缓冲液,10mm的hepesph值8.0,50mmkcl。
测试样品
测试样品是(i)含有0.1%癸基-β-d-吡喃麦芽糖苷(dm,anatrace)的pbs中的烟草花叶病毒(tmv),(ii)含有tris-hcl缓冲液中针对大肠杆菌的噬菌体(vb_ecom_cba120)和脱铁铁蛋白的混合物,以及(iii)在amphipols中重构的纯化的200kda膜蛋白(名称未公开)。在这种情况下,将大量膜蛋白样品施加于用补充有5μm叠氮化钠的hepes缓冲液平衡的s20010/300gl大小排阻色谱柱。使用对应于主a280峰的中心的单个300μi部分,以通过使用cryowriter和使用vitrobot插入式冷冻器(fei)来制备冷冻载网。通过使用uv-vis分光光度计(nanodrop2000,thermofisherscientificinc.)的吸光度测量确定该部分的蛋白质浓度为0.35mg/ml,并假设abs(0.1%)=1。(iv)在pbs缓冲液中浓度为0.35mg/ml的来自小肠结肠炎耶尔森氏菌(yersiniaenterocolitica)的脲酶。
电镜载网
与cryowriter一起使用各种电镜载网,诸如带有多孔碳膜的200目铜载网(r2/2、r2/1和r1.2/1.3,quantifoil,德国),以及带有附加的连续碳层的多孔碳载网,和微珊碳载网。电镜载网在使用前即刻在空气等离子体中辉光放电30秒。注意,当载网在温度控制的露点平台(dp平台)上时,载网的平坦度对于机械写入步骤和有效热传递都是重要的方面。
冷冻载网制备
与cryowriter设备一起使用的两种沉积方案在以下部分和图1中详述。
电子显微镜和单颗粒分析
除非另有说明,否则将具有测试样品的电镜载网置于gatan-626冷冻架中,并在200kv下操作并配备有tvipsf4164kcmos相机(tvips,德国)的philipscm200(feg)tem中成像。
使用feititankrios获得用于单颗粒分析的脲酶图像,其在300kv下操作并且配备有gatanquantum-ls(20ev的零损失狭缝宽度)和gatank2summitded。对于在电影模式下获得的40个图像的堆叠,以5-6e7物理像素/秒的剂量率施加具有
结果
原理和设备
cryowriter(根据本发明的系统)设备和方法的原理在图2中描绘,进一步的细节可以在图1和图7中找到。cryowriter集成到先前为纳升体积样品调节以及负染色和海藻糖包埋的电镜载网制备而开发的液体处理和转移系统中(arnold,s.a.,albiez,s.,opara,n.,chami,m.,schmidli,c,bieri,a.,padeste,c,stahlberg,h.,braun,t.,2016.totalsampleconditioningandpreparationofnanolitervolumesforelectronmicroscopy.acsnano10,4981-4988)。该方法使用高精度移液系统控制微毛细管的液体提取和分配,使用温度控制的露点平台(dp平台)控制电镜载网的环境,使用实时监测系统控制样品层的厚度,以及使用抽取和插入机构或机制以用于样品玻璃化。设备本身不包含在湿度控制的环境中。整个过程由labview(elliott,c,vijayakumar,v.,zink,w.,hansen,r.,2007.nationalinstrumentslabview:aprogrammingenvironmentforlaboratoryautomationandmeasurement.jala12,17-24)中开发的openbeb(ramakrishnan,c,bieri,a.,sauter,n.,roizard,s.,ringler,p.,mijller,s.a.,goldie,k.n.,enimanev,k.,stahlberg,h.,rinn,b.,braun,t.,2014.openbeb:open)插件控制,并且可以使用宏实现自动化(参见图7)。
用于冷冻载网制备的设备和基本步骤(图2)如下:(i)载网冷却:由镊子保持的辉光放电标准的多孔碳膜透射电镜载网定位于冷的dp平台上。(ii)样品提取;如前所述,使用微毛细管和高精度泵系统来在电裂解后立即从样品储液或单个细胞的裂解物中吸入液体塞(arnold,s.a.,albiez,s.,opara,n.,chami,m.,schmidli,c,bieri,a.,padeste,c,stahlberg,h.,braun,t.,2016.totalsampleconditioningandpreparationofnanolitervolumesforelectronmicroscopy.acsnano10,4981-4988;kemmerling,s.,arnold,s.a.,bircher,b.a.,sauter,n.,escobedo,c,dernick,g.,hierlemann,a.,stahlberg,h.,braun,t.,2013.single-celllysisforvisualanalysisbyelectronmicroscopy.j.struct.biol.183,467-473)。
(iii)样品沉积(图2a),使微毛细管尖端紧密靠近载网表面。然后从微毛细管分配样品以形成小液滴,所述小液滴跨越微毛细管尖端与电镜载网的亲水(辉光放电)多孔碳表面之间的间隙。同时,载网相对于喷嘴以正弦或圆形图案移动;将液体样品展开到表面,填充碳膜的孔。(iv)通过受控水蒸发使样品稳定并变薄(图2b及下面的相应内容);设置dp平台的温度以使电镜载网和悬浮样品始终保持在接近室内的露点温度的指定温度。注意,载网不会立即玻璃化,而是可以在短时间内保持在平台上(根据所选择的偏移温度,在<1s和10s之间),使得可以蒸发一定量样品水。载网和施加的含水样品与780nm激光束的相互作用所产生的干涉/散射效应可以用来监测蒸发(图3)。一些水的受控损失对于确保薄水膜跨越碳层的孔是重要的。(iv)冷冻载网抽取和插入冷冻(图2c);该机构由监测系统触发,或在预定时间后迅速将载网(和镊子尖端)插入液体乙烷/丙烷(40:60)浴中(tivol,w.f.,briegel,a.,jensen,g.j.,2008.animprovedcryogenforplungefreezing.microsc.microanal.14,375-379)以用于玻璃化(还参见图1)。
根据实验和样品,这种基本步骤可以使用两种沉积方案。在方案1中,在载网上沉积相对大的体积(20nl),通过用分配微毛细管再吸入来除去过量样品并回收;该方案对于制备用于单颗粒分析和高分辨率结构确定的纯化蛋白复合物的大电镜成像区域是理想的。在方案2中,约3nl样品的体积直接沉积在载网上,避免了对再吸入步骤的需求。该方案更适合限于微量体积的应用,例如,单细胞可视化蛋白质组学(arnold,s.a.,albiez,s.,opara,n.,chami,m.,schmidli,c,bieri,a.,padeste,c,stahlberg,h.,braun,t.,2016.totalsampleconditioningandpreparationofnanolitervolumesforelectronmicroscopy.acsnano10,4981-4988;engel,a.,2010.assessingbiologicalsampleswithscanningprobes,p.417-431,springerberlinheidelberg;kemmerling,s.,ziegler,j.,schweighauser,g.,arnold,s.a.,giss,d.,muller,s.a.,ringler,p.,goldie,k.n.,goedecke,n.,hierlemann,a.,stahlberg,h.,engel,a.,braun,t.,2012.connectingμ-fluidicstoelectronmicroscopy.j.struct.biol.177,128-134)。
这些方案将在下文详细描述:
方案1:沉积,伴有回收过量样品
使用微毛细管和高精度泵系统以用于从样品储液中吸入几十纳升样品。然后将微毛细管尖端降低至辉光放电的载网表面(分离-10μm),并从其分配20nl的样品的液滴。所述液滴跨越微毛细管尖端和电镜载网之间的间隙,并且可以通过相对于微毛细管移动载网(图2a)进一步扩散以覆盖-0.5mm2的区域。随后,降低微毛细管尖端以接触该区域内的载网表面,并再吸入尽可能多的过量样品,将其回收以备将来使用。对于所有这些步骤,dp平台(和载网)的温度保持在室内的露点温度以上,以允许最少量的水蒸发。温度从露点偏移+8℃,结合过量样品被再吸入后立即进行插入式冷冻,通常可以获得良好的样品厚度,以实现高分辨率结构分析。如果需要更高的精度,可以使用下面描述的实时监测系统通过受控水蒸发来优化样品膜的厚度。对于使样本变薄过程的更广泛讨论可以在相应的部分中找到。
方案2:直接沉积样品,无再吸入
使用该方案,将约3nl的样品直接沉积在载网上,以避免样品的再吸入。将载网温度保持在露点温度以避免水蒸发,并且通过以正弦或圆形图案移动微毛细管尖端下面的电镜载网将微小的样品液滴扩散,所覆盖的区域大约为0.5mm2。随后,必须在插入式冷冻之前通过受控水蒸发执行使样品变薄步骤。通过将dp平台温度增加到稍微高于室内露点温度的值(例如,+2℃)来引起蒸发。为了获得这些小体积的可重复结果,使样品变薄过程必须由监测系统监督(参见相应的部分)。
通过受控水蒸发来使样品稳定和变薄
由于表面张力效应,即使极小的样品等分试样也必须变薄,以使载网可用于冷冻电镜。近来,使用“自吸干”载网结合喷墨点样证明了一种有趣的方法(razinkov,i.,dandey,v.p.,wei,h.,zhang,z.,melnekoff,d.,rice,w.j.,wigge,c,potter,c.s.,carragher,b.,2016.anewmethodforvitrifyingsamplesforcryoem.j.struct.biol.195,190-198)。
这里,我们提出一种基于样品水的受控蒸发的方法以创建薄的样品层。可以通过调节dp平台的温度和开始进行抽取和插入式冷冻之前的时间跨度来调整样品膜厚度。通过水蒸发使样品稍微浓缩。这可能是蛋白质所期望的,但盐浓度也会增加,这可能会损害蛋白质复合物。因此,以这种方式变薄仅限于已经很薄的样品膜,使得通过沉积方案1制备的样品的再吸入是必要的。注意,如果有必要,支持cryowriter的液体处理和转移系统将允许样品调节,例如在冷冻载网制备之前通过扩散驱动过程(arnold,s.a.,albiez,s.,opara,n.,chami,m.,schmidli,c,bieri,a.,padeste,c,stahlberg,h.,braun,t.,2016.totalsampleconditioningandpreparationofnanolitervolumesforelectronmicroscopy.acsnano10,4981-4988)进行盐交换。
cryowriter设备包括激光二极管(780nm;图2b)和光电检测器,以实时跟踪来自载网的样品液体的蒸发。在波长为780nm下,光不会被水或生物材料显著吸收,这使得转移到样品的热量可以忽略不计(bircher,b.a.,lang,h.-p.,duempelmann,l.,gerber,c,braun,t.,2013.photothermalexcitationofmicrocantileversinliquid:effectoftheexcitationlaserpositionontemperatureandvibrationalamplitude.micronanolett.8,770-774)。然而,由于蒸发引起的水膜厚度的变化对光电检测器记录的信号的幅度具有可检测到的影响。除了光散射的变化,透射光信号也受到薄膜表面处反射的光波之间干涉的影响(图3)。随着水蒸发,信号近似线性增加,直到达到其中信号开始急剧增加的特定的层厚度。我们将这个正峰归因于层厚度d-a/(2n)处几乎垂直的束的相长干涉,波长λ=780nm且n78o=1-329(hale,g.m.,querry,m.r.,1973.opticalconstantsofwaterinthe200-nmto200-μηιwavelengthregion.appl.opt.12,555-563)。如相消干涉所预期的那样,负峰直接跟随正峰。使用具有在405nm附近而不是在780nm的发射峰值的激光二极管验证观察到的信号特性(图3)主要是由于干涉效应。一旦达到相对于用干载网获得的绝对信号的特定的用户定义的信号阈值(参见图3进行说明),监测系统就触发抽取和插入机构或机制,由此冷冻载网快速玻璃化。
注意,“干信号”取决于载网类型和网孔大小。由于差异显著,因此在样品沉积之前总是需要进行“空白(blank)”测量(图3)。相比之下,信号不取决于沉积在特定载网类型/网孔上的样品类型,使得可以仅使用缓冲液(无样品)进行筛选运行以确定用于实验的理想冷冻条件。
从不同样品中获得概念冷冻载网制备的证明
本部分和以下部分中的示例显示,cryowriter设备可用于制备不同生物样品(例如,可溶性或膜蛋白颗粒、丝状组合体、病毒、细胞裂解物)的高质量冷冻载网,以用于各种目的,诸如结构确定,所述结构确定通过单颗粒分析(下面说明)或螺旋分析,以及单细胞可视化蛋白质组学(engel,a.,2010.assessingbiologicalsampleswithscanningprobes,p.417-431,springerberlinheidelberg)。在实践中,用于特定样品的沉积方案的选择取决于其性质和实验目的。该方法对于所采用的缓冲系统不敏感。
如图4所示,使用cryowriter和沉积方案1将20nl样品体积扩散在辉光放电的多孔碳膜上。对于所有制备步骤,dp平台温度保持在露点温度以上8℃。随后,再吸入过量样品并在插入式冷冻之前进行使样品变薄1秒。如图4a所示,再吸入后留下的样品形成覆盖冷冻载网的一部分的均匀的玻璃态冰层;该区域的周边是可见的并用箭头指示。图4b证实了该层的均匀性,其示出了在更高放大倍数下的多孔碳膜,以说明样品层跨越碳载体的孔。图4c示出了通过该方法制备的高质量的脱铁铁蛋白颗粒(环状外观)和噬菌体。显示了噬菌体尾部的结构(插图)。注意,没有结晶冰结构,这表明载网确实被玻璃化。其他示例显示在单个颗粒处理部分中。
如图5所示,使用cryowriter和沉积方案2将3nl样品分配到辉光放电的多孔碳膜上。如上面相应的部分所详述,通过监测的水蒸发进行使样品变薄。图5a示出了通常的载网的概貌。玻璃态样品覆盖的区域通常小于使用沉积方案1时所覆盖的区域。此外,玻璃化样品层的厚度是不均匀的(比较图5a与图4a和图4b);尽管通过方案2沉积的图案化液体区域在亲水载网上展开,但由于表面张力并且因为水在湿区域的周边处蒸发得更快而保持厚度梯度。可能由于液滴周边的表面/体积比率较大,样品区域中心的蒸发率较低,由于水蒸发导致高于载网的瞬间过高的湿度,并且蒸发过程的冷却效果被来自液滴中心的载网的热流所补偿的效率较低。
当方案2应用于多孔碳膜时观察到的厚度梯度是一个缺陷。对于某些样品,它们可以通过使用痕量的表面活性剂,或者在较小的范围内使用覆盖有薄的连续碳膜的电镜载网来最小化这个缺陷。然而,如图5b和图5c所示,冷冻电镜可以在冰厚度略微不均匀的样品上运作。图5b示出了从使用cryowriter和方案2制备的多孔碳冷冻载网上记录的使用amphipols稳定的200kda膜蛋白的图像。图10示出了使用vitrobot插入式冷冻器或cryowriter,在薄碳膜上制备用于负染色透射电镜的与在微珊和多孔碳上制备用于冷冻电镜的相同蛋白的图像。而负染色图像示出完整单一颗粒,通过传统的抽取-冷冻方法,在制备用于冷冻电镜的载网上有规律地发现降解的颗粒,其可能由于吸干步骤而引起。相比之下,使用cryowriter制备的冷冻电镜载网似乎在更高浓度下比在使用传统的插入式冷冻方法制备时具有更均匀的蛋白颗粒。
使用沉积方案2时所消耗的微小体积允许由原本无法使用的样品制备冷冻载网。例如,可以检查单个真核细胞的裂解物。为了证明这一点,在导电玻璃载玻片上培养粘附的hek293细胞,并在光学显微镜中鉴定单个靶细胞,并使用如前所述的微毛细管电穿孔和吸入(arnold,s.a.,albiez,s.,opara,n.,chami,m.,schmidli,c,bieri,a.,padeste,c,stahlberg,h.,braun,t.,2016.totalsampleconditioningandpreparationofnanolitervolumesforelectronmicroscopy.acsnano10,4981-4988;kemmerling,s.,arnold,s.a.,bircher,b.a.,sauter,n.,escobedo,c,dernick,g.,hierlemann,a.,stahlberg,h.,braun,t.,2013.single-celllysisforvisualanalysisbyelectronmicroscopy.j.struct.biol.183,467-473)。使用相同的铂涂层微毛细管以用于电穿孔、细胞裂解物吸入及分配,从而最小化暴露于表面的微量的生物材料,并最小化所导致的细胞成分的损失。如图5c所示,使用方案2的裂解物沉积得到高质量的冷冻载网,并且可见具有相关联的蛋白质的通常的膜结构。使用样品沉积方案2制备的单细胞裂解物的更多示例在图11中示出。
单颗粒分析
为了证明cryowriter方法用于高分辨率结构分析的有用性,使用沉积方案1制备来自小肠结肠炎耶尔森菌的脲酶以用于冷冻电镜,并用配备有直接电子检测器的titankrios显微镜成像(参见材料和方法)。图6a记录了高质量的样品载网。从初始2d分类中选择的类平均在图6b示出。从在最终处理步骤中生成和使用的类中选择颗粒的子集(图6c)。根据“金标准”(henderson,r.,sali,a.,baker,m.l.,carragher,b.,devkota,b.,downing,k.h.,egelman,e.h.,feng,z.,frank,j.,grigorieff,n.,jiang,w.,ludtke,s.j.,medalia,o.,penczek,p.a.,rosenthal,p.b.,rossmann,m.g.,schmid,m.f.,schroder,g.f.,steven,a.c.,stokes,d.l.,westbrook,j.d.,wriggers,w.,yang,h.,young,j.,berman,h.m.,chiu,w.,kleywegt,g.j.,lawson,c.l.2012.outcomeofthefirstelectronmicroscopyvalidationtaskforcemeeting.,pp.205-214structure(london,england:1993),vol.20;scheres,s.h.w.,chen,s.,2012.preventionofoverfittingincryo-emstructuredetermination.nat.methods9,853-854)进行细化以产生根据傅立叶壳相关性(fsc=0.143,图12)的
讨论
本发明解决了改进样品载网制备方法以用于冷冻电镜以及使用最少量的样品(纳升)制备这种载网的问题。本文描述的冷冻电镜样品沉积和玻璃化工具仅消耗每载网3nl至20nl的样品,并且可与不同类型的样品一起使用;例如,单颗粒制备(制品)的可溶性和膜蛋白、病毒和噬菌体,或全细胞裂解物。该设备包括监测系统,以允许一旦达到限定的阈值,就控制使样品膜变薄,并自动激活抽取和插入机构或机制。重要的是,可以使用仅通过缓冲液而无需实际样品制备的载网来确定冷冻条件和该阈值。
其他重要方面是,cryowriter方法以最小的样品损失工作,并且不涉及任何纸张吸干步骤。许多依赖冷冻载网制备的实验室的经验表明,传统的制备方法可能对精细蛋白复合物的保存有害。这通常归因于:纸吸干步骤,该步骤可以快速改变样品的缓冲特性(盐、ph变化、从滤纸中浸出的离子),会致使剪切力干扰长蛋白组合体(lee,j.,saha,a.,pancera,s.m.,kempter,a.,rieger,j.,bose,a.,tripathi,a.,2012.shearfreeandblotlesscryo-temimaging:anewmethodforprobingearlyevolutionofnanostructures.langmuir28,4043-4046);或者归因于:吸干后样品膜的表面与体积的大比率,这在吸干期间和吸干之后将更多的蛋白质暴露于恶劣的空气-水界面。本文提供的样品沉积方案完全避免了纸张吸干。沉积方案1还使在样品被再吸入后留在载网上的蛋白的空气-水界面的暴露时间最小化;如果dp平台偏移为+8℃,则样品可在沉积后立即玻璃化。当使用沉积方案2时,暴露于空气-水界面更长。在载网最终处于冷冻剂之前,样品沉积、扩散和变薄可能需要10秒。两种沉积方案还允许使用添加剂,诸如在空气-水界面处浓缩的痕量表面活性剂,其可以保护蛋白质免受表面效应。通过扩散驱动过程进行的样品调节(arnold,s.a.,albiez,s.,opara,n.,chami,m.,schmidli,c,bieri,a.,padeste,c,stahlberg,h.,braun,t.,2016.totalsampleconditioningandpreparationofnanolitervolumesforelectronmicroscopy.acsnano10,4981-4988)可以包含在cryowriter设备中,以允许将表面活性剂快速引入小样品体积(<5nl),并通过方案2制备均匀的载网(arnold,s.a.,albiez,s.,opara,n.,chami,m.,schmidli,c,bieri,a.,padeste,c,stahlberg,h.,braun,t.,2016.totalsampleconditioningandpreparationofnanolitervolumesforelectronmicroscopy.acsnano10,4981-4988)。
该方法允许显著缩短确定合适的冷冻条件所需的时间和精力。实现几乎无损的制备和低样品消耗,会使冷冻电镜适用于稀疏可获得的蛋白质/蛋白复合物和单细胞的内含物的结构分析。这是特别令人感兴趣的,原因在于冷冻电镜的技术进步现在允许通过单颗粒成像和仅对几千到几百万蛋白复合物的分析来达到
cryowriter:详细的设备描述和样品玻璃化
cryowriter设备如图1所示。其具有保持接近露点的温控平台1(dp平台)。组合的温度和湿度传感器(uft75-at,sensor-tec,德国)连续确定室内的露点,并使用由帕尔贴控制器(cooltronicgmbh,瑞士)调节的水冷帕尔贴元件来对应地调整dp平台1的温度。电子显微镜(em)载网20(先前在空气等离子体中辉光放电30秒)由固定到第一适配器3的镊子2保持。旋转第一适配器3上的指状螺旋装置打开和关闭镊子,以允许抓住并保持载网20。电磁体(mmtmagnettechnikgmbh&co.德国)4将镊子2保持在水平位置,并且镊子2通过安装在其上的两个小帕尔贴元件冷却。电磁体固定到精密的运动支架5(ks05k/m,thorlabsgmbh,德国),该支架本身安装在手动z轴平台上。因此,由镊子2保持的载网20可以对齐并且平放(水平地),其中在dp平台1的槽中,多孔碳面朝上。槽在其中心具有小孔(2mm直径),以允许激光束通过(见下文)。除了在该区域中,载网20的外缘和下表面与平台材料直接接触。dp平台1本身安装在机动平台(priorscientific,英国)6上,以允许定位的载网和镊子在水平面上移动。插入有另一永磁体的第二个适配器7通过枢转连接到大螺线管8(hd8286-rf,kuhnke,德国)。该第二适配器7可以绕其枢转轴线自由旋转,但是通过小永磁体9保持在水平方向。大螺线管8具有30mm的毂长度并且由螺线管控制器控制(mst-1630.001/002,trembagmbh,德国),使得当次级电路10接通时致动螺线管。
熔融二氧化硅微毛细管(newobjective,美国)11安装在线性平台组件(m-404.2pd和m-414.3pd,physikinstrumente,德国)上,并连接到高精度注射泵(cetonigmbh,德国)(未示出)。所述微毛细管用于从储存容器(例如pcr管、孔板等)或从裂解的单细胞吸入样品(arnold,s.a.,albiez,s.,opara,n.,chami,m.,schmidli,c,bieri,a.,padeste,c,stahlberg,h.,braun,t.,2016.totalsampleconditioningandpreparationofnanolitervolumesforelectronmicroscopy.acsnano10,4981-4988),并将样品分配到dp平台1上的载网上。由于dp平台1安装在机动平台上,因此如果需要的话在分配样品时可以移动载网20,以允许样品分布在载网20的更广泛的区域上。两个ccd相机(未示出)允许直接观察样品沉积和扩散(侧视图和倾斜俯视图,参见图7)。其一旦完成,微毛细管就会缩回。
在样品沉积之后,液体的蒸发由dp平台1的温度控制,并且可以使用激光二极管(λ=780nm,cps192,thorlabsgmbh,德国)13和具有手动孔径(sm1d12sz,thorlabs,germany)的光电检测器(光电二极管pda100a,thorlabsgmbh)14监测。激光二极管13安装在dp平台1上方,照射载网20的沉积样品的区域。光电检测器14定位在激光二极管13的光路中的dp平台1的下面。
当监测系统记录的激光信号达到限定的阈值时或在用户限定的预定时间之后,样品自动进行玻璃化。当电磁体4关闭并且适配器3和适配器7内的两个磁体咬合在一起时,触发将载网插入到冷冻剂中,从dp平台1抽出镊子2和载网20。由于重量增加,新形成的组件下落到竖向位置。当组件到达竖向位置时,其自动接通次级电路10,这触发大螺线管。30mm螺线管毂将电镜载网和镊子2的尖端投入冷冻剂12(乙烷和丙烷(40:60)的混合物,在具有定制的聚苯乙烯泡沫塑料盖的美国fei的vitrobot标准的制冷剂容器中液化,以在插入式冷冻过程中最大限度地减少冰污染)。从电磁体4关闭的那一刻直到载网浸入冷冻剂中只需要几百毫秒。镊子2现在可以很容易地手动从组件中移除(磁性连接),并且载网20可以放置在浸入液氮中的载网储存箱中,并随后转移到储存杜瓦瓶或直接进入配备冷冻的电子显微镜以用于观察。
cryowriter:控制软件
所有仪器均通过美国国家仪器(nationalinstruments)labview软件控制(elliott,c,vijayakumar,v.,zink,w.,hansen,r.,2007.nationalinstrumentslabview:aprogrammingenvironmentforlaboratoryautomationandmeasurement.jala12,17-24)。使用openbeb框架(www.openbeb.org)以将每个仪器程序作为独立插件加载(ramakrishnan,c,bieri,a.,sauter,n.,roizard,s.,ringler,p.,mqiier,s.a.,goldie,k.n.,enimanev,k.,stahlberg,h.,rinn,b.,braun,t.,2014.openbeb:openbiologicalexperimentbrowserforcorrelativemeasurements.bmcbioinf.15,84)。诸如样品加载、沉积和冷冻插入之类的许多实验步骤已经使用openbeb的宏语言自动化。图7示出了控制软件的屏幕截图,包括用于过程自动化的宏窗口。
通过780nm激光二极管实时监测水厚度
如果载网和平台保持在露点温度,则靠近载网的微环境的相对湿度(rh)为100%。为了防止水冷凝并允许来自载网表面的样品水的受控蒸发,平台温度需要略高于露点温度,例如,选择温度偏移以在载网表面处产生90%rh。
(i)dp平台/载网微环境的rh和室内rh的灵敏度
计算表明,对于从露点温度的小偏移(例如,+2℃),dp平台微环境的rh线性相关于在23℃室温下室内rh范围从20%变化至90%的平台温度。(图8a)。此外,对于在23℃下室内rh范围从20%变化至90%,在平台上产生90%rh微环境所需的温度偏移变化小于0.3℃(图8b)。因此,cryowriter程序对室内的rh变化不敏感,并且系统不一定需要湿度控制的室,然而,这可能是将来的应用所期望的。
温度t下的rh,rh(t)的计算如下:
其中,e(rt)和es(t)分别是室温rt下的实际蒸气压(帕斯卡)和温度t下的最大(饱和)蒸气压,如magnus公式所述(alduchov,o.a.,eskridge,r.e.,1996.improvedmagnusformapproximationofsaturationvaporpressure.journalofappliedmeteorology35,601-609)。
与上述结论一致的是,当通过方案1沉积较大的样品体积时,通常足以确定样品沉积和使用缓冲液等分试样的抽取和插入冷冻之间所需的时间滞后,不需要通过实验监测变薄的程度。
(ii)激光透射与样品层厚度的相关性
cryowriter设备允许通过由780nm激光二极管和光电检测器组成的光学系统通过实验监测水蒸发。这是上述的一种选项,并对沉积方案2尤为重要。测量通过载网的几乎垂直的激光束的透射(参见图1和图2)。由蒸发引起的膜厚度变化会影响光电检测器记录的信号幅度(图3)。为了确认这些信号变化受干涉效应支配,针对发射不同波长(780nm和405nm)的激光二极管测量发射信号。正如从干涉理论预期的那样(图8c),两种图案在质量上相同,并且蓝色激光信号的正峰朝向更薄的水层移动(图8d)。
参考标记列表
- 还没有人留言评论。精彩留言会获得点赞!