检测Zika病毒NS1抗原的试纸条和试剂盒及方法与流程
本发明属于生物检测技术领域,具体涉及一种检测zika病毒ns1抗原的试纸条和试剂盒及方法。
背景技术:
寨卡病毒(zikavirus,zikv)是属于黄病毒科(flaviviridae)黄病毒属(flavivirus)的一类蚊媒传染性病毒,为不分片段的单股正链rna病毒。病毒颗粒直径约40-60nm,呈球状。病毒基因组全长为10749个核苷酸,含2个非编码区和1条单一的开放读码框架,编码3个非结构蛋白(c、prm、e)以及7个非结构蛋白(ns1、ns2a、ns2b、ns3、ns4a、ns4b、ns5),其中分泌型ns1蛋白作为黄病毒感染早期检测的生物学标志物而具备极大的诊断性价值。对zika病毒开放读码框架的分子生物学分析表明,寨卡病毒主要存在2个亚型:非洲型和亚洲型。
zika病毒最初是1947年科学家于乌干达寨卡森林黄热病研究检测网络中的恒河猴(动物编号766)体内发现,并以其血清接种于小鼠颅内而得以分离。1952年,乌干达和坦桑尼亚联合共和国确认了首例人源性zika病毒感染报道,截止2007年前,据文献记录全球范围内仅见14例人类感染zika病例,集中在非洲和亚洲国家。2007年,位于太平洋西部的密克罗尼西亚联邦地区(federatedstatesofmicronesia)的雅浦岛(yapisland)上发生了zika病毒的暴发流行,波及该岛上将近3/4的人口,此次暴发流行首次标志着zika病毒在亚非大陆以外地区的传播。自2013年始,国家输入性传播病例时有报道。鉴于我国和美洲地区有持续的经贸和旅游等往来,目前我国已检出输入性病例12例(包括深圳4例),其中南方省份为我国出现寨卡病毒传播的高风险省份。综上所述,zika病毒感染及其引起的寨卡病毒病业已成为我国乃至国际上一项亟需引起重视的公共卫生问题。
寨卡病毒病,也称寨卡热(zikafever),主要是感染了zika病毒的伊蚊类(其中埃及伊蚊为主要者)等蚊媒通过叮咬传播所致。有关孕母感染与新生儿出生缺陷(如小头畸形)间关联的研究发现愈加引起卫生部门对母婴传播的重视。此外,不安全性行为、血液传播等途径尚待进一步证实。感染了zika病毒的灵长类动物(含患者、隐性感染者)为可能传染源,而人群对该病毒普遍易感。zika病毒的潜伏期尚不明确,有文献指出多在3-10天,且大多感染者呈隐性感染。出现症状的寨卡病毒病患者大多病情轻微,表现为皮疹、发热、头痛、关节痛、肌痛等,多无出血倾向,病死率相较登革热、基孔肯雅热低。但少数病例可出现中枢神经系统并发症,如格林-巴利综合征(guillain-barrésyndrome,gbs)。寨卡病毒病暂无疫苗、相应抗病毒药物治疗,现以防治蚊虫叮咬、对症治疗处理措施为主。由于寨卡病毒病初期症状与登革热、基孔肯雅热等相似,因此有效的诊断措施对该病的早期处理意义重大。
世卫组织于2016年3月发布的临时指导文件中建议,对有暴露风险的疑似病例,据发病时间长短而采取核酸检测和(或)血清学检测策略,其中血清学检测方法包括酶免疫分析法(eias)和免疫荧光检测法(ifa)以检测igm抗体。而我国卫生部于2016年发布的第1版《寨卡病毒病诊疗指南》中则建议以elisa、免疫荧光法、空斑减少中和试验(prnt)、荧光定量rt-pcr、免疫组化、病毒分离培养等方法行实验室检测。然而,此上检测方法均存在费时、高昂、检测流程复杂、需配备专业试验人员器材等限制,无法满足大人群初筛时快速、简便等需求要点。因此,建立一种即时、可靠的实验室诊断zika感染的早期检测试剂势在必行。
聚集诱导发光(aggregation-inducedemission,aie)类材料具有典型的“人多力量大”(越聚集发光越强)的特性,这就解决了目前有机发光体在oled和水系以及生物荧光探针系统中应用的效率降低难题。aie材料几乎在众多发光材料领域得到应用,如作为对刺激(ph、温度、溶剂、压力等)特异性响应与可逆性传感的智能材料、可调谐折射率的液晶或偏振光材料、高效率的oled显示和照明材料、光波导材料、选择性生化传感材料、痕迹识别型材料以及在生物体系中的细胞器、病毒或细菌、血管成像材料等。其中,aie荧光探针在细胞器特异成像和长效追踪等领域的应用备受期待。目前使用的商业化荧光探针部分基于荧光蛋白或复杂的化学骨架,合成、提取和纯化成本高,价格居高不下。另外,这些探针在高精度地大量使用会出现“聚集导致荧光猝灭”(aggregation-causedquenching,acq)现象,而微量使用虽然可以遏制acq效应,却容易在多次光学扫描下出现光漂白现象(光稳定性差),导致荧光信号消失,因此很难满足细胞器或活体的体内、体外动态监测和原位成像方面的需要。
技术实现要素:
本发明的目的在于克服现有技术的上述不足,提供一种检测zika病毒ns1抗原的试纸条和试剂盒及方法,旨在解决现有zika病毒检测费时、高昂、检测流程复杂的技术问题。
为实现上述发明目的,本发明采用的技术方案如下:
本发明一方面提供检测zika病毒ns1抗原的试纸条,所述试纸条包括垫板,所述垫板上设置有第一吸水垫、检测层和第二吸水垫,所述第一吸水垫、检测层和第二吸水垫顺次搭接,且所述第一吸水垫和所述检测层之间的搭接处设置有aie标记层析垫,所述检测层上设置有检测区和质控区;其中,所述aie标记层析垫含有aie材料标记的第一抗zika病毒ns1单克隆抗体,所述检测区含有第二抗zika病毒ns1单克隆抗体。
相应地,本发明还提供一种上述试纸条的制备方法,包括如下步骤:
用aie材料标记第一抗zika病毒ns1单克隆抗体,然后喷涂在玻璃纤维膜上固定,得到所述aie标记层析垫;
将第二抗zika病毒ns1单克隆抗体喷涂在所述检测层上固定,得到所述检测区;
将所述第一吸水垫、所述aie标记层析垫、所述检测层和所述第二吸水垫粘贴在所述垫板上,得到所述试纸条。
本发明还提供检测zika病毒ns1抗原的试剂盒,包括检测板,所述检测板上设置有加样孔和观察孔,所述检测板内装有本发明的上述试纸条,且所述加样孔对齐所述第一吸水垫,所述观察孔对齐所述检测层。
最后,本发明还提供一种检测zika病毒ns1抗原的方法,包括如下步骤:
提供待测样品;
将所述待测样品加入到本发明的上述试纸条中的第一吸水垫上,静置处理;
观察所述检测层:若所述检测线区和所述质控线区均显色,则所述待测样品含有zika病毒ns1抗原,若只有所述质控线区显色,则所述待测样品不含有zika病毒ns1抗原。
本发明提供的用于检测zika病毒ns1抗原的试纸条和试剂盒利用双抗体夹心法原理检测zika病毒ns1抗原,即该试纸条或试剂盒中的第一抗zika病毒ns1单克隆抗体和aie材料标记的第二抗zika病毒ns1单克隆抗体可以与ns1抗原结合形成可显色的“单抗-ns1抗原-aie标单抗”夹心复合物,该夹心复合物可显色,因此,该试纸条和试剂盒可简便快速、结果直观地检测ns1抗原,而且具有敏感性高、特异性强、稳定性好、重复性好、无需专门设备、不受环境条件的干扰、易于在广大群众中推广等优点,非常适合医院检验科、疾病防控中心、社康中心、私人诊所等部门用于zika病毒病的临床诊断、疗效考核和流行病学调查,也适合高校和科研机构参考学习,具有很高的实用价值。
本发明提供的用于检测zika病毒ns1抗原的试纸条的制备方法简单易行,成本低,不需要大型工艺设备,且使用的aie材料具有制备成本低、用量灵活度大、背景噪声低、光稳定性高、长效追踪效果等优势,最终制得的试纸条可简便快速检测ns1抗原,而且具有敏感性高、特异性强、重复性好、结果直观、无需专门设备、不受环境条件的干扰等优点,
本发明提供的用于检测zika病毒ns1抗原的方法使用了本发明特有的试纸条,该方法为现有检测zika病毒的一步法和两步法结合,该方法敏感性高、特异性强、重复性好,非常适合批量标本的检测和疗效的考核。
附图说明
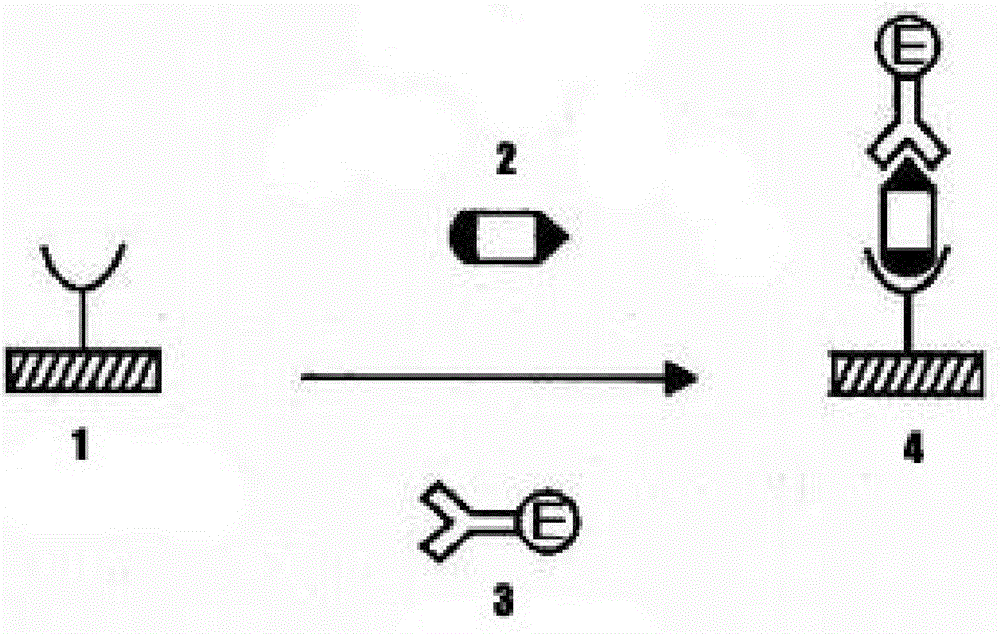
图1是本发明检测zika病毒ns1抗原的试纸条所使用的双抗体夹心法原理图:其中,1-包被好第一抗zika病毒ns1单克隆抗体的固相载体;2-ns1抗原(来源于待测样品如尿液、血清等);3-aie标记的第二抗zika病毒ns1单克隆抗体;4-“单抗-ns1抗原-aie标单抗”夹心复合物;
图2是本发明实施例1检测zika病毒ns1抗原的试剂盒中检测板的外观结构示意图:其中,5-检测板;6-加样孔;7-观察孔;
图3是本发明实施例1检测zika病毒ns1抗原的试剂盒中检测板的内部结构示意图:其中,8-第一吸水垫;9-aie标记层析垫;10-检测层;11-检测区;12-质控区;13-第二吸水垫,14-垫板;
图4是本发明实施例2检测zika病毒ns1抗原的试剂盒的阳性结果图,样品液为zika病毒病人血清;
图5是本发明实施例2检测zika病毒ns1抗原的试剂盒的阴性结果图,样品液为正常人血清。
具体实施方式
为了使本发明要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
一方面,本发明实施例提供了一种检测zika病毒ns1抗原的试纸条,如图3所示,所述试纸条包括垫板(14),所述垫板(14)上设置有第一吸水垫(8)、检测层(10)和第二吸水垫(13),所述第一吸水垫(8)、检测层(10)和第二吸水垫(13)顺次搭接,且所述第一吸水垫(8)和所述检测层(10)之间的搭接处设置有aie标记层析垫(9),所述检测层(10)上设置有检测区(11)和质控区(12);其中,所述aie标记层析垫(11)含有aie材料标记的第一抗zika病毒ns1单克隆抗体,所述检测区(12)含有第二抗zika病毒ns1单克隆抗体。
本发明提供的用于检测zika病毒ns1抗原的试纸条利用双抗体夹心法原理检测zika病毒ns1抗原,即该试纸条或试剂盒中的第一抗zika病毒ns1单克隆抗体和aie材料标记的第二抗zika病毒ns1单克隆抗体可以与ns1抗原结合形成可显色的“单抗-ns1抗原-aie标单抗”夹心复合物,该夹心复合物可显色,具体原理如图1所示:两种针对zika病毒ns1抗原上不同决定簇的抗zika病毒ns1抗原单克隆抗体,其中第一抗zika病毒单克隆抗体用于包被固相载体得到包被好第一抗zika病毒ns1单克隆抗体的固相载体(1),第二抗zika病毒单克隆抗体用aie标记得到aie标记的第二抗zika病毒ns1单克隆抗体(3),将人或鼠类的尿液、血清或全血等待测样品滴于包被好第一抗zika病毒ns1单克隆抗体的固相载体(1)中,同时加入aie标记的第二抗zika病毒ns1单克隆抗体(3),保温反应后,阳性标本形成“单抗-ns1抗原-aie标单抗”夹心复合物(4),加底物显色后形成有色产物,而阴性则无。用aie材料标记抗体,其灵敏度比直接荧光标记抗体高140倍,且能够解决荧光自淬灭问题。因此,该试纸条和试剂盒可简便快速、结果直观地检测ns1抗原,而且具有敏感性高、特异性强、稳定性好、重复性好、无需专门设备、不受环境条件的干扰、易于在广大群众中推广等优点,非常适合医院检验科、疾病防控中心、社康中心、私人诊所等部门用于zika病毒病的临床诊断、疗效考核和流行病学调查,也适合高校和科研机构参考学习,具有很高的实用价值。
进一步地,在本发明实施例的上述检测zika病毒ns1抗原的试纸条中,所述aie材料为四苯基乙烯和/或四苯基乙烯衍生物;aie材料具有制备成本低、用量灵活度大、背景噪声低、光稳定性高、长效追踪效果等优点,优选的四苯基乙烯和/或四苯基乙烯衍生物即为最常用的aie材料。更进一步地,所述检测层为硝酸纤维膜检测层;所述垫板为pvc垫板;所示aie标记层析垫为玻璃纤维膜。更进一步地,所述检测区和所述质控区的距离为0.5-1cm,该范围内可更加快速观察到检测区和质控区的显色反应。具体优选实施例中,检测区和质控区可以是线形状,即为检测线(t)和质控线(c)。更进一步地,第一吸水垫为样品端,第二吸水垫为末端,第一吸水垫和第二吸水垫均由多层滤纸制成。更进一步地,所述质控区含有羊抗鼠igg或羊抗鼠igm。
另一方面,本发明实施例提供了一种上述检测zika病毒ns1抗原的试纸条的制备方法,包括如下步骤:
s01:用aie材料标记第一抗zika病毒ns1单克隆抗体,然后喷涂在玻璃纤维膜上固定,得到所述aie标记层析垫;
s02:将第二抗zika病毒ns1单克隆抗体喷涂在所述检测层上固定,得到所述检测区;
s03:将所述第一吸水垫、所述aie标记层析垫、所述检测层和所述第二吸水垫粘贴在所述垫板上,得到所述试纸条。
本发明实施例提供的用于检测zika病毒ns1抗原的试纸条的制备方法简单易行,成本低,不需要大型工艺设备,且使用的aie材料具有制备成本低、用量灵活度大、背景噪声低、光稳定性高、长效追踪效果等优势,最终制得的试纸条可简便快速检测ns1抗原,而且具有敏感性高、特异性强、重复性好、结果直观、无需专门设备、不受环境条件的干扰等优点,
进一步地,所述用aie材料标记第一抗zika病毒ns1单克隆抗体的步骤包括:将所述aie材料和所述第一抗zika病毒ns1单克隆抗体混合后,加入胎牛血清,静置后离心处理,再用含胎牛血清和nan3的tris-hcl缓冲液溶解沉淀。更进一步地,所述离心处理的步骤包括:先以离心速度为1200-1800r/min进行第一次离心,弃去凝聚物,再以离心速度为6000-14000r/min进行第二次离心,弃去上清液。在一具体实施例中,aie材料和第一抗zika病毒ns1单克隆抗体分别以0.1mol/lk2co3调ph至7.4,在aie材料溶液中按20-80μg/ml加入第一抗zika病毒ns1单克隆抗体,电磁搅拌30min后加入5%胎牛血清(bsa),使溶液中bsa终浓度为1%,以防止抗体蛋白与aie材料聚合发生沉淀,静置后先1200-1800r/min低速离心20min,弃去凝聚的沉淀,接着6000-14000g4℃离心1h,吸出上清,将沉淀用含1%bsa和0.02%nan3的tris-hcl缓冲液重悬为原体积的1/10,4℃保存。
更进一步地,喷涂在玻璃纤维膜上的所述第一抗zika病毒ns1单克隆抗体的浓度为0.2-0.8mg/ml;具体喷涂过程为:用二维喷动仪将该浓度的aie材料标记好的第一抗zika病毒ns1单克隆抗体均匀地喷在玻璃纤维膜上,喷液量为0.8~2.0μl/cm,37℃烘干过夜,封袋备用。喷涂在检测层上的所述第二抗zika病毒ns1单克隆抗体的浓度为0.8-1.5mg/ml,具体喷涂过程为:调试二维喷动仪,将浓度为0.8~1.5mg/ml的第二抗zika病毒ns1单克隆抗体用1~3%的甲醛固定后,均匀地喷在硝酸纤维膜中段,得到检测线。进一步地,可用1~3%的甲醛固定浓度为2~2.5mg/ml的羊抗鼠igg或igm后,均匀地喷在硝酸纤维膜上,距离检测线0.5~1cm处得到质控线,喷液量均为0.8~2.0μl/cm,37℃烘干过夜,封袋备用。
再一方面,本发明实施例还提供了一种检测zika病毒ns1抗原的试剂盒,包括检测板,所述检测板上设置有加样孔和观察孔,所述检测板内装有本发明实施例的上述试纸条,且所述加样孔对齐所述第一吸水垫,所述观察孔对齐所述检测层。
本发明实施例的试剂盒工作原理为:当待测样品滴加在第一吸水垫上时,样品液体即向质控区处不断扩散,当液体到达aie标记层析垫处时,aie材料标记的第一抗zika病毒ns1单克隆抗体被溶解,同时与样品中的ns1抗原反应而形成初始复合物,液体继续前移至检测区处,该复合物再与检测区的第二抗zika病毒ns1单克隆抗体结合形成“单抗-ns1抗原-aie标单抗”夹心复合物而呈现蓝色荧光线条,多余的初始复合物继续前移至质控区处与羊抗鼠igg或igm结合而呈现蓝色荧光线条,最后残余的液体被第二吸水垫吸收。该试剂盒的有益效果与上述试纸条相同,不再阐述。
最后,本发明实施例还提供一种检测zika病毒ns1抗原的方法,包括如下步骤:
t01:提供待测样品;
t02:将所述待测样品加入到本发明实施例的上述试纸条中的第一吸水垫上,静置处理;
t03:观察所述检测层:若所述检测线区和所述质控线区均显色,则所述待测样品含有zika病毒ns1抗原,若只有所述质控线区显色,则所述待测样品不含有zika病毒ns1抗原。
本发明实施例提供的用于检测zika病毒ns1抗原的方法使用了本发明特有的试纸条,该方法为现有检测zika病毒的一步法和两步法结合,该方法敏感性高、特异性强、重复性好,非常适合批量标本的检测和疗效的考核。
进一步地,所述静置处理的时间为5-15min。即可以在该时间范围内,快速判断待测样品中是否含有zika病毒ns1抗原。
本发明先后进行过多次试验,现举一部分试验结果作为参考对发明进行进一步详细描述,下面结合具体实施例进行详细说明。
实施例1
检测zika病毒ns1抗原的试剂盒及其制备方法
参照图2和图3,检测zika病毒ns1抗原的试剂盒内设检测板(5),检测板(5)上设置有加样孔(6)和观察孔(7);检测板(5)内装有试纸条,所述试纸条包括垫板(14),所述垫板(14)上设置有第一吸水垫(8)、检测层(10)和第二吸水垫(13),所述第一吸水垫(8)、检测层(10)和第二吸水垫(13)顺次搭接,且所述第一吸水垫(8)和所述检测层(10)之间的搭接处设置有aie标记层析垫(9),所述检测层(10)上设置有检测区(11)和质控区(12);其中,所述aie标记层析垫(11)含有四苯基乙烯标记的第一抗zika病毒ns1单克隆抗体,所述检测区(12)含有第二抗zika病毒ns1单克隆抗体。垫板(14)为pvc垫板,检测层(10)为硝酸纤维膜检测层,检测区(11)和质控区(12)可以是线形状,即为检测线和质控线。
该检测zika病毒ns1抗原的试剂盒的制备方法主要包括如下步骤:
a、抗zika病毒ns1单克隆抗体:
第一抗zika病毒ns1单克隆抗体:鼠抗zika病毒ns1单克隆抗体a(ab218546);第二抗zika病毒ns1单克隆抗体:鼠抗zika病毒ns1单克隆抗体b(ab218547)均购置于英国的剑桥科学园abcam公司。
b、aie材料的制备:
aie材料四苯基乙烯的制备,在带有回流装置的两口圆底烧瓶中加入二苯甲酮锌粉,并抽真空充换氮气三次。向反应体系中加入重蒸四氢呋喃后,冷却至-78度。在该条件下缓慢加入四氯化钛,滴加完毕反应体系缓慢回到室温后,加热回流12小时。将反应液冷却后经滤纸过滤,并用乙醚洗涤。旋转蒸发除去溶剂后,将固体到入1m的稀盐酸溶液,用二氯甲烷箤取三次。有机相合并后用饱和食盐水和去离子水洗涤多次,再用无水硫酸镁干燥后过滤,用二氯甲烷和石油醚进行重结晶,得到目标aie材料:四苯基乙烯。
c、四苯基乙烯标记抗体的制备:
将四苯基乙烯发光材料和第一抗zika病毒ns1单克隆抗体分别以0.1mol/lk2co3调ph至7.4,在四苯基乙烯发光材料溶液中按20~80μg/ml加入抗zika病毒单克隆抗体,电磁搅拌30min后加入5%胎牛血清(bsa),使溶液中bsa终浓度为1%,以防止抗体蛋白与四苯基乙烯发光材料聚合发生沉淀,静置后先1200~1800r/min低速离心20min,弃去凝聚的沉淀,接着6000~14000g4℃离心1h,吸出上清,将沉淀用含1%bsa和0.02%nan3的tris-hcl缓冲液重悬为原体积的1/10,4℃保存;该标记抗体其灵敏度比直接荧光标记抗体高140倍,且能够解决荧光自淬灭问题。
d、四苯基乙烯标记层析垫的制备:
用二维喷动仪将标记好四苯基乙烯发光材料的第一抗zika病毒ns1单克隆抗体均匀地喷在玻璃纤维膜上,喷液量为0.8~2.0μl/cm,37℃烘干过夜,封袋备用;
e、硝酸纤维膜检测层中检测线和质控线的制备:
调试二维喷动仪,将浓度为0.8~1.5mg/ml的第二抗zika病毒ns1单克隆抗体用1~3%的甲醛固定后,均匀地喷在硝酸纤维膜中段,得到检测线;用1~3%的甲醛固定浓度为2~2.5mg/ml的羊抗鼠igg或igm后,均匀地喷在硝酸纤维膜上,距离检测线0.5~1cm处得到质控线,喷液量均为0.8~2.0μl/cm,37℃烘干过夜,封袋备用。
f、组装与包装:
将第一吸水垫、aie标记层析垫、检测层、第二吸水垫粘贴在pvc垫板上,用切条机将试纸裁剪成6~8cm长、3~5mm宽规格试纸条,将试纸条装入检测板内,加样孔正对第一吸水垫,观察孔正对检测层。将试纸条与干燥剂封装在铝箔袋内,4~30℃避光保存,切勿冻存。铝箔袋打开后应尽快使用试纸条,受潮后试纸条将失效。
实施例2
检测zika病毒ns1抗原的试剂盒的使用
取出实施例1制备的检测zika病毒ns1抗原的试剂盒,平放于操作台上,在加样孔内加入2滴(约100μl)人或鼠类的尿液、血清等待测样品,5-15min可判定结果。结果判断:在观察孔内,检测线(t)及质控线(c)在紫外继发光下(波长430-500nm)均发出蓝色荧光,判为阳性(见图4),ns1抗原的浓度越高,检测线(t)颜色越深;而在观察孔内,只有质控线(c)出现一条蓝色荧光时,则判为阴性(见图5);当观察孔内结果质控线(c)和检测线(t)都不出现蓝色荧光或仅检测线(t)出现蓝色荧光时,则为试剂盒失效。
实施例3
检测zika病毒ns1抗原的试剂盒的敏感性、特异性和稳定性检测
敏感性和特异性试验:选用24份实验感染zika病毒模型动物ag6小鼠血清、24份正常模型动物ag6小鼠血清、24份zika病毒vero细胞培养上清、24份正常vero细胞培养上清,12份zika病毒病病人血清和尿液,20份正常人血清、2份zika病毒ns1抗原稀释液;24份登革热和乙型脑炎病毒c6/36细胞培养上清、24份登革热病人血清、乙型脑炎病毒病人血清、采用实施例1制备的检测zika病毒ns1抗原的试剂盒进行检测,结果除了48份实验感染zika病毒病毒模型动物ag6小鼠血清、12份zika病毒病病人血清、2份zika病毒ns1抗原稀释液在检测线(t)及质控线(c)均出现蓝色荧光而显阳性外,其余对照和病人血清均只在质控线(c)出现一条蓝色荧光而显阴性。至此为止,此检测zika病毒ns1抗原的试剂盒的敏感性和特异性均为100%。
稳定性试验:将实施例1制备的检测zika病毒ns1抗原的试剂盒分别放置于4℃和室温(20~25℃)4周,取出后分别用zika病毒病病人血清进行检测,测试的结果的敏感性和特异性未发生变化。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!