一种检测及定性大鼠血清中的差异金属蛋白质的方法与流程
本发明属于生物检测领域,更具体地、涉及一种检测及定性高脂血症大鼠血清中的差异金属蛋白质的方法。
背景技术:
蛋白质是生物体的基本组成物质,也是生物体各种功能的执行者。研究表明,人体内有三分之一的蛋白与金属元素结合成金属蛋白。而金属离子常常作为活性中心或协同因子完成蛋白质的多种反应。金属蛋白组学主要有三种研究方法。首先是广泛使用的质谱分析技术,特别是电喷雾电离质谱(esi-ms)和电感耦合等离子体质谱(icp-ms)。这两种技术特别适用金属蛋白综合结构和功能特征的分析。第二种方法是高通量x射线吸收光谱法(ht-xas),以提供对组织和细胞中蛋白质和蛋白质金属分布的直接金属分析。第三种方法是通过计算生物信息学分析。随着基因组测序的进行,已经建立了蛋白质一级结构的大型数据库。目前,还开发了鉴定基因组序列中的金属蛋白的具体工具。将氨基酸序列代入已知金属结合区域中已知的同源序列,可以预测金属结合特性。该方法已被用于预测蛋白质中的锌、铜和其它痕量金属。
目前可用于人体微量元素检测的方法有原子吸收光谱法(aas)、电感耦合等离子体原子吸收光谱法(icp-aes)、同位素稀释质谱法(id-ms)、电感耦合等离子体质谱法(icp-ms)、x射线荧光分析法(xrf)、中子火花分析法(inaa)、电化学分析法、分子光谱法、生化法等,其中icp-aes和aas法是应用最广泛的两个方法,尤其是石墨炉原子吸收光谱法(gf-aas),但是icp-aes法分析生物样品集体效应难以解决,而且有些元素不能测量,如as、hg、pb、cd等,需要再利用gf-aas技术进行测定。另外,icp-aes法存在对样品需求量大的问题;gf-aas不适宜使用有机溶剂,分析速度慢,且基体干扰很严重,测定不同元素时必须采用不同的基体改进剂。其复杂的操作步骤、较低的工作效率限制了它的广泛应用,更重要的是,在分析hg、tl、u、b等元素时,gf-aas的检测限不能满足体液等生物样品的分析要求。icp-ms技术提供了最低的检出限和最宽的线性范围,而且干扰少、分析速度快、精密度高、可多元素同时测定以及可提供精确的同位素信息等优点。
六十年代开始,质谱广泛地应用与有机化学中分子量和结构的测定,传统的质谱方法能够很好地测定一些分子量较小的化合物,但是在测量生物样品时,由于其极性大、难挥发、不易气化、热不稳定等特点,传统质谱存在局限性。80年代末期,出现了两种新型质谱软电离技术电子喷雾离子化(electrosprayionization,esi)和基质辅助激光解吸离子化(matrix-assistedlaserdesorption/ionization,maldi),成为生物样品分析中最重要和最有发展前景的技术之一。
因此,目前亟待一种用于复杂样品中差异金属蛋白检测和定性的方法。
技术实现要素:
本发明所解决的技术问题是克服现有技术的缺陷,提供一种用于检测及定性大鼠血清中的差异金属蛋白质的方法。该方法原理简单、易行。经实验,检测出两种因患高脂血症而带有金属铬的蛋白质谷胱甘肽过氧化物酶(gpx-3)和载脂蛋白ai(apoai)。为进一步阐明血脂的代谢机制和高脂血症的治疗提供基础和新思路。
本发明通过如下方法实现的:
本发明通过2d-icp-ms联合maldi-tof-ms的方法,检测及定性高脂血症大鼠血清中差异金属蛋白质。
本发明所述的方法,包括如下步骤:
(1)二维电泳法分离血清蛋白质;
(2)icp-ms检测金属蛋白;
(3)maldi-tof-ms鉴定金属蛋白。
具体地,
步骤(1)包括高丰度蛋白的去除、蛋白的定量、一向等电聚焦电泳、二维sds-page、银染。
所述的高丰度蛋白的去除包括如下步骤:
a、去除低丰度蛋白试剂盒中柱子下面的盖子,离心,弃去上清液;
b、柱子中加入洗脱液,放置柱子,离心,弃去上清液;
c、将样品加入柱子中,室温旋转,离心,去除上清液,再离心;
d、加洗脱液于柱子中,旋转,离心,去除上清液,重复该步骤2-3次;
e、加超纯水于柱子中,旋转,离心,去除上清液;
f、加入再水化洗脱液,涡旋,把柱子放入干净的收集管中,离心,该步骤重复2-3次,合并两次的离心得到的溶液。
步骤b所述的洗脱液与步骤f所述的再水化洗脱液为试剂盒中配套试剂
步骤a-f中离心时间为:30-60sec转速为:4000rpm
步骤f中涡旋时间为t≥15min
所述的蛋白的定量采用bradford法测定蛋白质浓度。
所述的一向等电聚焦电泳是将蛋白样品与水化上样缓冲液、4.5mg1%dtt、0.5%~1%两性电解质混合均匀,连续、线性地加入到聚焦盘中。保持20℃。
所述的二维sds-page的步骤是:取出ipg胶条,分别放入平衡缓冲液a和缓冲液母液b中作用10-15分钟。垂直向sds-page使用12%(质量分数)的凝胶。
所述的平衡缓冲液a为:尿素6m、甘油20%、sds2%、ph8.8的tris-hcl0.375m;
所述的缓冲液母液b为:0.4g碘乙酰胺溶于10ml超纯水。
所述的银染方法如下:用固定液振摇,然后用超纯水清洗2-3次,每次振摇10-15min。使用0.02%na2s2o3水溶液敏化3-5min,超纯水清洗2-3次,每次20-30s。用0.1%的agno3避光振摇30min以上,用超纯水稍作清洗。用显色液显色至蛋白斑点清晰可见。最后用终止液(1.46%edta·na2)振摇约1-2min。多次水洗待用。
所述的固定液配方为:45%甲醇、5%乙酸、50%超纯水;
所述的显色液的配制方法为:取1gnaco3,精密称量,再取32μl甲醛,一起溶解至50ml超纯水中。
步骤(2)中icp-ms检测金属蛋白的步骤如下;
切割蛋白点,精密称定,蛋白点面积较小的点,切取空白部分的胶补齐,使所有抠取的蛋白点的质量保持一致。同时切取一份不含蛋白点的空白凝胶。将称取的凝胶放置在消解罐中,加入1ml硝酸,在电加热板上以160-170℃加热溶解完全,冷却到室温,移至lep管中,加水稀释至1.5ml,混匀。测定fe、cu、zn、se、cr。采用四级杆电感耦合等离子体质谱进行样品测定。
步骤(3)中maldi-tof-ms鉴定金属蛋白的步骤如下:
a、胶粒脱色
脱色液的配制:100mm的na2s2o3和30mm的k3(fe(cn)6)按1:1的比例混合均匀即得。脱色液呈黄色。将胶粒放置于适量脱色液中20-30min后,用超纯水清洗至无色。
b、胶内酶解
将脱色的胶粒冻干,加入0.01mg/ml的胰蛋白酶溶液(含50mmnh4hco3,5mmcacl2),在4℃下放置45min,令胶块充分膨胀。然后于37℃水浴酶解15-16h,用5%的tfa水溶液提取酶解肽段,提取液至于-80℃冰箱内备用。
c、ziptipc18微柱脱盐
先用乙腈洗柱一次,再用50%乙腈/0.1%tfa洗柱一次,最后用0.1%的tfa洗柱多次,平衡ziptipc18柱。用移液枪吸取样品,并反复吹打30次,使肽段混合物充分吸附在柱子上。吸取chca溶液3μl(配制方法:0.3%的氰-4-羟基苯丙烯酸,用70%乙腈/0.1%tfa稀释),在离心管中反复吸打5次式样品和基质充分混合。点在maldi的靶上,自然晾干结晶。
本发明的方法原理简单、易行。经实验,检测出两种因患高脂血症而带有金属铬的蛋白质gpx-3和apoai。为进一步阐明血脂的代谢机制和高脂血症的治疗提供基础和新思路。
附图说明
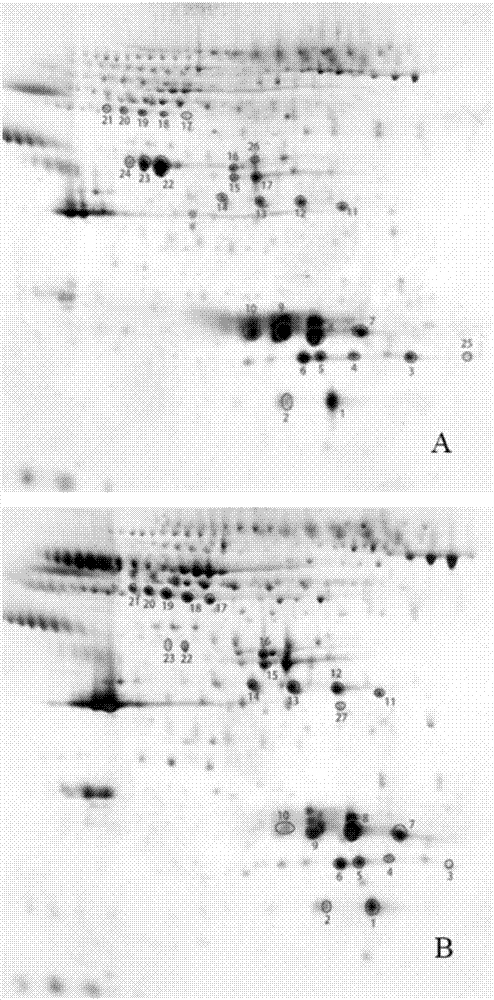
图1为高脂血症组与对照组双向电泳结果。
a高脂血症组b对照组。
图2为蛋白质斑点的pmf图。
a蛋白点4(gpx3-rat)b蛋白点9(apoai-rat)。
具体实施方式
实施例1:
1.1实验方法
1.1.1高脂血症大鼠模型建立及血清样本的采集
高脂血症大鼠模型建立,造模成功后,大鼠通过眼眶静脉丛采血方式,每次每只采血500μl。12000r/min离心5min,取上清液,置于-80℃冰箱中备用。
1.1.2二维电泳法分离血清蛋白质
1.1.2.1去除血清中的高丰度蛋白
①去除低丰度蛋白试剂盒中柱子下面的盖子,离心30-60sec,弃去上清液。
②柱子中加入600μl洗脱液(washbuffer),旋转柱子5min,离心30-60sec,除去上清液,重复该步骤两次。
③将1ml样品加入柱子中,室温旋转2h,离心30-60sec,去除上清液,再离心一次。
④加600μl洗脱液(washbuffer)于柱子中,旋转5min,离心30-60sec,去除上清液,重复该步骤3次。
⑤加600μl超纯水于柱子中,旋转1min,离心30-60sec,去除上清液。
○6加入100μl再水化洗脱液(rehydratedelutionreagent),涡旋至少15min,把柱子放入干净的收集管中,离心30-60sec,该步骤重复2次,合并两次的离心得到的溶液。
1.1.2.2蛋白定量
采用bradford法测定蛋白质浓度。先取少量浓缩后的样本用水进行适当稀释,使其终浓度落在标准曲线范围内。稀释好的样本和标准品(将bsa用水稀释成系列浓度的标准蛋白)各取20μl分别与200μl蛋白定量染料混合,室温反应5min,用酶标仪同时测定标准品和样本在595nm下的吸光值,数据如表1所示。根据标准品每管吸光值和浓度的关系绘制标准曲线,y=1.7165x+0.2590,线性关系r为0.9977,线性关系良好。根据标准曲线公式计算各样品的蛋白浓度约为7μg/μl。
考马斯亮蓝(cbb)测定蛋白质含量是一种染料结合法。游离状态下的考马斯亮蓝呈现红色,最大吸收波长是488nm,但是当它与蛋白质结合后即变为青色,蛋白质-色素结合物的最大吸收波长是595nm。吸光度与蛋白质的含量成正比关系,所以可以用作蛋白质的定量测定。该法试剂配制简单,操作简便快捷,灵敏度高,比lowry法高4倍,可以用作测定微克级的蛋白定量。
表1标准品吸光值检测表
1.1.2.3一向等电聚焦电泳
将蛋白样品与水化上样缓冲液、4.5mg1%dtt、0.5%~1%两性电解质混合均匀,连续、线性地加入到聚焦盘中。去除ipg预制胶条(24cm)的保护膜,放入聚焦盘,注意正反(胶面与样品完全接触)和正负极(正极对正极,负极对负极)。并应保持20℃,温度过低尿素会结晶,并且温度不稳定会造成胶上蛋白质点位置的变化。在胶条背面均匀、连续地覆盖矿物油。设置等电聚焦程序如表2所示。聚焦结束直接进行第二项电泳前的平衡。
表2一维等电聚焦程序
1.1.2.4二维sds-page
取出ipg胶条,分别放入平衡缓冲液a(尿素6m、甘油20%、sds2%、ph8.8的tris-hcl0.375m)和缓冲液母液b(0.4g碘乙酰胺溶于10ml超纯水)中作用15分钟。垂直向sds-page使用12%(质量分数)的凝胶。先以每块胶10ma、45min,然后每块胶24ma,电泳约5h。
1.1.2.5银染
用固定液(配方:45%甲醇、5%乙酸、50%超纯水)振摇至少30min,然后用超纯水清洗3次,每次振摇10min。使用0.02%na2s2o3水溶液敏化3min,超纯水清洗3次,每次20s。用0.1%的agno3避光振摇30min以上,用超纯水稍作清洗。用显色液(配制方法:取1gnaco3,精密称量,再取32μl甲醛,一起溶解至50ml超纯水中。)显色至蛋白斑点清晰可见。最后用终止液(1.46%edta·na2)振摇约1min。多次水洗待用。
1.1.3利用icp-ms检测金属蛋白
1.1.3.1胶条的前处理
切割蛋白点,精密称定,蛋白点面积较小的点,切取空白部分的胶补齐,使所有抠取的蛋白点的质量保持一致。同时切取一份不含蛋白点的空白凝胶。将称取的凝胶放置在消解罐中,加入1ml硝酸,在电加热板上以160℃加热溶解完全,冷却到室温,移至2mlep管中,加水稀释至1.5ml,混匀。在优化的仪器工作参数下,测定fe、cu、zn、se、cr。与空白比较,检测是否含有金属。
1.1.3.2icp-ms仪器参数
采用四级杆电感耦合等离子体质谱进行样品测定。质谱测定样品前需进行手动调协,采用含1ng/ml的li、y、ce、tl、co混合标准溶液校准低质量数、中质量数和高质量数的质量峰位。并优化仪器的各项参数,使仪器的灵敏度、背景、氧化物、双电荷、分辨率等指标满足分析要求。优化后的参数见表3。
表3icp-ms仪器工作参数
1.1.4利用maldi-tof-ms鉴定金属蛋白
1.1.4.1胶粒脱色
脱色液的配制:100mm的na2s2o3和30mm的k3(fe(cn)6)按1:1的比例混合均匀即得。脱色液呈黄色。将胶粒放置于适量脱色液中20-30min后,用超纯水清洗至无色。
1.1.4.2胶内酶解
将脱色的胶粒冻干,加入0.01mg/ml的胰蛋白酶溶液(含50mmnh4hco3,5mmcacl2),在4℃下放置45min,令胶块充分膨胀。然后于37℃水浴酶解16h,用5%的tfa水溶液提取酶解肽段,提取液至于-80℃冰箱内备用。
1.1.4.3ziptipc18微柱脱盐
先用乙腈洗柱一次,再用50%乙腈/0.1%tfa洗柱一次,最后用0.1%的tfa洗柱多次,平衡ziptipc18柱。用移液枪吸取样品,并反复吹打30次,使肽段混合物充分吸附在柱子上。吸取chca溶液3μl(配制方法:0.3%的氰-4-羟基苯丙烯酸,用70%乙腈/0.1%tfa稀释),在离心管中反复吸打5次式样品和基质充分混合。点在maldi的靶上,自然晾干结晶。
1.1.4.4maldi-tof-ms质谱参数
质谱参数如表4所示。
表4maldi-tof-ms运行参数
1.2方法学验证
1.2.1线性关系
为消除基体效应,标准曲线溶液的配制,先切取5份来自相同电泳凝胶的不含蛋白点的空白凝胶,后分别加入相应浓度的fe标准溶液,置于消解罐中用硝酸消解至完全溶解。将溶液转移至ep管中,用超纯水稀释至1.5ml,用icp-ms测定样品。测定结果如表3-5所示。以铁的浓度为横坐标,icp-ms计数值为纵坐标,制成标准曲线,y=2.5×105x+1.6×106,线性相关系数r为0.9990,线性关系良好。
表5标准曲线测定结果
1.2.2含量测定
配制3种浓度的已知铁含量的转铁蛋白,用“1.2.2”项下方法进行二维电泳后,切取蛋白点置于消解罐中用硝酸消解至完全溶解。用icp-ms测量铁的计数值,代入标准曲线算出结果,并与天平称量的结果比较,见如下表6。可见通过称量的蛋白质质量与经过ge-icp-ms处理测得的蛋白质质量差别不大。说明该方法较准确、可行,可以用于大鼠血清中金属蛋白质的检测。
表6ge-icp-ms法定量转铁蛋白结果与天平秤量结果含量比较
1.3实验结果
1.3.1二维电泳结果
结果如图1所示。高脂血症组中找出了26个分离度良好,且含量较高的蛋白点。对照组中找出了25个分离度良好,含量较高的蛋白斑点。其中,点24、25为高脂血症组特有蛋白点,点27为对照组特有蛋白点。
1.3.2icp-ms检测结果
结果如表7所示,对照组中蛋白点1、2含有cr,蛋白点3、13、19含有fe;高脂血症组中,蛋白点4、9、20、21含有cr,蛋白点15、21含有fe,蛋白点18含有cu。经过二维电泳处理大部分蛋白质中的金属仍被会保留。结果中显示,并没有含硒蛋白的存在,可能是由于硒蛋白的含量太低不能通过这种方法被检测]。
表7图1中标记的蛋白质斑点中发现的差异元素
1.3.3maldi-tof-ms鉴定金属蛋白结果
采用maldi-tof-ms尝试定性上述带金属的蛋白点,获得的pmf图谱用mascotdistiller软件与其中的蛋白质数据库对比匹配。数据库为ncbi蛋白质数据库,搜索的肽片段质量范围为800~4000da。结果检测出其中2个蛋白点。结果如表8所示。图2为相应蛋白质点的pmf图,x轴为质荷比(m/z),y轴为相对强度,峰旁边标示的数字代表肽段的同位素峰[m+h]+的质量数。
表8蛋白点鉴定结果
- 还没有人留言评论。精彩留言会获得点赞!