一种生理环境下细胞密度测算方法与流程
本发明涉及细胞量化分析领域,尤其涉及一种生理环境下细胞密度测算方法。
背景技术:
现有技术中,细胞量化分析主要是以下几种方法:
1、悬浮微通道谐振(suspendedmicrochannelresonator,smr)是将微流体通道集成到微悬臂谐振器内部,当细胞经过微流体通道,其质量会改变悬臂的振动频率,通过测量悬臂振动频率变化可获得单个细胞的质量。称重细胞的方式有两种,一种是使用压电晶体的强烈激励以大幅度振荡smr,使smr内的颗粒产生明显的离心力。当离心力克服粘滞阻力时,颗粒可以被捕获在smr的u形转弯附近;另一种是减小驱动振幅来减小惯性力,在粒子连续流过smr时称重。
2、空间光干涉显微技术(spatiallightinterferencemicroscopy,slim)是一种高灵敏度的定量相位成像技术,结合了zernike的相差显微技术和gabor的全息技术,可快速地产生无斑点高精度的定量相位图像,再利用活细胞积累的光学相移与细胞的干质量成线性比例关系,可准确地测量细胞的干质量。
3、基座共振传感(pedestalresonantsensor,prs)的测量原理与smr类似,是通过估计传感器在空载和载荷时的谐振频率偏移来测量细胞的质量。不同的是,基座共振传感器采用由四个弹簧悬挂的矩形平台组成的结构,大大缓解了smr这类基于悬臂结构而导致的质量灵敏度不均匀的问题,但同时由于振动基座在流体中的阻尼较高,导致了传感器的灵敏度远低于悬浮微通道谐振方法。
4、基于光诱导介电泳方法(opticallyinducedelectrokinetics,oek)是在光诱导介电泳平台上通过测算细胞在液体中的动力学特性估算细胞的质量。
但上述方法存在如下不足之处:
悬浮微通道谐振:由于制造工艺复杂且细胞必须被捕获并通过谐振器,该项技术不太适用于需要同时测量多个细胞质量的情况。
空间光干涉显微技术:该方法对细胞的干质量直接测量,受限于其复杂的映射过程,不能对细胞在正常生理环境下的质量进行测量。
基座共振传感方法:制造工艺复杂,不能同时测量多个细胞质量,测量效率较低。
基于光诱导介电泳方法:由于光诱导介电泳对液体电介质的电导率和介电常数要求较敏感,而细胞生理环境下的培养液的电导率和介电常数不能满足光诱导介电泳的要求,因此,基于光诱导介电泳方法无法实现生理环境下活体单细胞的质量和密度测算。
因此,现有技术还有待于改进和发展。
技术实现要素:
鉴于上述现有技术的不足,本发明的目的在于提供一种生理环境下细胞密度测算方法,旨在解决现有细胞量化分析方法成本高、操作复杂、不能在正常生理环境下对细胞进行密度测算的问题。
本发明的技术方案如下:
一种生理环境下细胞密度测算方法,其中,包括步骤:
将微流控芯片放置到全息光镊系统的显微镜载物台上,并将含有待测细胞的培养液注入到所述微流控芯片中;
调制所述全息光镊系统的入射光线,使所述激光通过显微物镜在所述微流控芯片上聚焦并形成光阱;
通过对所述光阱的激光聚焦在x-y平面上进行微操纵,控制待测细胞的旋转,获取所述待测细胞的半径,计算出所述待测细胞的体积;
通过调整光阱在竖直的z方向的位置,实现对细胞在竖直方向上的控制,将待测细胞从微流控芯片的流体下层推到上层;
关掉激光源,去掉所述光阱,细胞由于重力的原因而下沉,根据所述待测细胞在所述培养液中的下沉速度以及所述体积,测算出所述待测细胞的密度。
所述的生理环境下细胞密度测算方法,其中,所述步骤调制所述全息光镊系统的入射光线,使所述激光通过显微物镜在所述微流控芯片上形成光阱具体包括:
调制所述入射光线的相位,并通过透镜聚焦使所述激光在所述微流控芯片上形成光阱。
所述的生理环境下细胞密度测算方法,其中,所述步骤通过对所述光阱进行微操纵,控制待测细胞的旋转,获取所述待测细胞的半径,计算出所述待测细胞的体积,具体包括:
通过在水平方向移动所述光阱对所述待测细胞进行捕获;
操纵所述光阱,使捕获到的待测细胞旋转并结合显微视觉,获取所述待测细胞的半径,计算出所述待测细胞的体积。
所述的生理环境下细胞密度测算方法,其中,所述待测细胞的半径为空间三个轴向的半径。
所述的生理环境下细胞密度测算方法,其中,所述光阱包括单个点光阱或由多个点光阱形成的阵列。
所述的生理环境下细胞密度测算方法,其中,去掉光阱后,所述待测细胞在细胞培养液中下沉的受力用如下公式描述:
其中,fgravity表示细胞所受到的重力,fbouyancy表示细胞受到的浮力,fviscosity表示细胞受到的粘滞阻力。
所述的生理环境下细胞密度测算方法,其中,所述待测细胞密度测算公式如下:
有益效果:本发明的生理环境下细胞密度的测算方法,采用全息光镊技术操控细胞,微流控系统保证液体电介质的电导率和介电常数适合细胞生理环境下的培养液的电导率和介电常数的要求,实现了生理环境下活体单细胞的质量和密度测算。通过全息光镊技术操控细胞旋转,利用显微视觉方法获取细胞的三个轴向的半径,实现细胞体积估算,因此对细胞受到的粘滞阻力的测算更精确,提高了细胞密度测算的精度。
附图说明
图1为本发明一种生理环境下细胞密度测算方法较佳实施例的流程图。
图2为本发明中的全息光镊的微流控平台的结构示意图。
图3为本发明中通过调整光阱在的z方向的位置,待测细胞在微管道中的移动示意图。
具体实施方式
本发明提供一种生理环境下细胞密度测算方法,为使本发明的目的、技术方案及效果更加清楚、明确,以下对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
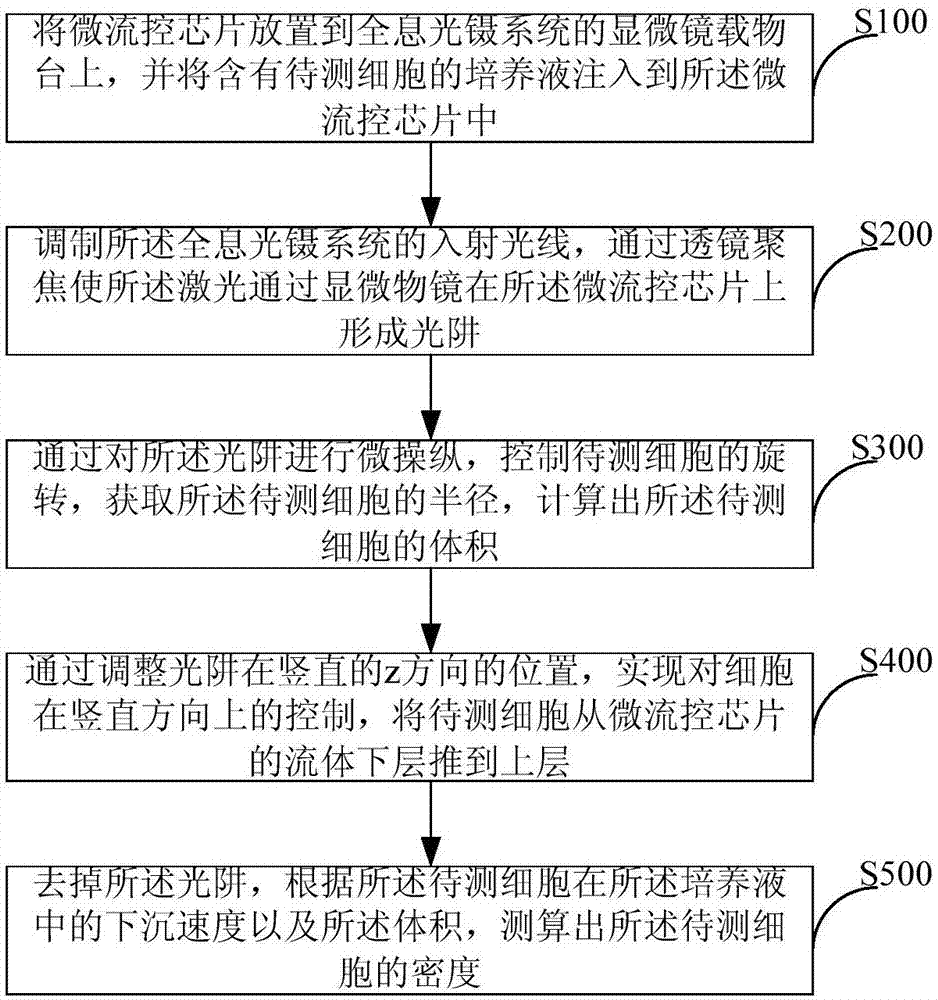
请参阅图1,图1为本发明一种生理环境下细胞密度测算方法较佳实施例的流程图,如图所示,其包括步骤:
s100、将微流控芯片放置到全息光镊系统的显微镜载物台上,并将含有待测细胞的培养液注入到所述微流控芯片中;
s200、调制所述全息光镊系统的入射光线,通过透镜聚焦使所述激光通过显微物镜在所述微流控芯片上形成光阱;
具体而言,调制所述入射光线的相位,使所述光线通过显微物镜在所述微流控芯片上形成光阱,所述入射光线为激光。通过调整入射光相位,不仅可以产生任意排列分布的点光阱大阵列来同时捕获多个微粒,而且可通过计算机编程独立控制其中的每一个光阱,实现复杂的动态操纵。
s300、通过对所述光斑进行微操纵,控制待测细胞的旋转,获取所述待测细胞的半径,计算出所述待测细胞的体积;
具体而言,通过对所述光阱在x-y平面上进行微操纵,对所述待测细胞进行捕获;操纵所述光阱,使捕获到的待测细胞旋转并结合显微视觉,获取所述待测细胞的半径,计算出所述待测细胞的体积。
s400、通过调整光阱在竖直的z方向的位置,实现对细胞在竖直方向上的控制,将待测细胞从微流控芯片的流体下层推到上层;
具体而言,如图3所示,通过调整激光焦点在竖直的z方向的位置,实现对细胞在竖直方向上的控制:将激光焦点向上移动,控制待测细胞由微流控芯片的底层上升到培养液的上层;
s500、去掉所述光阱,根据所述待测细胞在所述培养液中的下沉速度以及所述体积,测算出所述待测细胞的密度。
具体而言,关掉激光源,去掉所述光阱,细胞由于重力的原因而下沉,根据所述待测细胞在所述培养液中的下沉速度以及所述体积,测算出所述待测细胞的密度。
本发明所提供的在生理环境下细胞密度测算方法,依据平行激光通过显微物镜聚焦后会得到一个微纳米尺度的光阱,并产生电场,由于电场强度的梯度变化,相对于电介质微粒/细胞,强聚焦光阱形成三维光学势阱,细胞会被束缚在其势能最低处。通过对光阱进行微操控,例如在平面方向上移动光阱,则光阱中的细胞会随着光阱的移动而移动,实现对细胞的捕获。同理可以控制细胞的旋转,同时结合显微视觉即可获取细胞在空间三个轴向的半径,从而使细胞的体积计算更加的精确。
现结合图2对上述方法进行解释说明,如图2所示,全息光镊的微流控平台包括:微动平台,光学显微镜、摄像机、激光光源、空间光调制器(slm)以及主机系统。所述主机系统包括:图像采集模块、显微视觉算法处理模块、微动平台控制模块、全息图像生成模块、细胞密度估算模块以及显示输出模块。所述图像采集模块用来采集光学显微镜的图像,并交由显微视觉算法处理模块来进行处理并通过显示输出模块来显示,所述显微视觉算法处理模块还向微动平台控制模块、全息图像生成模块、细胞密度估算模块发出信号用来控制其工作。所述微动平台控制模块连接微动平台控制其工作。所述微动平台包括微流控芯片,含待测细胞的培养液位于所述微流控芯片中。所述激光光源产生的激光束通过slm进行相位调制后经过显微物镜聚焦后在微流控芯片上形成光斑,对微流控芯片内的待测细胞进行照射。
可通过调制入射光(激光源发出的平行激光)的相位获得聚焦在微流控芯片形成光阱的任意强度图像,同时产生电场,由于电场强度的梯度变化,相对于电介质微粒/细胞,聚焦光阱形成三维光学势阱,细胞会被束缚在其势能最低处。由激光束聚焦形成的光阱相对于细胞就是一个可以捕获和操控的光阱,如果在水平平面上移动聚焦光阱,细胞就会跟着光阱在平面上移动,并实现对细胞的捕获、移动和旋转等微操纵。
在所述步骤s300中,通过控制细胞的旋转,结合显微视觉,获取待测细胞的空间三个轴向的半径a,b,c,从而更准确的计算细胞的体积
下面介绍下,如何实现由操纵光阱来实现对在生理环境下细胞密度的准确测算。
在全息光镊系统中通过调整激光焦点在竖直的z方向的位置,实现对细胞在竖直方向上的控制,将细胞从微流控芯片的流体下层推到上层,当去掉光镊产生的光阱,细胞周围的电场就会撤销,细胞由于重力的作用,细胞会竖直下沉,直至最后停在下方的流控芯片基底上。
细胞在介质(培养液)中下沉的受力用公式描述如下:
其中fgravity表示细胞所受到的重力,fbouyancy表示细胞受到的浮力,fviscosity表示细胞受到的粘滞阻力。
对公式(1)进行推导变形,可表示为:
其中,
由于斯托克斯粘滞阻力公式的适用条件是物体相对于流体的速度小时无紊流状态,但是在我们的实验中微流控芯片的微管道相对于细胞体积不足以使得细胞的运动忽略其产生的紊流,因此,需要针对微流控芯片的状况加入修正系数k。k可以通过测算标准的已知半径的微球在确定的微流控芯片中的运动进行标定以确定修正参数k。
由于细胞下沉速度越大,所受到的粘滞阻力越大,当速度达到ut时便匀速下落,处于平衡状态,此时小球所受合力为零。细胞的体积可以通过显微视觉方法估算,细胞的粘滞阻力通过斯托克斯粘滞阻力公式计算。因此,细胞的密度公式如下,
所述公式(3)中,ut可通过显微视觉计算细胞下沉的速度,细胞体积v以及r均可精确的估算出,因此,所得到的细胞密度是精确的。
综上所述,本发明的在生理环境下细胞密度的测算方法,采用全息光镊技术操控细胞,微流控系统保证液体电介质的电导率和介电常数适合细胞生理环境下的培养液的电导率和介电常数的要求,实现了生理环境下活体单细胞的质量和密度测算。通过全息光镊技术操控细胞旋转,利用显微视觉方法获取细胞的三个轴向的半径,实现细胞体积估算,因此对细胞受到的粘滞阻力的测算更精确,提高了细胞密度测算的精度。全息光镊配合微流控芯片设计可以实现高通量多细胞密度同时并行测量,提高了测量效率。
应当理解的是,本发明的应用不限于上述的举例,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,所有这些改进和变换都应属于本发明所附权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!