电泳用分离介质、电泳用试剂盒及电泳方法与流程
本发明涉及一种电泳用分离介质、电泳用试剂盒及电泳方法。
背景技术:
在微芯片电泳法及毛细血管(capillary)电泳法等在毛细管中进行电泳的方法中,通常使用水溶性聚合物溶液作为核酸(例如脱氧核糖核酸(desoxyribonucleicacid,dna)、核糖核酸(ribonucleicacid,rna))、蛋白质等的分离介质。所述水溶性聚合物溶液以满足在流路中的填充及置换的容易性与分离性能及迅速分离的必要条件的方式选择。例如,在对链长短的dna进行电泳的情况下,使用分子量较低且高浓度的水溶性聚合物溶液。另外,还报告了以扩大分离的尺寸范围、或者促进对流路的表面的吸附为目的而使用无规共聚物(例如,聚(丙烯酰胺-co-二甲基丙烯酰胺))、嵌段共聚物(例如,聚(环氧乙烷)-聚(环氧丙烷))及接枝共聚物(例如,聚(n-异丙基丙烯酰胺)-接枝-聚环氧乙烷)等共聚物、或者将不同种类或同种聚合物混合而得的混合聚合物的例子(日本专利特开2014-055829号公报(专利文献1)等)。
[现有技术文献]
[专利文献]
[专利文献1]日本专利特开2014-055829号公报
技术实现要素:
[发明所要解决的问题]
且说,近年来,改变任意的碱序列的基因组编辑技术迅速发展。基因组编辑技术中确认了目标碱序列中有无变异,但每次通过dna测序确认多个碱的插入变异或缺失变异的方法会花费时间与费用,因此寻求改善。作为此种dna测序的替代技术,已经使用了可以简单且廉价地筛选的微芯片电泳法。利用微芯片电泳法的筛选方法例如以如下方式进行。首先,将包含目标的碱序列的基因组dna作为模板,利用聚合酶链反应(polymerasechainreaction,pcr)使包含所述目标的碱序列的dna产物增幅。此处,当将在所述目标的碱序列中混合有野生型序列和变异型序列的基因组dna用作模板时,可利用pcr法而获得含有部分不匹配的双链dna产物(异源双链(heteroduplex)dna)。与维持互补性的序列彼此的双链dna产物(同源双链(homoduplex)dna)相比,异源双链dna在电泳中的迁移率不同。因此,可以将所述电泳中的迁移率作为指标来筛选包含目标的碱序列的dna产物等。
然而,即使使用利用微芯片电泳法的筛选方法,检测通过pcr而获得的双链dna产物100bp中的2bp~8bp的差异也存在限制,而寻求短链区域(例如25bp~250bp)中的分离性能的进一步的提高。为了提高短链区域的双链dna产物的分离性能,自之前以来已知有以高浓度使用分子量较低的水溶性聚合物作为分离介质的方法。但是,所述方法中分离介质的粘度上升,因此对于重复使用微芯片时的分离介质的再填充及置换而言,另外需要用以对流路施加充分的压力的装置,具有作为电泳装置而成为大规模的课题。
本发明是鉴于所述情况而成者,其目的在于提供一种不提高粘度而分离性能得到改善的电泳用分离介质。
[解决问题的技术手段]
本发明者进行了努力研究,结果发现通过在包含水溶性纤维素衍生物的电泳用分离介质中加入源自单糖或二糖的糖醇或分子量较低的多糖类,不提高粘度而电泳的分离性能改善,从而完成了本发明。即,本申请提供以下发明。
[1]一种电泳用分离介质,其包含:
水溶性纤维素衍生物、及
源自单糖(monosaccharide)或二糖(disaccharide)的糖醇(sugaralcohol)或低分子量的多糖类(polysaccharide)。
[2]根据所述[1]所述的电泳用分离介质,其中所述糖醇包含甘露醇(mannitol)、赤藓醇(erythritol)、木糖醇(xylitol)、乳糖醇(lactitol)、麦芽糖醇(maltitol)、山梨糖醇(sorbitol)或它们的组合。
[3]根据所述[1]或[2]所述的电泳用分离介质,其中所述多糖类的重量平均分子量为10000~80000。
[4]根据所述[1]~[3]中任一项所述的电泳用分离介质,其中所述多糖类包含短梗霉聚糖(pullulan)、琼脂糖(agarose)、葡聚糖(dextran)、糊精(dextrin)、直链淀粉(amylose)、黄原胶(xanthangum)、甘露聚糖(mannan)、半乳甘露聚糖(galactomannan)、结冷胶(gellangum)、卡拉胶(carrageenan)、凝胶多糖(curdlan)、果胶(pectine)、威兰胶(welangum)、海藻酸(alginicacid)、海藻酸盐(alginicacidsalt)、海藻酸酯(alginicacidester)、刺梧桐胶(karayagum)、罗望籽胶(tamarindseedgum)、鼠李聚糖胶(rhamsangum)或它们的组合。
[5]根据所述[1]~[4]中任一项所述的电泳用分离介质,其中所述糖醇或所述多糖类包含甘露醇、短梗霉聚糖或它们的组合。
[6]根据所述[1]~[5]中任一项所述的电泳用分离介质,其中所述水溶性纤维素衍生物包含纤维素的重复单元中的至少一个羟基的氢原子经选自由碳数1~3的烷基、碳数1~3的羟基烷基、碳数2~4的羧基烷基、-(ch2o)x-h所表示的基、-(ch2ch2o)y-h所表示的基及-[ch2ch(ch3)o]z-h所表示的基(x、y、z分别独立地表示正整数)所组成的群组中的取代基取代而成的重复单元。
[7]根据所述[1]~[6]中任一项所述的电泳用分离介质,其中所述水溶性纤维素衍生物包含选自由甲基纤维素、羟基甲基纤维素、羟基乙基纤维素、羟基丙基纤维素及羧基甲基纤维素所组成的群组中的一种或两种以上。
[8]一种电泳用试剂盒,其包含根据所述[1]~[7]中任一项所述的电泳用分离介质。
[9]一种电泳方法,其为试样中的对象物质的电泳方法,且所述电泳方法包括:
(a)在填充有根据所述[1]~[7]中任一项所述的电泳用分离介质的流路中导入所述试样的步骤;以及
(b)对所述流路施加电压而进行电泳,并进行所述试样中的所述对象物质的分离的步骤。
[10]根据所述[9]所述的电泳方法,其中所述对象物质包含核酸(例如,dna、rna)或蛋白质。
[发明的效果]
根据本发明,可提供一种不提高粘度而分离性能得到改善的电泳用分离介质。
附图说明
图1是对本实施形态的电泳用分离介质与之前的电泳用分离介质的分离性能进行比较的电泳图。波峰的顶点中表述的数字是按照检测的顺序指定的各波峰的编号,同一编号表示同一dna片段。
图2是表示dna产物的尺寸(bp)与尺寸分解能(%)的关系的图表。
图3是表示dna产物的尺寸(bp)与可分离的尺寸差(bp)的关系的图表。
图4是对在水溶性纤维素衍生物中添加甘露醇的电泳用分离介质与在水溶性纤维素衍生物中不添加甘露醇的电泳用分离介质的分离性能进行比较的电泳图。波峰的顶点中表述的数字是按照检测的顺序指定的各波峰的编号,同一编号表示同一dna片段。
图5是对在水溶性纤维素衍生物中添加甘露醇的电泳用分离介质与在水溶性纤维素衍生物中不添加甘露醇的电泳用分离介质的分离性能进行比较的电泳图。波峰的顶点中表述的数字表示与各波峰对应的dna片段的尺寸(bp)。另外,(lm)及(um)的表述分别表示低分子量内部标准标记、高分子量内部标准标记。
图6是对在水溶性纤维素衍生物中添加短梗霉聚糖的电泳用分离介质与在水溶性纤维素衍生物中不添加短梗霉聚糖的电泳用分离介质的分离性能进行比较的电泳图。波峰的顶点中表述的数字表示与各波峰对应的dna片段的尺寸(bp)。另外,(lm)及(um)的表述分别表示低分子量内部标准标记、高分子量内部标准标记。
图7是对在水溶性纤维素衍生物中添加甘露醇的电泳用分离介质与在水溶性纤维素衍生物中不添加甘露醇的电泳用分离介质的分离性能进行比较的电泳图。波峰的顶点中表述的数字表示与各波峰对应的dna片段的尺寸(bp)。另外,(lm)及(um)的表述分别表示低分子量内部标准标记、高分子量内部标准标记。
图8是表示使用包含重量平均分子量大的羟基丙基甲基纤维素(hydroxypropylmethylcellulose,hpmc)的电泳用分离介质时的分离性能的电泳图。波峰的顶点中表述的数字表示与各波峰对应的dna片段的尺寸(bp)。另外,(lm)的表述表示低分子量内部标准标记。
具体实施方式
以下,对本发明的实施形态进行说明,但本发明并不限定于这些实施形态。另外,“a~b”这一表述是指范围的上限下限(即,a以上且b以下),在a中无单位记载且仅在b中记载单位的情况下,a的单位与b的单位相同。
(电泳用分离介质)
本实施形态的电泳用分离介质(以下,有时简称为“电泳用分离介质”)包含:水溶性纤维素衍生物、及源自单糖或二糖的糖醇或低分子量的多糖类。所述电泳用分离介质通过具备所述构成,可不提高粘度而改善分离性能。此处,所谓“分离性能”是指在利用电泳而获得的电泳图中能够以可将接近的2个波峰分别作为不同的波峰而识别的程度来分离并检测与所述波峰对应的对象物质的性能。电泳用分离介质的分离性能可利用后述的尺寸分解能、分离度、可分离的尺寸差等来进行评价。
所谓“电泳用分离介质”是指可导入试样,用以对所述试样进行电泳而分离的介质。
所谓“水溶性纤维素衍生物”是指将纤维素的重复单元中的至少一个羟基(-oh)变换为醚(-or)且水溶性提高的纤维素衍生物。此处,所谓“水溶性”是指对于25℃、1气压下的蒸馏水100g具有1g以上的溶解度。
水溶性纤维素衍生物优选为包含纤维素的重复单元中的至少一个羟基的氢原子经选自由碳数1~3的烷基、碳数1~3的羟基烷基、碳数2~4的羧基烷基、-(ch2o)x-h所表示的基、-(ch2ch2o)y-h所表示的基及-[ch2ch(ch3)o]z-h所表示的基(x、y、z分别独立地表示正整数)所组成的群组中的取代基取代而成的重复单元。所述取代基更优选为包含碳数1~3的烷基或碳数1~3的羟基烷基。
即,所述水溶性纤维素衍生物由下述式(i)表示。
[化1]
式中,r优选为分别独立地为选自由氢原子、碳数1~3的烷基、碳数1~3的羟基烷基、碳数2~4的羧基烷基、-(ch2o)x-h所表示的基、-(ch2ch2o)y-h所表示的基及-[ch2ch(ch3)o]z-h所表示的基(x、y、z分别独立地表示正整数)所组成的群组中。r更优选为分别独立地为选自由氢原子、碳数1~3的烷基及碳数1~3的羟基烷基所组成的群组中。n表示正整数。
作为水溶性纤维素衍生物,例如可列举:甲基纤维素、乙基纤维素及丙基纤维素等烷基纤维素;羟基甲基纤维素、羟基乙基纤维素(hydroxyethylcellulose,hec)及羟基丙基纤维素等羟基烷基纤维素;羟基乙基甲基纤维素、羟基乙基乙基纤维素及羟基丙基甲基纤维素(hpmc)等羟基烷基烷基纤维素;以及羧基甲基纤维素、羧基乙基纤维素及羧基丙基纤维素等羧基烷基纤维素(也包含碱金属盐等盐的形态)、羧基甲基羟基乙基纤维素等羧基烷基羟基烷基纤维素(也包含碱金属盐等盐的形态)等,可自这些水溶性纤维素衍生物中选择使用一种,也可组合使用多种。水溶性纤维素衍生物优选为包含选自由羟基丙基甲基纤维素、甲基纤维素、羟基甲基纤维素、羟基乙基纤维素、羟基丙基纤维素及羧基甲基纤维素所组成的群组中的一种或两种以上。水溶性纤维素衍生物更优选为包含羟基丙基甲基纤维素。
水溶性纤维素衍生物的重量平均分子量(mw)优选为50000~2000000,更优选为250000~1300000,进而优选为300000~370000。通过使重量平均分子量为所述范围内,可容易找到与浓度的最佳化一起可尽可能不提高电泳用分离介质的粘度而进一步满足分离性能的条件。所述重量平均分子量可利用光散射法或凝胶渗透色谱(gelpenetrationchromatography)法(gpc法)进行测定。
水溶性纤维素衍生物的数量平均分子量(mn)优选为20000~500000,更优选为80000~160000。所述数量平均分子量可利用光散射法或凝胶渗透色谱法(gpc法)进行测定。
水溶性纤维素衍生物的多分散度(mw/mn)可为1.0~100.0,也可为2.0~20.0,还可为3.0~4.0。所述多分散度可通过所述重量平均分子量除以数量平均分子量而求出。
水溶性纤维素衍生物的粘度(浓度2wt%、温度25℃)优选为50cp~4000cp,更优选为50cp~100cp。通过使粘度为所述范围内,电泳的流路中的电泳用分离介质的填充、置换变得容易。所述粘度可利用布鲁克菲尔德(brookfield)粘度计进行测定。
电泳用分离介质中的水溶性纤维素衍生物的浓度可为0.2%~2.0%(w/v),也可为0.5%~1.6%(w/v)。
水溶性纤维素衍生物可利用公知的方法制造。另外,水溶性纤维素衍生物可不将市售品精制而直接使用,也可将市售品精制而加以使用。在使用hpmc作为水溶性纤维素衍生物的情况下,作为市售品,例如可列举后述实施例中使用的日本西格玛奥德里奇(sigma-aldrichjapan)公司制造的hpmc。
所谓“糖醇”是指糖的羰基经还原的链状的多元醇。所谓“源自单糖或二糖的糖醇”是指通过对单糖或二糖进行还原而获得的糖醇。本实施形态中,作为糖醇,例如可列举甘露醇、赤藓醇、木糖醇、乳糖醇、麦芽糖醇、山梨糖醇,可自这些糖醇中选择使用一种,也可组合使用多种。再者,在糖醇中存在光学各向异性体(d体及l体)的情况下,可使用任一种各向异性体,另外也可使用它们的混合物。糖醇优选为包含甘露醇。
电泳用分离介质中的糖醇的浓度优选为1wt%~5wt%,更优选为1wt%~3wt%。通过浓度为所述范围内,可进一步改善电泳用分离介质的分离性能。
所谓“多糖类”是指单糖进行了聚糖基化的高分子化合物。本实施形态中,所谓“低分子量的多糖类”是指其自身作为相对于dna等对象物质而言的分离介质而不会发挥功能的程度的为低分子量的多糖类。例如,可列举具有后述重量平均分子量的多糖类。作为多糖类,例如可列举:短梗霉聚糖、琼脂糖、葡聚糖、糊精、直链淀粉、黄原胶、甘露聚糖、半乳甘露聚糖、结冷胶、卡拉胶、凝胶多糖、果胶、威兰胶、海藻酸、海藻酸盐(例如,海藻酸钠、海藻酸钾、海藻酸钙、海藻酸铵等)、海藻酸酯(例如,海藻酸丙二醇酯等)、刺梧桐胶、罗望籽胶、鼠李聚糖胶等,可自这些多糖类中选择使用一种,也可组合使用多种。多糖类优选为包含短梗霉聚糖。
多糖类的重量平均分子量(mw)优选为10000~80000,更优选为20000~80000,进而更优选为22800~80000。通过使用适量的重量平均分子量为所述范围内者,可尽力抑制增粘效果。所述重量平均分子量可利用凝胶渗透色谱法(gpc法)进行测定。
电泳用分离介质中的多糖类的浓度优选为0.2wt%~5wt%,更优选为0.25wt%~1.0wt%。通过使浓度为所述范围内,可进一步改善电泳用分离介质的分离性能。
糖醇或多糖类优选为甘露醇、短梗霉聚糖或包含它们的组合。
电泳用分离介质通常为液体,优选为水溶液,更优选为具有缓冲能的水溶液(以下,有时称为“缓冲溶液”)。此处,所谓“缓冲能”是指对于溶液中的氢离子浓度的缓冲作用。作为所述缓冲溶液,可列举tbe缓冲溶液(89mmtris、89mm硼酸、2mmedta-na2-salt、ph8.3)、tae缓冲溶液(40mm三羟基甲基氨基甲烷(tris)、乙酸、1mm乙二胺四乙酸二钠(edta-na2-salt)、ph8.3)等。另外,有时也使这些缓冲溶液的离子强度变化而使用。例如为2×tbe缓冲溶液(178mm三羟基甲基氨基甲烷(tris)、178mm硼酸、4mm乙二胺四乙酸二钠(edta-na2-salt)、ph8.3)等。
电泳用分离介质的粘度(温度25℃)优选为10cp~200cp,更优选为20cp~100cp。通过使粘度为所述范围内,电泳的流路中的电泳用分离介质的填充、置换变得容易。所述粘度可利用布鲁克菲尔德粘度计进行测定。
电泳用分离介质也可在不损害本实施形态的效果的范围内包含dna染色试剂(例如,赛默飞世尔科技(thermofisherscientific)公司制造、商品名:西博(sybr)(注册商标)戈尔德(gold))、日本龙扎沙(lonzajapan)公司制造、商品名:杰斯塔(gelstar)(注册商标)等的其他成分。
在使用核酸(例如,dna或rna)作为进行电泳的对象物质的情况下,本实施形态的电泳用分离介质中100bp~300bp的尺寸区域中的尺寸分解能(%)优选为3%以下。此处,所谓尺寸分解能(%)是指相对于迁移的dna片段的尺寸(bp)而言的可分离的最小的尺寸差(bp)的比率。尺寸分解能是指值越小,越可精度良好地区别尺寸的差小的两个dna片段,分离性能越高。具有此种尺寸分解能的电泳用分离介质适合用于用以利用基因组编辑的变异导入的确认的电泳中。所述尺寸分解能可根据通过进行电泳而获得的电泳图而求出。具体而言,所述尺寸分解能着眼于所述电泳图中接近的两个波峰(“第1波峰”及“第2波峰”),并根据以下式子求出。此处,第1波峰的尺寸(bp)小于第2波峰的尺寸(bp)。
尺寸分解能(%)=(尺寸分解能[bp]/第1波峰的尺寸[bp])
(其中,尺寸分解能[bp]=(接近的两个波峰的尺寸差[bp])/rs)
此处,rs是指在假定所述接近的两个波峰的宽度及高度大致相同时的分离度。在rs大于规定的基准值的情况下,判断为接近的两个波峰分离。例如,在rs≧0.8的情况下,可判断为接近的两个波峰充分分离。rs是利用下述式求出。
[数1]
式中,t表示迁移时间(migrationtime),wb表示基底线的波峰宽度,4σ表示波峰为正态分布时的基底线的波峰宽度,wh表示波峰高度为1/2时的波峰宽度。t及wb下标注的数字是指对应的波峰的编号。其中,关于4σ,假定可利用分散σ2=2dt(d为扩散系数)来表示电泳流路中的波峰的扩展,可在能够无视扩散以外的因素(例如试样成分在流路内壁的吸附等)所引起的波峰扩展的情况下使用。例如,t1是指第1波峰的迁移时间,t2是指第2波峰的迁移时间。
在使用dna或rna作为进行电泳的对象物质的情况下,本实施形态的电泳用分离介质中25bp~100bp的尺寸区域中的可分离的尺寸差优选为1bp~5bp,更优选为1bp~3bp。具有此种可分离的尺寸差的电泳用分离介质适合用于用以利用基因组编辑的变异导入的确认的电泳中。所谓可分离的尺寸差是指为了成为rs=0.8而需要的两个波峰的片段尺寸(链长的大小)的差。是指所述可分离的尺寸差越小,越可精度良好地分离尺寸的差小的两个dna片段,分离性能越高。所述可分离的尺寸差可根据通过进行电泳而获得的电泳图而求出。
本实施形态的电泳用分离介质包含水溶性纤维素衍生物、及糖醇或分子量较低的多糖类。所述电泳用分离介质通过具备所述构成,可不提高粘度而改善分离性能。为了提高短链区域(例如25bp~250bp)的双链dna产物的分离性能,自之前以来已知有以高浓度使用分子量较低的水溶性聚合物作为分离介质的方法。但是,所述方法中分离介质的粘度上升,因此对于重复使用微芯片时的分离介质的再填充及置换而言,另外需要用以施加充分的压力的装置,具有作为电泳装置而成为大规模的课题。关于所述电泳用分离介质,将其自身作为相对于dna等对象物质而言的分离介质而不发挥功能的低分子量的糖醇或多糖类(例如,分子量为80000左右或其以下)添加于作为水溶性聚合物的水溶性纤维素衍生物中,因此可不提高粘度而改善分离性能。
进而,关于水溶性纤维素衍生物(例如,hpmc),存在许多纤维素的羟基、羟基丙基等,可与糖醇、多糖类形成氢键。因此,单一成分中在分子结构上不进行交联、且直链上所存在的纤维素衍生物分子彼此通过糖醇或多糖类介入存在(intervention)而相互作用,带来筛分效果的网眼结构发生变化。进而,所述纤维素的羟基、羟基丙基等也可与dna获得氢键。因此,在本实施形态的电泳用分离介质中迁移的dna产物等除了纯粹的尺寸的分离以外,受到氢键的亲和力(affinity)的影响,分离选择性发生变化。结果,本发明者等人认为短链区域中即使为同一dna尺寸,也会因碱序列的差异及有无轻微的变异而使电泳中的迁移率产生差。若考虑到所述机制,则本实施形态中使用的糖醇及多糖类在可对于水溶性纤维素衍生物形成氢键的方面具有相同的技术特征。进而,并不限于糖醇、多糖类,只要为可形成氢键的化合物,则通过与水溶性纤维素衍生物组合,可作为所述电泳用分离介质而使用。作为可形成氢键的化合物,例如可列举包含cooh基或nh2基的化合物等。
(电泳用试剂盒)
本实施形态的电泳用试剂盒(以下,有时称为“试剂盒”)包含所述电泳用分离介质。试剂盒中也可包含缓冲溶液、dna染色试剂、分子量标记、内部标准标记、容器、操作说明书等。
(电泳方法)
本实施形态的电泳方法为试样中的对象物质的电泳方法,且所述电泳方法包括:
(a)在填充有电泳用分离介质的流路中导入所述试样的步骤;以及
(b)对所述流路施加电压而进行电泳,并进行所述试样中的所述对象物质的分离的步骤。
步骤(a):在填充有电泳用分离介质的流路中导入试样的步骤
所谓步骤(a)中的“填充有电泳用分离介质的流路”是指如下流路,所述流路用于使试样中所含的对象物质通过电泳而移动且流路中填充有本实施形态的电泳用分离介质。所述流路的长度并无特别限制,例如可列举10mm~40mm。所述流路的尺寸(例如,作为流路的毛细血管的内径、设置于微芯片上的流路的宽度等)并无特别限制,例如可列举20μm~100μm。
所述流路可为毛细血管(capillarytube),也可为设置于微芯片上的微流路(microflowpath)。在毛细血管或设置于微芯片上的微流路由玻璃等构成的情况下,为了抑制电渗透流(electro-osmoticflow),或者为了抑制试样中所含的混杂成分的吸附,可对所述流路的表面进行涂布(例如,聚丙烯酰胺涂布)。聚丙烯酰胺涂布例如可以如下方式对所述流路的表面实施。首先使具有甲基丙烯酰基的硅烷偶联剂作用于微流路的表面且在所述表面上导入甲基丙烯酰基。其次,使丙烯酰胺单体作用于所述甲基丙烯酰基,在规定条件下进行聚合反应,由此对微流路的表面进行聚丙烯酰胺涂布。
导入流路中的试样并无特别限制,但优选为溶液,例如也可为溶解了dna等的te缓冲溶液(10mmtris-hcl、1mmedta-na2-salt、ph8.0)。所述试样也可包含内部标准标记。作为内部标准标记,例如可列举岛津制作所股份有限公司制造的商品名mce(注册商标)-202麦提纳(multina)(注册商标)用dna-500试剂盒中所含的内部标准标记。
试样中所含的对象物质只要为进行离子化的物质,则并无特别限制,优选为包含核酸(例如,dna、rna)或蛋白质,更优选为包含dna。dna可为双链dna(例如,异源双链dna、同源双链dna等),也可为单链dna。
所述试样可导入至流路的任意位置,就确保充分的迁移距离的观点而言,优选为导入至所述流路的一端侧。
步骤(b):对流路施加电压而进行电泳,并进行试样中的对象物质的分离的步骤
只要对流路的整体或一部分施加步骤(b)中的电压即可。就确保充分的迁移距离的观点而言,优选为对流路的两端之间施加所述电压。施加的电压可根据电泳流路的长度、尺寸、试样、对象物质的种类等适宜决定。施加的电压例如可列举0.2kv~10kv。
所述电泳方法也可进一步包括(c)检测经分离的对象物质的步骤。步骤(c)也可包含利用光学方法对经分离的对象物质进行检测。作为利用光学方法进行的检测,例如可列举吸光度或萤光的测定。检测中使用的波长可根据试样、对象物质的种类等适宜决定。
本实施形态的电泳方法例如可利用微芯片电泳装置全自动进行步骤(a)至步骤(c)。作为微芯片电泳装置,例如可列举岛津制作所股份有限公司制造的mce(注册商标)-202麦提纳(multina)(注册商标)(商品名)。具体而言,首先在微芯片电泳装置中设置微芯片(例如,岛津制作所股份有限公司制造、商品名泰普(type)we)、电泳用分离介质、试样及内部标准标记。其后,视需要变更填充电泳用分离介质的压力(100kpa~500kpa)及施加于微芯片上所设置的流路的两端的电压(0.2kv~1.4kv),全自动进行电泳。
本实施形态的电泳方法适合于用以利用基因组编辑的变异导入的确认的电泳中,尤其适合于异源双链dna产物的分离。
[实施例]
以下,示出实施例来对本发明进行更详细地说明,但本发明并不受到这些实施例的限定。
(电泳用分离介质的制备)
1.含有hpmc的tbe缓冲溶液的制备
关于羟基丙基甲基纤维素(hpmc),不将市售品(日本西格玛奥德里奇(sigma-aldrichjapan)公司制造)精制而直接使用。利用凝胶渗透色谱法(gpc)测定各hpmc的数量平均分子量(mn)、重量平均分子量(mw)及多分散度(mw/mn)。具体而言,使用分子量已知的标准试样(分子量504~1800000),进行gpc分析,根据其溶出时间制成标准曲线。使用包含作为测定对象的各hpmc的试样(浓度0.4%(w/v)),利用与标准试样的情况相同的分析条件进行gpc分析,基于所述标准曲线求出mn、mw及mw/mn。
gpc的分析条件
管柱:索得克斯(shodex)ohpaksb-806mhq、保护管柱索得克斯(shodex)ohpaksb-g
流动相:0.1mol/l硝酸钠
流量:1.0ml/min
温度:40℃
检测器:示差折射率计、岛津制作所股份有限公司制造、rid-20a(商品名)
各hpmc的粘度是利用布鲁克菲尔德粘度计进行测定。具体而言,按照以下顺序进行测定。首先使用依据美国国家标准技术研究所(nationalinstituteofstandardsandtechnology,nist)标准的粘度计标准液(100mpa·s)验证测定法的妥当性,利用相同的条件对包含作为测定对象的hpmc的试样(浓度2.0%(w/v))进行粘度测定。
粘度测定条件
粘度计:布鲁克菲尔德dv-ii+pro
轴:cpa-40z
温度:25℃
在表1中示出所使用的hpmc的一览表。
表1
*粘度测定的条件:布鲁克菲尔德dv-ii+pro粘度计(viscometer)、轴:cpa-40z
其后,在2×tbe缓冲溶液(178mmtris、178mm硼酸、4mmedta-na2-salt、ph8.3)中以浓度成为2%(w/v)的方式完全溶解各hpmc,而获得含有hpmc的tbe缓冲溶液。含有hpmc的tbe缓冲溶液在到使用时以不超过下限临界溶液温度(45℃)的方式进行保管。另外,在缓冲溶液中的hpmc因热负荷而不熔化的情况下,利用冷却进行再溶解。
2.电泳用分离介质的制备
在所制备的含有hpmc的tbe缓冲溶液中将作为dna染色试剂的西博(sybr)(注册商标)戈尔德(gold)(赛默飞世尔科技(thermofisherscientific)公司制造、商品名)以成为1/10000稀释的方式溶解,进而将甘露醇或短梗霉聚糖以成为后述浓度的方式溶解,进行充分混合,由此获得电泳用分离介质。
(电泳用试样的制备)
将作为对象物质的dna尺寸标记(25bpdna梯、英杰(invitrogen)公司制造、或者25bpdna阶梯、普洛麦格(promega)公司制造)以成为7.2ng/μl~20ng/μl的方式利用te缓冲溶液(10mmtris-hcl、1mmedta-na2-salt、ph8.0)进行稀释,而制备电泳用试样。内部标准标记使用dna分析用标记(岛津制作所股份有限公司制造的商品名mce(注册商标)-202麦提纳(multina)(注册商标)用dna-500试剂盒)。
(数据的测定顺序)
在微芯片电泳装置(岛津制作所股份有限公司制造的商品名mce(注册商标)-202麦提纳(multina)(注册商标))中设置微芯片(岛津制作所股份有限公司制造、商品名泰普(type)we)、电泳用分离介质、试样及内部标准标记。其后,视需要变更填充电泳用分离介质的压力(100kpa~500kpa)及施加于微芯片上所设置的流路的两端的电压(0.2kv~1.4kv),全自动进行电泳,并分析所得的实验数据。
(本实施形态的电泳用分离介质与之前的电泳用分离介质的比较)
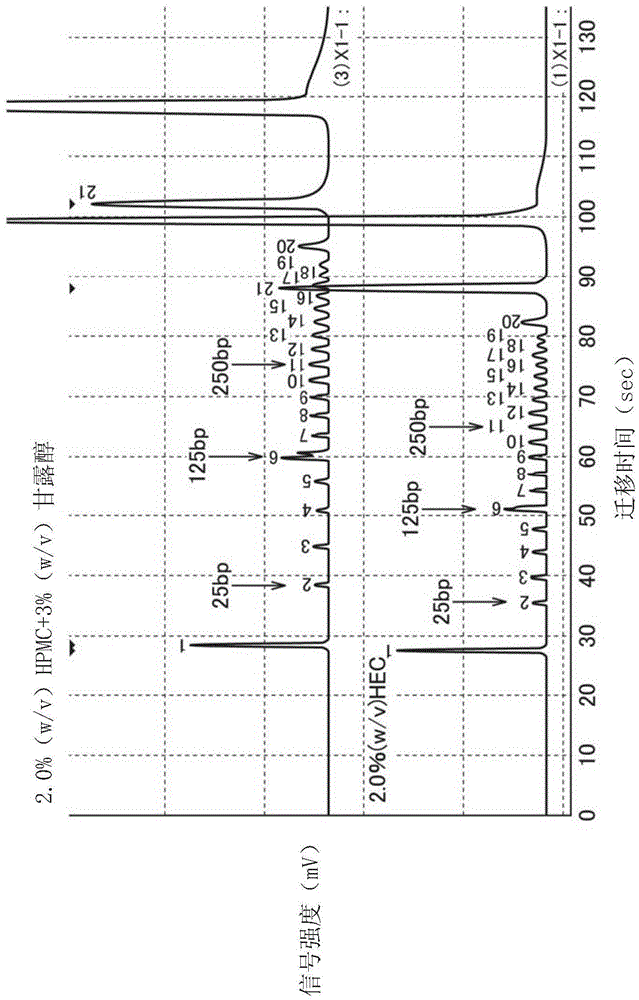
在图1~图3及表2中示出将本实施形态的电泳用分离介质(2.0%(w/v)hpmc(表1的#2)+3%(w/v)甘露醇;实施例1)与之前以来一直使用的电泳用分离介质(2.0%(w/v)羟基乙基纤维素(hec)(重量平均分子量mw=475000、多分散度mw/mn=4.28、布鲁克菲尔德粘度90cp(2wt%、25℃));比较例1)进行比较的实验结果。图2、图3及表2中,“a0308a”、“w7613”的表述表示芯片id,除了使用不同的芯片以外,在相同的分离条件下进行测定,均包含于实施例1中。对象物质使用英杰(invitrogen)公司制造的dna尺寸标记(~500bp),内部标准标记使用mce(注册商标)-202麦提纳(multina)(注册商标)用dna-500试剂盒中所含的高分子侧的标记。
若对电泳图(图1)进行比较,则尽管电泳用分离介质的粘度为相同程度,但实施例1中相较于比较例1而言迁移时间变慢,同时300bp附近的各波峰间的间隔扩大,分解性能改善。进而,关于100bp~300bp的尺寸区域中的尺寸分解能(%),比较例1中为约4%左右,相对于此实施例1中改善至约3%左右(图2)。另外,关于25bp~100bp的可分离的尺寸差,比较例1中为3bp~4bp,相对于此实施例1中改善至3bp以下(图3)。
表2
(对于在hpmc中添加甘露醇所带来的分离性能的改善效果的验证)
在图4及表3中示出将本实施形态的电泳用分离介质(2.0%(w/v)hpmc(表1的#2)+1wt%甘露醇;实施例2)、与不添加甘露醇的电泳用分离介质(2.0%(w/v)hpmc(表1的#2);比较例2)进行比较的实验结果。对象物质使用普洛麦格(promega)公司制造的25bp阶梯(~300bp)。内部标准标记使用mce(注册商标)-202麦提纳(multina)(注册商标)用dna-500试剂盒中所含的高分子侧的标记。通过添加1wt%的甘露醇,迁移时间变慢,同时300bp附近的各波峰间的间隔扩大,分解性能改善。
表3
其次,在图5及表4中示出将本实施形态的电泳用分离介质(2.0%(w/v)hpmc(表1的#2)+3wt%甘露醇;实施例3)、与不添加甘露醇的电泳用分离介质(2.0%(w/v)hpmc(表1的#2);比较例3)进行比较的实验结果。对象物质使用英杰(invitrogen)公司制造的25bp阶梯(~500bp)。内部标准标记使用mce(注册商标)-202麦提纳(multina)(注册商标)用dna-500试剂盒中所含的高分子侧的标记。通过添加3wt%的甘露醇,迁移时间变慢,同时300bp附近的各波峰间的间隔扩大,分解性能改善。尤其示出了125bp附近的波峰分离为两个波峰,分离性能明显改善。
表4
(对于在hpmc中添加短梗霉聚糖所带来的分离性能的改善效果的验证)
在图6及表5中示出将本实施形态的电泳用分离介质(2.0%(w/v)hpmc(表1的#2)+0.25wt%短梗霉聚糖;实施例4)、与不添加短梗霉聚糖的电泳用分离介质(2.0%(w/v)hpmc(表1的#2);比较例4)进行比较的实验结果。所使用的短梗霉聚糖的重量平均分子量为22800。对象物质使用英杰(invitrogen)公司制造的25bp阶梯(~500bp)。内部标准标记使用mce(注册商标)-202麦提纳(multina)(注册商标)用dna-500试剂盒中所含的高分子侧的标记。通过添加0.25wt%的短梗霉聚糖,确认到不扩大波峰宽度而使迁移时间延迟的效果,例如200bp的分离度(rs)自2.37改善至2.55。
表5
(使用重量平均分子量不同的hpmc时的实验数据)
在图7及表6中示出将本实施形态的电泳用分离介质(1.6%(w/v)hpmc(表1的#1)+3wt%甘醇;实施例5)、与不添加甘醇的电泳用分离介质(1.6%(w/v)hpmc(表1的#1);比较例5)进行比较的实验结果。对象物质使用普洛麦格(promega)公司制造的25bp阶梯(~300bp)。内部标准标记使用mce(注册商标)-202麦提纳(multina)(注册商标)用dna-500试剂盒中所含的高分子侧的标记。即使在使用重量平均分子量小的hpmc的情况下,通过添加3wt%的甘露醇,迁移时间变慢,同时300bp附近的各波峰间的间隔扩大,整体上分离性能改善(100bp:rs=3.61→4.71、200bp:rs=1.84→2.29、300bp:rs=1.23→1.50)。
表6
其次,在图8及表7中示出作为电泳用分离介质的0.5%(w/v)hpmc(表1的#3)的溶液(比较例6)的实验结果。对象物质使用普洛麦格(promega)公司制造的25bp阶梯(~300bp)。内部标准标记使用mce(注册商标)-202麦提纳(multina)(注册商标)a用dna-500试剂盒中所含的高分子侧的标记。通过对高分子量的hpmc进行稀释而使用,可获得迁移时间短的分离,但即使在所述情况下通过添加甘露醇,也揭示了迁移时间的延迟效果与分离性能的改善。
表7
如上所述对本发明的实施形态及实施例进行了说明,但自起初起也预定了将所述各实施形态及各实施例的构成适宜组合。
应认为此次揭示的实施形态及实施例在所有方面为例示,且并不进行限制。本发明的范围并非所述实施形态及实施例而是由权利要求书所示,且意图包含与权利要求书均等的含义及范围内的所有的变更。
- 还没有人留言评论。精彩留言会获得点赞!