用于使血液样品成像的方法、试剂盒及系统与流程
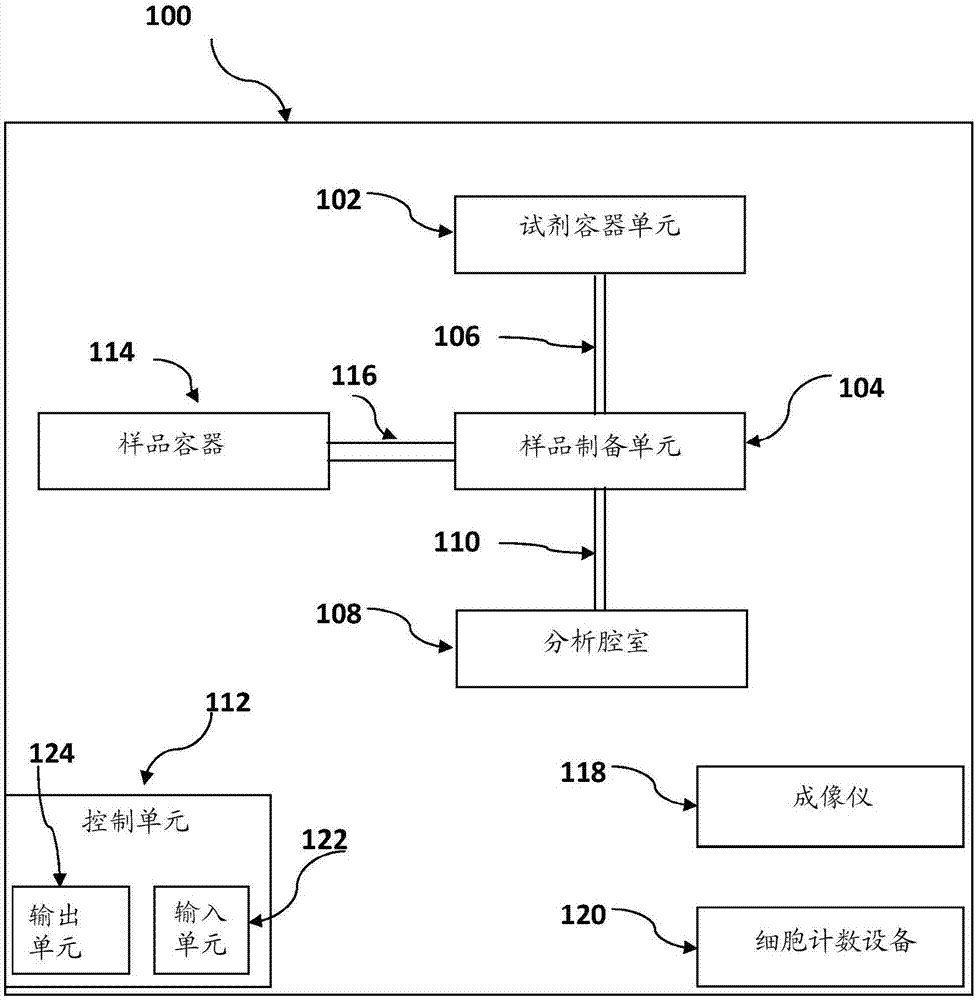
本公开内容是在微生物学领域且具体地是涉及特别是在诊断中使用的细胞样品制备及其成像的方法。现有技术下面列出了认为是与目前公开的主题相关的参考文献:-anthonymoodyvariousrapiddiagnostictestsformalariaparasiteinclinicalmicrobiologyreviews2002年1月第66-78页;-vinkjp.等人anautomaticvision-basedmalariadiagnosissystemjournalofmicroscopy,2013,第1-13页;国际专利申请公布号wo2010/116341;-"countingbloodcellswithcountessautomatedcellcounter",见http://www.lifetechnologies.com/content/dam/lifetech/migration/files/cell-tissue-analysis/pdfs.par.83996.file.dat/w-082149-countess-application-blood-cells.pdf;-美国专利号4,209,548;-美国专利号4,494,479;-美国专利号6,819,408;-leifrc.等人methodsforpreparingsortedcellsasmonolayerspecimens,springerlabmanuals2000第592-619页;-zahniserdj等人automatedslidepreparationsystemfortheclinicallaboratory,cytometry1996年3月15;26(10):60-4;-knesselea等人rocheimageanalysissystems,inc.actacytologica1996;40:60-66;不得将本文对上述参考文献的确认推断为意味着这些参考文献以任何方式与目前公开的主题的专利性相关。背景在细胞病理学方法,即在细胞水平上研究和诊断疾病中通常制备细胞载玻片。载玻片制备的最普遍的方法之一是涂抹。将样品涂抹在玻璃显微镜载玻片上以进行随后的染色和显微镜检查。需要涂抹方法以便在载玻片上获取细胞薄层,从而使聚焦在细胞上并使细胞成像成为可能。然而,涂抹会引起细胞形态方面的改变。此外,细胞快速地变干以及在不固定的情况下的另外的染色几乎是不可能的,至少由于该原因使用涂抹难以准确地和稳定地使活细胞成像。anthonymoody特别地描述了[variousrapiddiagnostictestsformalariaparasiteinclinicalmicrobiologyreviews2002年1月,第66-78页]含有单层红细胞的薄血膜和多层的厚血膜的制备。后来vinkjp.等人[anautomaticvision-basedmalariadiagnosissystemjournalofmicroscopy,2013,第1-13页]参考了moody,其描述了用于基于视觉的疟疾诊断的定量支架-扫描仪系统(cartridge-scannersystem),聚焦于低疟原虫密度。提出的支架允许形成薄血膜以及检测恶性疟原虫(plasmodiumfalciparum)。为了能够测定寄生虫密度,vink等人旨在形成包含单层红细胞的薄血膜以及基于他们对在国际专利申请公布号wo2010/116341(美国专利申请公布号20120225446)中描述的支架的设计。具体地,wo2010/116341描述了用于生产流体样品的薄层进行分析的装置,其具有分析腔室的二维阵列,以及耦合到阵列以使分析腔室能够被并行地填充的分支模式的入口通道。分析腔室是平面的,具有低于入口通道高度的高度以便于在用流体样品填充时产生薄层。分析腔室可适合于通过指定的流体样品诸如血液毛细填充。为了使细胞形成单层,分析腔室不应该大于15μm高。制造具有该等级高度的腔室并不总是可能的并且是相对昂贵的。美国专利号4,209,548描述了一种方法,其中旋转载玻片上的血液样品以创建随机分布的红细胞单层。为了抑制在干燥期间发生细胞形态变形,在单层制备之后但在干燥之前通过固定剂保持包含于单层中的细胞的形态。美国专利号4,494,479描述了用于在载玻片设备上制备生物流体样品的单层膜的设备,该设备包括用于在其上保持载玻片的基底和可在将载玻片上的流体样品扩散成这样的单层的通路中相对于基底和载玻片线性地手动移动的涂布器。公布“countingbloodcellswithcountessautomatedcellcounter”描述了涉及稀释的用于计数血细胞的白/红细胞的血液样品的制备。美国专利号6,819,408描述了在分析过程中不需要额外的稀释试剂或流体流通过装置的用于分析静止状态中的血液或另外的生物流体样品的方法和装置。该方法和装置允许使用光学扫描仪器计数和检测生物样品的颗粒成分。leifrc等人(methodsforpreparingsortedcellsasmonolayerspecimens)springer实验手册2000描述了应用离心细胞学方法从此前用细胞分类器(facs)分类的细胞创建单层的方法。跟据leif,离心细胞学是通过应用离心力将悬浮液中的细胞离心到衬底上且然后同时固定的方法。knesselea等人(rocheimageanalysissystems)actacytologica1996描述了应用ma批离心方法连同计算机控制的机器人移液站(computercontrolledroboticpipettingstation)以制备来自颈样品悬浮液的单层。zahniserdj等人(automatedslidepreparationsystemforclinicallaboratory)cytometry1996,描述了使用过滤-转移技术(filter-transfertechnology)从悬浮液收集细胞并将它们在载玻片上分散为单层的自动化的设备。概述本公开内容提供了一种用于使血液样品成像的方法,该方法包括:-将包括红细胞的细胞悬浮液引入到载体的基底(base)表面上,该载体具有大于或等于当在所述基底载体上时所述细胞悬浮液的垂直深度(h)的垂直高度(h),细胞悬浮液包括由以下函数确定的细胞浓度(c):c=f/(h*pi/4*d2)(f)是预期的基底表面覆盖度;以及(d)是细胞悬浮液中的细胞的平均细胞尺寸;-使细胞悬浮液中的细胞沉降在载体的所述基底表面上以在载体的基底表面上形成细胞单层;-获取细胞单层的至少一部分的至少一幅显微图像,其中通过设置为不超过当沉降到所述基底表面上时细胞悬浮液的垂直高度的20%的景深(dof)的显微镜获得所述至少一幅显微图像。本公开内容还提供了一种用于使血液样品成像的试剂盒,该试剂盒包括:-载体,所述载体包括基底表面和垂直高度(h);以及-用于执行以下步骤的使用说明:-从包括红细胞的血液样品提供细胞悬浮液,细胞悬浮液具有由以下函数确定的细胞浓度(c):c=f/(h*pi/4*d2)(f)是预期的基底表面覆盖度;以及(d)是细胞悬浮液中的细胞的平均细胞尺寸;-将预期的浓度c的细胞悬浮液引入到载体的基底表面上,当在所述载体中时细胞悬浮液具有所述垂直深度(h),所述垂直深度(h)小于或等于所述垂直高度(h);-使细胞悬浮液中的细胞沉降到载体的所述基底表面上以在基底表面上形成细胞单层;-获取细胞单层的至少一部分的至少一幅显微图像,其中通过将显微镜设置为不超过当沉降到所述基底表面上时细胞悬浮液的垂直高度的20%的景深(dof)获得所述至少一幅显微图像。还进一步,本公开内容提供了一种用于使血液样品成像的系统,该系统包括:-一个或更多个容器单元,所述一个或更多个容器单元用于分别容纳包括至少一种血细胞稀释剂的一种或更多种样品处理剂;-血液样品制备单元,所述血液样品制备单元与所述一个或更多个容器单元流体连通且被配置为接收包括红细胞的血液样品及至少一种血细胞稀释剂的用量并由此形成血细胞悬浮液,所述至少一种细胞稀释剂的用量确定为以稀释因子(d)稀释所述细胞的样品以便提供细胞浓度(c);-显微图像获取单元,所述显微图像获取单元用于获取当在载体的基底表面上时血细胞悬浮液的至少一幅图像,所述载体具有大于或等于当在所述基底表面上时所述细胞悬浮液的垂直深度(h)的垂直高度(h);-控制单元,所述控制单元被配置为:-提供稀释所述样品的稀释因子d,因子d是预期的基底表面覆盖度(f)、细胞血细胞的平均细胞尺寸d和当沉降到载体的所述基底表面上时提供细胞单层的所述细胞的悬浮液的垂直深度h的函数;以及-通过设置为不大于当沉降到所述基底表面上时细胞悬浮液的垂直高度的20%的景深(dof)的显微镜获取细胞悬浮液的至少一幅显微图像。本公开内容还提供了以下内容:1)一种用于使血液样品成像的方法,所述方法包括:-将包括红细胞的细胞悬浮液引入到载体的基底表面上,所述载体具有大于或等于当在所述基底载体上时所述细胞悬浮液的垂直深度(h)的垂直高度(h),所述细胞悬浮液包括由以下函数确定的细胞浓度(c):c=f/(h*pi/4*d2)(f)是预期的基底表面覆盖度;以及(d)是所述细胞悬浮液中的细胞的平均细胞尺寸;-使所述细胞悬浮液中的细胞沉降在所述载体的所述基底表面上以在所述载体的基底表面上形成细胞单层;以及-获取所述细胞单层的至少一部分的至少一幅显微图像,其中,通过设置为不超过当沉降到所述基底表面上时所述细胞悬浮液的垂直高度的20%的景深(dof)的显微镜获得所述至少一幅显微图像。2)如项1)所述的方法,其中所述垂直高度(h)在20μm与1000μm之间。3)如项1)或2)所述的方法,其中通过不大于当沉降在所述基底表面上时所述细胞悬浮液的垂直高度的15%的dof的显微镜获得所述至少一幅显微图像。4)如项1)至3)中任一项所述的方法,其中所述dof在0.5μm与10μm之间。5)如项1)至3)中任一项所述的方法,其中所述dof在0.5μm与5μm之间。6)如项1)至5)中任一项所述的方法,其中所述细胞是人细胞。7)如项1)至5)中任一项所述的方法,其中所述细胞包括至少50%红细胞。8)如项1)至5)中任一项所述的方法,其中所述细胞包括至少75%红细胞。9)如项1)至8)中任一项所述的方法,包括以稀释因子(d)稀释包括所述细胞的血液样品以获得所述细胞悬浮液,所述因子d是稀释前每一ml细胞的浓度(c0)与所述预期的浓度c的函数。10)如项9)所述的方法,其中通过以下函数确定所述因子d:11)如项9)或10)所述的方法,其中样品是血液样品且所述因子d在50与300之间。12)如项9)或10)所述的方法,其中所述因子d在约75与200之间。13)如项9)或10)所述的方法,其中所述因子d为约100。14)如项1)至13)中任一项所述的方法,包括稀释包括红细胞的血液样品以获得细胞悬浮液中的细胞浓度c,使得在沉降到所述基底表面上后,细胞的密度在约10,000至约30,000个细胞/mm2之间。15)如项1)至14)中任一项所述的方法,所述稀释提供了形成具有在0.4与0.9之间的平均基底表面覆盖度的单层的细胞悬浮液。16)如项15)所述的方法,其中所述基底覆盖度在0.4与0.6之间。17)如项1)至16)中任一项所述的方法,包括选择提供所述dof的显微镜物镜透镜,其中所述透镜允许获取在其任一维度不大于3μm长的至少一个物体的图像。18)如项17)所述的方法,其中所述透镜允许获取具有相对于所述基底表面不大于3μm的高度的至少一个物体的图像。19)如项1)至18)中任一项所述的方法,包括分析所述至少一幅图像以基于所述至少一幅图像确定所述细胞悬浮液中病原体的存在或不存在。20)如项19)所述的方法,其中所述细胞的至少一部分感染了病原体。21)如项19)或20)所述的方法,其中所述病原体是寄生虫。22)如项21)所述的方法,其中所述寄生虫是血液感染原生动物。23)如项22)所述的方法,其中所述血液感染原生动物选自由锥虫属(trypanosoma)、疟原虫属(plasmodium)、弓形虫属(toxoplasma)和巴贝虫属(babesi)组成的属。24)如项22)所述的方法,其中所述血液原生动物是选自由恶性疟原虫(p.falciparum)、间日疟原虫(p.vivax)、卵形疟原虫(p.ovale)、三日疟原虫(p.malariae)和诺氏疟原虫(p.knowlesi)组成的组的疟原虫。25)如项1)至24)中任一项所述的方法,包括应用所述载体中的至少部分上部表面,将所述至少部分上部表面放置在预期的垂直深度h。26)如项25)所述的方法,其中所述一个或更多个间隔物包括微粒。27)如项1)至26)中任一项所述的方法,包括在将所述细胞悬浮液引入到所述载体上之前、在使所述细胞沉降之前或在获取所述至少一幅显微图像之前将所述细胞与一种或更多种染色剂混合。28)如项27)所述的方法,其中所述一种或更多种染色剂的至少一种是荧光染色剂且其中所述至少一幅显微图像包括用于检测使用所述荧光染色剂染色的荧光图像。29)如项1)至28)中任一项所述的方法,包括使所述细胞以每μm垂直深度h约1秒钟的时间段沉降在所述基底表面上藉以形成所述单层。30)如项1)至28)中任一项所述的方法,包括允许用于所述细胞沉降在所述基底表面上作为单层的少于5分钟的时间段。31)如项1)至30)中任一项所述的方法,其中所述细胞悬浮液的所述垂直深度h在20μm和1000μm之间。32)如项1)至31)中任一项所述的方法,其中所述垂直高度h在20μm至300μm之间。33)如项1)至32)中任一项所述的方法,其中所述细胞悬浮液的所述垂直深度h在20μm和300μm之间。34)如项1)至32)中任一项所述的方法,其中所述细胞悬浮液的所述垂直深度h在20μm和250μm之间。35)如项1)至34)中任一项所述的方法,包括获取多幅显微图像,所述多幅显微图像的至少两幅在不同的条件下提供,所述条件包括使所述基底表面的不同部分成像和不同的照射条件。36)一种试剂盒,所述试剂盒包括:-载体,所述载体包括基底表面和垂直高度(h);以及-用于执行以下步骤的使用说明:-从包括红细胞的血液样品提供细胞悬浮液,所述细胞悬浮液具有由以下函数确定的细胞浓度(c):c=f/(h*pi/4*d2)(f)是预期的基底表面覆盖度;以及(d)是所述细胞悬浮液中的细胞的平均细胞尺寸;-将所述预期的浓度c的细胞悬浮液引入到所述载体的基底表面上,当在所述载体中时所述细胞悬浮液具有所述垂直深度(h),所述垂直深度(h)小于或等于所述垂直高度(h);-使所述细胞悬浮液中的细胞沉降到所述载体的所述基底表面上以在所述基底表面上形成细胞单层;-获取所述细胞单层的至少一部分的至少一幅显微图像,其中通过将显微镜设置为不超过当沉降到所述基底表面上时所述细胞悬浮液的垂直高度的20%的景深(dof)获得所述至少一幅显微图像。37)如项36)所述的试剂盒,其中所述使用说明用于执行如项1至35中任一项所述的方法。38)一种用于使血液样品成像的系统,所述系统包括:-一个或更多个容器单元,所述一个或更多个容器单元用于分别容纳包括至少一种血细胞稀释剂的一种或更多种样品处理剂;-血液样品制备单元,所述血液样品制备单元与所述一个或更多个容器单元流体连通且被配置为接收包括红细胞的血液样品及至少一种血细胞稀释剂的用量并由此形成血细胞悬浮液,所述至少一种细胞稀释剂的用量确定为以稀释因子(d)稀释所述细胞的样品以便提供细胞浓度(c);-显微图像获取单元,所述显微图像获取单元用于获取当在载体的基底表面上时所述血细胞悬浮液的至少一幅图像,所述载体具有大于或等于当在所述基底表面上时所述细胞悬浮液的垂直深度(h)的垂直高度(h);-控制单元,所述控制单元被配置为:-提供稀释所述样品的稀释因子d,因子d是预期的基底表面覆盖度(f)、细胞血细胞的平均细胞尺寸d和当沉降到所述载体的所述基底表面上时提供细胞单层的所述细胞的悬浮液的垂直深度h的函数;以及-通过设置为不大于当沉降到所述基底表面上时所述细胞悬浮液的垂直高度的20%的景深(dof)的显微镜获取所述细胞悬浮液的至少一幅显微图像。39)如项38)所述的系统,其中所述一种或更多种处理剂包括一种或更多种染色剂。40)如项39)所述的系统,其中所述至少一种稀释剂的至少一种包括所述一种或更多种染色剂。41)如项40)所述的系统,其中至少一种染色剂是荧光染色剂。42)如项38)至41)中任一项所述的系统,其中所述至少一种染色剂选自由吖啶橙、赫希斯特家族、分子信标、sytox或dapi组成的组。43)如项38)至42)中任一项所述的系统,包括流体抽取机构,所述流体抽取机构用于从血液来源抽取血细胞的样品以及将所述血细胞的样品引入所述样品制备单元。44)如项38)至43)中任一项所述的系统,包括细胞计数单元,所述细胞计数单元用于计数由所述细胞制备单元接收的细胞。45)如项38)至44)中任一项所述的系统,其中所述样品制备单元包括搅拌单元,所述搅拌单元被配置为使所述细胞悬浮液中的细胞均匀地分布。46)如项38)至45)中任一项所述的系统,包括输出端口,所述输出端口用于输出所述至少一幅图像或与所述图像对应的数据。47)如项38)至46)中任一项所述的系统,包括存储单元,所述存储单元通过所述控制单元可访问并包括指示所述输入参数的数据。48)如项42)所述的系统,其中所述数据还包括用于一个或更多个输入参数的所述血液样品中的细胞类型并且所述数据通过所述控制单元可访问。49)如项38)至48)中任一项所述的系统,包括处理器,所述处理器被配置为分析所述至少一幅显微图像以基于所述至少一幅显微图像确定所述细胞悬浮液中的病原体的存在或不存在。50)如项49)所述的系统,其中所述病原体是寄生虫。51)如项38)至50)中任一项所述的系统,其中将所述控制单元配置为使所述显微图像获取单元获取所述单层的多幅显微图像,所述多幅显微图像的至少两幅在不同的条件下提供,所述条件包括所述单层的不同部分和不同的照射条件。附图概述为了更好地理解本文公开的主题并例证其在实践中可如何实现,现将参照附图仅通过非限制性实例描述实施方案,其中:图1a-1c图解了根据本公开内容的非限制性实施方案的系统的构件以及根据一些实施方案使用的载体。图2是当在根据本发明的实施方案获得的单层中鉴定布氏锥虫(trypanosomabrucei)寄生虫(用箭头标记的)时捕获的来自外周血样品的布氏锥虫寄生虫的显微图像。图3是当在根据本发明的实施方案获得的单层中鉴定布氏锥虫寄生虫(用箭头标记的)时捕获的来自外周血样品的布氏锥虫寄生虫的荧光图像。图4a-4b示出了在20x放大倍数以及75%单层覆盖度下作为血细胞的亮图像获得的血液样品的图像(图4a)和在2.3μm景深下用吖啶橙荧光染料(λ=570nm)染色的相应荧光图像(图4b),显示如箭头所示的病原体的存在。图5a-5b示出了在20x放大倍数以及80%单层覆盖度下作为血细胞的亮图像获得的血液样品的图像(图5a)和其用赫希斯特33342(hoechst33342)染色的相应荧光图像(显示在460nm下的发射)(图5b)。在图像中我们显示了我们通过区分样品中的疟疾病原体与远小于rbc的血小板以诊断导致疟疾的疟原虫滋养体的能力。实施方式的详细描述本公开内容基于以下理解:在细胞制备(cellpreparates)领域中有以快速(以秒钟或几分钟的尺度计)且可重复的方法在单层中提供细胞以便允许使细胞样品特别是血液样品中的小物体快速成像的需求。为了这个目的,发明人开发了不需要使用昂贵的仪器或在显微镜检查之前等待直到样品变干的简单的方法。特别地,本发明提供了一种方法,包括将包括红细胞的细胞悬浮液引入到载体的基底表面上,该载体具有大于或等于当在所述基底载体上时所述细胞悬浮液的垂直深度(h)的垂直高度(h),细胞悬浮液包括由以下函数确定的细胞浓度(c):c=f/(h*pi/4*d2)(f)是预期的基底表面覆盖度;以及(d)是细胞悬浮液中的细胞的平均细胞尺寸;使细胞悬浮液中的细胞沉降在载体的所述基底表面上以在载体的基底表面上形成细胞单层;获取细胞单层的至少一部分的至少一幅显微图像,其中通过以不超过当沉降到所述基底表面上时细胞悬浮液的垂直高度的20%的景深(dof)的显微镜获得所述至少一幅显微图像。任选地,当假定载体的垂直高度h和样品的垂直深度h近似地相等时,诸如当用样品填充满载体或其腔室时,可使用载体的垂直高度h作为样品的垂直深度h的近似值计算细胞浓度c。血液样品可含有各种各样的细胞,包括红细胞、血小板和巨噬细胞。如此,在本公开内容的上下文中,当提及d时,应理解为意思是考虑样品中的各种各样的细胞的不同尺寸的样品中细胞的平均尺寸。由于血液样品中的绝大多数细胞是rbc,在一些实施方案中可将d取为rbc的平均尺寸。尺寸(d)以mm提供。例如d的值可通过光谱学测定或来自文献。例如,人rbc的平均直径为6.2-8.2μm(0.0062-0.0082mm)。在用于确定细胞浓度c的上述函数中,pi是定义圆周长与它的直径的比率的常数且约等于3.14159。在本文使用的基底表面覆盖度f,定义了细胞沉降在基底表面上后由细胞覆盖的基底表面面积的百分比,且为了便于说明,当f=1或接近1时,100%或几乎100%的细胞完全地覆盖基底表面。当f=0时,没有细胞在基底表面上。在本公开内容的上下文中,高f(换句话说,较接近1)能够快速显示较大量的细胞而低f(换句话说,较接近0)能够在不同细胞之间清楚的区分以及在一些实施方案中还可以能够更精确的预测。在一个实施方案中,平均基底表面覆盖度在40%(f=0.4)与90%(f=0.9)之间。在一些其他实施方案中,平均基底表面覆盖度在40%与60%之间(f在0.4与0.6之间)。垂直深度h可取决于分配用于细胞沉降到表面基底的预期的最小或最大时间间隔。在高度(垂直深度)与细胞沉降到基底需要的时间之间有直接的关系。在一些实施方案中,为了在短时间内(例如,几十秒钟及直至仅几分钟)形成单层,h在20μm至1000μm的范围中。在一些其他实施方案中,h在25μm至600μm或30μm至250μm或甚至75μm至200μm的范围中。将使其成像的细胞是包括至少红细胞(rbc)的血细胞(全血或rbc样品)。在一些实施方案中,血细胞是人血细胞。在一些实施方案中血液样品包括白细胞(wbc)、细菌和血小板的至少一种。进一步,在一些实施方案中,血液样品包括至少50%rbc。在一些其他实施方案中,血液样品包括至少75%rbc。从生命实体抽取的血液样品中的血细胞的平均浓度是本领域中已知的。例如,血液中最高正常红细胞(rbc)浓度对于女性是420至540万/μl,对于男性是470至610万/μl以及对于儿童是460至480万/μl。当使用在文献中已知的浓度时,取平均值或最大正常值并用它作为稀释的基础值以便获得预期的浓度c可能是有用的。例如,对于人血液样品可使用约6m细胞/μl的值。可选地,可在稀释之前和/或之后(如本领域中已知的,手动地或自动地)计数或估算血液样品中的细胞以便对给定的样品具有精确的细胞计数。细胞悬浮液的预期的浓度c是这样的,如果将一定体积的细胞悬浮液放置在载体的基底表面以便细胞悬浮液具有测定的或估算的垂直深度,并且使所有或几乎所有细胞沉淀到载体的表面,在表面上形成单层而在细胞之间没有或几乎没有重叠。可测定或利用(impose)或估算细胞悬浮液的垂直深度h。例如,当将细胞悬浮液引入到具有垂直高度h的载体的基底表面上时,h的最大值等于h。因此当细胞悬浮液实质上完全地填充载体时可假定细胞悬浮液的垂直深度h与载体的垂直高度h相等。如果将较少量的细胞悬浮液引入到基底表面上,将不完全地填充垂直高度h,并且因此可基于填充的程度和/或通过将细胞悬浮液的体积除以它覆盖的表面面积来计算或估算垂直深度h。细胞在载体的基底表面上的沉降可能花几秒钟到几分钟,例如在不施加外力(例如,机械力或离心力)以影响过程下。为了这个目的,方法提供了在将细胞引入到载体上与获取图像之间的时间段以使细胞沉降并形成单层。在一些实施方案中,时间段是不多于5分钟,有时候,不多于2分钟,或甚至不多于90秒钟,在该时间段后载体的基底的表面上形成了预期的单层。在一些实施方案中,沉降涉及在将细胞悬浮液引入到所述基底表面上之后将基底表面维持在水平位置以及在20秒钟至5分钟之间的时间间隔。有时候由载体的侧壁的高度(垂直高度(h))和悬浮液的垂直深度h决定时间间隔(即,每mmh的分钟)。在该时间间隔期间可将载体维持实质上没有运动。在一些实施方案中,直至形成了单层的时间间隔不少于20秒钟,有时候,不少于30秒钟。在本公开内容的上下文中,当提及细胞“单层”时,应理解为包括细胞在表面上的分布为实质上单层,其中至少50%,有时候至少60%、70%、80%或甚至90%的细胞与载体的基底表面直接接触以及不多于20%,有时候不多于10%或甚至不多于5%的细胞彼此重叠(即,不多于20%的细胞部分地或全部地一个位于另一个的上面)。进一步,当提及“单层”时,应理解的是至少5%,有时候,至少10%或甚至至少20%的细胞在可靠的基底表面上彼此接触。为了提供细胞单层,需要以预期的浓度c将细胞样品引入到载体上。有时候,引入到载体上的细胞已经具有浓度c,尽管,有时候细胞的浓度是需要稀释的。为了获得样品中的血细胞(一般来说主要为rbc)的浓度c,可将细胞样品稀释。如此,并根据一些实施方案,方法包括以稀释因子(d)稀释血液样品以提供细胞悬浮液。可如下基于预期的浓度c与稀释之前细胞的浓度(c0)计算因子d:由于预期的浓度c可计算为c=f/(h*pi/4*d2)。如此,可使用以下公式计算d因子:稀释之前细胞的浓度(c0)可基于计数样品中的细胞。可通过本领域任何已知的技术执行计数,包括但不限于,计数室(血细胞计数器)、平板法、分光光度法、流式细胞术、库尔特计数器及使用图像分析技术。有时候,可应用来自文献的信息。例如,血液中最高正常红细胞(rbc)浓度对于女性是420至540万/μl,对于男性是470至610万/μl以及对于儿童是460至480万/μl。当使用在文献中已知的浓度时,取平均值或最大正常值并用它作为稀释的基础值可能是有用的。例如,对于人血液样品可使用约6m细胞/μl的值。在这样的实例中,可选择d以确保绝大多数正常的样品将落入预期的f的范围。要注意的是,只要总稀释以因子d进行(或最终细胞浓度等于c),以稀释因子d的稀释可在一个或更多个稀释步骤中执行。如此,根据本公开内容,为了获得包括rbc的血细胞单层,考虑以下内容:对于在每μl血液样品中的血细胞的浓度c0=6,000,000(正常血液样品中的c0为4,000,000至6,100,000细胞/μl);对于血液中的细胞的平均直径d=0.0075mm;对于载体具有垂直高度h=0.2mm以及悬浮液具有垂直深度h=0.2mm;对于期望的基底表面覆盖度f=0.5(细胞单层覆盖50%的表面);使用上面公式计算的稀释因子d将因此为约100。相似地,在相同条件下但是使用具有垂直高度h=0.1mm的载体以及具有垂直深度h=0.1mm的悬浮液,使用上面公式计算稀释因子d,且将因此具体地为约50。在一些实施方案中,稀释是以约50至约300之间的因子d进行。在一些其他实施方案中,因子d在约75和约200之间。在又一些其他实施方案中,稀释是以约100的因子d进行。在又一些其他实施方案中,稀释包括rbc的血液样品是以便获得细胞悬浮液中的细胞浓度c,使得在沉降到载体的基底表面上并形成预期的单层后,在表面上的细胞的密度为约10,000至约30,000个细胞每mm2之间。可使用任何细胞稀释剂诸如已知在细胞生物学领域中使用的在样品制备时将是等渗的缓冲液稀释(通过因子d)。缓冲液的非限制性实例包括磷酸盐缓冲盐水(pbs),包括以下的缓冲液:4-(2-羟乙基)-1-哌嗪乙磺酸(hepes)、2-(n-吗啉)乙磺酸(mes)、哌嗪-n,n’-双(2-乙磺酸)(pipes)、n-(2-乙酰氨基)-2-氨基乙磺酸(aces)、3-(n-吗啉基)丙磺酸(mops)、2-[[1,3-二羟基-2-(羟甲基)丙-2-基]氨基]乙磺酸(tes)、2-(双(2-羟乙基)氨基)乙酸(n,n-二[羟乙基]甘氨酸(bicine))、3-[4-(2-羟乙基)-1-哌嗪基]丙磺酸(hepps或epps)、3-[[1,3-二羟基-2-(羟甲基)丙-2-基]氨基]丙烷-1-磺酸(taps)、n-(2-羟基-1,1-双(羟甲基)乙基)甘氨酸(三羟甲基甘氨酸(tricine))、乙二胺四乙酸(edta)、氯化钠(nacl)、三(羟甲基)氨基甲烷(tris)。可在没有额外的干预(例如,没有离心或涂抹)的情况下执行在将细胞悬浮液引入载体时或其后形成单层。这可仅仅通过使样品在载体的平坦的水平表面上静止一段短的时间(换句话说,从秒钟到几分钟)执行。一旦细胞沉降在载体的基底表面上并且形成了预期的单层(作为在所述引入时预期的细胞浓度的结果),获取细胞的至少一幅显微图像。图像是关于细胞覆盖的表面的至少一部分。显微成像技术是在本领域中熟知的,并且特别地,包括光学显微术、荧光显微术等等。在一些实施方案中,显微成像用于诊断目的。任选地,采集一幅或更多幅荧光图像和一幅或更多幅明场图像二者。发明人发现,为了在从预期的浓度c(如上讨论的)的细胞悬浮液中获得的血细胞的单层中检测物体,人们应当选择特定的景深(dof)范围以使在血细胞的群中清楚地显示小物体。dof已知为在图像中显现可接受地清晰的视景中最近的物体与最远的物体之间的距离。dof主要是显微镜的物镜透镜和放大倍数的属性,后者由感兴趣的分辨率确定。例如,对于尺寸约1μm的物体(例如,裂殖体或一些血小板),通常将需要至少0.5μm的分辨率;相似地,对于尺寸约2μm的物体,通常将需要至少1μm的分辨率。这还决定放大倍数,且至少20x的放大倍数将用于约0.5μm的分辨率,而至少10x的放大倍数将用于约1μm的分辨率。在这方面,需要注意的是选择透镜以提供预期的放大倍数。透镜以数值孔径(na)为特征。例如用于20x放大倍数的透镜可能具有约0.4-0.5的数值孔径(na),而用于10x放大倍数的透镜可能具有明显较小的na。根据shillaber公式,对于给定光的波长(λ)及介质折射率(ri),dof与na有关:下面提供了使用500nm光以及空气作为显微镜物镜和物体之间的介质(ri=1.00)时几种商业上可获得的显微镜物镜的dof的非限制性实例:放大倍数数值孔径(na)景深(dof)4x0.105010x0.257.720x0.402.940x0.650.960x0.850.36100x0.950.17为了获得感兴趣的dof,根据一些实施方案,方法可包括选择提供所述dof的显微镜物镜透镜,其中所述透镜允许获取在其任一维度不大于3μm长的至少一个物体的图像。在一些实施方案中,所述透镜允许获取具有相对于所述基底表面不大于3μm的高度的至少一个物体的图像。发明人出人意料地发现了对于高分辨率显微镜制备单层不需要将血液放置入本领域已知的特殊的载体,该载体经常具有15μm或更小的垂直高度h。相反,通过提供稀释的细胞样品并将其插入具有较大垂直高度h的载体的基底表面可形成单层,且该单层分散良好且可在十分高的分辨率下使该单层成像,考虑到当放置在基底表面上时悬浮液的相对大的垂直深度h,该分辨率是出人意料的。发明人已经成功地确定了,形成具有至少40%细胞的预期的表面覆盖度(f>0.4)的这样的血细胞单层之后,其对于在即使是放置在基底表面上时悬浮液的垂直高度h的甚至20%或更少、有时候不多于15%的垂直高度或甚至不多于10%的所述垂直高度的dof下的使用是足够的。为了这个目的,如以下进一步讨论的,发明人已经确定了垂直高度h可在30μm至300μm范围内。如此,且仅仅作为实例,对于具有约1μm尺寸的物体(如,裂殖体和一些血小板),通常需要至少0.5μm的分辨率,为此至少20x的放大倍数通常以约0.4-0.5的数值孔径(na)为特征。0.4-0.5的数值孔径可提供2.9μm的dof,其不大于本文定义的当放置在表面基底上时悬浮液的30-300μm垂直高度h的20%。相似地,并仅仅作为进一步的实例,对于具有约2μm尺寸的物体,将通常需要至少1μm的分辨率,且将因此使用至少10x的放大倍数。对于该放大倍数,可使用具有约0.2-0.25的na的透镜且这与显著地大于上述20x物镜的dof,但仍然不大于本文定义的当沉降到表面基底时细胞的30-300μm垂直高度h的20%的dof相关。与上文一致且根据本发明的一些实施方案,成像在约0.5μm与约10μm之间;有时候在约0.5μm与约5μm之间的dof下执行。用于获取显微图像的上述条件允许检测在血液样品中的小于红细胞的小物体诸如血小板和病原体。根据一些实施方案,显微镜装置提供了允许获取在其任一维度下不大于3μm长的至少一个物体的图像(一幅或更多幅)的dof。如上所述,为了允许使这些较小的物体成像,需要样品中的较大细胞的单层,且这通常需要在引入到载体上之前稀释原始血液样品(任选地包括抗凝剂或edta)。然而,除稀释外,可用一种或更多种其他试剂诸如染色剂处理细胞(例如,可将细胞与其混合)。可在将样品放置入载体之前、期间或之后执行染色。染色剂可为适合于细胞染色的任何染料、探针或底物,包括荧光染料,并且如果添加多种染料、探针或底物,染色剂的一些或全部可为荧光染料。在一个实施方案中,至少一种染色剂是荧光染料。在一些实施方案中,至少一种染料包含在稀释剂中。当提及染色剂时,应理解为包括能够染色生物细胞的成分以增强收缩并加亮染色的物体的结构的任何化学的或生物的物质,无论该染色的物体是细胞或细胞的部分。染色剂可具有种类偏好性或特异性,例如,对核酸染色以及在核酸中对dna或rna的偏好性或特异性,对氨基酸、对脂质、对碳水化合物等的偏好性或特异性。当提及偏好性或占优势的染色时,应理解的是染色剂以特定的颜色或荧光标记(染色)细胞成分,该颜色或荧光的强度比在该相同的颜色或荧光光谱下对另一种细胞成分的染色强度大至少两倍、三倍、四倍或甚至10倍。在一些实施方案中,当提及偏好性或占优势的染色时,应理解的是染色剂具有对一种细胞成分的亲和力(分子吸引力)(以特定的颜色或荧光光谱),该亲和力是(在该相同的颜色或荧光光谱下)它对另一种细胞成分的亲和力的至少两倍、三倍、四倍或甚至10倍更大。在一些另外的实施方案中,当提及偏好性或占优势的染色时,应理解的是染色剂对该一种成分的染色是稳定的或与它对其他成分的染色相比具有更高的稳定性。可将稳定性理解为指在开始与染色剂接触至少30分钟后,有时候在使用对该一种成分具有偏好性的染色剂染色样品后至少1小时、至少2小时或甚至5小时后,染色剂产生的染色基本上是保持一致的。可选地,可将稳定性理解为指在暴露于光(例如,用于荧光激发的光)至少0.25秒钟、1秒钟或甚至15秒钟暴光期间,染色剂产生的染色基本上是保持一致的。在该上下文,应理解的是,例如,对dna具有偏好性的染色剂可能也染色其他细胞成分但具有较低的吸引力或较低的强度或具有不同的荧光响应(激发光谱和/或发射光谱)使得它允许较大地增强染色剂对其具有偏好性的一种成分。例如,染色剂可能占优势地染色dna,然而,在一些其他条件下,相同的染色剂可能染色rna。在一些实施方案中,染色剂不是细胞类型特异性的。换句话说,染色剂可以不是特定病原体特异性的或特定病原体的细胞周期的特定阶段特异性的或感染了该特定病原体的宿主的特定细胞特异性的并且将染色细胞成分而不考虑其来源,例如,dna序列或结构本身、rna序列或结构本身、蛋白质本身,等。根据本公开内容可使用各种各样的染色剂。在一些实施方案中,染色剂是生色团或荧光团。染色剂诸如吉姆萨染色剂(cas51811-82-6)已知是生色的——它们的效果是为样品提供颜色或不透明性,以及,例如,在明场显微术中是可见的。在一些实施方案中,染色剂提供了样品的荧光染色。荧光通过用“激发”光谱照射样品可视化,所述用“激发”光谱照射样品产生在不同的光谱的“发射”。在一些实施方案中,染色剂是选自由以下组成的组的荧光染料(fluorochromaticdye):吖啶橙(ao,n,n,n',n'-四甲基吖啶-3,6-二胺,染色dna呈绿色,染色rna呈红色);吉姆萨染色剂,已知其为亚甲蓝(3,7-双(二甲基氨基)-吩噻嗪-5-鎓氯化物)、伊红(cas号17372-87-1)和天青b(三甲基硫堇氯化物)的溶液;溴化乙锭(3,8-二氨基-5-乙基-6-苯基菲啶鎓溴化物);赫希斯特家族(c25h26n6r,r代表多种可能的取代基,例如,但不限定为,-oh(赫希斯特33258)、-ch2ch3(赫希斯特33342)、-n(ch3)2(赫希斯特34580)、-so2nh2(赫希斯特s769121));dapi(4',6-二脒基-2-苯基吲哚);碘化丙啶(2,7-二氨基-9-苯基-10(二乙基氨基丙基)-菲啶鎓碘化物甲碘化物(2,7-diamino-9-phenyl-10(diethylaminopropyl)-phenanthridiumiodidemethiodide));sybr家族;yoyo;draq家族;sytox家族;toto家族;结晶紫(三(4-(二甲基氨基)苯基)甲基氯化物(tris(4-(dimethylamino)phenyl)methyliumchloride));任何或所有分子探针信标;相邻探针;核酸酶探针;lightup探针;基于底物的探针苏木精染色剂;臧红(对称的2,8-二甲基-3,7-二氨基-吩嗪的氮鎓化合物);酸-希夫染色剂;masson’s染色剂;普鲁士蓝及其任何组合。在一个实施方案中,使用了多于一种染色剂。例如,可用两种或更多种染色剂染色样品,包括至少一种占优势地染色dna的染色剂从而提供在dna与至少一种与dna不同的其他细胞成分之间的差异染色。可选地,可使用单一染色剂,在两个不同的波段下激发该染色剂,从而提供两种不同的颜色。例如,染色剂诸如ao对不同的细胞成分提供不同的荧光光谱。当ao在中性ph下染色dna时,它具有在502nm下的激发最大值(青色)和525nm下的发射最大值(绿色);当ao在中性ph下染色rna时,激发最大值移动到460nm(蓝色)以及发射最大值动到650nm(红色)。如此,取决于激发波长和样品的条件,其允许在dna与rna之间差异染色。当提及两种或更多种染色剂的组合时,应当理解的是,可同时地或依次地将两种或更多种染色剂添加到样品。本文公开的方法提供了血液样品中病原体的检测。因此,不需要所有细胞被感染且当病原体仅感染了一部分细胞(甚至单个细胞)时该方法也是适用的。病原体可为任何感染性微生物。在一些实施方案中,病原体是真核寄生虫,且寄生虫可为一个细胞的寄生虫。在一些实施方案中,寄生虫是选自由锥虫属(trypanosoma)(引起恰加斯病和非洲昏睡病);疟原虫属(plasmodium)(引起疟疾);弓形虫属(toxoplasma)(引起弓形虫病);巴贝虫属(babesia)(引起巴贝虫病)组成的属的血内原生动物。特别地,当提及疟原虫属时,应理解为包括由恶性疟原虫(p.falciparum)、间日疟原虫(p.vivax)、卵形疟原虫(p.ovale)、三日疟原虫(p.malariae)和诺氏疟原虫(p.knowlesi)组成的组的至少任一成员。在一些实施方案中,将病原体理解为指特定的病原体或其组的生命周期的特定阶段。例如,可将本文公开的发明特别地应用于检测疟原虫属物种(plasmodiumspecies)或特别地恶性疟原虫的滋养体、裂殖体或配子体。将样品(通常地稀释的)引入其中的载体通过它的基底表面和侧壁界定。侧壁界定了载体的垂直高度(h),其等于或大于当将细胞样品引入到载体的基底表面上(也就是,引入到载体中)时该细胞样品的垂直深度(h)。如此,载体可为由基底表面和侧壁界定的并且与生物细胞是生物相容的具有内部空间的任何单元。当提及生物相容,应当理解的是细胞至少保持完整,并且任选地,还实质上地维持活力和/或功能性。可以以不同的形式提供载体。在一些实施方案中,载体是在诊断成像中适合的一种。根据本公开内容适用的载体的实例包括微流控通道和孔,诸如在多孔板中。本发明使用的载体可为不同的种类且可具有不同的形式,或者为商业上可获得的载体,或者为专门设计的载体,只要它具有不少于约20μm垂直高度且能够容纳具有垂直深度h(垂直深度是在载体中的样品的上表面与载体的基底表面之间的距离)的细胞样品且,非强制地,不大于1000μm。载体可具有开口末端,例如,开口上部(例如,具有侧壁的基底),有或没有相容的盖子,然而它也可以是具有用于引入细胞的专用的狭窄入口的封闭的腔体的形式(例如,以瓶或微流控腔室的形式)。在一些实施方案中,通过毛细力将细胞悬浮液引入腔室。有时候,可涂覆或处理载体的一个或更多个内部部分以使其变成亲水的并且增加了毛细力。在一些实施方案中,载体是孔,例如用于细胞培养的孔,且可用相容的盖子盖住孔。使用施加到细胞悬浮液的盖子可克服孔的壁对样品的毛细管效应,当后者以小体积引入时,毛细管效应可引起在孔中的样品的非均匀分布。上表面(是固定的或可移动的)可平行于基底表面或仅平行于其部分延伸。而且,其可在将细胞悬浮液引入到基底表面上之前或之后应用。载体或至少载体的基底表面可包括用于物理和/或化学固定被引入的细胞的手段(means)。可通过使用细胞粘合剂固定化。此外或可选地,可使基底表面带电荷以吸引细胞。例如,在rbc情况下,通过使用具有正电荷的多聚赖氨酸处理基底表面,这将吸引带负电荷的rbc并帮助获取更稳定的单层。可用于使表面带电的化合物的其他实例是氨基硅烷、环氧树脂(epoxy)、乙醛和戊二醛。当使用可移动的盖子时,它可将力施加到已经引入到基底表面上的样品上,并且通过这样以加快沉降过程。在另一方面,盖子可能(诸如通过纯粹的(sheer)重量)引起细胞的破裂。预防或最小化细胞损伤的一种方法是通过利用与平均细胞尺寸相容的尺寸的间隔物。此外,间隔物还可起到创建更均匀的层厚度并且进而细胞在载体的基底表面上更均匀的分布的作用。这些间隔物可为微粒或珠的形式,充当支撑盖子在细胞悬浮液上方的支柱或支撑体,而不引起对细胞的任何破坏性压力。间隔物的示范性形状可包括但不限于,具有柱形状以及圆形横截面、椭圆形横截面、六角形横截面、星形横截面的间隔物。此外,间隔物可为盘的形式,或可为具有多边形表面的珠的形式。间隔物的尺寸决定了在基底表面与盖子(上表面)之间的间隙。不受其限制,间隔物的尺寸使得在两个表面之间形成50μm,有时候100μm且进一步有时候200μm的空间。通过使用在50μm,有时候100μm且进一步有时候200μm范围内的沿着它们的较小轴的横截面直径来获得该空间。任选地,间隔物具有相当于样品中的细胞高度的直径。因此,它们可防止盖子挤压细胞到可损坏的程度。相应地,间隔物的直径可为2-3μm。当以珠的形式使用间隔物时,该空间可由珠半径诸如在上述范围中的珠半径决定。可用任何生物相容的材料制造间隔物。例如并不受其限制,乳胶、硅、玻璃、塑料等。进一步,间隔物可为透明的、半透明的或不透明的。它们还可为仅在给定波长或波段下可见的类型。可选择使用的间隔物的数量以便确保载体的上部与基底表面基本上平行。为了这个目的,有时候使用的间隔物单元具有实质上均匀的尺寸是优选的。为了在表面之间维持固定的高度,可将间隔物固定到所述表面中的至少一个表面,例如,基底表面。这还可减少需要的间隔物的数量。在一些实施方案中,使用在1个间隔物每mm2至2500个间隔物每mm2的范围内的间隔物(例如,珠)用量。在一些实施方案中,在基底表面与上部盖子之间的空间可通过附加到所述表面中的至少一个表面的弹簧的使用来决定。间隔物可用于建构具有任何给定的垂直高度(例如,等于流体样品的垂直深度h)的载体的过程中。例如,间隔物可在粘合腔室的上表面和下表面的粘结剂中混合(在诸如在液晶显示器(lcd)中使用的粘结剂中混合珠)。本公开内容还提供了试剂盒,该试剂盒包括:载体,所述载体包括基底表面和垂直高度(h);以及用于执行以下步骤的使用说明:-从包括红细胞的血液样品提供细胞悬浮液,细胞悬浮液具有由以下函数确定的细胞浓度(c):c=f/(h*pi/4*d2)(f)是预期的基底表面覆盖度;以及(d)是细胞悬浮液中的细胞的平均细胞尺寸;-将预期的浓度c的细胞悬浮液引入到载体的基底表面上,当在所述载体中时细胞悬浮液具有所述垂直深度(h),所述垂直深度(h)小于或等于垂直高度(h);-使细胞悬浮液中的细胞沉降到载体的所述基底表面上以在基底表面上形成细胞单层;-获取细胞单层的至少一部分的至少一幅显微图像,其中通过将显微镜的放大倍数设置为不超过当沉降到所述基底表面上时细胞悬浮液的垂直高度的20%的景深(dof)获得所述至少一幅显微图像。试剂盒与其中的使用说明允许执行如本文所公开的方法。本公开内容还提供了一种用于使血液样品成像的系统,该系统包括:-一个或更多个容器单元,所述一个或更多个容器单元用于分别容纳包括至少一种血细胞稀释剂的一种或更多种样品处理剂;-血液样品制备单元,所述血液样品制备单元与所述一个或更多个容器单元流体连通且被配置为接收包括红细胞的血液样品及至少一种血细胞稀释剂的用量并由此形成血细胞悬浮液,所述至少一种细胞稀释剂的用量确定为以稀释因子(d)稀释所述细胞的样品以便提供细胞浓度(c);-显微图像获取单元,所述显微图像获取单元用于获取当在载体的基底表面上时血细胞悬浮液的至少一幅图像,载体具有大于或等于当在所述基底表面上时所述细胞悬浮液的垂直深度(h)的垂直高度(h);-控制单元,所述控制单元被配置为:-提供稀释所述样品的稀释因子d,因子d是预期的基底表面覆盖度(f)、细胞血细胞的平均细胞尺寸d和当沉降到载体的所述基底表面上时提供细胞单层的所述细胞的悬浮液的垂直深度h的函数;以及-通过设置为不大于当沉降到所述基底表面上时细胞悬浮液的垂直高度的20%的景深(dof)的显微镜获取细胞悬浮液的至少一幅显微图像。在一些实施方案中,将控制单元配置为基于访问的或引入的或已存储在系统中的参数测定稀释因子。为了这个目的,将控制单元配置为访问这样的参数,包括指示预期的基底表面覆盖度的参数。系统还可包括用于容纳具有大于或等于所述垂直深度(h)的垂直高度(h)的载体的分析腔室,所述分析腔室与所述样品制备单元流体连通且被配置为接收具有浓度c的细胞的用量到所述载体中。当提及流体连通时,应理解为包括连接一个单元与另一个单元的管道(conduit),例如,管路(pipe)、导管(tube),以及任何流体转移工具诸如自动的流体抽取和排放设备或移液器。作为本文公开的系统的部分,根据一些实施方案,所述一种或更多种处理剂可包括一种或更多种染色剂。所述至少一种稀释剂的至少一种包括一种或更多种染色剂。换句话说,可在稀释血液样品前将至少一种染色剂与稀释缓冲液混合。在一些实施方案中,至少一种染色剂是荧光染色剂。在一些实施方案中,至少一种染色剂选自由吖啶橙、赫希斯特家族、分子信标、sytox或dapi组成的组。此外且根据一些实施方案,系统包括流体抽取机构,所述流体抽取机构用于从血液来源抽取血细胞样品以及将所述血细胞样品引入所述样品制备单元。进一步,在一些实施方案中,系统包括细胞计数单元,所述细胞计数单元用于计数由细胞制备单元接收的细胞。在又一些另外的实施方案中,系统包括样品制备单元以及后者可包括被配置为使细胞悬浮液中的细胞均匀地分布的搅拌单元。如所理解的,根据一些实施方案,系统还可包括输出端口,所述输出端口用于输出所述至少一幅图像或与图像对应的数据到诸如相关的显示器和/或远程位置。还进一步,根据一些实施方案,系统可包括存储单元,所述存储单元通过控制单元可访问并包括指示所述输入参数的数据。数据可包括用于一个或更多个输入参数的血液样品中的细胞类型并且所述数据通过所述控制单元可访问。数据还可包括所述用于一个或更多个输入参数的血液样品中的细胞类型并且所述数据通过所述控制单元可访问。进一步,有时候,系统可包括处理器,所述处理器被配置为分析所述至少一幅显微图像以基于所述至少一幅显微图像确定所述细胞悬浮液中病原体的存在或不存在。优选地,系统用于检测血液样品中的一种或更多种寄生虫。系统还包括控制单元。根据一些实施方案,控制器被配置为使显微图像获取单元获取单层的多幅显微图像,其中的至少两幅在不同的条件下提供,所述条件包括使单层(或基底表面)的不同部分成像和不同的照射条件。现参考图1a,其为根据本公开内容的实施方案的系统100的构件的示意图。系统100包括用于容纳样品处理剂的试剂容器单元102和样品制备单元104,试剂容器单元102包括稀释剂并且通过管道线路106与样品制备单元104流体连通。虽然系统100图解为包括单个的试剂容器单元102,但是如在图1b中所示,可将系统相似地配置为包括多个试剂容器单元102a、102b、102c,每个用于容纳相同或不同的试剂并且通过管道106a、106b和106c的阵列与样品制备单元104流体连通。每个试剂容器单元102a、102b、102c可包括不同浓度的相同的稀释剂、不同的稀释剂或不同的处理剂,诸如染色剂、染料、间隔物试剂,如下面进一步讨论的。样品制备单元104配置为接收细胞的样品且,如果需要,接收来自试剂容器单元102的细胞稀释剂的用量。在运行中,在样品制备单元104中的细胞生物样品优选地是以细胞悬浮液的形式。为了这个目的,可将样品制备单元装备有混合机构,诸如温和的搅动器(stirrer)、摇动/搅拌(agitation)平台等(未示出),以便引起细胞在它们所处介质中悬浮(也就是说,防止细胞在样品制备单元中沉降)。系统100还包括用于容纳载体200的分析腔室108,其在图1c中图解为具有基底202、侧壁204、开口上部206和垂直高度(h)的孔。在图1a和1b中的分析腔室108通过管道线路110与样品制备单元104流体连通并被配置为在运行中且当其中容纳载体200时,载体200接收来自样品制备单元104的细胞用量,该细胞用量以预期的浓度c输送。值得注意的是,当将系统100解释为包括流体连通线路时,物质从一个单元向其他单元的转移可以可选地或额外地手动地例如使用转移设备诸如移液器和/或自动地例如通过机器人布置(roboticarrangement)完成。系统100还包括配置为特别是接收关于稀释前细胞的浓度(c0)、所述细胞的平均尺寸(d)与预期的基底表面覆盖度(f)的输入参数的控制单元112。可手动地诸如通过用户界面(未示出)和/或从储存的数据库提取将该输入引入控制单元112。控制单元112还配置为应用通过稀释剂稀释细胞的容器样品的因子d。进一步,控制单元112配置为控制系统的构件的运行,包括确定的稀释剂的用量从试剂容器单元102到样品制备单元104的输送,将细胞的用量从样品制备单元202到当容纳于分析腔室108中时的载体200的输送。控制单元还可配备有存储单元(未示出),所述存储单元可操作以存储一种或更多种输入参数,所述输入参数任选地与细胞类型和/或细胞来源以及预期的表面覆盖度(f)和预期的因子d相关的参数以及用户期望存储的任何其他参数。有时候,系统100还可包括用于容纳它的基本(未稀释的)浓度的细胞来源样品的样品容器114。样品容器114通过管道线路116与样品制备单元104流体连通。系统100还可包括成像仪118或与成像仪118相连接,该成像仪118用于在细胞以单层的形式沉降在载体200的基底表面202上后使载体200中的细胞成像;并且在这样的实施方案中,控制单元112进一步配置为开动成像仪118以获取在载体200中的细胞的至少一幅图像。成像仪118可为本领域中已知的任何图像获取设备。在一些实施方案中成像仪118为显微摄像机(例如,ccd)。有时候成像可需要在成像之前染色样品。为了这个目的,且如上也提到的,在系统100中一个或更多个试剂容器单元102a、102b或102c等可包括染色试剂。有时候,在试剂容器中的染色剂可与分析腔室108直接地流体连通(未示出)。进一步,有时候,在系统100中一个或更多个试剂容器单元102a、102b或102c等可包括间隔物试剂包括诸如如上所讨论的在合适的缓冲液中的微粒或珠。系统100还可包括细胞计数单元220或与细胞计数单元220相连接,该细胞计数单元220用于计数样品容器中的细胞数量(即估算稀释前细胞的浓度(c0)和/或样品制备单元中的细胞数量(预期的浓度c))。系统100还包括流体抽取机构,诸如泵和注射器(未示出),所述流体抽取机构被配置为由控制单元112决定从不同的容器单元抽取流体并将抽取的流体注射入样品制备单元104和/或当在分析腔室108中时注射入载体200,以及将从样品制备单元104的抽取的流体注射入分析腔室108。系统100还可包括输入和输出工具122和124,所述输入和输出工具122和124分别将数据引入控制单元112并呈递由成像仪获得的至少一幅图像或与所述至少一幅图像相应的数据。非限制性实施例的描述实施例1:布氏锥虫的检测如下测定哺乳动物血液样品(人)的布氏锥虫存在。一般来说,这样的血液样品在每1μl中持有3,000,000与6,000,00之间的rbc(c0)。制造了具有一个主腔室的支架,从而腔室的高度(h)为100μm且腔室可接收1μl的体积。使用含有1%tris-edta1mm、15μl赫希斯特1μg/μl、2μl吖啶橙1μg/μl、99%缓冲盐水的1000μl溶液将血液样品稀释50x(d)以具有在0.6-0.8之间的表面覆盖度(f)。将样品填充入腔室并将腔室转移到显微镜载物台使用自动的显微镜设备进行在明场中和在370nm和475nm激发及约433nm和517nm及613nm发射下的荧光二者中成像。样品的沉降以约1秒钟每1μm腔室高度(h)发生,其为约90秒钟。在将血液引入腔室后1-2分钟获取显微图像。对于荧光图像,在20x放大倍数下,用约2.3μm的景深(dof)(即,约2.3%样品高度)拍摄图像。如在图2中所示的明场图像中所见到的,细胞形成了单层,其中一些细胞是接触的但几乎没有细胞是重叠的。如所见,样品主要包括了红细胞,其覆盖了表面的约70%(f≈0.7)。此外,观察到布氏锥虫并用箭头示出。图3描述了荧光成像的相同细胞(在约350nm激发及在461nm测量发射)以相对于红细胞的背景特别地加亮布氏锥虫且允许检测它们。实施例2:恶性疟原虫的检测染色溶液组成本实施例染色溶液的目的是识别在活的血细胞内部的活的病原体(例如疟原虫属)。溶液包括赫希斯特33342(350nm激发)和吖啶橙(500nm激发)。将染料与盐水和tris-edta混合以创建等渗溶液以在染色期间将红细胞维持在生理条件下并防止它们裂解。将该溶液用作稀释溶液从而潜在地在单一步骤中提供染料并稀释细胞。染色血液样品进行疟原虫检测在上述染色溶液(~1:100)中稀释预先与edta(或任何其他抗凝剂)混合的血液。在10秒钟之内,血液染上化学染料并当合适地照射时发出在450nm及550nm之间的荧光信号。将与血液混合的溶液填充入塑料支架。当血细胞沉降后使用led荧光灯及荧光显微镜扫描它们。赫希斯特旨在染色细胞中的dna而吖啶橙意味着染色细胞中的rna。在正常的成熟红细胞中没有dna或rna,因此显示阳性染色的成熟红细胞可指示细胞内病原体诸如疟疾。布氏锥虫的检测用疑似感染了恶性疟原虫的血液样品执行与实施例1相似的测定。总之,在包括tris-盐水和荧光染料吖啶橙的荧光染色溶液中稀释全血样品达因子100(1:100)。将稀释的细胞样品/悬浮液引入具有约200μm的高度(h)的腔室并将其填充满,借以达到约200μm的垂直深度。然后使细胞沉降并形成单层。图4a示出了在20x放大倍数下细胞单层的明场图像,具有约75%的表观表面基底覆盖度(f≈0.75)。图4b示出了用染色溶液染色的稀释的血液样品的相同细胞的荧光图像,在该图像中示出了通过吖啶橙(ao)荧光染料染色,且在570nm下发射荧光。dof为2.3μm(为样品高度(h)的约1.12%)。在该图中描述的rbc具有约4μm的最大尺寸。在血液样品中检测疟原虫和血小板使用与上述图4a-4b中相同的测定条件和参数,还执行了在包括红细胞的血液样品中疟原虫和血小板之间的差示检测。图5a是以连续层的形式示出细胞的分布的明场图像。图5b是示出血小板和疟疾感染(在相同的rbc中有两个寄生虫,这样叫做滋养体)的荧光图像(460nm发射)。疟原虫的荧光信号较强且与由具有相似尺寸的血小板显示出的信号是可区分的。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1