KL-6检测乳胶凝集试剂的制作方法
本发明涉及生物技术领域,具体涉及一种kl-6检测乳胶凝集试剂。
背景技术:
在以生物体成分为检测样本的免疫检测法中,通常会把试剂的ph值调整至接近7.0,以使达到在接近生物体体内环境的条件下进行抗原抗体反应的目的。在临床检查中,乳胶凝集免疫检测法具有高通量及通用性高的优势,为了提高凝集反应的反应性,通常会将反应溶液的ph值由中性6.0~7.0调整至偏酸性。
另一方面,像涎液化糖链抗原-6(krebsvondenlungen-6,kl-6)这种类似涎液化糖链的较长糖链,其易发生凝集、扭转,其对抗原的特殊立体结构(表位)的特异性识别类似抗原抗体反应,将对反应强度带来致命影响。而且,kl-6是粘蛋白类糖链,不仅在不同患者之间,其在同一个生物体体内也具有多样性,因此造成其通过凝集、扭转形成的立体结构也千差万别。kl-6的临床意义是,通过检测其在血液中的含量来监控肺胞细胞等的损伤、损坏程度。然而,因其凝集、扭转不同而引起的反应强度的偏差,会极大地降低kl-6的临床意义,并且将引起严重的误诊及导致错误治疗。
为使上述的立体结构间的差别得以均一化,在免疫检测中常常会加入界面活性剂。然而,在以通用的生化自动分析仪为检测平台的乳胶凝集免疫检测试剂中,向试剂反应体系加入界面活性剂会造成检测单元受到污染。
此外,在使用乳胶凝集免疫检测试剂进行检测时,当把抗体固定在载体上后,除了通过氨基偶联等原理会引发粒子的化学偶联外,也会因疏水性吸附而引起粒子的物理吸附。尤其是在后一种情况中,由于粒子对抗体fc区域的物理性状的适应范围更广,在检测中我们更希望发生这类反应。然而,向试剂里加入界面活性剂会对抗体和粒子之间的疏水性吸附反应产生严重阻碍。
综上所述,为了实现使用乳胶凝集免疫检测法来对kl-6进行检测,不得不接受因kl-6的凝集、扭转而产生的千差万别的反应强度,这极大地损害了其临床意义。在临床检查中,这种反应强度的差别导致了乳胶凝集免疫检测法和其他免疫检测方法之间的检测值会发生相关性背离这一难题,因此急需具有良好相关性的kl-6乳胶凝集免疫检测试剂。此外,为了解决相关性背离的问题而变更其他的实验条件时,往往会使重复性变差。因此,同时实现良好的相关性和重复性非常困难。
技术实现要素:
本发明的目的是提供一种kl-6检测乳胶凝集试剂,以解决现有技术的不足。
本发明采用以下技术方案:
一种kl-6检测乳胶凝集试剂,以使用固定了抗kl-6抗体的粒子与检测样本中的kl-6在ph为7.8~9.0的条件下进行免疫凝集反应。
进一步地,包括第一试剂和第二试剂,第一试剂包括缓冲液,第二试剂包括固定了抗kl-6抗体的粒子、ph为7.8~9.0的缓冲液。
进一步地,在ph为8.0~9.0的条件下进行免疫凝集反应。
进一步地,第二试剂中缓冲液ph为8.0~9.0。
进一步地,第二试剂中固定了抗kl-6抗体的粒子的含量为0.01~1.00wt%。
进一步地,第一试剂缓冲液包括磷酸缓冲液、柠檬酸缓冲液、甘氨酸缓冲液、mes缓冲液、hepes缓冲液、tes缓冲液,mops缓冲液,bis-tris缓冲液,aces缓冲液,ada缓冲液、pipes缓冲液、tris-硼酸缓冲液、tris-hcl缓冲液、edta缓冲液、tris-edta缓冲液、碳酸氢盐缓冲液、tapso缓冲液、popso缓冲液、hepeso缓冲液、epps缓冲液、tricine缓冲液、bicine缓冲液、taps缓冲液、ches缓冲液、caps缓冲液中的一种或多种;第二试剂缓冲液包括磷酸缓冲液、柠檬酸缓冲液、甘氨酸缓冲液、mes缓冲液、hepes缓冲液、tes缓冲液,mops缓冲液,bis-tris缓冲液,aces缓冲液,ada缓冲液、pipes缓冲液、tris-硼酸缓冲液、tris-hcl缓冲液、edta-na缓冲液、tris-edta缓冲液、碳酸氢盐缓冲液、tapso缓冲液、popso缓冲液、hepso缓冲液、epps缓冲液、tricine缓冲液、bicine缓冲液、taps缓冲液、ches缓冲液、caps缓冲液中的一种或多种。
进一步地,第一试剂和第二试剂按体积比1:1~5:1混合,进行免疫凝集反应。
进一步地,免疫凝集反应在4-60℃下进行。
进一步地,免疫凝集反应在30~50℃下进行。
进一步地,免疫凝集反应时浊度的检测波长的主波长为300~1000nm。
本发明的有益效果:
本发明kl-6检测乳胶凝集试剂通过将反应溶液的ph范围控制在7.8以上9.0以下,可以实现使乳胶凝集免疫法的测量结果与其他的免疫检测方法具有极好的相关性这一目的,并保证高重复性。
附图说明
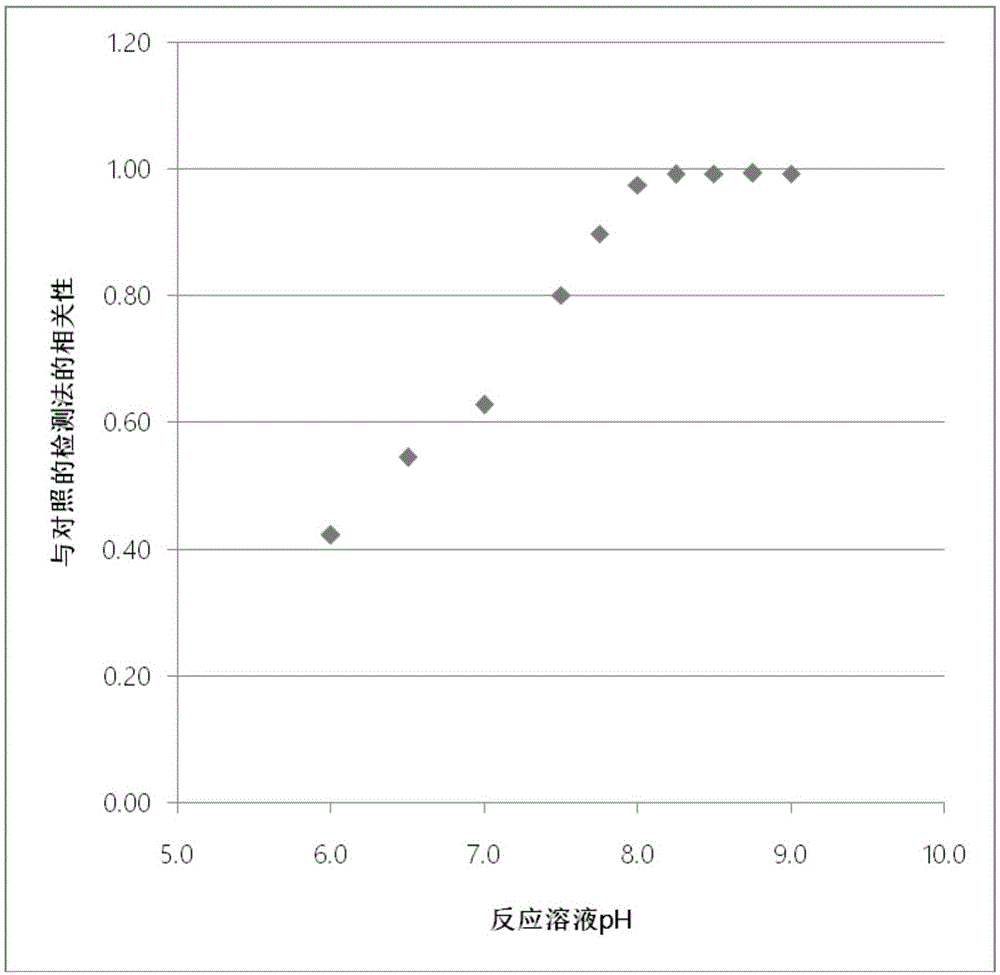
图1为使用tris-hcl缓冲液时的ph和相关性的比较。
图2为使用mes缓冲液时的ph和相关性的比较。
图3为反应溶液的ph对试剂反应性的影响。
图4为反应溶液的ph对检测灵敏度的影响
具体实施方式
下面结合实施例和附图对本发明做更进一步地解释。下列实施例仅用于说明本发明,但并不用来限定本发明的实施范围。
本发明kl-6检测乳胶凝集试剂,可以只由固定了抗kl-6抗体的粒子溶液组成。但是,由为稀释样本和为反应提供溶媒的第一试剂(反应缓冲液),和通过对固定了抗kl-6抗体的粒子溶液进行悬浊而得到的第二试剂(乳胶粒子溶液)来组成,则其检测结果更佳。其相关性结果、防止发生非特异性反应的效果及反应强度,会因第一试剂与第二试剂在混合时发生的多种情况而发生变化。但是,从大致的作用上来说,第一试剂的作用为稀释样本、优化检测对象的抗原性、防止发生非特异性反应及促进凝集反应(增强敏感度)。本发明中涉及的第二试剂,其缓冲液为分散媒介,固定了抗kl-6抗体的粒子为分散体。根据需要可以在第一试剂、第二试剂加入添加剂。
本发明抗kl-6抗体既可以使用多克隆抗体,也可使用单克隆抗体。抗kl-6多克隆抗体能够通过免疫小鼠、大鼠、兔、山羊、鸡、骆驼等动物来制得。抗kl-6单克隆抗体可以通过采用通常的单克隆化方法从其多克隆抗体来制得,也可以通过噬菌体展示技术来制得。为使能够在免疫凝集反应中获得较高的信号值,本发明中涉及的抗kl-6抗体优选使用单克隆抗体。
本发明中涉及的抗kl-6抗体的固定方法可以使用氨基偶联等化学偶联方法,也可以使用疏水性吸附等物理吸附法。
本发明中所涉及的粒子可以采用如下粒子:polystyrene(聚苯乙烯树脂)、styrene-methacrylicacidcopolymer(苯乙烯-甲基丙烯酸共聚物)、styrene-acrylicacidcopolymer(苯乙烯-丙烯酸共聚物)、styrene-glycidylmethacrylatecopolymer(苯乙烯-甲基丙烯酸缩水甘油酯共聚物)、styrene-styrenesulfonicacidsaltcopolymer(苯乙烯-苯乙烯磺酸盐共聚物)、methacryliccopolymer(甲基丙烯酸酯共聚物)、acryliccopolymer(丙烯酸酯共聚物)等。
本发明适宜使用经测定仪器测定其平均直径为0.05~0.50μm的粒子。
第二试剂中固定了抗kl-6抗体的粒子的浓度为0.01~1.00wt%。
本发明涉及的免疫凝集反应的ph条件通常为7.8~9.0,在8.0~9.0之间更佳。通过把进行免疫凝集反应时的ph值控制在上述范围内,可以使本发明的kl-6检测乳胶凝集试剂同时实现良好的相关性和重复性。如果ph值低于上述范围,则其相关性不好;如果超过上述范围,则重复性变差。
本发明涉及的免疫凝集反应发生的ph条件,其由第一试剂的ph值、第二试剂的ph值及发生反应时第一试剂和第二试剂的容量比来决定。第一试剂和第二试剂的ph值可以不同。在发生反应时,为保证第一试剂的稳定性,最好使第一试剂和第二试剂的混合容量比(v/v)为第一试剂:第二试剂=1:1~5:1。
本发明涉及的kl-6检测乳胶凝集试剂一般由含缓冲液的第一试剂和含有固定了抗kl-6抗体的乳胶粒子、ph为7.8~9.0的缓冲液的第二试剂构成。为使待测样本中的kl-6在ph为7.8~9.0的条件下进行免疫凝集反应,从试剂的重复性角度来看,将第一试剂的缓冲液的ph调整至7.8~9.0更佳。
为使在上述ph范围内进行免疫凝集反应,第一试剂和第二试剂需使用以下合适的缓冲液。如,磷酸缓冲液、柠檬酸缓冲液、甘氨酸缓冲液、mes(2-(n-吗啉)乙磺酸一水合物)缓冲液、hepes(n-(2-羟乙基)哌嗪-n'-乙烷磺酸)缓冲液、tes(三羟甲基氨基甲烷-乙二胺四乙酸-十二烷基硫酸钠,tris-hcl,edta,sds)缓冲液,mops(3-(n-吗啉)丙磺酸)缓冲液,bis-tris(二(2—羟乙基)亚胺基三(羟甲基)甲烷)缓冲液,aces(n-(2-乙酰氨基)-2-氨基乙烷磺酸)缓冲液,ada(n-(2-乙酰胺基)二氨基亚乙酸)缓冲液、pipes(哌嗪-1,4-二乙磺酸)缓冲液、tris-硼酸缓冲液、tris-hcl缓冲液、edta-na缓冲液、tris-edta缓冲液、碳酸氢盐缓冲液、tapso(3-三羟甲基甲胺-2-羟基丙磺酸)缓冲液、popso(哌嗪-1,4-二羟基丙磺酸)缓冲液、hepso缓冲液、epps(n-2-羟乙基哌嗪-n'-丙磺酸)缓冲液、tricine(三(羟甲基)甲基甘氨酸)缓冲液、bicine(n,n-二羟乙基甘氨酸)缓冲液、taps(n-三(羟甲基)甲基-3-氨基丙烷磺酸)缓冲液、ches(2-(环己胺)-1-乙磺酸)缓冲液、caps(3-(环己胺-1-丙磺酸))缓冲液等。
本发明涉及的缓冲液是通过将适量缓冲剂稀释至合适浓度调制而成。使用的缓冲剂浓度为1~500mm,最佳浓度为3~300mm。
本发明涉及的第一试剂,其必要成分为缓冲液,可根据需要加入添加剂。在可加入第一试剂的添加剂中,为优化检测对象(如蛋白、复合蛋白、多肽等)的抗原性,可加入氯化钠、氯化钾等盐类。为防止检测单元受到污染,可加入牛血清白蛋白等蛋白质。为防止由类风湿病因子、异嗜性抗体等引起的非特异性凝集反应,可以添加抗igm抗体、可与异嗜性抗体结合的蛋白等。此外,为防止因脂质而引起的非特异性凝集反应,可添微量的(第一试剂重量的0.01~1.00%的)tween、triton等界面活性剂。为增强凝集反应,可添加聚乙二醇、葡聚糖等水溶性高分子。
在可加入第二试剂的添加剂中,使用氯化胆碱等季铵盐或氨基酸可以达到保持粒子分散稳定性的目的;加入蔗糖等糖类、牛血清白蛋白(bsa)等担体蛋白可以达到维持包被抗体的反应稳定性的目的。
进行上述免疫凝集反应时的温度条件最好为4-60℃,30-50℃更佳。本发明涉及的免疫检测法一般可以适用于光学检测法,如可以通过检测散射光的强度、吸光度或粒子量中的一种指标或多种指标来得到结果。一般适用的检测波长范围为300~1000nm。
对比例1~4、11~14;实施例5~10、15~20(使用临床样本进行通过控制ph条件来对检测值的相关性进行对比)
(1)调制第一试剂
使用200mm含有1wt%的牛血清白蛋白、1wt%的氯化钠的缓冲液(tris-hcl:ph6.0(对比例1))、tris-hcl:ph6.5(对比例2)、tris-hcl:ph7.0(对比例3)、tris-hcl:ph7.5(对比例4)、tris-hcl:ph7.8(实施例5)、tris-hcl:ph8.00(实施例6)、tris-hcl:ph8.3(实施例7)、tris-hcl:ph8.5(实施例8)、tris-hcl:ph8.8(实施例9)、tris-hcl:ph9.0(实施例10)、mes:ph6.0(对比例11)、mes:ph6.5(对比例12)、mes:ph7.0(对比例13)、mes:ph7.5(对比例14)、mes:ph7.8(实施例15)、mes:ph8.00(实施例16)、mes:ph8.3(实施例17)、mes:ph8.5(实施例18)、mes:ph8.8(实施例19)、mes:ph9.0(实施例20)来调制。
(2)调制第二试剂
使用尺寸约为0.20μm的聚苯乙烯乳胶粒子(jsr生命科学株式会社生产)1g,使其通过化学法吸附0.05mg的来源于小鼠杂交细胞瘤的抗kl-6抗体。通过离心除去上清后,在沉淀后的乳胶粒子内加入含有1wt%牛血清白蛋白的磷酸缓冲液50mm(ph7.2),在25℃条件下搅拌1个小时,并进行封闭处理。再次离心除去上清后,向沉淀下来的乳胶粒子内加入与含有1wt%牛血清白蛋白的上述(1)所述第一试剂相同的缓冲液进行悬浮处理,从而调制出含有1wt%的包被抗体粒子的悬浮液,作为第二试剂。
(3)检测方法
使用全自动生化分析仪7180(日立制作所生产)来检测kl-6。检测条件如下。
向检测系统中逐一加入样本、第一试剂、第二试剂后,测量加入80秒后的吸光度与320秒后的吸光度的差值(δod)。将此差值的10,000倍的数值作为吸光度变化量。
使用60例已通过elisa法赋值的临床样本,作为检测对象。
(4)检测结果
如表1和图1所示,在对比例1~4及实施例5~10中,在ph范围为6.0~9.0的反应溶液中,随着ph值的升高,与elisa的对照相关性逐渐升高,尤其是在7.8~9.0的范围内,相关性达0.90以上。作为临床检测试剂的实际使用规格,其相关性需要为0.9以上,而在本实施例中当ph为7.8以上时达到了此标准。
如表2和图2所示,在对比例11~14及实施例15~20中,即使是在mes缓冲液中,其结果也有和对比例1~4及实施例5~10高度相似的倾向。因此可以得出结论,无论缓冲液的种类或缓冲液最适合的ph值如何,通过提高反应溶液的ph,其在对照法中的相关性都在提高。
表1使用tris-hcl缓冲液时的ph值和相关性的比较
表2使用mes缓冲液时的ph和相关性的比较
对比例21、22、28~32、38~40;实施例23~27、33~37
(1)调制第一试剂、(2)调制第二试剂
使用和对比例1~4及实施例5~10相同的组成和方法来调制。
(3)检测方法
使用和对比例1~4及实施例5~10相同的组成和方法来测量吸光度变化值。关于检测样本,在表3所示的反应溶液ph值条件下,使用含有kl-6为0、660、1320、2640、5280、10560u/ml的标准液来作为检测对象(实施例23~27、对比例21、22、28~30)。此外,使用其灵敏度为kl-6临床检测试剂的实际使用时的期待最低灵敏度,即为50u/ml的临床样本,在表4所示的反应溶液ph条件下,每个样本检测20次,对其重复性cv%进行评价(对比例31、32、38~40;实施例33~37)。
(4)测量结果
如表3和图3所示,在反应溶液的ph范围为7.5~11.0时,随着ph升高,试剂的反应性逐渐降低。
如表4和图4所示,反应溶液的ph范围为7.5~11.0时可以看出,随着ph升高,检测样本的重复性cv%值也呈升高趋势。一般来说,作为临床检测试剂的实际使用规格,定量范围内的重复性cv(%)≦10%为较理想状态。保证cv(%)≦10%时的最低定量值叫做最小定量值(loq)。如表4所示,ph为9.5以上时,cv(%)>10%,无法达到对kl-6的临床试剂的敏感度的要求。
表3反应溶液的ph对试剂反应性的影响
表4反应溶液的ph对检测灵敏度的影响
根据以上结果可知,通过将反应溶液的ph调整至7.8以上,可以使之与其他的检测方法具有良好的相关性。但是另一方面,当ph超过9.0时,基于作为kl-6的临床检测试剂的所需最低灵敏度时的重复性则难以达到要求。
根据以上实施例及对比例可知,本发明通过将反应溶液的ph范围控制在7.8以上9.0以下,可以实现使乳胶凝集免疫法的测量结果与其他的免疫检测方法具有极好的相关性这一目的,并保证高重复性。
- 还没有人留言评论。精彩留言会获得点赞!