乙型肝炎病毒e抗原、e抗体联合检测试剂盒的制作方法
本发明涉及体外检测技术领域,尤其是涉及一种乙型肝炎病毒e抗原、e抗体联合检测试剂盒。
背景技术:
乙型肝炎是由乙型肝炎病毒引起的一种重要的具有公众危害性的传染性疾病。据估计,全球范围内目前大约有3亿乙肝病毒携带者。我国的乙肝病毒感染率约60%~70%,全国约有9300万人携带乙肝病毒,其中乙肝患者大约有3000万。常见的临床症状有不适、发热、黄疸、无症状肝炎、爆发性肝炎以及慢性肝炎等,且流行病学研究已经清楚地表明乙肝病毒与肝细胞癌的发生有密切联系,因此乙型肝炎的检测工作至关重要。
目前,常用的检测方法是胶体金法、酶联免疫法、化学发光法、电化学发光法、荧光免疫法、时间分辨法、微粒子化学发光检测法。其中,胶体金法和酶联免疫法用于定性检测,其他检测方法多用于定量检测。胶体金法灵敏度相对较低,检测方便,比较适于普通体检人群的快速筛查。酶联免疫法灵敏度较高,出现漏检的概率较低,但基本为定性检测,比较适用于基层医疗机构,用于疑似hbv感染者检测、病人术前检测、献血者筛查等方面。化学发光、电化学发光、荧光免疫、时间分辨、微粒子化学发光技术等在保证高灵敏度的基础上,实现了定量检测的目标,多用于对hbv感染者的病情发展、用药指导、治疗效果、预后情况等的动态监测。不管是哪种检测方法,目前对乙型肝炎病毒检e抗原、e抗体检测试剂均为单独检测试剂,全自动仪器尽心操作时需要占据2个试剂位置,而e抗原e抗体联合检测试剂1套试剂检测两个项目,可节省全自动仪器试剂位,增加单台仪器可开展的项目,节约仪器成本。而对一些手工或者半自动化的操作使用者,可以有效的利用不配套的试剂,对于制造商,有利于包装的缩小,成本的降低,增加产品的便捷性性能。另外从检测结果看,同一来源的载体包被,有利于降低因各自鼠源性单抗的特异性不足导致的临床假阳性从而临床异常模式的概率,联合使用,有利于发现常规检测中的异常结果。
技术实现要素:
本发明的目的在于提供一种乙型肝炎病毒e抗原、e抗体联合检测试剂盒,本发明试剂盒将乙型肝炎病毒hbeag(e抗原)和hbeab(e抗体)检测合二为一,给试剂生产和临床使用带来更大的便捷,且灵敏度高、误差小、安全快捷。
为实现上述目的,本发明可采取下述技术方案:
本发明所述的乙型肝炎病毒e抗原、e抗体联合检测试剂盒,包括试剂r、试剂n、试剂m、对照品a和对照品b;
所述试剂r包括辣根过氧化物酶标记的抗-hbe抗体,pbs缓冲液,酪蛋白及诊断试剂防腐剂;
所述试剂n包括基因重组hbeag,pbs缓冲液,酪蛋白及诊断试剂防腐剂;
所述试剂m包括人源性hbeab包被的磁微粒,所述磁微粒经诊断试剂防腐剂处理;
所述对照品a包括人源性乙肝e抗原,牛血清白蛋白及诊断试剂防腐剂;
所述对照品b包括人源性乙肝e抗体,ph6.0~8.0的tris-nacl缓冲溶液,牛血清白蛋白及诊断试剂防腐剂。
所述试剂盒还包括以h2o2-鲁米诺为基础的底物系统(包括含有鲁米诺的化学发光底物a液和含有h2o2的化学发光底物b液;以pbs为基础的洗液系统。
所述磁微粒是以fe3o4为内核,表面修饰有氨基官能团的聚合物。
所述抗-hbe抗体为鼠源性单克隆抗体。
所述试剂r和试剂n中的pbs缓冲液的ph值为6.0~8.0。
所述诊断试剂防腐剂为0.1%的proclin300防腐剂。
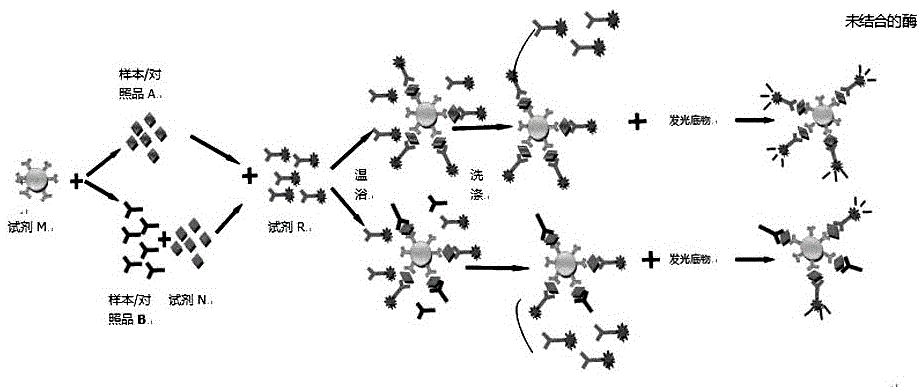
本发明试剂盒的检测原理如图1所示:
1、进行乙型肝炎病毒e抗原检测:
1.1在反应杯中加入试剂m(人源性hbeab包被的磁微粒),待检样本(对照品a)和试剂r(辣根过氧化物酶标记的抗-hbe抗体),混合均匀后37℃温浴;
1.2待温浴结束,采用清洗液)洗涤;
1.3加入化学发光底物a液和化学发光底物b液检测其发光强度;对照品a产生的光强度与对照品a对应的浓度值成正相关,进行曲线拟合,将样本的光强度带入拟合曲线,可计算出样本中hbeag浓度水平。
2、进行乙型肝炎病毒e抗体检测:
2.1在反应杯中加入试剂m(人源性hbeab包被的磁微粒)、待检样本(对照品b)、试剂n(基因重组hbeag)、试剂r(辣根过氧化物酶标记的抗-hbe抗体);混合均匀后37℃温浴;
2.2待温浴结束,采用清洗液洗涤;
2.3加入化学发光底物a液和化学发光底物b液,检测其发光强度,对照品b产生的光强度与对照品b对应的浓度值成负相关,进行曲线拟合,将样本的光强度带入拟合曲线,可计算出样本中hbeab浓度水平。
本发明的优点在于采用两种乙肝标志物对照品,两种检测和校准模式,通过中和抗原试剂的添加与否,转换检测模式,同时对乙型肝炎病毒e抗原、e抗体进行联合检测。人体感染乙型肝炎病毒(hbv)后,在血清中检测到乙型肝炎病毒e抗原(hbeag)、乙型肝炎病毒e抗体(hbeab),结合其它hbv血清学诊断指标,可准确判断hbv感染的不同阶段,对指导医生用药、治疗效果评估及预后监测具有重要意义。
本发明试剂盒利用了夹心法和中和试剂竞争抑制法的化学发光原理,在磁场中反应液中的磁微粒会被吸收,通过洗涤将未结合的酶结合物和样本重新除去,然后再注入激发液检测化学发光光子强度,光强度与样本中的hbeag浓度成正相关,与样本中hbeab浓度成负相关。
对乙型肝炎病毒e抗原、e抗体联合进行检测时,只需按照常规医用技术采集病人的全血样本,使血清(血浆)分离完全,不含有血细胞成分,然后使用本发明提供的试剂盒,即可检测出乙型肝炎e抗原(hbeag)/乙型肝炎e抗体(hbeab),结合hbv感染的其它指标,可以准确判断hbv感染的不同阶段。
附图说明
图1是本发明试剂盒的检测原理及步骤。
具体实施方式
下面通过具体实施例对本发明做更加详细的说明,以便于本领域技术人员的理解。如无特殊说明,本发明中所用的试剂和仪器均为本领域常规产品,本发明中所用的方法也为本领域常规方法。
实施例1制备乙型肝炎病毒e抗原、e抗体联合检测试剂盒
1、制备试剂r
每瓶12ml,内含辣根过氧化物酶标记的抗-hbe(1‰-3‰),ph6.0~8.0的pbs缓冲溶液,0.1%proclin300诊断试剂防腐剂。
2、制备试剂n
每瓶6ml,内含基因重组hbeag(0.01‰-0.1‰),ph6.0~8.0的pbs缓冲溶液,0.1%proclin300诊断试剂防腐剂。
3、制备试剂m(人源性hbeab包被的磁微粒)
每瓶5ml,内含有hbeab包被的磁微粒4mg-6mg,该磁微粒经0.1%proclin300诊断试剂防腐剂处理;其中,hbeab为人源性hbeab多抗,磁微粒是以四氧化三铁为内核包裹活性基团的聚合物。
4、制备对照品a和对照品b
对照品a:包括人源性乙肝e抗原,ph6.0~8.0的tris-nacl缓冲溶液,牛血清白蛋白及诊断试剂防腐剂;对照品共6组:3s0、3s1、3s2、3s3、3s4、3s5,各1ml,其浓度如下:0peiu/ml、0.1peiu/ml、0.7peiu/ml、5peiu/ml、35peiu/ml、200peiu/ml。
对照品b:包括人源性乙肝e抗体,ph6.0~8.0的tris-nacl缓冲溶液,牛血清白蛋白及诊断试剂防腐剂;对照品共6组:4s0、4s1、4s2、4s3、4s4、4s5,各1ml,其浓度如下:0peiu/ml、0.14peiu/ml、0.42peiu/ml、1.05peiu/ml、2.1peiu/ml、4.2peiu/ml。
5、制备化学发光底物a液和化学发光底物b液
化学发光底物a液:主要成分为鲁米诺。
化学发光底物b液:主要成分为h2o2。
化学发光底物a液和化学发光底物b液也可以采用郑州安图生物工程股份有限公司生产的成品。
实施例2本发明试剂盒的检测方法
首先对待测样品进行处理:按照常规医学技术采集病人全血样本,按照相应的采血管操作规程使血清(血浆)分离完全,不含有血细胞成分备用。
检测步骤:
1、将待测样品和试剂m、试剂r混合均匀,形成反应液1;将待测样本和试剂m、试剂n、试剂r混合均匀,形成反应液2;
2、将反应液1和反应液2在37℃温浴30min;
3、待温浴结束,采用清洗液(含有pbs缓冲液)进行洗涤;
4、加入化学发光底物a液和化学发光底物b液,检测其发光强度,反应液1的光强度与待测样品中的hbeag浓度值成正相关,反应液2与待测样品中的hbeab浓度成负相关。
本发明采用autolumoa2000化学发光检测仪,检测时,将试剂包装载到化学发光检测仪试剂仓上,并在软件操作系统上扫描试剂包条码,自动获取测试所需参数。新试剂在装载前,应轻轻混合,避免出现气泡,不要倒转已经打开的试剂包;将样本容器放置在仪器配套样本架中,每次测试样本容量为50μl,考虑检测系统死体积因素,应确保样本量在150μl以上,装载样本架,在仪器软件界面中输入样本信息,选择“运行”开始测试,系统自动进行试验操作;定标时,仪器通过扫描条码卡自动获取测试所需的参数,将校准品转移至样本容器,放置在仪器配套样本架中,转载样本架,在仪器软件界面中输入定标信息,选择“运行”开始测试,生产定标曲线;
结果计算:
本发明试剂盒推荐采用四参数拟合方式,以校准品的浓度值为x轴,以校准品的发光强度log值为y轴建立定标曲线。根据待测样品的发光强度值回算相应的浓度值。仪器软件系统可通过存储的定标曲线及待测样品测试得到的信号值自动计算样品测试结果。样品的hbeag含量≥0.1peiu/ml,判断为有反应性,样品的hbeag含量<0.1peiu/ml,判断为无反应性,样品的hbeab含量≥0.15peiu/ml,判断为有反应性,样品的hbeag含量<0.15peiu/ml,判断为无反应性。
实施例3本发明试剂盒的性能测定
1、灵敏度
使用实施例2的检测方法,检测200例乙肝患者样本和800例正常人样本,用roc曲线方法确定hbeag正常参考值为<0.1peiu/ml,hbeab正常参考值为<0.15peiu/ml。检测结果如表1所示。
表1hbeag、hbeab国家盘检测结果
表1结果显示:检测hbeag和抗-hbe试剂国家盘最低检出限,符合标准;检测国家阳性参考品,符合标准;检测国家阴性参考品,符合标准。
2、精密度
精密度以照美国国家临床实验室标准化委员会(nccls)ep5-a方案制定,对3份hbeag质控品(血清/血浆),3份hbeab质控品(血清/血浆),采用同一批试剂,每天不同时间各检测一次,每次双孔,共进行20天,实验结果如表2所示。
表2实验结果
结论:hbeag在0.17peiu/ml、50.43peiu/ml、120.42peiu/ml水平,精密性批间变异和总变异均≤15%,hbeab在0.21peiu/ml、1.03peiu/ml、2.14peiu/ml水平,精密性批间变异和总变异均≤20%。满足国家对此类产品的精密性要求。
3、干扰性
依照美国国家临床实验室标准化委员会(nccls)ep7-a2方案制定,选择1例hbeag0.1-200peiu/ml的样本和1例hbeab0.14-4.2peiu/ml的样本,每份样本分成4份,一份不添加,另三份在样本中分别添加胆红素(40mg/dl),甘油三酯(500mg/dl),血红蛋白(2.5mg/ml),分别检测不添加样本和添加样本,计算添加后样本相对不添加样本的偏倚,结果如表3所示,证明对检测结果无显著影响。
表3
在使用本发明试剂盒进行人血清(血浆)中的乙型肝炎病毒e抗原(hbeag)、乙型肝炎病毒e抗体(hbeab)检测时,需要注意以下几点:避免在恶劣的环境(如含有84消毒液、次氯酸钠、酸碱或乙醛等高浓度腐蚀性气体及灰尘的环境)条件下进行试验;加样前应保证磁微粒混悬液充分混匀,无肉眼可见沉淀;微量移液器吸嘴不可混用,以免交叉污染;样本中若存在沉淀物、悬浮物等可见杂质会影响试验结果,此类样本不得使用;加入底物前,反应容器内的磁微粒必须震荡散开;使用仪器自动操作,测试样本需要考虑样本容器死体积;本产品仅用于体外诊断,体外诊断试剂为一次性使用产品,使用后不可回收再次利用。
- 还没有人留言评论。精彩留言会获得点赞!