X型胶原α1测定法的制作方法
本发明涉及与x型胶原α1的n末端新表位特异性反应的抗体、及其在检测和定量x型胶原α1的免疫测定方法中的用途。
背景技术:
骨关节炎(oa)是一种常见的关节疾病,其特征是软骨损伤和关节功能丧失。oa的病因包括多种因素,包括衰老、肥胖、外伤和遗传[1]。由于该疾病的异质性和复杂性,人们对oa的发病机理了解甚少。
值得注意的是,oa的某些特征类似于软骨内骨化在骨骼发育过程中的软骨细胞分化过程。在健康的关节软骨中,软骨细胞抵抗增殖和终末分化。相比之下,患病软骨中的软骨细胞逐渐增生并肥大。此外,开始了关节软骨的血管化和局部钙化[2-5]。调节软骨细胞分化的分子事件仍然是未知的,但是oa中软骨细胞肥大样变化已引起更多研究关注[6-8]。
x型胶原α1
x型胶原α1是非原纤维,但与软骨胶原蛋白结合形成细小的细胞细丝。从软骨细胞培养物中或从软骨分离的分子是59kdax型胶原α1链的同三聚体,并且已经报道了约75kda的x型胶原的重组分子[9]。x型胶原α1与viii型胶原蛋白具有相似的结构域结构:50kda的中央三螺旋(col1)域位于n末端(nc2)和c末端(nc1)非三螺旋域[10]。另外,两种胶原类型都代表六边形晶格结构的主要成分,其中胶原分子通过涉及非三螺旋末端区域的相互作用而连接在一起。
x型胶原α1分布仅限于长骨,椎骨和肋骨的生长区以及成年(>21岁)甲状腺软骨的正常胎儿肥大性软骨,在这种情况下,由于软骨基质的存在,它可能会提供一个支架以防止局部塌陷软骨内骨化过程中去除[11]。它也存在于骨折、骨关节炎软骨和成软骨肿瘤中,并且可能与软骨矿化有关。
骨关节炎
oa通常被认为是滑膜关节(主要是膝盖和臀部)的非炎性疾病。软骨细胞肥大和软骨钙化是oa的关键病理事件。网络形成的x型胶原蛋白的高表达被认为是软骨细胞肥大的特定信号[12-15],因此,x型胶原蛋白可用作所述疾病的可检测标记。
有几种与肥大软骨细胞相关的蛋白质,例如x型胶原、mmp13、骨桥蛋白、骨钙素[16]、indianhedgehog[17]、runx2[18]、vegf[19]、htra1[20]和转谷氨酰胺酶-2(tg-2)[21]。x型胶原和mmp13是最肥大的软骨细胞标记。然而,mmp13的合成可通过炎症和机械应力在软骨细胞中诱导[22-23]。因此,作为肥大性软骨细胞特异性标志物的x型胶原蛋白可以表明软骨细胞的表型改变。
下因此,准确地定量生物样品中的x型胶原蛋白或其片段的量的方法可以允许更好地理解x型胶原蛋白的病理学或影响x型胶原蛋白周转的诸如oa的生理过程。显然,需要这种方法。
发明概述
发明人现已发现,组织蛋白酶k在478a-g479之间的肽键处裂解x型胶原α1,从而导致形成n末端新表位生物标记h2n-479giatkglngp(seqidno:1)。x型胶原α1的这种新表位生物标记物已显示与骨关节炎良好相关。
因此,本发明的第一方面涉及抗体,其中所述抗体与氨基酸序列h2n-giatkglngp(seqidno:1)中包含的x型胶原α1的n末端新表位特异性结合。
优选地,抗体特异性结合n末端氨基酸序列h2n-giatkg(seqidno:2)。
优选地,抗体不特异性识别或结合所述n末端氨基酸序列的n延伸的延长形式。就此而言,“所述n末端氨基酸序列的n延伸的延长形式”是指延伸至序列h2n-giatkglngp(seqidno:1)的n末端之外的一个或多个氨基酸。例如,如果n末端氨基酸序列h2n-giatkglngp(seqidno:1)被丙氨酸残基延长,则相应的“n延伸的延长形式”将为h2n-agiatkglngp…(seqidno:3)。类似地,优选抗体不特异性识别或结合所述n末端氨基酸序列的n截短的转变形式。就此而言,“所述n末端氨基酸序列的n截短的缩短形式”是指从序列h2n-giatkglngp(seqidno:1)的n末端去除的一个或多个氨基酸。例如,如果将n端氨基酸序列h2n-giatkglngp(seqidno:1)缩短一个氨基酸残基,则相应的“n截短的缩短形式”将为h2n-iatkglngp…(seqidno:4)。
该抗体优选是单克隆抗体或其片段。本发明包括产生这种单克隆抗体或其片段的细胞系。
本发明的第二方面涉及一种用于检测生物样品中包含n末端新表位氨基酸序列h2n-giatkglngp(seqidno:1)的x型胶原α1片段的免疫测定方法,所述方法包括使包含所述n末端新表位氨基酸序列h2n-giatkglngp(seqidno:1)的所述生物样品接触上述的抗体,并确定所述抗体的结合量。
优选地,所述方法是定量的。
优选地,所述方法用于检测和/或定量生物流体中包含n末端新表位氨基酸序列h2n-giatkglngp(seqidno:1)的x型胶原α1的片段的量。
生物流体可以是源自患者的生物流体。生物流体可以是但不限于血液、尿液、滑液、血清、血浆或羊水。
免疫测定的方法可以是但不限于竞争测定法或三明治测定法。免疫测定的方法可以是但不限于放射免疫测定法或酶联免疫吸附测定法。
所述方法还包括将通过所述方法确定的包含所述n末端新表位氨基酸序列h2n-giatkglngp(seqidno:1)的x型胶原α1的片段的量与已知疾病严重性的标准疾病样品相关联,以评估与x型胶原α1相关的疾病的严重性。
可选择地或另外,所述方法还可包括将通过所述方法确定的包含所述n末端新表位氨基酸序列h2n-giatkglngp(seqidno:1)的x型胶原α1的所述片段的量与和健康受试者相关的标准值进行比较,以评估与x型胶原α1相关的疾病的存在和/或严重性。
就此而言,所述方法还可包括将通过所述方法确定的包含所述n末端新表位氨基酸序列h2n-giatkglngp(seqidno:1)的x型胶原α1的片段的量与已知严重性的标准骨关节炎样品相关联。
类似地,所述方法还可包括将通过所述方法确定的包含所述n末端新表位氨基酸序列h2n-giatkglngp(seqidno:1)的x型胶原α1片段的量与和已知年龄和性别的受试者中已知严重性的标准骨关节炎样品与/或与健康受试者相关的标准值进行关联,以评估骨关节炎的存在和/或严重性。就此而言,样本的比较最好是在患者样本之间进行,其中患者(样本来源)与标准样本的性别和年龄相同。
所述方法还可包括在第一个时间点和至少一个后续时间从受试者获得的至少两个样品中定量包含所述n末端新表位氨基酸序列h2n-giatkglngp(seqidno:1)的x型胶原α1的片段的量,其中从第一时间点到至少一个后续时间点的所述片段的量的变化指示从第一时间点到至少一个后续时间点的与x型胶原α1相关的疾病的状态变化的时间点。
例如,当与x型胶原α1相关的疾病是骨关节炎时,包含所述n末端新表位氨基酸序列h2n-giatkglngp(seqidno:1)的x型胶原α1的片段的量从第一时间点到至少一个后续时间点的增加指示从第一时间点到至少一个随后的时间点的受试者的骨关节炎的恶化。类似地,包含所述n末端新表位氨基酸序列h2n-giatkglngp(seqidno:1)的x型胶原α1的片段的数量从第一时间点到至少一个后续时间点的减少指示从第一个时间点到至少一个随后的时间点,受试者骨关节炎的改善。
在最后方面,本发明涉及一种测定试剂盒,用于测定生物样品中包含n末端新表位氨基酸序列h2n-giatkglngp(seqidno:1)的x型胶原α1的片段的量,所述试剂盒包括上述抗体和以下至少之一:
链霉亲和素包被的96孔板
生物素化肽h2n-giatkglngp-l-生物素(seqidno:5),其中l是任选的接头
用于夹心免疫分析的二抗
校准肽,包含序列h2n-giatkglngp
抗体生物素化试剂盒
抗体hrp标记试剂盒
抗体放射性标记试剂盒
测定可视化试剂盒。
定义
如本文所用,术语“n末端”是指多肽的末端,即在多肽的n末端,并且不应解释为在其总方向上的含义。
如本文所用,术语“n末端新表位”是指通过蛋白酶切割蛋白质形成的n末端表位。对于本发明,这是指通过组织蛋白酶k切割x型胶原蛋白α-1而形成的n末端表位。
如本文所用,术语“包含n末端新表位氨基酸序列h2n-giatkglngp(seqidno:1)的x型胶原α1的片段”是指x型胶原α1肽片段,其中该肽片段的n末端是氨基酸序列h2n-giatkglngp…(seqidno:1)。
如本文所用,术语“竞争性elisa”是指竞争性酶联免疫吸附测定法,并且是本领域技术人员已知的技术。
如本文所用,术语“夹心免疫测定法”是指至少两种抗体用于检测样品中的抗原的用途,并且是本领域技术人员已知的技术。
如本文所用,术语“col10neo”用作简写形式,以描述本文公开的用于检测和定量包含n末端新表位氨基酸序列h2n-giatkglngp(seqidno:1)的x型胶原α-1的片段的特异性测定法。
附图简述
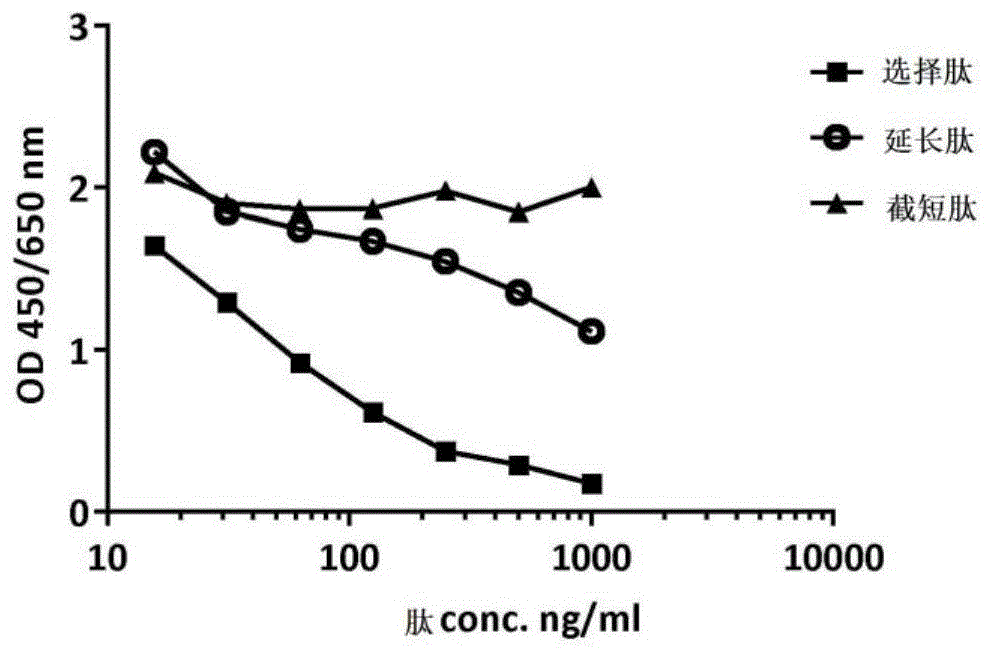
图1:mab的肽结合特异性。2f4对生物素化合成肽giatkglngp-k(biotin)(seqidno:5)的反应活性通过添加1000ng/ml选择肽而完全取代。相反,在相同浓度下选择肽的延长或选择肽的截短观察到轻微或没有置换。
图2:酶对软骨的体外切割。2a:mmp裂解人类软骨。2b:adamts切割了人类软骨。2c:组织蛋白酶k切割人软骨。数据显示为平均值±sd。与在消化缓冲液中未添加蛋白酶的mmp或adamts溶液相比,没有一种mmp或adamts溶液的col10/c水平没有增加。相反,组织蛋白酶k产生的量最大,表明其释放携带479giatkglngp新表位的片段的能力。
图3:479giatkg在软骨中的免疫定位。3a:正常小鼠igg。3b:11g8,x型胶原蛋白的抗c末端。3c:2f4,抗479giatkg。11g8检测到的x型胶原蛋白存在于深部软骨细胞的细胞外基质中,但在钙化软骨区域却不存在。c.令人惊讶地,在软骨的所有区域的软骨细胞的细胞外基质中都观察到479giatkg的强烈染色。比例尺=500μm
图4:在c4pain研究中,受试者血浆中kl等级与col10neo水平之间的关联。数据显示为平均值±95ci%。4a:不同k/l组的血浆col10neo水平。有较高的k/l等级提高col10neo水平的趋势,但没有达到统计学显着性。4b:三分位数的血浆col10neo水平为k/l3-4的受试者分布。使用具有事后tukey-kramer检验的单向anova。在所有分析中对血浆col10neo数据进行对数转换。p值<0.05被认为具有统计学意义。
图5:nyuhjd进展研究中的血浆col10neo水平。数据显示为平均值±95ci%。oa中血浆col10neo在统计学上高于健康对照组(p=0.0002)或ra(p<0.0001)。健康对照和ra均无明显差异。使用具有事后tukey-kramer检验的单向anova。在所有分析中对血浆col10/cat数据进行对数转换。p值<0.05被认为具有统计学意义。如果p<0.05,则为一个星号(*);如果p<0.01,则为两个星号(**);如果p<0.001,则为三个星号(***);如果p<0.0001,则为四个星号(****)。
发明详述
在以下实施例中描述了当前公开的实施方案,其旨在帮助理解本公开,并且不应解释为以任何方式限制如在其后的权利要求书中所限定的本公开的范围。提出以下实施例以向本领域普通技术人员提供关于如何制作和使用所描述的实施方案的完整公开和描述,并且无意限制本公开的范围,也无意表示以下实验是全部或仅有的实验。尽力确保所使用数字(例如数量、温度等)的准确性,但应考虑一些实验误差和偏差。除非另有说明,否则份数是重量份、分子量是重均分子量、温度是摄氏度、压力是大气压或接近大气压。
在以下实施例中,采用以下材料和方法。
用料
除非另有说明,否则用于实验的所有材料都是高质量的,并且是从sigma-aldrich(丹麦哥本哈根)或vwr(rodedovre,丹麦)订购的。用于单克隆抗体生产和测定开发的合成肽购自genscript(usa)。mmp-2催化域(目录号g04mp02c)、mmp-9催化域(目录号g04mp09c)和mmp-13催化域(目录号g04mp13c)购自gittobiotech(意大利佛罗伦萨)。组织蛋白酶k(cat#219461)、组织蛋白酶b(cat#219362)和组织蛋白酶s(cat#219343)和adamts-4(cat#cc1028)来自默克密理博(merckmillipore)(德国达姆施塔特(darmstadt))。adamts-5(目录号2198-ad-20)购自r&d系统(美国明尼苏达州)。
选择免疫顺序
通过lc-ms/ms对oa患者人尿中天然存在的肽进行了分析。在人oa尿液中鉴定出大量肽片段。发现17种肽序列是人类x型胶原蛋白独特的。在患病的尿液中存在17个序列中的两个,这些序列带有位于氨基酸(aa)位置478'的相同游离c端(登录号:q03692;数据库:uniprot),表明在a478-479g键之间发生了切割。选择通过该切割产生的游离n末端的前10个氨基酸479giatkglngp488(seqidno:1)进行免疫。还使用基本局部比对搜索工具(blast,请参阅表1)分析了不同物种的序列比对。
单克隆抗体(mab)生产
用乳化的giatkglngp-ggc-klh(seqidno:6)和sigma
479giatkg特异性免疫测定(col10neo)
首先通过三种合成肽、选择肽(giatkglngp;seqidno:1)、选择肽的延伸(agiatkglngp;seqidno:3)和选择肽的截短(iatkglngp;seqidno:4)测试了纯化的单克隆抗体的肽结合特异性,然后用于竞争性免疫测定。在使用关键试剂的缓冲液、温度、温育时间和浓度进行优化后,开发了用于检测479giatkg(seqidno:2)分析的最终方案,如下所示:在96孔链霉亲和素预包被的微板上,用1ng/ml生物素化的肽giatkglngp-k(生物素)(seqidno:5)在200℃溶解于50mmpbs-btb缓冲液(磷酸盐缓冲盐水,含牛血清白蛋白和tween-20,ph7.4)中包被30分钟。然后,将板用标准洗涤缓冲液(20mmtris,50mmnacl,ph7.2)洗涤5次。将20μl的肽标准品,试剂盒对照或样品添加到适当的孔中,然后在含有5%osteocalcineiapuf-liq(德国罗氏诊断公司)的50mmpbs-btb缓冲液中加入100μl23ng/ml单克隆抗体,并在40℃下孵育过夜(20±1小时)。洗涤5次后,加入100μl山羊抗小鼠二抗(115-035-003,jacksonimmunoresearch)并在20℃下孵育1小时。完成此步骤后,将板用洗涤缓冲液洗涤5次。最后,向每个孔中加入100μl3,3',5,5'-四甲基联苯胺(tmb),并在黑暗中于20℃孵育15分钟。通过加入100μl终止溶液(1%h2so4)终止比色反应,并在650nm下作为参考在450nm下进行测量。
板间和板内变异通过一式两份的10次独立的质量控制小组(三种人血清和两种肽标准品)测定。将检测下限(llod)计算为21个零标准品的平均值的3sd。在孵育缓冲液中以2倍、4倍、6倍、8倍、16倍的纯净浓度检测多种人血清或血浆样品。将回收率计算为测量浓度除以稀释所需的校正浓度。
人软骨的体外裂解
来自膝关节置换手术的骨关节炎(oa)患者的关节软骨活检取自gentofte医院(丹麦gentofte)。标本的检索符合处理人类标本和患者信息的国际道德准则。所有参与者均签署了知情同意书,并且该研究得到丹麦当局的批准。为鉴定负责切割a478-479g键的酶,软骨被多种蛋白酶切割,包括基质金属蛋白酶(mmp2、mmp9和mmp13)、组织蛋白酶(catk,catb和cats)以及具有血小板反应蛋白基序的双整合蛋白和金属蛋白酶结构域(adamts-4和adamts-5)。将30mg速冻和粉碎的软骨(每种酶分别含1μg酶)置于0.5ml带250μl消化缓冲液(mmp的消化缓冲液:100mmtris,100mmnacl,10mmcacl2和2mm醋酸锌,ph8.0;用于adamts的消化缓冲液:50mmtris,100mmnacl和10mmcacl2,ph7.5;组织蛋白酶的消化缓冲液:25mmna2hpo4、150mmnacl,2mmedta,2mmdtt,ph6.5)的eppendorf中。一日两次重复进行消化。加入5mmedta(用于mmp和adamts的广谱抑制剂)和5mme64(用于组织蛋白酶的广谱抑制剂)以终止反应。在使用前,所有上清液都储存在-80℃。
免疫组织化学(ihc)
ihc的骨标本的软骨是与丹麦权威机构(n-20110031)批准的,与frederikshavn医院(丹麦)合作开展的研究。所有参与者都签署了知情同意书。将从接受过膝关节置换手术的oa患者中分离出的标本固定并脱钙,然后包埋在石蜡中。将5μm厚的软骨切片在60℃融化1小时,然后进行脱钙和水合,然后使用pronasee(目录号10165921001,roche)在37℃下进行抗原修复10分钟。在室温下,在tris缓冲盐水(tbs)中用0.5%酪蛋白处理切片30分钟,以阻断非特异性结合。通过本研究开发的抗体nb117-2f4和先前开发的抗体nb509-11g8进行免疫染色。用过氧化物酶标记的抗小鼠和二氨基联苯胺(dab,dako,丹麦)观察免疫反应性。用mayer的苏木精染色。使用配备有olympusc5050数码相机的olympus显微镜bx60拍摄照片。
研究参与者
从两项研究中检索血浆样本,这两项研究是由地方伦理委员会批准的c4pain研究(n-20100094)[24]和由地方伦理委员会批准的nyuhjd进步研究[25,26]。所有参与者在注册前均已提供知情同意。
简而言之,c4pain是一项横断面研究。它由281名个体组成,使用kellgren/lawrance(k/l)分级量表(k/l0-4),无关节退化至严重关节退化。由于其他28个样本的容量不足,本研究中对253名参与者的血浆样本进行了测量。
nyuhjdprogression研究在基线时包括21位非oa健康对照(k/l≤1,且双膝均无疼痛),146例oa患者(k/l≥2)和36名类风湿关节炎(ra)患者。146例oa患者被进一步随访24个月。在基线和24个月时进行放射线评估,并在基线时收集血浆。在本研究中,可用于测量基线时来自20位非oa健康对照、142位oa受试者和34位ra受试者的血浆样品。但是,在本研究中,我们仅研究了基线时不同组中col10neo的水平。未来的研究将继续朝着更完整的col10neo方向发展,将其作为oa放射学进展的潜在预后生物标志物。
统计
使用graphpadprism6或medcalc16.8分析数据。为了进行正态检验,对所有感兴趣的变量进行了shaprio-wilk检验。在年龄、bmi和vas分数的组比较之间,使用了事后tukey-kramer检验的单向anova。在所有分析中对血浆col10neo数据进行对数转换。p值<0.05被认为具有统计学意义。如果p<0.05,则为一个星号(*);如果p<0.01,则为两个星号(**);如果p<0.001,则为三个星号(***);如果p<0.0001,则为四个星号(****)。
结果
肽选择
通过质谱法在oa患者的尿液中鉴定了具有相同游离c末端的物种2片段中的选定肽的序列比对,分别为463pgskgdpgspgppgpa478(seqidno:7)和465skgdpgspgppgpa478(seqidno:8),表明在a478-479g之间存在一个切割位点。选择通过切割产生的来自游离n端的10aa肽479giatkglngp(seqidno:1)进行免疫。爆炸显示,在人类蛋白质中,该序列是x型胶原α1所特有的。物种间的序列相似性表明人与小鼠之间100%相同,而与人序列相比,大鼠或牛中含有不匹配的氨基酸。
表1.跨物种选择的肽的序列比对
1人(seqidno:1);2大鼠(seqidno:9);3小鼠(seqidno:10);4牛(seqidno:11);5狗(seqidno:12)
col10neo分析的技术性能
从杂交瘤产生靶向479giatkg(seqidno:2)的单克隆抗体2f4(同种型:igg2b,κ),并通过hitrapproteing亲和柱(目录号17-0404-01,gehealthcare)纯化。在测试肽结合特异性时,通过添加1000ng/ml选择肽,完全取代了2f4对生物素化的合成肽giatkglngp-k(生物素)(seqidno:5)的反应性。相反,在相同浓度下,选择肽的延长或选择肽的截短则观察到轻微或没有位移(图1)。这表明已开发的抗体2f4对选择肽具有特异性。
因此,显示出极高特异性的抗体2f4被用于竞争性elisa分析中,即col10neo。总结了该测定的技术性能,并在表2中列出。ic50为41.9ng/ml。批内系数变化(cv%)为3%,批间系数cv%为11.8。测量范围是8-250ng/ml。在血清稀释度为4至32倍和edta抗凝血浆稀释度为8至64倍的宽范围内,线性良好。
表2.col10neo分析的技术性能摘要
组织蛋白酶k衍生的479giatkg
为了研究负责切割a478-479g键的酶,将几种蛋白酶分别与人软骨一起孵育。所有蛋白酶均具有相同的酶浓度,并且所有孵育均在相同的孵育时间内进行。通过应用于col10neo测定法来评估每种蛋白酶产生479giatkglngp的新表位的相对效率(seqidno:1)。与在消化缓冲液中未添加蛋白酶的mmp或adamts溶液相比,在任何一种测试的mmp或adamtss溶液中,col10neo的含量均未增加(图2a和2b)。相反,组织蛋白酶k产生的量最大,表明其释放携带479giatkglngp(表idno:1)的新表位的片段的能力(图2c)。
479giatkg在软骨中的免疫定位
为了进一步确定479giatkg(seqidno:2)的产生和分布,将来自tkr(全膝关节置换)患者的关节软骨的连续切片用抗479giatkg(seqidno:2)(2f4)、正常小鼠igg(阴性对照)以及x型胶原的抗c末端(11g8–在wo2014/180992中公开)染色。我们没有观察到正常小鼠igg的任何染色(图3a)。与先前的研究一致,发现由11g8检测到的x型胶原蛋白发生在深区软骨细胞的细胞外基质中,但在钙化软骨区域中却不存在(图3b)。出人意料的是,在软骨所有区域的软骨细胞的细胞外基质中都发现了479giatkg(seqidno:2)的强烈染色(图3c)。新表位的染色表明释放到细胞外基质中的x型胶原蛋白已经进行了进一步的蛋白水解处理。
c4pain研究中k/l级与血浆col10neo水平之间的关联
来自c4pain研究的253名参与者根据k/l等级分为4组。表3汇总了这4组的人口统计学特征。
表3.c4pain研究中受试者的人口统计学
除非另有说明,否则值是平均值±sd。vas等级=最近24小时的最大疼痛强度,bmi=体重指数。
$,p<0.05,与k/l0-1组相比
由于参与者的平均年龄>60岁,因此k/l为0或k/l为1的参与者很少。参与本研究的受试者中,有57%的k/l为2,并被分配到第2组。在各组中,性别分布没有显着差异。k/l4的平均年龄显着高于k/l0-1组(p<0.005)。随着k/l等级的增加,bmi有明显但不显着的趋势。vas评分的平均值(定义为最近24小时的最大疼痛强度)与每组均无显着差异。
来自kl0-4的4组参与者中col10neo的平均±95ci%浓度分别为2.6[2.316-2.884]μg/ml、3.288[2.885-3.691]μg/ml、3.435[2.729-4.141]μg/ml和3.517[2.599-4.435]μg/ml。有较高的k/l级,col10neo水平有增加的趋势,但是没有达到统计学显着性(图4a)。根据col10neo水平将受试者分为三分位数,并比较k/l等级的分布(图4b)。在col10neo最高三分位数中,k/l3-4的受试者人数最多。
nyuhjd进展研究中的血浆col10neo水平
c4pain研究的结果使我们研究了在包括非oa健康对照、oa和ra在内的nyuhjdprogression研究中将col10neo用作诊断生物标志物的潜力。oa和ra组的女性参与者百分比高于健康对照组。对照组和oa组的平均年龄显着不同。但是,ra组的受试者比oa组年轻得多,因为ra可以发生在任何年龄,但其峰值在30-55岁之间。健康对照和oa之间的bmi略有差异。
对照、oa和ra中血浆col10neo(平均值±95ci%)分别为2.953[2.711-3.194]μg/ml、4.04[3.835-4.246]μg/ml和2.548[2.285-2.81]μg/ml(图5)。oa中血浆col10neo在统计学上高于健康对照组(p=0.0002)或ra(p<0.0001)。在健康对照和ra之间未发现明显差异。调整年龄和性别数据后,相对于对照组(p=0.003)或ra(p<0.0001),col10neo的水平在oa中仍显着增加(表5)。
出人意料的是,当调整年龄和性别时,ra的对照和col10neo之间的差异变得很明显(p=0.0084;表5)。
表5.按年龄和性别调整的血浆col10neo水平的ancova分析。
bonferroni校正
结束语
已经证明本文公开的col10neo测定法可用于评估oa。
本文提出该有用性可以扩展到评估与x型胶原α-1相关的其他疾病,例如强直性脊柱炎。
在本说明书中,除非另有明确说明,否则单词“或”的含义是当一个或两个条件都满足时返回一个真值的运算符,而运算符“排他或”则要求仅满足条件之一。“包含”一词的含义是“包括”,而不是“由...组成”。上文承认的所有现有教导通过引用并入本文。本文中任何在先的公开文件均不得视为承认或表示其教示是本报告日期在澳大利亚或其他地方的常识。
参考文献
1.abhishek,a.andm.doherty,pathophysiologyofarticularchondrocalcinosisroleofankh.natrevrheumatol,2011;7:96-104.
2.kronenberg,h.m.,developmentalregulationofthegrowthplate.nature,2003;423:332-6.
3.pfander,d.,b.swoboda,andt.kirsch,expressionofearlyandlatedifferentiationmarkers(proliferatingcellnuclearantigen,syndecan-3,annexinvi,andalkalinephosphatase)byhumanosteoarthriticchondrocytes.amjpathol,2001;159:1777-83.
4.vondermark,k.,etal.,typexcollagensynthesisinhumanosteoarthriticcartilage.indicationofchondrocytehypertrophy.arthritisrheum,1992;35:806-11.
5.fuerst,m.,etal.,calcificationofarticularcartilageinhumanosteoarthritis.arthritisrheum,2009;60:2694-703.
6.dreier,r.,hypertrophicdifferentiationofchondrocytesinosteoarthritis:thedevelopmentalaspectofdegenerativejointdisorders.arthritisresther,2010;12:216.
7.pitsillides,a.a.andf.beier,cartilagebiologyinosteoarthritis--lessonsfromdevelopmentalbiology.natrevrheumatol,2011;7:654-63.
8.vanderkraan,p.m.andw.b.vandenberg,chondrocytehypertrophyandosteoarthritis:roleininitiationandprogressionofcartilagedegeneration?osteoarthritiscartilage,2012;20:223-32.
9frischholz,s.,etal.,j.biol.chem.,1998;273:4547.
10.yamaguchi,n.,etal.j.biol.chem.,1989;264:16022.
11.olsen,b.j.,andninomiya,y.,in:“guidebooktotheextracellularmatrixandadhesionproteins”,kreis,t.,andvale,r.(eds.),oxforduniversitypress,oxford,pp.32-48(1993).
12.schmid,t.m.,andlinsenmayer,t.f.,in:“structureandfunctionofcollagentypes”,mayne,r.,andburgeson,r.e.(eds.),academicpressinc.,pp.223-259(1987).
13.rucklidge,g.j.,etal.,matrixbiol.,1996;15;73.
14.aigner,t.,etal.,histochem.cellbiol.,1997;107;435.
15.girkontaite,i.,etal.,matrixbiol.,1996;15;231.
16.gerstenfeld,l.c.andf.d.shapiro,expressionofbone-specificgenesbyhypertrophicchondrocytes:implicationofthecomplexfunctionsofthehypertrophicchondrocyteduringendochondralbonedevelopment.jcellbiochem,1996;62:1-9.
17.wei,f.,etal.,activationofindianhedgehogpromoteschondrocytehypertrophyandupregulationofmmp-13inhumanosteoarthriticcartilage.osteoarthritiscartilage,2012;20:755-63.
18.dong,y.f.,etal.,wntinductionofchondrocytehypertrophythroughtherunx2transcriptionfactor.jcellphysiol,2006;208:77-86.
19.horner,a.,etal.,immunolocalisationofvascularendothelialgrowthfactor(vegf)inhumanneonatalgrowthplatecartilage.janat,1999;194:519-24.
20.tsuchiya,a.,etal.,expressionofmousehtra1serineproteaseinnormalboneandcartilageanditsupregulationinjointcartilagedamagedbyexperimentalarthritis.bone,2005;37:323-36.
21.huebner,j.l.,etal.,transglutaminase2isamarkerofchondrocytehypertrophyandosteoarthritisseverityinthehartleyguineapigmodelofkneeoa.osteoarthritiscartilage,2009;17:1056-64.
22.fitzgerald,j.b.,etal.,shear-andcompression-inducedchondrocytetranscriptionrequiresmapkactivationincartilageexplants.jbiolchem,2008;283:6735-43.
23.goldring,m.b.,etal.,definingtherolesofinflammatoryandanaboliccytokinesincartilagemetabolism.annrheumdis,2008;67:75-82.
24.arendt-nielsenl,eskehavetn,egsgaardll,etal.associationbetweenexperimentalpainbiomarkersandserologicmarkersinpatientswithdifferentdegreesofpainfulkneeosteoarthritis.arthritisrheumatol(hoboken,nj).2014;66(12):3317-3326.doi:10.1002/art.38856.
25.atturm,statnikova,samuelsj,etal.plasmalevelsofinterleukin-1receptorantagonist(il1ra)predictradiographicprogressionofsymptomatickneeosteoarthritis.osteoarthrcartil.2015;23(11):1915-1924.doi:10.1016/j.joca.2015.08.006.
26.atturm,krasnokutskys,statnikova,etal.low-gradeinflammationinsymptomatickneeosteoarthritis:prognosticvalueofinflammatoryplasmalipidsandperipheralbloodleukocytebiomarkers.arthritisrheumatol.2015;67(11):2905-2915.doi:10.1002/art.39279.
序列表
<110>北欧生物科技公司
<120>x型胶原α1测定法
<130>p19934wo
<150>gb1712071.8
<151>2017-07-27
<160>12
<170>bissap1.3.6
<210>1
<211>10
<212>prt
<213>智人(homosapiens)
<220>
<221>
<222>
<223>x型胶原α1的n末端新表位生物标记(n-terminusneo-epitopebiomarkerofcollagentypexalpha1)
<400>1
glyilealathrlysglyleuasnglypro
1510
<210>2
<211>6
<212>prt
<213>智人(homosapiens)
<220>
<221>
<222>
<223>x型胶原α1的n末端新表位生物标记(n-terminusneo-epitopebiomarkerofcollagentypexalpha1)
<400>2
glyilealathrlysgly
15
<210>3
<211>11
<212>prt
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>延长肽(elongatedpeptide)
<400>3
alaglyilealathrlysglyleuasnglypro
1510
<210>4
<211>9
<212>prt
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>截短肽(truncatedpeptide)
<400>4
ilealathrlysglyleuasnglypro
15
<210>5
<211>11
<212>prt
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>生物素化肽(biotinylatedpeptide)
<220>
<221>site
<222>11
<223>生物素残基,在生物素残基和肽之间具有任选的接头(biotinresiduewithoptionallinkerbetweenbiotinresidueand
peptide)
<400>5
glyilealathrlysglyleuasnglyproxaa
1510
<210>6
<211>14
<212>prt
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>免疫原性肽(immunogenicpeptide)
<220>
<221>site
<222>14
<223>匙孔血蓝蛋白残基(keyholelimpethemocyaninresidue)
<400>6
glyilealathrlysglyleuasnglyproglyglycysxaa
1510
<210>7
<211>16
<212>prt
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>质谱片段(massspecfragment)
<400>7
proglyserlysglyaspproglyserproglyproproglyproala
151015
<210>8
<211>14
<212>prt
<213>人工序列(artificialsequence)
<220>
<221>
<222>
<223>质谱片段(massspecfragment)
<400>8
serlysglyaspproglyserproglyproproglyproala
1510
<210>9
<211>10
<212>prt
<213>鼠(rattus)
<220>
<221>
<222>
<223>大鼠序列(ratsequence)
<400>9
glyilevalthrlysglyleuasnglypro
1510
<210>10
<211>10
<212>prt
<213>鼠科(murinae)
<220>
<221>
<222>
<223>小鼠序列(mousesequence)
<400>10
glyilealathrlysglyleuasnglypro
1510
<210>11
<211>10
<212>prt
<213>牛科(bovidae)
<220>
<221>
<222>
<223>牛序列(bovinesequence)
<400>11
glyilealavallysglyleuasnglypro
1510
<210>12
<211>10
<212>prt
<213>犬科(canidae)
<220>
<221>
<222>
<223>犬序列(dogsequence)
<400>12
glyvalalathrlysglyleuasnglypro
1510
- 还没有人留言评论。精彩留言会获得点赞!