通过实时谷胱甘肽测量改善治疗细胞质量的方法与流程
本发明涉及通过实时谷胱甘肽监测来改善治疗细胞质量的方法。
背景技术:
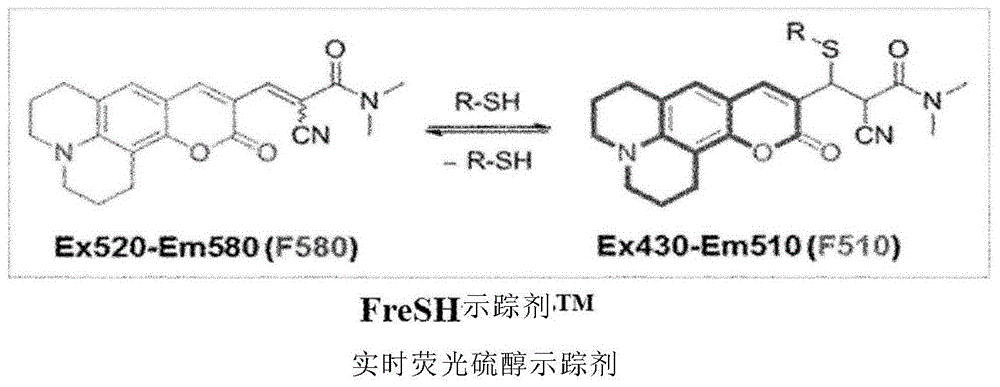
:尽管人体通过抗氧化剂系统的作用适当地消除了活性氧(ros)以维持体内平衡,但是当ros的产生和抗氧化剂作用之间的平衡被打破时,氧化应激会增加,并且氧化应激作为代谢综合症(如糖尿病、肥胖或心血管疾病以及衰老)、与年龄有关的变性疾病(如变性关节炎、白内障或阿尔茨海默氏病)、各种类型的癌症和纤维化疾病的发病的重要常见病因,最近引起了人们的关注。作为衰老的主要机制之一,ros不稳定且对氧化生物分子具有高反应活性,因此会引起生化和生理损伤。因此,除人体的氧化度外,抗氧化度或抗氧化能力可能是计算生物年龄的关键生物标记。ros是调节细胞代谢、增殖和存活的重要信号分子。ros的增加会诱导信号蛋白上半胱氨酸残基的巯基氧化,导致调节细胞功能的蛋白活性发生变化。尤其是,ros介导的氧化在调节干细胞(scs)的各种信号蛋白中起着重要作用,这些干细胞会影响自我更新能力、多能性、生存能力和基因组稳定性,包括oct4、nrf2、foxo、ape1/ref-1、atm、hif-1、p38和p53(wang等,2013)。同时,有多种方法用于评估干细胞和细胞培养物的质量、一致性和功效。干细胞通过自我更新能力和特定标记的表达来定义。应该对所需细胞群的身份进行定义。当前的hesc细胞系的特征是使用一系列标准化指标(例如,体外(形成胚胎体)和体内分化(形成畸胎瘤样异种移植物))、以及表面抗原、特定酶活性(例如碱性磷酸酶)的表达、基因表达、表观遗传标记、基因组稳定性、细胞学和形态的评估缺乏可测量的微生物感染潜能(日本专利5185443)。然而,尽管用于评估这些干细胞特性的程序需要熟练的技术人员,但它们提供的信息相对较少,既耗时又昂贵。此外,这些程序没有提供有关所生产细胞的安全性和/或客观适宜性的关键信息。就干细胞而言,除了在支持未分化细胞增殖的条件下扩大细胞群外,还必须提供有关诱导期干细胞系质量和一致性的信息,并改善细胞培养中连续传代培养中的细胞质量。[公开][技术问题]本发明旨在提供一种通过实时谷胱甘肽监测来改善治疗细胞质量的方法。另外,本发明涉及表征细胞和/或改善体外细胞培养系统的质量和安全性。[技术方案]在下文中,在本发明中描述的各种示例性实施例参考附图进行描述。在下面的描述中,为了完全理解本发明,描述了各种具体细节,例如具体形式、组成和方法。但是,可以在没有一个或多个这些具体细节或其他已知方法和形式的情况下实现特定实施例。在另一实施例中,没有特别详细地描述已知的工艺和制造技术,以免不必要地使本发明晦涩难懂。整个说明书中对“一种实施方案”或“实施方案”的引用是指结合该实施例描述的特定特征、形式、组成或特性包括在本发明的一个或多个实施方案中。因此,在整个说明书中的不同位置表示的“一个实施方案”或“实施方案”的不一定代表本发明的相同实施方案。另外,在一个或多个实施方案中,可以以任何合适的方式组合特定特征、形式、组成或特性。除非另有定义,否则在说明书中,本文所用的所有科学和技术术语具有与本发明所属领域的普通技术人员通常所理解的相同含义。在本发明的一个示例性实施方案中,术语“荧光实时sh基团(fresh)-示踪剂”或“fresh”是指包含下式a表示的化合物或其盐的化合物,并用作用于检测不限于细胞器硫醇的荧光物质。因此,fresh-示踪剂既包括对细胞器特异性的化合物又包括不限于此的化合物。[式a]在上述式a中,r1和r2各自独立地为氢、c1-4直链或支链烷基,或由r1、r2和x形成的具有5或6元环的杂环烷基或杂环烯基;r3为氢或c1-4直链或支链烷基;r4和r5各自独立地为氢、c1-5直链或支链烷基,或-(ch2)m-coo-c1-5直链或支链烷基(m为1至5的整数),或r4、r5和y形成c3-7杂环烷基,且所述杂环烷基是未取代的或r6-取代的杂环烷基;r6为-coo(ch2)n-oco-c1-5直链或支链烷基(n为1至5的整数)、-(conh)-(ch2)o-pph3+cl-(o为1至5的整数)或-(conh)-chr7-coo(ch2)p-oco-c1-5直链或支链烷基(p为1至5的整数);r7为-(ch2)q-coo(ch2)r-oco-c1-5直链或支链烷基(q和r均为1至5的整数);x和y各自独立地为n或o。在本发明的一个示例性实施方案中,术语“线粒体荧光实时sh基-示踪剂(mitofresh-示踪剂)”或“高尔基荧光实时sh基-示踪剂(golgifresh-示踪剂)”是指包含由下面的式b表示的化合物或其盐,并用于测量线粒体或高尔基体中的硫醇的量,但是本发明不限于此。另外,作为实例,特别地,由式b-8表示的化合物用作golgifresh-示踪剂,并且由式b-4表示的化合物用作mitofresh-示踪剂。通过使用这些化合物,可以证明荧光强度根据线粒体或高尔基体中的硫醇的量连续地、成比例地、并可逆地增加/减少。[式b]在上述式b中,r1为杂环烷基,其为包含一个或多个n原子的3-至7-元环。本发明使用的术语“比例”是指输出(output)与输入(input)成正比。具体地,在本发明的一个示例性实施方案中,所述“比率”是指本发明的组合物的荧光强度或荧光强度的比例与硫醇输入增加或减少成正比。本发明使用的术语“检测”是指检测样品中化学物种或生物材料的存在或测量其量。本发明使用的术语“可逆的”是指在化学反应中,反应物和产物的混合物可以使混合物达到平衡的状态。本发明使用的术语“硫醇(thiol)”是指包括与碳结合的巯基的有机化合物,并且可以与“巯基(sulfhydryl)”互换使用。在本发明的示例性实施方案中,本发明所述的线粒体被包括在活细胞中。就线粒体中的硫醇水平的测量而言,本发明的组合物不限于测量从细胞分离的线粒体中的硫醇水平,并且可以测量细胞中所包括的线粒体中的硫醇水平。特别地,可以特异性地检测活细胞中线粒体中的硫醇水平。在本说明书中,golgifresh-示踪剂是指具有氰基丙烯酰胺亲电子体的香豆素衍生物,其是本发明的式b表示的化合物,并且根据本发明用作检测高尔基复合体中硫醇的荧光物质。发明人开发了golgifresh-示踪剂,其是一种能够实时定量或定性检测细胞中高尔基复合体中硫醇的量的生物传感器。结果证明,由本发明式b-5表示的本发明golgifresh-示踪剂的荧光强度根据细胞中高尔基复合体中硫醇的量连续地、成比例地和可逆地增加或减少,并且证明了本发明golgifresh-示踪剂可以有效地用作具有显著灵敏度的生物传感器,用于实时定量或定性检测细胞中高尔基复合体中硫醇的量。在本发明的一个示例性实施方案中,关于细胞或干细胞的“安全性”和“质量”,在不安全(例如致瘤性)细胞或细胞和/或质量较差(可能缺乏特定标记的表达)细胞之间的表型有所不同。表型的差异可能无法通过标准方法检测到。本发明提供了一种高度灵敏和精细的手段,用于确定细胞或细胞体系(例如细胞培养的细胞群体)是否符合一系列预定标准并改善细胞特性以符合这些标准。以前,为了研究细胞质量特性,本领域技术人员能够建立已知符合一系列预定安全性和/或质量标准的细胞的microrna图谱,并通过比较microrna与其他相同类型的细胞,评估它们是否符合预定质量和/或特性。在本发明的一个示例性实施方案中,“丁硫氨酸-亚砜亚胺(bso)”不可逆地抑制用于合成谷胱甘肽(gsh)所必需的γ-谷氨酰半胱氨酸合酶,以诱导细胞中氧化应激。众所周知,由gsh消耗引起的氧化应激可以诱导基因组重排,例如dna缺失,当氧化促进条件被外源性抗氧化剂n-乙酰-l-半胱氨酸(nac)阻断时,dna缺失可以被抑制。本发明中使用的术语“干细胞”是指具有自我复制能力和分化/增殖能力的未分化细胞。根据分化能力,干细胞包括多能(pluripotent)干细胞、专能(multipotent)干细胞和单能干细胞的亚群。多能干细胞是指具有分化为构成活体的所有组织或细胞的能力的细胞。另外,专能干细胞是指具有分化为多种类型而非所有类型组织或细胞的能力的细胞。单能干细胞是指具有分化成特定组织或细胞的能力的细胞。专能干细胞可以包括胚胎干细胞(es细胞)、未分化的胚胎生殖细胞(eg细胞)和诱导型专能干细胞(ips细胞)。专能干细胞可包括成体干细胞(例如间充质干细胞(源自脂肪、骨髓、脐带血或脐带))、造血干细胞(源自骨髓或外周血)、神经系统干细胞和生殖干细胞。另外,单能干细胞可以包括定型干细胞,其通常以低的分裂能力存在,但是一旦被激活,它们就会剧烈分裂,仅产生肝细胞。特别地,在本发明中,优选间充质干细胞(msc)是人胚胎干细胞来源的间充质基质细胞(hes-msc)、骨髓间充质干细胞(bm-msc)、脐带间充质干细胞(uc-mscs),和脂肪干细胞(adscs),但是本发明不限于此。本发明中使用的术语胚胎干细胞(escs)是指通过在受精卵植入前立即分离胚泡的内部细胞团并体外培养内部细胞团而获得的细胞,并且所述escs具有全能性,因此它们可以分化成个体所有组织的细胞。广义上讲,escs包括源自胚胎干细胞的胚胎体。本发明使用的术语“胚胎体或胚状体(eb)”是指在悬浮培养中产生的干细胞的球形团块,并且由于eb具有分化为内胚层、中胚层和外胚层的潜力,因此可以用作确保组织特异性分化细胞的大多数分化诱导过程的前体。本发明所用的术语“提取物”是指将草药挤压入合适的浸提液中,并通过蒸发将其浓缩的试剂,但本发明不限于此,并且可以指通过提取、稀释、或浓缩液体提取物获得的液体提取物,通过干燥液体提取物而获得的干燥产品或部分纯化或纯化的组分。作为提取方法,优选可以使用沸腾提取、热水提取、冷浸提取、回流冷却提取或超声波提取,但是本发明不限于此。在本发明中,可以通过用萃取溶剂萃取或通过分馏溶剂对用萃取溶剂萃取制备的萃取物进行分馏而制备所述萃取物。提取溶剂可以是但不限于水、有机溶剂或其混合溶剂,并且有机溶剂可以是极性溶剂(例如具有1-4个碳原子的醇、乙酸乙酯或丙酮)、非极性溶剂(例如己烷或二氯甲烷),或其混合溶剂。可以通过谷胱甘肽探针测量根据整个细胞或细胞器的gsh量。本发明的fresh-示踪剂是一种新合成的荧光染料,用于快速且容易地测量活细胞中的谷胱甘肽(gsh)的量。fresh-示踪剂是一种小分子探针,可以容易地进入细胞和细胞器,并与gsh的硫醇基(-sh)结合(参见图1)。当fresh-示踪剂与gsh结合时,在包括510nm(f510)的波长范围内观察到荧光,而当fresh-示踪剂不与gsh结合时,在包括580nm(f580)的波长范围内观察到荧光。利用测得的f510/f580的荧光值,可以测量细胞中的gsh量。fresh-示踪剂与gsh之间的反应是可逆的,并且在测量中不消耗细胞中的gsh。本发明使用的术语“谷胱甘肽均值或中值水平(gm)”是通过监测谷胱甘肽的方法,测量培养细胞中gsh的均值或中值来测量细胞的抗氧化能力的参数。本发明中使用的术语“谷胱甘肽异质性(gh)”是用于通过使用监测谷胱甘肽的方法,测量培养细胞中gsh的分布模式来测量细胞的抗氧化能力的参数。异质性是变异系数或稳健变异系数,并且变异系数的计算方法如图8所示。本发明使用的术语“谷胱甘肽再生能力(grc)”是可以客观地分析细胞的抗氧化能力的参数,该参数通过处理二酰胺以诱导将gsh还原为gssg的条件并通过实时监测细胞的谷胱甘肽浓度以评估真实还原gsh的细胞能力来测量。也就是说,grc是通过用氧化剂处理活细胞后实时检测fr或f510所获得的值,该值是通过第一氧化剂处理组的第一曲线下面积auc减去第二氧化剂处理组的第二曲线下面积(auc)所得的值,除以幼稚对照组的第三auc减去第二氧化剂处理组的第二auc所得的值,并乘以100得到的。本发明所用的术语“可逆氧化剂”或“第一氧化剂”可包括氢过氧化物(例如h2o2)和叔丁基过氧化物;硫醇氧化剂,例如二酰胺)、gssg(氧化的gsh)、5,5-二硫代双(2-硝基苯甲酸)、马来酰亚胺、n-乙基马来酰亚胺、4-马来酰亚胺基丁酸、3-马来酰亚胺基丙酸和碘乙酰胺;谷胱甘肽还原酶抑制剂,例如双-氯乙基硝基唑脲;硫氧还蛋白抑制剂,例如px-12;线粒体电子传输链抑制剂,例如抗霉素a、鱼藤酮、寡霉素和羰基氰化物间氯苯腙;nadph氧化酶激活剂,例如佛波醇12-肉豆蔻酸酯13-乙酸酯;gpx4抑制剂,例如1s,3r-ras选择性致死3(1s,3r-rsl3)、dpi19、dpi18、dpi17、dpi13、dpi12、dpi10(ml210)、dpi7(ml162)和六甲蜜胺;系统x-c抑制剂,例如爱拉斯汀(erastin)、柳氮磺胺吡啶、索拉非尼、谷氨酸盐、哌嗪爱拉斯汀、咪唑酮爱拉斯汀和爱拉斯汀类似物;降低gpx4蛋白和辅酶q10水平的诱导剂,如铁诱导的细胞死亡(ferroptosis)诱导剂56(fin56);脂质过氧化诱导剂,例如半胱天冬酶非依赖性的致死性56(cil56)和内过氧化物(fino2),其是铁诱导的细胞死亡诱导剂;谷氨酸-半胱氨酸连接酶(gcl)抑制剂,例如丁硫氨酸-(s,r)-亚磺酰亚胺;gsh还原诱导剂,例如马来酸二乙酯;dpi2、顺铂、半胱氨酸酶、他汀类药物、柠檬酸铁铵、葫芦巴碱、四氯化碳、硅基纳米颗粒和比热等离子体。氧化应激水平可以为0.05至20μm。本发明使用的术语“不可逆硫醇氧化剂”,“不可逆氧化剂”或“第二氧化剂”是指可用于确保细胞毒性剂中任何未反应基团(例如硫醇)失活的试剂。该试剂可帮助防止细胞毒性剂,特别是具有未反应硫醇基团(例如,dm1)的细胞毒性剂的二聚化。也就是说,不可逆硫醇氧化剂是用于形成完全消除gsh的空白基团的物质。例如,所述物质可以是马来酰亚胺、4-马来酰亚胺基丁酸、3-马来酰亚胺基丙酸、乙基马来酰亚胺、n-乙基马来酰亚胺、碘乙酰胺、5,5'-二硫代双(2-硝基苯甲酸)或碘乙酰胺基丙酸,但是本发明不是限于此,并且所述物质优选为乙基马来酰亚胺。在一个示例性实施方案中,干细胞的质量可以通过一系列的gm、gh和grc参考值来确定,并且可以通过比较靶细胞的gm、gh和grc值与靶细胞的标准干细胞的值来确定。除了引起氧化的物质以外,本发明中使用的术语“氧化剂”通常包括引起细胞中氧化应激的处理。优选地,所述氧化剂包括第一氧化剂或第二氧化剂。术语“抗氧化应激能力(orc)”是随gsh表达而变化的细胞计数值,其通过将活细胞用第一氧化剂处理后定量的gsh水平与没有用氧化剂处理过的对照细胞或尚未用氧化剂处理的对照细胞中定量的gsh水平进行比较而获得。例如,可以对orc进行检测,以了解在向细胞施加氧化应激后,是否可以将线粒体谷胱甘肽(mgsh)表达水平维持在正常水平。另外,在一个示例性实施方案中,干细胞的质量可以被确定为具有10%至100%的orc值,优选地30%至90%,并且更优选地40%至90%。在本发明中,在orc中,本发明使用的术语“氧化应激”是指将第一氧化剂施加至细胞。本发明提供了一种改善细胞质量的方法,该方法包括:分离需要的细胞;以及测量分离细胞中的谷胱甘肽水平;根据谷胱甘肽水平确定细胞质量;向分离的细胞中添加能够改善谷胱甘肽评估参数的物质。在本发明的一个示例性实施方案中,根据谷胱甘肽水平测定的细胞质量是基于如下的任何一个或多个评估参数进行的:i)细胞的gm;ii)细胞的gh;iii)细胞的grc;iv)orc。此处,gm计算为细胞fresh-示踪剂比率(fr)或f510的平均值或中位数;gh计算为细胞fr或f510的变异系数或稳健变异系数;grc通过用氧化剂处理细胞后,实时检测fr或f510而获得,方法是通过从第一氧化剂的第一曲线下面积auc中减去第二氧化剂处理组的第二曲线下面积(auc)所得的值,除以未处理对照组(naivecontrol)的第三auc中减去第二氧化剂处理组的第二auc所得的值,并将所得值乘以100;orc是随gsh表达而变化的细胞计数值,其通过将活细胞用第一氧化剂处理后定量的gsh水平与没有用氧化剂处理过的对照细胞或尚未用氧化剂处理的对照细胞中定量的gsh水平进行比较而获得。在本发明的另一个示例性实施方案中,在orc测量中,与未使用氧化剂处理的细胞相比,通过氧化剂处理来提高gm和grc(谷胱甘肽评估参数)、降低gh或降低减少gsh的细胞比例来实现细胞质量的改善。在本发明的另一个示例性实施方案中,能够改善谷胱甘肽评估参数的物质是选自下组的任何一种或多种:谷胱甘肽乙酯、抗坏血酸2-葡萄糖苷、谷胱甘肽、n-乙酰半胱氨酸、2-巯基乙醇、二硫苏糖醇(dtt)、半胱氨酸、γ-谷氨酰胺基半胱氨酸(ggc)、ggc酯、氧代4-噻唑烷羧酸(otc)、l-2-氧代-4-噻唑烷羧酸、硫辛酸,费洛他汀-1、立普他汀-1、维生素d3、1-α、25-二羟基vitd3、维生素e、辅酶q10、铁或铜离子螯合剂(例如去铁胺、去铁酮或地拉罗司)、黄芩苷、黄芩素、木犀草素、槲皮素、紫铆因、杭白菊(chrysanthemummorifoliumramat)的花提取物、中华雪松(cedelasinensisa.juss)的叶提取物、待宵草(oenotherastrictaledeb)的提取物、问荆(equisetumarvensel.)的提取物、甘薯(ipomoeabatatas)的叶提取物、番茄提取物和高半胱氨酸。在本发明的又一示例性实施方案中,在改善谷胱甘肽评估参数的步骤之前,还包括测量谷胱甘肽水平的步骤。在本发明的又一示例性实施方案中,在添加能够改善谷胱甘肽评估参数的物质步骤之后,还包括通过测量谷胱甘肽水平来确认谷胱甘肽水平增加的步骤。在本发明的另一个示例性实施方案中,所需细胞可以是选自下组中的任何一种干细胞:成体干细胞、胚胎干细胞和诱导性多能干细胞;选自下组中的任何一种免疫细胞:树突状细胞、天然杀伤细胞、t细胞、b细胞、调节性t细胞(treg细胞)、天然杀伤性t细胞、先天性淋巴样细胞、巨噬细胞、粒细胞、嵌合抗原受体的免疫细胞t(car-t)细胞、淋巴因子激活的杀伤(lak)细胞和细胞因子诱导的杀伤(cik)细胞;选自下组的任何一种体细胞:纤维母细胞、软骨细胞、滑膜细胞、角质形成细胞、脂肪细胞、成骨细胞、破骨细胞和外周血单核细胞;选自下组中的任何一种用于生产蛋白质制剂的细胞系:cho细胞、ns0细胞、sp2/0细胞、bhk细胞、c127细胞、hek293细胞、ht-1080细胞和per.c6细胞;或选自下组的任何一种微生物组:来源于人或动物的口腔、鼻腔、肺、皮肤、胃肠道和泌尿道的微生物。在本发明的另一个示例性实施方案中,t细胞不包括调节性t细胞(treg细胞)。在本发明的另一个示例性实施方案中,第一氧化剂可包括氢过氧化物(例如h2o2)和叔丁基过氧化物;硫醇氧化剂,例如二酰胺)、gssg(氧化的gsh)、5,5-二硫代双(2-硝基苯甲酸)、马来酰亚胺、n-乙基马来酰亚胺、4-马来酰亚胺基丁酸、3-马来酰亚胺基丙酸和碘乙酰胺;谷胱甘肽还原酶抑制剂,例如双-氯乙基硝基唑脲;硫氧还蛋白抑制剂,例如px-12;线粒体电子传输链抑制剂,例如抗霉素a、鱼藤酮、寡霉素和羰基氰化物间氯苯腙;nadph氧化酶激活剂,例如佛波醇12-肉豆蔻酸酯13-乙酸酯;gpx4抑制剂,例如1s,3r-ras选择性致死3(1s,3r-rsl3)、dpi19、dpi18、dpi17、dpi13、dpi12、dpi10(ml210)、dpi7(ml162)和六甲蜜胺;系统x-c抑制剂,例如爱拉斯汀(erastin)、柳氮磺胺吡啶、索拉非尼、谷氨酸盐、哌嗪爱拉斯汀、咪唑酮爱拉斯汀和爱拉斯汀类似物;降低gpx4蛋白和辅酶q10水平的诱导剂,如铁诱导的细胞死亡诱导剂56(fin56);脂质过氧化诱导剂,例如半胱天冬酶非依赖性致死性56(cil56)和内过氧化物(fino2),其是铁诱导的细胞死亡的诱导剂;谷氨酸-半胱氨酸连接酶(gcl)抑制剂,例如丁硫氨酸-(s,r)-亚磺酰亚胺;gsh还原诱导剂,例如马来酸二乙酯;dpi2、顺铂、半胱氨酸酶、他汀类药物、柠檬酸铁铵、葫芦巴碱、四氯化碳、硅基纳米颗粒和比热等离子体。在本发明的另一个示例性实施方案中,第二氧化剂包括马来酰亚胺、4-马来酰亚胺基丁酸、3-马来酰亚胺基丙酸、乙基马来酰亚胺、n-乙基马来酰亚胺、碘乙酰胺、5,5'-二硫代双(2-硝基苯甲酸)或碘乙酰胺基丙酸。本发明提供了用于改善细胞质量的组合物,所述组合物是在确定所需细胞中根据谷胱甘肽水平确定细胞质量后添加的,其中,根据谷胱甘肽水平确定细胞质量是基于如下评价参数进行的:i)gm细胞;ii)细胞的gh;iii)细胞的grc;iv)orc。此处,gm计算为细胞fr或f510的平均值或中位数;gh计算为细胞fr或f510的变异系数或稳健变异系数;grc通过用氧化剂处理细胞后,实时检测fr或f510而获得,方法是通过从第一氧化剂的第一曲线下面积(auc)中减去第二氧化剂处理组的第二曲线下面积(auc)所得的值,除以未处理对照组的第三auc中减去第二氧化剂处理组的第二auc所得的值,并将所得值乘以100;orc是随gsh表达而变化的细胞计数值,其通过将活细胞用第一氧化剂处理后定量的gsh水平与没有用氧化剂处理过的对照细胞或尚未用氧化剂处理的对照细胞中定量的gsh水平进行比较而获得。在本发明的一个示例性实施方案中,在orc测量中,与未使用氧化剂处理的细胞相比,通过氧化剂处理来提高gm和grc(谷胱甘肽评估参数)、降低gh或降低减少gsh的细胞比例来实现细胞质量的改善。在本发明的另一个示例性实施方案中,能够改善谷胱甘肽评估参数的物质是选自下组的任何一种或多种:谷胱甘肽乙酯、抗坏血酸2-葡萄糖苷、谷胱甘肽、n-乙酰半胱氨酸、2-巯基乙醇、二硫苏糖醇(dtt)、半胱氨酸、γ-谷氨酰胺基半胱氨酸(ggc)、ggc酯、氧代4-噻唑烷羧酸(otc)、l-2-氧代-4-噻唑烷羧酸、硫辛酸,费洛他汀-1、立普他汀-1、维生素d3、1-α、25-二羟基vitd3、维生素e、辅酶q10、铁或铜离子螯合剂(例如去铁胺、去铁酮或地拉罗司)、黄芩苷、黄芩素、木犀草素、槲皮素、紫铆因、杭白菊(chrysanthemummorifoliumramat)的花提取物、雪松(cedelasinensisa.juss)的叶提取物、待宵草(oenotherastrictaledeb)的提取物、问荆(equisetumarvensel.)的提取物、甘薯(ipomoeabatatas)的叶提取物、番茄提取物和高半胱氨酸。在本发明的另一示例性实施方案中,所需细胞可以是选自下组中的任何一种干细胞:成体干细胞、胚胎干细胞和诱导性多能干细胞;选自下组中的任何一种免疫细胞:树突状细胞、天然杀伤细胞、t细胞、b细胞、调节性t细胞(treg细胞)、天然杀伤性t细胞、先天性淋巴样细胞、巨噬细胞、粒细胞、嵌合抗原受体的免疫细胞t(car-t)细胞、淋巴因子激活的杀伤(lak)细胞和细胞因子诱导的杀伤(cik)细胞;选自下组的任何一种体细胞:纤维母细胞、软骨细胞、滑膜细胞、角质形成细胞、脂肪细胞、成骨细胞、破骨细胞和外周血单核细胞;选自下组中的任何一种用于生产蛋白质制剂的细胞系:cho细胞、ns0细胞、sp2/0细胞、bhk细胞、c127细胞、hek293细胞、ht-1080细胞和per.c6细胞;或选自下组的任何一种微生物组:来源于人或动物的口腔、鼻腔、肺、皮肤、胃肠道和泌尿道的微生物。在本发明的另一个示例性实施方案中,第一氧化剂可包括氢过氧化物(例如h2o2)和叔丁基过氧化物;硫醇氧化剂,例如二酰胺)、gssg(氧化的gsh)、5,5-二硫代双(2-硝基苯甲酸)、马来酰亚胺、n-乙基马来酰亚胺、4-马来酰亚胺基丁酸、3-马来酰亚胺基丙酸和碘乙酰胺;谷胱甘肽还原酶抑制剂,例如双-氯乙基硝基唑脲;硫氧还蛋白抑制剂,例如px-12;线粒体电子传输链抑制剂,例如抗霉素a、鱼藤酮、寡霉素和羰基氰化物间氯苯腙;nadph氧化酶激活剂,例如佛波醇12-肉豆蔻酸酯13-乙酸酯;gpx4抑制剂,例如1s,3r-ras选择性致死3(1s,3r-rsl3)、dpi19、dpi18、dpi17、dpi13、dpi12、dpi10(ml210)、dpi7(ml162)和六甲蜜胺;系统x-c抑制剂,例如爱拉斯汀(erastin)、柳氮磺胺吡啶、索拉非尼、谷氨酸盐、哌嗪爱拉斯汀、咪唑酮爱拉斯汀和爱拉斯汀类似物;降低gpx4蛋白和辅酶q10水平的诱导剂,如铁诱导的细胞死亡诱导剂56(fin56);脂质过氧化诱导剂,例如不依赖半胱天冬酶非依赖性致死性56(cil56)和内过氧化物(fino2),其是铁诱导的细胞死亡的诱导剂;谷氨酸-半胱氨酸连接酶(gcl)抑制剂,例如丁硫氨酸-(s,r)-亚磺酰亚胺;gsh还原诱导剂,例如马来酸二乙酯;dpi2、顺铂、半胱氨酸酶、他汀类药物、柠檬酸铁铵、葫芦巴碱、四氯化碳,二氧化硅基纳米颗粒和比热等离子体。在本发明的另一个示例性实施方案中,第二氧化剂包括马来酰亚胺、4-马来酰亚胺基丁酸、3-马来酰亚胺基丙酸、乙基马来酰亚胺、n-乙基马来酰亚胺、碘乙酰胺、5,5'-二硫代双(2-硝基苯甲酸)或碘乙酰胺基丙酸。fr可以是430-550nm的荧光强度(f510)与550-680nm的荧光强度(f580)之比,但本发明不限于此。[有益效果]fresh-示踪剂可用于实时监测活干细胞中的细胞内gsh水平并根据gsh水平进行细胞分化,并且本发明涉及一种能够评估细胞治疗剂质量和改善其质量的新颖方法。[附图说明]图1示出了反应路线,其中,本发明的fresh-示踪剂与谷胱甘肽(gsh)可逆地反应(图1a),通过uv-可见吸收光谱法(图1b)测量fresh-示踪剂的可逆反应,通过监测fresh-示踪剂分别在430nm和520nm激发产生510nm(f510)和580nm(f580)的荧光发射光谱(图1c)图1c的结果图(图1d)和发射率是通过将f510值除以f580值(即(f510/f580(fr)),然后根据gsh浓度增加调整结果值而计算出的(图1e)。图2示出了通过f510/f580(fr)对hbm-mscs进行facs分选的步骤图。图3示出了从细胞中除去fresh-示踪剂的图,其中,图3a示出了fresh-示踪剂染色的细胞洗涤后,在新的培养基中培养之一段时间后的facs分析结果,图3b示出了通过量化结果获得的图。图4示出了通过基于fresh-示踪剂的facs分选的hbm-mscs的cfu-f(图4a)和通过sdf-1α和pdgf-aa测量迁移能力的结果(图4b)。图5a至5f示出了通过fresh-示踪剂分选的成纤维细胞的抗衰老活性。图6示出了通过fresh-示踪剂分选的树突细胞的活性。图7示出了通过fresh-示踪剂分选的t细胞中treg细胞的活性。图8示意性地示出了用于评估治疗细胞的质量四个谷胱甘肽参数、推导的公式和所得实施例。图9示出了根据hbm-mscs的继代培养的cfu-f分析结果(图9a)和sdf-1α和pdgf-aa的迁移能力(图9b)。图10a至图10c示出了根据hbm-mscs的继代培养,基于fresh-示踪剂、golgifresh-示踪剂或mitofresh-示踪剂分析gm和gh的结果。图11示出了根据hbm-mscs的继代培养,基于fresh-示踪剂、golgifresh-示踪剂或mitofresh-示踪剂分析grc的结果。图12示出了根据谱系分离大鼠骨髓细胞后基于mitofresh-示踪剂分析gm和gh的结果。图13示出了使用fresh-示踪剂(图13a)通过facs对hes-mscs进行分选后分析cfu-f(图13a),或用bso或gsh-ee处理未分选培养的hes-mscs(图13b)后分析pdgf-aa引起的细胞迁移能力(图13b)的结果。图14a至图14c示出了将huc-mscs在含有aa2g的培养基中继代培养3次之后,基于fresh-示踪剂分析grc的结果。图15a和15b示出了将huc-mscs在含有aa2g的培养基中继代培养3次后,基于fresh-示踪剂分析orc的结果。图16a示出了将huc-mscs用125μg/ml的aa2g(左图)或250μg/ml的aa2g(右图)处理三天之后,cfu-f测定结果的图像。图16b示出了用125或250μg/ml的aa2g处理huc-mscs三天之后,cfu-f测定(n=3)结果的图表。图17a示出了将huc-mscs用125或250μg/ml的aa2g处理三天后,pdgf-aa的迁移能力。图17b示出了显示用125或250μg/ml的aa2g处理huc-msc三天之后,通过pdgf-aa分析迁移能力(n=3)的结果图表。图18a示出了显示用125或250μg/ml的aa2g处理huc-mscs三天后,降低t细胞的增殖能力(n=3)的效果图。图18b示出了用125或250μg/ml的aa2g处理huc-msc三天后,降低t细胞的分化能力(n=3)的效果图。图18c示出了用125或250μg/ml的aa2g处理huc-msc三天后,促进treg细胞的分化(n=3)的效果图。图19示出了用0.1、0.25和0.5mmγ-谷氨酰半胱氨酸(ggc)处理huc-msc2小时之后,cfu-f测定(n=3)的结果图。图20a示出了在没有用ggc处理huc-mscs的情况下,通过sdf1α和pdgf-aa分析迁移能力(n=3)的结果图。sti571用作pdgfr激酶抑制剂。图20b示出了用0.1mmggc处理了huc-mscs之后,通过sdf1α和pdgf-aa分析迁移能力(n=3)的结果图。sti571用作pdgfr激酶抑制剂。图20c示出了用0.25mmggc处理huc-msc之后,通过sdf1α和pdgf-aa分析迁移能力(n=3)的结果图。sti571用作pdgfr激酶抑制剂。图21示出了通过gm、gh和orc分析筛选用于调节细胞的gsh的物质的实验过程图。图22a和22b示出了在huc-mscs中铁死亡抑制剂lip-1分析orc的结果。图23a至23c示出了在huc-mscs中,维生素d3的gm、gh和orc的分析结果。图24示出了在huc-mscs中,维生素e的gm、gh和orc的分析结果。图25a至图25e示出了在huc-mscs中,类黄酮的gm、gh和orc的分析结果,其中图25a示出了在huc-mscs中,黄芩苷的gm、gh和orc的分析结果,图25b示出了在huc-mscs中,黄芩素的gm、gh和orc的分析结果,图25c示出了在huc-mscs中,木犀草素的gm、gh和orc的分析结果,图25d示出了在huc-mscs中,槲皮素的gm、gh和orc的分析结果,并且图25e示出了在huc-mscs中,紫铆因的gm、gh和orc的分析结果。图26a至26f示出了在huc-mscs中,植物提取物的gm、gh和orc的分析结果,其中图26a示出了在huc-mscs中,杭白菊的花提取物的gm、gh和orc的分析结果,图26b示出了在huc-mscs中,中华雪松(cedelasinensisa.juss)叶提取物的gm、gh和orc的分析结果,图26c示出了在huc-mscs中,待宵草提取物的gm、gh和orc的分析结果。图26d示出了在huc-mscs中,问荆(equisetumarvensel.)提取物的gm、gh和orc的分析结果。图26e示出了在huc-mscs中,番薯(ipomoeabatatas)叶提取物的gm、gh和orc的分析结果,以及图26f示出了在huc-mscs中,番茄提取物的gm、gh和orc的分析结果。图27示出了将huc-mscs用0.2、1、2和4μm铁死亡抑制剂fer-1和0.1、0.5、1和2μm铁死亡抑制剂lip-1处理24小时后,cfu-f测定(n=3)的结果图。图28a示出了将huc-mssc用1μm铁死亡抑制剂fer-1处理24小时或用0.2mmggc或2mmgsh-ee处理2小时后,降低t细胞增殖能力(n=3)的效果图。图28b示出了将huc-mscs用1μm铁死亡抑制剂fer-1处理24小时或用0.2mmggc或2mmgsh-ee处理2小时后,降低t细胞分化能力(n=3)的效果图。图28c示出了将huc-mscs用1μm铁死亡抑制剂fer-1处理24小时,或用0.2mmggc或2mmgsh-ee处理2小时后,促进treg细胞分化(n=3)的效果图。图29a示出了在含有aa2g(250μg/ml)的培养基中继代培养3次的hes-msc(2×105)注入由前部的破裂引起十字韧带(acl)大鼠的关节后的关节组织的图像。图29b示出了在含有aa2g(250μg/ml)的培养基中将hes-msc(2×105)继代培养3次后,注入到具有acl破裂引起的骨关节炎的大鼠关节中的hcl和esafranin-o的关节组织图像。图29c示出了在含有aa2g(250μg/ml)的培养基中传代培养3次的hes-mscs(2×105)在注入具有acl破裂引起的骨关节炎的大鼠的关节中的关节组织的免疫染色的ii型胶原蛋白的图像。图30示出了通过流式细胞术获得的第4、7和15代细胞中mgsh表达水平的直方图。图31示出了通过共聚焦成像获得的第4、7和15代细胞中mgsh表达水平的直方图。图32示出了根据干细胞的传代数和rsl3浓度的mgsh高细胞和mgsh低细胞的分布模式。图33示出了通过铁死亡抑制剂fer-1处理证实了用rsl3处理mscs效果的脂质氧化物依赖性。图34示出了在rls3处理之后,比较mgsh高和mgsh低细胞的cd146表面表达的结果。图35示出了根据成纤维细胞的传代数的mgsh高和mgsh低细胞的分布模式。[发明的实施方式]通过使用本发明的fresh-示踪剂和评估参数实时监测活干细胞中的细胞内gsh水平,并根据gsh水平进行细胞分化,可以评估细胞治疗剂的质量并改善其质量。[实施例]在下文中,将参考实施例更详细地描述本发明。提供这些实施例仅仅是为了更全面地描述本发明,并且对于本领域的普通技术人员显而易见的是,根据本发明的要旨,本发明的范围不限于以下实施例。<化合物的制备>制备了包含下式a表示的化合物或其盐的组合物用作fresh-示踪剂:[式a]在上述式a中,r1和r2各自独立地为氢、c1-4直链或支链烷基,或由r1、r2和x形成的具有5或6元环的杂环烷基或杂环烯基;r3为氢或c1-4直链或支链烷基;r4和r5各自独立地为氢、c1-5直链或支链烷基,或-(ch2)m-coo-c1-5直链或支链烷基(m为1至5的整数),或r4、r5和y形成c3-7杂环烷基,且所述杂环烷基是未取代的或r6-取代的杂环烷基;r6为-coo(ch2)n-oco-c1-5直链或支链烷基(n为1至5的整数)、-(conh)-(ch2)o-pph3+cl-(o为1至5的整数)或-(conh)-chr7-coo(ch2)p-oco-c1-5直链或支链烷基(p为1至5的整数);r7为-(ch2)q-coo(ch2)r-oco-c1-5直链或支链烷基(q和r均为1至5的整数);x和y各自独立地为n或o。更优选地,用作fresh-示踪剂的式a表示的化合物,是选自由式a-1至a-6表示的化合物:[式a-1][式a-2][式a-3][式a-4][式a-5][式a-6]更优选地,使用式a-1的化合物作为fresh-示踪剂。随后,制备了包含以下式b所示的化合物或其盐的组合物,用作mitofresh-示踪剂:[式b]在上述式b中,r1为包含一个或多个n原子的3至7元杂环烷基,其中,所述杂环烷基具有r2取代基;其中,r2为-(c(=o)nh)-(ch2)m-pph3+cl-(m为1至4的整数)、-(ch2)n-pph3+cl-(n为1至6的整数)或-(c(=o))-(ch2)p-r3(p为1-4的整数);其中,r3为-c(nhc(=o)-r4),其中,r4是由下式b-1表示的取代基。[式b-1]在上述式b-1中,x是1至4的整数。另外,本发明的r1是包含一个或两个n原子的6元杂环烷基环。在本发明中,术语“6元杂环烷基环”中包括的术语“6元环”是指单6元环,其是单环化合物,而不是几个共轭环(例如双环化合物或螺环化合物),并且“杂环烷基”是指其中环中包含的至少一个碳原子被杂原子(例如氮、氧或硫)取代的非芳族环状烷基。优选地,r1为6元杂环烷基环,包括一个或两个氮原子作为包含在该环中的杂原子。更优选地,用作mitofresh-示踪剂的b表示的化合物,是选自由式b-2至b-4表示的化合物:[式b-2][式b-3][式b-4]更优选,使用式b-4的化合物作为mitofresh-示踪剂。随后,制备了包含以下式b-5表示的化合物或其盐的组合物,用作golgifresh-示踪剂:[式b-5]在上述式b-5中,r4为-(ch2)p-(och2ch2o)q-(ch2)r-或-(ch2ch2)s-的化合物(p、q、r和s各自为1至5的整数)。更具体地,在上述式b-5中,r4为(och2ch2o)-、-(ch2ch2)-和-(ch2(och2ch2)2och2)-中的任何一种。更优选地,用作golgifresh-示踪剂由式b-5表示的化合物,是选自由式b-6至b-8表示的化合物:[式b-6][式b-7][式b-8]更优选地,使用式b-8的化合物作为golgifresh-示踪剂。通过使用根据本发明的化合物a或b或包含其的组合物,测量包括干细胞在内的所有细胞的细胞器(例如线粒体或高尔基复合体)的抗氧化能力,从而准确地测量和选择抗氧化能力强的细胞。使用本发明的组合物的细胞活性测量包括抗氧化能力的测量,但是本发明不限于此。另外,本发明提供了一种用于测量细胞器的抗氧化能力的组合物,其包含由式a或b表示的化合物;其外消旋体、其对映异构体、其非对映异构体、其对映异构体的混合物或其非对映异构体的混合物;和作为活性成分的其药学上可接受的盐。实施例实施例1:使用fresh-示踪剂建立实验条件并确认细胞内表达模式使用fresh-示踪剂测量活细胞的细胞活性,并且为了分离具有高细胞活性的细胞,如下建立实验条件。使用人骨髓间充质干细胞(hbm-msc,购自lonza)、人脐带间充质干细胞(huc-msc,衍生自首尔国立大学妇产科提供的脐带样品)和源自人胚胎干细胞的间充质干细胞(hes-msc,由韩国建国大学的hyung-minchung教授提供)。此处,下式a-1的化合物用作fresh-示踪剂,下式b-4的化合物用作mitofresh-示踪剂,并且下式b-8的化合物用作golgifresh-示踪剂。通过混合gsh(0至200mm)和fresh-示踪剂(10μm)制备缓冲液混合物(10mm磷酸盐,150mmnacl,ph7.4,h2o:dmso=98:2),并分别使用scincos-3100和hitachif-7000分光光度计测量溶液随时间变化的uv-可见光吸收光谱和荧光发射光谱。具体地,在mitofresh-示踪剂中添加gsh时,随着gsh的浓度增加,示踪剂对在λmax=430nm处紫外和可见光的吸光度增加,而在λmax=520nm处的吸光度降低(图1a),示踪剂的荧光发射强度在约510nm(f510,λex=430nm;λem=510nm)处增加,并在约580nm(f580,λex=520nm;λem=580nm)处下降(图1b和1c)。另外,证实了fresh-示踪剂的f510与f580的荧光发射强度比(f510/f580,fr)在很大的范围内与gsh浓度成比例地变化(图1d)。由fr荧光比率获得的回归曲线,比细胞内存在的gsh的浓度范围更宽的浓度范围(0至50mm)内显示出线性(r2=0.9938)(图1e)。此外,fresh-示踪剂中包含的各种衍生物(上述化合物a或b)对紫外和可见光的吸光度在λmax=430nm时也增加,在λmax=520nm时降低,并且其荧光发射强度在f510时增加,在f580下降。同样,经证实,其与式b-1的情况一样,f510/f580(fr)也在较大的gsh浓度范围成比例地变化(数据未显示)。可以参考韩国专利申请号10-2015-0161745和10-2017-0107429中的详细数据。[式a-1][式b-4][式b-8]因此,这些结果表明fresh-示踪剂可以监测细胞匀浆中由ros诱导的gsh变化。实施例2:根据基于fresh-示踪剂的gsh浓度,使用facs分离活细胞2-1.hbm-mscs的分离将hbm-mscs以1x103细胞/cm2的密度接种到培养基(mscgmbulletkit;lonza#pt-3001)中,三天后,在含有2μmfresh的培养基中标记1.5小时。用dpbs(welgene#lb001-02)洗涤细胞两次,并用胰蛋白酶(gibco#12604-013)溶液分离,然后用含有2μmfresh的新鲜培养基灭活胰蛋白酶。随后,在4℃和1800rpm下离心10分钟后,将细胞重悬于含有2μmfresh的新鲜培养基中。在进行facs装载之前,立即用含2μmfresh的pbs将所得悬浮液稀释1/5(每次稀释约1ml,以保持温度为4℃)。随后,在以下条件下,使用facs指令(bdariaiii,激光波长为405(用于测量f510)和488(用于测量f580),喷嘴尺寸:100μm,2,000-3,000次/秒),根据f510/f580的比例,选择总细胞数的上部3.9-35%和下部3.9-35%的细胞进行facs分析。将细胞分类为gsh高(上部1.9-35%的细胞群),gsh中(gsh中,上部30.2-62.5%的细胞群)和gsh低(下部1.9-35%的细胞群),然后将培养基替换为新鲜培养基以去除fresh-示踪剂(图2)。由于fresh-示踪剂可逆地结合到gsh上,因此通过替换培养基将fresh-示踪剂从细胞中去除(图3)。2-2.人二倍体成纤维细胞的分离从人的阴茎包皮中分离出的hdfs制备为旧细胞(p32)[根据传代复制衰老模型],接种在150pi组织培养基中,并用不含酚红的杜尔贝科改良伊格尔培养基(dmem)标记,其包括含有2μmfresh和1%青霉素-链霉素的10%胎牛血清,持续2小时。2小时后,将细胞用pbs洗涤两次,用胰蛋白酶le溶液(invitrogen)处理以分离细胞,用新鲜培养基处理以使胰蛋白酶失活,然后置于冰上5分钟。随后,将细胞在4℃和1000rpm下离心10分钟,然后重悬于含有2μmfresh的新鲜培养基中,密度为2x107细胞/ml。随后,在以下条件下,使用facs指令(bdariaiii,激光波长为405(用于测量f510)和488(用于测量f580),喷嘴尺寸:100μm),根据f510/f580的比例,选择对应于gsh高(总细胞数的上部0.2-35%)和gsh低(总细胞数的下部0.2-35%)的细胞进行facs分析。之后,通过用新鲜培养基替换培养基以去除fresh(图4)。由于fresh可逆地与gsh结合,因此通过替换培养基,fresh立即被从细胞中去除(数据未显示)。2-3.源自单核细胞的人树突状细胞的培养收集人血并用dpbs(welgene#lb001-02)稀释至3倍体积,然后使用淋巴细胞分离液(ficoll-paqueplus)(通用医疗,17-1440-02)通过密度差分离法仅分离有核细胞。确定分离细胞的数量,每1x107细胞添加90μl的2%含fbs的dpbs和10μl的cd14微珠(microbead)(美天旎公司(miltenybiotech)#130-050-201),以使其在4℃下反应15分钟,然后使用ls色谱柱分离出cd14+单核细胞。将分离的细胞以1x106细胞/孔接种在6孔板中,以在2ml树突状细胞分化培养基(rpmi1640、2mml-谷氨酰胺、10%fbs、1%青霉素-链霉素、100μmβ-巯基乙醇、20ng/mlhgmcsf、20ng/mlil-4)中进行分化,持续6天。6天后,将分化完成的树突细胞视为未成熟的树突细胞,并用0.5μg/ml的lps处理24小时,以培养成成熟的树突细胞。如实施例2-1中所述,用含fresh的培养基标记细胞。2-4.大鼠t淋巴细胞的分离在24孔板上,在37℃下,用5μg/ml的cd3抗体(百进生技(biolegend)#100340)包被4小时,然后用dpbs洗涤。使用小鼠pant细胞分离试剂盒ii(美天旎公司#130-095-130)从小鼠的脾脏和淋巴结中分离出的t淋巴细胞以2x106细胞/孔添加,并在含10%fbs的rpmi1640以及1μg/ml的cd28抗体(百进生技#102112)的培养基中培养3天。将fresh添加到培养基中,使其终浓度为2μm,以标记细胞2小时,然后将所得的培养液在4℃和1500rpm下离心5分钟,然后重悬在含有2μmfresh的新鲜培养基中,密度为2x107细胞/ml。然后,在以下条件下,按照facs指令(bdariaiii,激光波长分别为405(用于测量f510)和488(用于测量f580),且喷嘴尺寸为70μm),根据f510/f580的比例将细胞分为三种细胞群类型。2-5.hes-mscs的分离将hes-mscs以3x106细胞/ml的密度接种在150pi组织培养基中十二小时后,将细胞用30mlpbs洗涤两次,并用含2μmfresh的egm-2mv培养液标记2小时。两个小时后,将细胞用含2μmfresh的pbs洗涤两次,并用胰蛋白酶le(invitrogen)溶液处理以分离细胞,然后用新鲜的含2μmfresh的egm-2mv培养基灭活胰蛋白酶。随后,将细胞在4℃和2000rpm下离心20分钟,然后重悬在含有2μmfresh新鲜的egm-2mv培养基中,密度为5x107细胞/ml。在进行facs装载之前,立即用含有2μmfresh的pbs将悬浮液稀释1/5(每次稀释约1ml,以保持温度为4℃)。随后,在以下条件下,使用facs指令(bdariaiii,激光波长为405(用于测量f510)和488(用于测量f580),喷嘴尺寸:100μm,2,000-3,000次/秒),根据f510/f580的比例,选择总细胞数的上部3.9-35%和下部3.9-35%的细胞进行facs分析。将细胞分类为gsh高(上部3.9-35%的细胞群)和gsh低(下部3.9-35%的细胞群)后,用新鲜的培养基(egm-2-mv介质,lonza)替换该培养基,以去除fresh(图4)。由于fresh可逆地与gsh结合,因此通过替换培养基,可将fresh立即从细胞中去除(数据未显示)。实施例3:分选细胞的特征分析3-1.基于fresh-示踪剂分选干细胞的细胞学特征分析在细胞培养模型中评估了确定hbm-mscs疗效的主要因素,即菌落形成单位-成纤维细胞(cfu-f)和移植物存活率。将细胞以200细胞/100pi培养皿接种并培养14天,然后通过随后的结晶紫染色,证实gsh高细胞的cfu-f水平明显高于gsh中或gsh低细胞(图4a)。此外,使用transwell培养法测量了sdf-1(150ng/ml)或pdgf-aa(10ng/ml)±sti571(0.5μg/ml)的趋化性,证实gsh高细胞表现出比gsh低细胞更高的细胞迁移(图4b)。3-2.基于fresh-示踪剂分选成纤维细胞的衰老特征分析从人的阴茎包皮中分离出的人二倍体成纤维细胞(hdfs)被制备为年轻细胞(p6)和衰老细胞(p32)[根据传代复制衰老模型],然后,当使用由promega生产的gshg/ssg-glotm分析试剂盒,证实了与衰老细胞相比,年轻细胞的gsh水平降低了约44%(图5a)。通过实施例2-2中描述的方法,将hdfs分类为gsh高和gsh低成纤维细胞。测量细胞尺寸的结果,证实了gsh低细胞的尺寸是gsh高细胞的1.5倍,并且证实了该结果与先前的报道相符(请参阅参考文献1),随着衰老的进程,细胞尺寸(前向角散射(fsc))变大(图5b)。当用5μm二氢罗丹明123(dhr123)处理细胞,并在37℃下培养30分钟,以测量细胞内ros水平时,证实了gsh低细胞比gsh高细胞染色更好(图5c)。此外,当使用alexa488荧光滤光片通过自发荧光测量和定量脂褐素水平时,与gsh高细胞相比,gsh低细胞的测量强度更高(图5d),并且gsh低细胞的ki67mrna表达水平低于gsh高细胞,但p21的mrna表达水平更高(图5e)。另外,如上所述,通过rq-pcr对sasp相关基因的表达水平进行分析时,证实与gsh高细胞相比,gsh低细胞的il-1a基因和il-1b基因表达增加(图5f)。已知随着细胞的衰老,脂褐素水平升高(参见参考文献2)、ki67表达水平降低、p21表达水平升高(参见参考文献3)、衰老相关分泌表型(sasp)相关基因的表达水平增加(参见参考文献4),据此,gsh高细胞比gsh低细胞具有更高的抗衰老活性。使用上述rq-pcr分析测量该实施例中的基因表达,并且使用quantprime(http://www.quantprime.de/)设计用于该分析的所有引物,这些引物的序列如下面的表1所示。[表1]引物名称引物序列(5→3’)il1a_正向引物tgtgactgcccaagatgaagaccil1a_反向引物ttgggtatctcaggcatctccttcil1b_正向引物gaactgaaagctctccacctccagil1b_反向引物aaaggacatggagaacaccacttgki67_正向引物agcacctgcttgtttggaagggki67_反向引物acacaacaggaagctggatacggp21_正向引物ggcagaccagcatgacagatttcp21_反向引物agatgtagagcgggcctttgag3-3.基于fresh-示踪剂分选树突状细胞的免疫活性分析对与源自人类单核细胞的树突状细胞和fresh-示踪剂的免疫活性相关的各种表面蛋白抗体同时染色后,通过门控gsh高(上部0.2-30.2%的细胞群),gsh中(上部30.2-62.5%的细胞群)和gsh低(下部0.3-32.7%的细胞群)进行流式细胞术,并确认了各细胞群中表面蛋白的表达水平。结果,证实了已知在t淋巴细胞活化中起关键作用的cd80的表达水平,不论树突状细胞的成熟与否,在gsh高中最高,然后是gsh中,在gsh低中最低(图6)。由此可以预期,gsh水平高的树突状细胞的免疫活性也会较高。该实验中使用的表面蛋白抗体如下表2所示。[表2]3-4.基于fresh-示踪剂分选的t细胞中treg细胞活性的分析使用cd3和cd28抗体激活小鼠t淋巴细胞,然后根据gsh浓度使用fresh-示踪剂将其分为三个实验组。使用trizol(invitrogen#15596026)对分选的t淋巴细胞进行mrna提取,通过rq-pcr分析了treg细胞特异性表达的转录因子foxp3的mrna水平,证实了gsh低的mrna水平大约比gsh高和gsh中高4倍(图7)。由此可以预期,具有高gsh水平的t细胞群中treg细胞的比例将更低。实施例4:基于fresh-示踪剂,构建细胞治疗剂质量评价参数为了评估治疗细胞的质量,以下开发并分析了基于使用fresh-示踪剂的实时谷胱甘肽测量方法的四个评估参数(图8)。四个参数分别是细胞的谷胱甘肽平均值(或中位数;谷胱甘肽平均值或中位水平;gm)和谷胱甘肽异质性(gh),谷胱甘肽再生能力(grc)和抗氧化应激能力(orc)。如图8所示,gm计算为细胞fr的平均值或中位数。另外,gh计算为细胞fr的变异系数或稳健变异系数。grc是指通过用氧化剂处理活细胞后,通过实时监测fr所获得的值,该值是通过从氧化剂(二酰胺,h2o2等)处理组的frauc中减去用0.1~100mmn-乙基马来酰亚胺(nem)处理组的auc所获得的值除以未处理对照的auc减去nem处理组的auc所得的值,乘以100得到。nem处理组的fr是通过将grc值视为目标细胞fr的空白值来提高其敏感性的值。此外,用0.5或1μm氧化剂,如谷胱甘肽过氧化物酶4(gpx4)抑制剂、rsl3处理huc-mscs,并在37℃下培养2小时,以计算orc。除去含rsl3的培养基后,每100μl加入15mmitofresh-示踪剂,然后在37℃培养1小时。此处,培养所用的培养基是含10mmhepes的hbss(汉克斯平衡盐溶液)。为了在测量前从培养基中除去mitofresh-示踪剂,将培养基换成新鲜的含10mmhepes的hbss,并使用共聚焦成像系统operetta获得荧光图像。通过比较从未用rsl3处理的对照细胞或在用rsl3处理之前的对照细胞定量的gsh水平,计算了gsh表达改变的细胞的分布。根据分布将直方图的点分成两个峰,细胞分为gsh高细胞(右峰)和gsh低细胞(左峰),然后将相应细胞的比例表示为百分比(%)。为了确认上述谷胱甘肽评估参数与干细胞质量之间的关系,根据hbm-msc的传代数(p)和迁移能力分析了菌落形成单位成纤维细胞(cfu-f)。分析结果表明,p4.5的hbm-mscs的cfu-f显著高于p9.5的hbm-mscs(图9a),sdf-1α(血管生成因子)或血小板源生长因子-aa(pdgf-aa)依赖性迁移能力大于p9.5的hbm-mscs(图9b)。在这些条件下,使用fresh-示踪剂,和高尔基复合体特异性golgifresh-示踪剂和线粒体特异性mitofresh-示踪剂,监测整个细胞中的谷胱甘肽,对干细胞的谷胱甘肽评估参数进行了比较分析(图10a)。就gm而言,随着传代次数的增加,hbm-mscs中的fr平均值和mito-fr平均值显著降低,但高尔基fr平均值没有显著变化(图10b)。就gh而言,随着通过传代次数的增加,hbm-mscs中的frrcv值和mito-frrcv值显著增加,但高尔基frrcv值没有显著变化(图10c)。就grc而言,随着传代次数的增加,用二酰胺处理hbm-mscs可降低基于fr的%grc和基于mito-fr的%grc,但基于golgi-fr的%grc则没有变化(图11)。从这些结果可以证明,干细胞的质量与基于fresh-示踪剂或基于mitofresh-示踪剂的gm和grc成正比相关,而与基于fresh-示踪剂或基于mitofresh-示踪剂的gh成反比。特别地,可以证实基于mitofresh-示踪剂的谷胱甘肽评估参数对干细胞质量具有更高的敏感性。随后,观察了根据mitofresh-示踪剂的谷胱甘肽评估参数随骨髓干细胞分化程度的变化。使用mitofresh-示踪剂对从小鼠中分离的谱系+细胞和谱系-(lin-)细胞进行染色,并使用operetta(perkinelmer)进行fr测量,并证实了每个细胞群基于mitofresh-示踪剂的谷胱甘肽评估参数。结果证实,与分化的谱系+细胞相比,在未分化的lin-细胞中,线粒体gm高而gh低(图12)。这意味着可以将骨髓细胞的干性作为谷胱甘肽评估参数加以区分。实施例5:使用fresh-示踪剂检测可增强细胞治疗剂质量的物质为了测试直接控制干细胞中gsh的水平是否导致细胞功能的变化,用丁硫氨酸亚砜亚胺(bso;谷胱甘肽合成抑制剂)和谷胱甘肽乙酯(gsh-ee)的处理对使用fresh-示踪剂分选的hes-mscs进行了处理。当通过用bso(80μm,24h)处理gsh高细胞而降低了细胞中的gsh时,证实了cfu-f升高,另一方面,当通过用gsh-ee(1mm,2h)处理gsh低细胞而提高了gsh时,证实cfu-f降低(图13a)。另外,已经证实,当用bso或gsh-ee处理未通过fresh-tracer分选的hes-mssc时,pdgf-aa诱导的细胞迁移能力分别降低或增加(图13b)。同时,当将huc-mscs在含有抗氧化剂抗坏血酸2-葡萄糖苷(aa2g,250μg/ml)的培养基中传代培养3次时,与原初细胞组相比,证实通过用低浓度的二酰胺处理,基于fresh-示踪剂的grc增加(图14)。因此,证明了用于增强谷胱甘肽评估参数的物质改善了细胞功能。此外,当将huc-mscs在含有aa2g(250μg/ml)的培养基中传代培养三次时,与原初细胞组(nc)相比,证实gsh高细胞中的基于fresh-示踪剂的orc更高(图15a和15b)。发明人通过用增强谷胱甘肽评估参数的物质处理每个干细胞来观察该物质对干细胞的作用。当将huc-mscs在含有l-aa2g的培养基中继代培养时,观察到cfu-f、迁移能力和抗炎作用。通过用125或250μg/ml的aa2g处理huc-mscs三天来进行cfu-f分析(n=3)。如图16a和16b所示,当用aa2g处理时,cfu-f上升。另外,当用125或250μg/ml的aa2g处理huc-msc三天时,分析了pdgf-aa诱导的迁移能力(n=3)。如图17a和17b所示,证实了通过aa2g处理,迁移能力增加。另外,通过用125或250μg/ml的aa2g处理huc-msc三天时,观察到t细胞增殖减少、t细胞分化减少和促进treg细胞分化。如图18a至18c所示,证实了通过处理aa2g,干细胞具有抗炎作用。同时,将huc-mscs与谷胱甘肽前体(例如γ-谷氨酰半胱氨酸)(ggc,0.1、0.25和0.5mm)一起培养。通过用每种浓度的ggc处理huc-mscs2小时进行cfu-f分析(n=3)。结果如图19所示,证实了cfu-f上升。此外,分析了未经ggc处理的huc-mscs的sdf1α和pdgf-aa诱导的迁移能力(n=3),并分析了通过用不断增加的ggc浓度处理huc-msc的sdf1α-和pdgf-aa诱导的迁移能力(n=3)。sti571用作pdgfr激酶抑制剂。如图20a至20c所示,证实了,随着ggc处理浓度的增加,sdf1α-和pdgf-aa诱导的迁移能力增强。另外,对于orc分析,如图21所示,准备活细胞,并在每个孔中接种3×103的细胞。将10%的胎牛血清和1x青霉素-链霉素添加到α-mem培养基中。对用于改善谷胱甘肽评估参数的物质进行处理。随后,对谷胱甘肽过氧化物酶4(gpx4)抑制剂,rsl3进行处理。培养2小时后,除去含rsl3的培养基,每100μl加入15μmmitofresh-示踪剂,然后在37℃培养1小时。培养中使用的培养基是含10mmhepes的hbss。发明人通过使用用于改善谷胱甘肽评估参数的物质(例如铁死亡抑制剂lip-1(liproxstatin-1)、维生素d3、维生素e、类黄酮型黄芩苷、黄芩素、木犀草素、槲皮素、紫铆因或植物提取物(例如杭白菊提取物、中华雪松叶提取物、待宵草叶提取物、问荆叶提取物、甘薯叶提取物或番茄提取物)对huc-mscs进行处理来分析orc(请参见图22a至26f)。例如,如图2所示,对22a,0、2.5、5或10μm铁死亡抑制剂lip-1进行了处理,并对0、0.5或1μmrsl3进行了处理。观察到,即使通过rsl3使细胞的质量降低,但是铁死亡抑制剂lip-1的浓度越高,细胞的质量越高。即,证实了gsh高细胞的比例增加。通过用0.2、1、2和4μm的铁死亡抑制剂fer-1和0.1、0.5、1和2μm的铁死亡抑制剂lip-1处理huc-mscs24小时,进行cfu-f分析(n=3)。如图27和28a至28c所示中,用ggc处理的抗炎作用没有改变。此外,将huc-mscs与铁死亡抑制剂fer-1(0.2、1、2和4μm)和铁死亡抑制剂lip-1(0.1、0.5、1和2μm)培养,后者通过抑制脂质氧化来控制细胞中的谷胱甘肽水平。如图27所示,证实了cfu-f得到了改善。同时,huc-mscs用1μm铁死亡抑制剂fer-1处理24小时,用0.2mmggc处理2小时,用2mmgsh-ee处理2小时。结果,观察到t细胞增殖能力降低和t细胞分化能力降低,并且观察到treg细胞分化的促进。如图27和28a至28c所示,诸如铁死亡抑制剂fer-1和铁死亡抑制剂lip-1之类的物质没有改变huc-msc的抗炎作用。这表明用于改善谷胱甘肽评估参数的物质可以增强治疗性干细胞功能。此外,根据骨关节炎动物模型中干细胞的抗氧化活性,发明者证实了软骨再生作用。通过破坏前十字韧带(acl)来制备骨关节炎诱导的大鼠关节。hes-msc(2x105)在含有aa2g(250μg/ml)的培养基中传代培养3次后,注入关节。结果,如图29a所示,与普通干细胞相比,在抗氧化能力增强的干细胞(高gshmsc)的移植中,可以证实软骨再生功效非常优异。此外,如上所述,制备注射了hes-mscs(2×105)的关节组织,并用h&e和番红-o染色(图29b)。此外,如上所述,制备注射了hes-mscs(2×105)的关节组织,并用ii型胶原染色(图29c)。证实了gag和ii型胶原的表达优异。这表明用于改善谷胱甘肽参数的物质改善了干细胞的治疗功效。对于非参数测试,使用bonferroni事后检验的单向anova或双向anova与分析所有数据。所有分析均使用graphpadprism5.0(graphpad软件,加拿大)进行,并确定当p<0.05或p<0.01时具有统计学意义。实施例6:使用脂质氧化剂测量gsh表达水平用不同浓度的rsl3处理第4、7或15代培养的人脐带间充质干细胞(huc-mscs)并用mitofresh染色后,通过使用流式细胞仪和共聚焦成像的直方图证实了线粒体gsh(mgsh)在细胞中的分布方式。1.根据rsl3浓度和传代次数改变mgsh表达水平1)实验过程<通过流式细胞术测定mscs中gsh的分布>准备了第4、7或15代的huc-mscs,以70000个细胞/孔接种在6孔细胞培养板上,并在37℃下培养24小时。通过向α-mem中加入10%的胎牛血清和1x青霉素-链霉素来制备用于培养的培养基。除去培养基后,以0.1/0.5/1μm的浓度添加谷胱甘肽过氧化物酶4(gpx4)抑制剂rsl3,然后在37℃下培养1.5小时。通过向α-mem中加入10%的胎牛血清和1x青霉素-链霉素来制备用于培养的培养基。除去含rsl3的培养基后,添加5μmmitofresh-示踪剂,然后在37℃下培养1.5小时。通过向α-mem中加入10%的胎牛血清和1x青霉素-链霉素来制备用于培养的培养基。除去含有mitofresh-示踪剂的培养基后,将细胞用2mldpbs洗涤两次。添加250μl的tryple表达,并在37℃下反应2.5分钟,添加等量的2%含fbs的dpbs,以使细胞与板分离。从板分离的细胞转移到facs管中并保存在冰上,并使用流式细胞仪测量荧光水平。<利用荧光成像测量gsh分布>准备了第4、7或15代的huc-mscs,以每孔7000细胞/100μl的密度接种在96孔细胞培养板上,并在37℃下培养24小时。通过向α-mem中加入10%的胎牛血清和1x青霉素-链霉素来制备用于培养的培养基。除去培养基后,添加100μl浓度为0.1/0.5/1μm的谷胱甘肽过氧化物酶4(gpx4)抑制剂rsl3,然后在37℃下培养2小时。通过向α-mem中加入10%的胎牛血清和1x青霉素-链霉素来制备用于培养的培养基。除去含rsl3的培养基后,每100μl加入15μmmitofresh-示踪剂,然后在37℃下培养1小时。培养中使用的培养基是含10mmhepes的hbss。在测量前从培养基中除去mitofresh-示踪剂,将培养基换成新鲜的含10mmhepes的hbss,并使用共聚焦成像系统operetta测量荧光图像。<直方图分析方法>f510/f580比率是指通过测量细胞中f510(当mitofresh-示踪剂与sh结合时的荧光值)和f580(不与sh结合的mitofresh-示踪剂的荧光值)的荧光值来计算表示gsh的平均值,并将f510值除以f580值。使用prism5程序,将每个细胞的f510/f580比率作为x轴,将与相应细胞的f510/f580比率的百分数作为y轴来表示直方图。使用flowjo软件分析流式细胞仪分析所有样品中的alexa430/pe(f510/f580)参数,并根据f510/f580分布的直方图的点分为两个峰,将细胞分为gsh高细胞(右峰),gsh低细胞(左峰),然后将相应细胞的比例表示为百分比(%)。2)实验结果当第4、7或15代的所有培养的huc-mssc均未进行rsl3处理时,尽管显示出几乎相同的mgsh分布模式,但可以证实,观察到在一个组中,mgsh水平的降低取决于rsl3浓度和传代次数(图30、31和32)。随着传代次数的增加,已知细胞会遭受抗氧化应激,并且许多研究表明这些细胞经历了细胞衰老,干细胞的功能遭到了破坏。基于这些研究,可以预测在由rsl3引起的脂质氧化应激的条件下抗氧化能力破坏的细胞中,与抗氧化能力没有破坏的细胞相比,mgsh水平不能正常维持。在图33中,细胞荧光图像所示的绿色细胞是维持mgsh的细胞,黄色细胞是mgsh减少的细胞。可以观察到,传代次数越高,黄色细胞的比例越高,即使在同样的细胞中,也观察到黄色细胞比绿色细胞更大和更宽。另外,当用铁死亡抑制剂fer-1(ferrostatin-1)处理时,rsl3的作用消失了,这表明该作用依赖于脂质氧化应激(图33)。2.人皮肤成纤维细胞中mgsh表达水平的变化如针对mscs的实验中所述,将经过数次传代的人皮肤成纤维细胞用rsl3处理,并用mitofresh-示踪剂染色细胞,将维持mgsh的细胞与没有维持mgsh的细胞之间的比例通过共聚焦成像表示为百分比。该结果与msc的结果一样,表明随着传代培养的进行,通过rsl3处理而mgsh减少的细胞比例增加(图35)。3.mgsh表达水平与cd146表达水平的关系1)实验过程为了确认由rsl3处理引起的脂质氧化应激下,mgsh水平降低的细胞的干细胞功能是否被破坏,通过流式细胞术证实了cd146(根据传统文献,其是已知的,在高质量干细胞中高表达的一种细胞表面蛋白)的表达水平。通过与如上所述通过流式细胞术测量线粒体gsh水平的方法相同的方法对细胞染色,并使用胰蛋白酶将其从平板上分离。对分离的细胞用针对cd146的流式细胞术抗体处理,荧光物质buv395与cd146的结合在4℃下进行30分钟,然后用pbs洗涤。使用流式细胞仪,测量f510和f580荧光值来测量gsh的水平,并测量buv395荧光值来测量cd146的表达。然后,根据f510/f580分布的直方图的点分为两个峰,使用flowjo软件将细胞分为gsh高细胞(右峰)和gsh低细胞(左峰),相应细胞的cd146阳性率以百分比(%)表示。2)实验结果经过rsl3处理后,通过对mitofresh和cd146抗体染色并比较mgsh高和mgsh低细胞中的cd146表面表达水平,与cd146mgsh水平维持组相比,证实cd146阳性比率在p4huc-msc组中降低了约25%,其mgsh水平通过rsl3降低(图34)。这与p15干细胞的cd146阳性比率类似。由于p7与p4在cd146阳性率上没有差异,因此无法通过这种利用表面蛋白的表达率来评价细胞质量的方法来区分两种细胞的质量,但还可以使用如图32所示的本发明的方法,按细胞类型分别评估。以上,已经详细描述了本发明的具体部分。然而,对于本领域普通技术人员将显而易见的是,这样的详细描述仅是示例性实施方案,因此,本发明的范围不限于此是显而易见的。因此,本发明的实际范围将由所附权利要求及其等价形式限定。参考文献1.e.robbins等.,实验医学杂志(jexpmed).1970年6月1日;131(6):1211-22.2.georgakopoulouea等.,衰老(albanyny),2013jan;5(1):37-50.3.thomaskuilman等.,基因与发展(genesdev).2010年11月15日;24(22):2463-79.4.jean-philippecopp′等.,植物病理学年度回顾(annurevpathol).2010;5:99-118.工业实用性根据本发明,通过使用fresh-示踪剂和根据本发明的评估参数来实时监测活干细胞中的细胞内gsh水平以及根据gsh水平的细胞分化,评估细胞治疗剂的质量并改善其质量。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1