免疫层析装置的制作方法
本发明涉及一种用于免疫层析法的测试条,用于容纳该测试条的盒子以及在该盒子中容纳有测试条的免疫层析装置。
背景技术:
在临床检查等中,免疫测定法被用作测定检体中的成分的方法。其中的免疫层析法由于操作简单并且可以在短时间内测定,因而在临床现场等中被广泛使用。免疫层析法的一般的测试条由被称为添加分析物的样品垫的多孔载体、以及被称为偶联垫的多孔载体,其中着色微粒标记抗体被分析物质溶解并可移动地被保持、以及被称为膜的多孔载体,其中抗体被固定在检出线的位置,并且通过偶联垫流出的液体展开;以及吸取展开成膜的液体的被称为吸收垫的吸水性材料而构成。
一般的免疫层析法的测定是通过向样品垫中添加检体来进行。测定物质和用着色微粒所标记的抗体形成复合物并沿着膜移动,当通过检出线时,复合物被固定的抗体捕获,复合物被观察为线状的发色。该方法被广泛应用于传染病的检查,一般在确认到发色的情况时判定为阳性,否则判定为阴性。
在免疫层析法中,尽管存在如下问题,即,如果延长反应时间,则测定灵敏度趋于变高,但相应地反应时间变长,便利性降低。近年来,通过免疫层析法的高灵敏度化的研究,使得能够在更短的时间内进行阳性判定,并且能够检出更微量的测定物质。
作为提高检出线的显色而提高灵敏度的方法,例如可以列举公开的下述方法:添加水溶性高分子化合物的方法(专利文献1)、通过使用含有银的化合物以及用于银离子的还原剂对作为标记物质的金属胶体进行敏化的方法(专利文献2)、以及使用提高了发色量的有机着色微粒的方法(专利文献3)。但是,无论在哪种方法中,由于测定物质和抗体的反应都是在与着色微粒结合的抗体之间进行,而且,反应是在膜的多孔载体中移动的同时进行的,所以测定物质与抗体的反应存在受到动态制约、空间位阻等而导致的抗原抗体反应的效率低下的问题。因此,为了提高反应效率,在需要测定低浓度的测定物质的情况时,采取诸如减慢检体的展开速度或大量展开检体量等的措施。
另外,作为用于改善反应效率以提高灵敏度的方法,例如可以列举公开的下述方法:在检出线上有效地捕获着色微粒标记抗体和测定物质的复合物的方法(专利文献4)、以及有效地进行着色微粒标记抗体和测定物质的结合反应的方法(专利文献5)。已经有人指出免疫层析法在测定原理上由于测定物质与着色微粒标记抗体之间的反应效率差,由于着色微粒引起的空间位阻等导致在检出线上的捕获效率差,这些公开的方法仅改善了两方面中的一个方面,所以课题依然存在。
进一步,还公开了一种免疫层析法的测定操作一般是通过以下的两步操作来完成的方法,即,添加检体或将测试条的端部浸入装有检体的容器中从而完成第一步操作,在添加检体后,在其他位置添加缓冲溶液的第二步操作中进行测定的方法。通过将操作分两步进行,尽管发现可以避免检体中所含有的反应阻碍物质的影响(专利文献6、专利文献8),但在操作变得繁杂的基础上依然存在着色微粒在检出线上的捕获效率问题。进一步,尽管公开了通过免疫层析法实施酶免疫测定的方法(专利文献7),但是除了操作变得繁杂的课题之外,还存在由于酶反应需要足够的时间而使测定时间变长的问题。
另外,进一步还存在以下问题,例如,在用于测定诸如流感和腺病毒等的传染病的市售测定试剂盒中,当测定物质为高浓度的情况时,可以在2-3分钟内判定检出线显色而判定为阳性,但是当测定物质为低浓度的情况时,检出线的显色需要花费时间,因此大致设定了8至15分钟的测定时间。另一方面,即使超过测定时间,检体的展开也在持续,由于微量残存的着色微粒标记抗体与测定物质的反应逐渐进行,因此,如果反应时间延长到必要以上,则有可能出现假阳性。因此,在市售测定试剂盒中,需要提醒注意不要进行超过测定时间的测定。
现有技术
专利文献
专利文献1:日本特许公开2003-344413号公报
专利文献2:日本特许公开2008-286590号公报
专利文献3:国际公开第2011/062157号公报
专利文献4:日本特许公开平9-184840号公报
专利文献5:日本特许公开平10-68730号公报
专利文献6:日本特许公开2001-337091号公报
专利文献7:日本特许公开平10-300750号公报
专利文献8:日本特许公开2009-002822号公报
技术实现要素:
发明要解决的技术问题
本发明所要解决的课题是要解决免疫层析法中的反应效率的问题,其目的在于提供一种能够以简便的操作高灵敏度且在短时间内判定的基于免疫层析法的测试条、用于容纳该测试条的盒子、以及在该盒子中容纳测试条的免疫层析装置。
解决技术问题的技术手段
为了解决上述课题,本发明的发明者进行了深入研究,结果发现,一边在膜上移动一边使测定物质与着色微粒标记抗体反应,接着通过使固定于检出线上的抗体捕获着色微粒标记抗体与测定物质的结合体的常规的免疫层析法难以提高反应效率。因此,首先在不存在着色微粒的状态下实施通过在常规的免疫层析法中实施的两步抗原抗体反应,接着,以使在检出线上捕获的测定物质和抗体的结合体捕获着色微粒的测试条进行测定,结果发现可以提高灵敏度高且在短时间内可以测定。但是,该测试条具有保持最初与测定物质反应的抗体的部位和保持着色微粒的部位,并且在每个部位上,将检体液滴加在前一个部位上,而将检体液或展开液滴加在后一个部位上,需要进行两次滴加操作,因此与常规的方法相比操作变得复杂,所以,本发明的发明者设计了通过一次滴加操作能够向测试条的两个部位导入检体液的一种盒子。这样,创造出一种不牺牲操作性,并且能够在短时间内以高灵敏度进行测定的免疫层析设备,从而完成了本发明。
即,本发明的技术方案如下。
[1]一种测试条,其用于通过免疫层析法检出检体液中的测定物质,其具有:
(1)第一部位,其为检出部位,其中特异性结合所述测定物质的第一抗体固定在多孔载体上;以及
(2)第二部位,其为检体液的添加部位,其中第二抗体可移动地保持在多孔载体上,所述第二抗体为特异性结合所述测定物质的标记抗体,并且具有不同于所述第一抗体的识别部位;以及
(3)第三部位,其为检体液或展开液的添加部位,其中与特异性结合所述第二抗体的标记物的物质结合的着色微粒可移动地保持在多孔载体上;
所述第二部位设置在所述第一部位与所述第三部位之间,检体液或展开液通过毛细管现象能够从所述第二部位向所述第一部位,以及从所述第三部位向所述第一部位移动。
[2]如上述[1]的技术方案中所述的测试条,进一步具有表示反应正常进行的质控线,其在所述第一部位的与所述第二部位相反的一侧附近。
[3]如上述[1]或者[2]的技术方案中所述的测试条,其中,在所述第二部位中,含有所述标记第二抗体的部位位于比所述检体液的添加部位更接近所述第一部位。
[4]如上述[1]-[3]的任一技术方案中所述的测试条,在所述第一部位和/或所述质控线的与所述第二部位相反的一侧进一步具有吸水体或多孔载体,用于吸收或移动检体液或展开液。
[5]如上述[1]-[4]的任一技术方案中所述的测试条,所述第二抗体的标记物为生物素,与结合至所述着色微粒的所述第二抗体的标记物特异性结合的物质选自含有链霉亲和素、中性亲和素以及抗生物素抗体的组。
[6]如上述[5]的技术方案中所述的测试条,其中,所述链霉亲和素是与蛋白质的复合物。
[7]如上述[1]-[6]的任一技术方案中所述的测试条,其中,所述着色微粒选自含有金属胶体、着色乳胶以及着色纤维素颗粒的组。
[8]如上述[1]-[7]的任一技术方案中所述的测试条,用于将所述检体液或所述展开液同时添加到所述第二部位和所述第三部位中,或者在添加到所述第二部位之后添加到所述第三部位中。
[9]一种盒子,其上表面配置有判定窗和凹状的检体添加部,用于容纳通过免疫层析法检出检体液中的测定物质的测试条,其特征在于形成有,
凸部,其在所述凹状的检体添加部中具有第一贯通孔;以及
第二贯通孔,其在所述凹状的检体添加部的与所述判定窗相反的一侧;以及
沟槽部,其具有流路,用于将从所述凸部的第一贯通孔泄漏的添加有检体液的一部分从所述凹状的检体添加部输送至第二贯通孔。
[10]如上述[9]的技术方案中所述的盒子,其中,在所述沟槽部中具备作为流路的用于输送液体的多孔载体,并且所述多孔载体的一端设置成通过所述第二贯通孔与容纳在盒子内的测试条接触。
[11]如上述[9]或者[10]的技术方案中所述的盒子,进一步在所述沟槽部上安装有盖子。
[12]一种免疫层析装置,其中,上述[1]至[8]的任一技术方案中所述的测试条容纳于上述[9]至[11]的任一技术方案中所述的盒子中。
[13]如上述[12]的技术方案中所述的免疫层析装置,所述盒子的判定窗被配置在位于所述测试条的检出部位的第一部位的位置、所述盒子的第一贯通孔被配置在位于所述测试条的第二部位的检体液的添加部位的位置、所述盒子的第二贯通孔被配置在位于所述测试条的第三部位的检体液或展开液的添加部位的位置。
发明效果
根据本发明,能够提供一种测试条、盒子以及免疫层析装置,与常规的免疫层析方法相比,其在免疫层析法的测定中维持高灵敏度的检出性能的状态下,能够缩短测定时间。特别是在临床检查领域中具有很高的实用价值。
附图说明
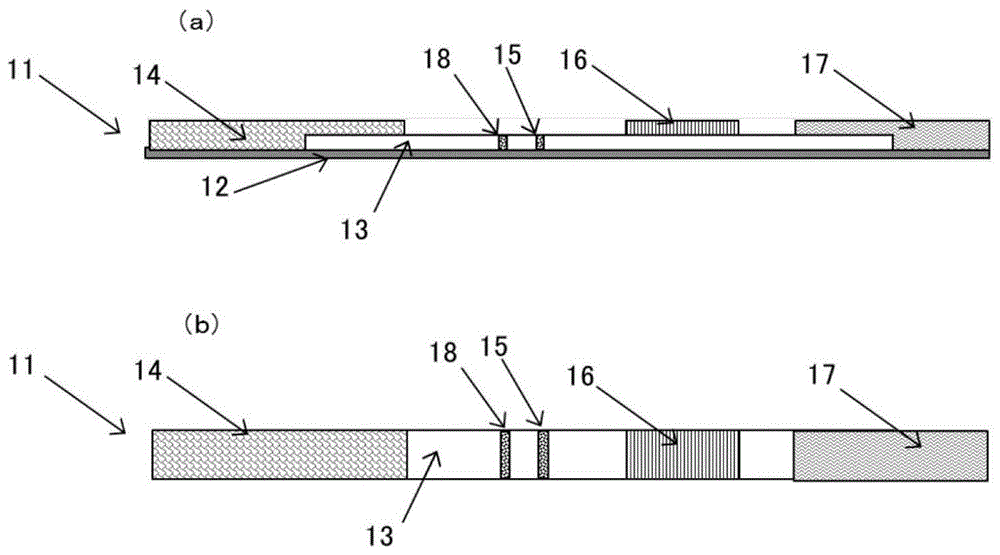
图1(a)是表示本发明的一个实施方式的测试条的侧视图;图1(b)是表示本发明的一个实施方式的测试条的平面图。
图2(a)是表示本发明的一个实施方式的盒子的侧视图,图2(b)是表示本发明的一个实施方式的盒子的平面图;图2(c)是表示沿着图2(a)所示的盒子的a-a线的剖视图。
图3(a)是表示本发明的一个实施方式的盒子,是表示取下沟槽部的盖子的状态的立体图;图3(b)是表示图3(a)的盒子中安装了沟槽部的盖子时的立体图;图3(c)是表示本发明的一个实施方式的盒子,是表示沟槽部的盖子与检体添加部成为一体的取下该盖子的状态时的立体图;图3(d)是表示在图3(c)中所示的盒子中安装了沟槽部的盖子时的立体图。
具体实施方式
以下,参考附图对本发明的实施方式进行说明。附图是用于说明本发明的视图,并且本发明的技术范围不限于附图中所示的实施形态。
图1是表示本发明的测试条的一个示例。测试条(11)包括粘合剂片材(12)、载体(13)、吸水体(14)、第一部位(15)、第二部位(16)、第三部位(17)以及质控线(18)。
第一部位(15)是用于目视或机械观察测定结果的检出部位,是在由多孔载体构成的载体(13)上固定能够特异性结合测定物质的第一抗体的部位。载体(13)优选使用硝酸纤维素制的膜过滤器,但是,只要是能够展开检体液或展开液,并且能够固定抗体的物质,也可以使用其他的纤维素制的膜过滤器、尼龙制的膜过滤器等。
第二部位(16)是由多孔载体构成的垫,该多孔载体构成的垫含有能够特异性结合检体中的测定物质的标记的第二抗体(以下称为标记第二抗体),还是检体液的添加部位。该检体液的添加部位优选位于比含有标记第二抗体的部位更远离作为检出部位的第一部位(15)。即,优选使标记第二抗体包含于第二部位(16)的更接近第一部位(15)的部位,并且将第二部位(16)的远离第一部位(15)的一侧用作检体液的添加部位。另外,第二部位(16)为检体液的添加部位也包括如下的实施方式,即,也可以将第二部位(16)的与第一部位(15)相反的一侧的附近作为检体液的添加部位。由此,通过添加检体液,标记第二抗体变得易于向作为检出部位的第一部位(15)的方向上移动,并且,能够防止向反方向的移动,以及能够防止标记第二抗体和后述的结合性着色微粒先形成结合物。因此,如果含有标记第二抗体的部位比检体液的添加部位更靠近第一部位(15),则可以获得良好的结果。
第二部位(16)通过双面胶带等固定在载体(13)上,此时,为了能够使滴加在第二部位(16)上的检体液向载体(13)移动,使第二部位(16)的一部分与载体(13)直接接触。第二部位(16)的多孔载体优选具有容易吸收从上方所添加的检体液,保水性低,并且难以吸取在载体(13)中移动、展开的液体的性质,可以使用玻璃纤维、聚酯制的膜、无纺布等。
上述检体液是含有测定物质的液体,使用生物体试样、生物体试样的稀释液或提取液等。作为生物体试样,例如可以列举:全血、血清、血浆、尿液、唾液、脑髓液、羊水、鼻分泌物、痰、组织渗出液、鼻腔或咽部擦拭物、细胞以及粪便。稀释液或提取液是含有缓冲剂等的溶液,并且可以适当含有盐类、表面活性剂、蛋白质、糖类、聚合物类、防腐剂等。测定物质可以是能够通过抗原抗体反应进行免疫测定的任何物质,例如可以列举:蛋白质、病毒、细菌以及激素等。
作为第二部位(16)的标记第二抗体的标记物,只要能够特异性结合标记物,并且可以制备可担载于后述的着色微粒上的物质,则可以是任何标记物。作为该标记物,例如可以使用半抗原、生物素、肽、蛋白质等。作为以使用半抗原为标记物的例子时,可以使用6-(2,4-二硝基苯胺基)己酸-n-琥珀酰亚胺基酯标记第二抗体,并且,作为特异性结合该第二抗体的标记物的物质,可以使用将抗二硝基苯基抗体与着色微粒相结合的组合;当使用生物素作为标记物时,使用生物素的n-羟基琥珀酰亚胺酯衍生物(例如,商品名:ez-linktmnhs-lc-lc-biotin)标记第二抗体,并且,作为特异性结合该第二抗体的标记物的物质,可以使用将链霉亲和素与着色微粒相结合的组合等。其中,优选使用生物素作为标记物。
第二部位的含有标记第二抗体的多孔载体,其上表面或下表面的全体或者一部分也可以由不含标记第二抗体的多孔载体构成的垫覆盖。根据需要,该垫可以包含亲水性聚合物、蛋白质、缓冲成分、表面活性剂等。该垫优选具有易于吸收检体液、保水性低,并且难以吸取在载体(13)中移动、展开的液体的特性,可以使用玻璃纤维、聚酯薄膜、无纺布等。另外,第二部位(16)可以不形成独立的结构体,而可以将载体(13)的一部分直接作为第二部位(16)。
第三部位(17)是由含有着色微粒(以下称为结合性着色微粒)的多孔载体构成的垫,还是添加检体液或展开液的部位,其中,该着色微粒(以下称为结合性着色微粒)与特异性结合标记第二抗体的标记物的结合物质结合。该检体液或展开液的添加部位优选位于比含有结合性着色微粒的部位更远离作为检出部位的第一部位(15)的一侧。在第三部位(17)中,可以使结合性着色微粒包含于更接近第一部位(15)的部位,并且可以将与第一部位(15)相反的一侧的附近用作检体液或展开液添加部位。第三部位(17)为添加检体液或展开液的部位事实上也包含如上所述的实施方式。由此,通过添加检体液或展开液,结合性着色微粒变得易于向作为检出部位的第一部位(15)的方向移动。第三部位(17)以与载体(13)接触的方式通过粘合剂片材(12)固定,但是也可以将载体(13)的端部延长(到图1中的第三部位的右侧为止),直接固定在载体(13)上。另外,第三部位(17)可以不形成独立的结构体,而可以将载体(13)的一部分直接作为第三部位(17)。
第三部位(17)的多孔载体可以使用无织布、玻璃纤维、聚酯制的膜等。在第三部位(17)中,可以直接添加剩余的检体液,或者可以使用展开液代替检体液。展开液是含有缓冲剂等的溶液,并且可以适当含有盐类、表面活性剂、蛋白质、糖类、水溶性高分子、防腐剂等。含有结合性着色微粒的多孔载体的上表面的全体或者一部分也可以由不含结合性着色微粒的另一种多孔载体构成的垫覆盖。根据需要,该垫可以含有亲水性聚合物、蛋白质、缓冲成分、表面活性剂等。该垫优选具有易于吸收检体液或展开液的性质,可以使用玻璃纤维、聚酯制的膜、无纺布等。
第三部位(17)的结合性着色微粒中使用的着色微粒可以是免疫层析法中通常所使用的任何微粒,例如可以使用金属胶体、着色乳胶以及着色纤维素微粒等。与着色微粒结合的物质可以根据标记第二抗体的标记物适当选择,如果标记物是合成肽,则可以使用针对该肽的抗体,如果标记物是生物素,则可以列举链霉亲和素、中性亲和素、抗生物素抗体等,其中,优选在标记第二抗体的标记物中使用生物素,在与着色微粒结合的物质中使用链霉亲和素。当如上所述使用链霉亲和素时,为了提高与生物素的反应性,优选与蛋白质形成复合物,作为该复合物中使用的蛋白质可以列举bsa和igg等。复合物的制作方法例如可以通过利用s-乙酰基巯基琥珀酸酐向蛋白质导入硫醇基,并利用n-[(4-马来酰亚胺基甲基)环己基羰氧基]磺基琥珀酰亚胺向链霉亲和素导入马来酰亚胺基,并通过使两者反应从而制备。
此处,与着色微粒结合的物质的量只要是能够与在第一部位所捕获的标记第二抗体的标记物反应的量即可,但是为了进一步提高反应性,优选结合能够与着色微粒结合的最大量。最大量由着色微粒的表面积、被结合的物质的大小等决定,但是本领域技术人员可以通过实验等容易地进行设定。
添加到第二部位的检体液的量,以及添加到第三部位的检体液或展开液的量尽管可以根据各部位使用的垫的大小、含水量等来设定,然而,如果所添加的液体的量太少,则液体不能从各部位移动到载体(13),因此,添加的液体能够从各部位移动到载体(13)的液体量被设定为最少液体量,添加的液体能够均匀地充满构成各部位的垫的液体量被设定为最大液体量。可以根据所需的测定灵敏度等从该液体量的范围适当设定最佳量。至少,添加到第三部位的检体液或展开液需要从第二部位(16)移动到第一部位(15),由于液体移动和展开的距离较长,因此所需的液体量较多。
在第一部位(15)的与第二部位(16)相反的一侧的附近设置有质控线(18)。质控线(18)是表示反应已正常进行的部位,其通过捕获从第3部位(17)移动、展开,并且未被第1部位(15)捕获而通过的结合性着色微粒,由此表示反应已正常进行。作为形成质控线的物质,只要是添加到第三部位的检体液或展开液正常通过第一部位时,结合性着色微粒能够显色为线状,则可以使用任何物质。例如,作为固定在质控线的位置的物质,可以使用标记第二抗体或其标记物,如果与结合性着色微粒结合的物质是链霉亲和素或中性亲和素,则也可以使用生物素。另外,如果标记第二抗体是来自小鼠衍生的igg抗体,则也可以固定抗小鼠igg抗体。
另外,在第一部位(15)以及质控线(18)的与第二部位(16)相反的一侧,设置有载体(13)的延伸部分和/或吸水体(14)。由此,使得第二部位(16)的检体液易于朝向第一部位(15)移动并展开,进一步越过第一部位(15)移动并展开,与此相伴,第三部位(17)的检体液或展开液向第一部位(15)的移动和展开变得顺畅。作为吸水体(14),优选具有吸水性、保水性的多孔载体,可以使用纤维素膜、滤纸、无纺布等。
进一步对本发明的测试条进行详细说明。测定是通过将检体液添加到第二部位(16)并同时或在其之后立即将检体液或展开液添加到第三部位(17)而开始的。在此,当手动操作的情况时,第二部位(16)和第三部位(17)中的检体液或展开液的添加时机,优选总是尽可能在相同的时机进行。添加到第二部位(16)的检体液在溶解保持在第二部位的标记第二抗体,并与测定物质反应的同时向载体(13)移动,在载体(13)中向第一部位(15)和第三部位(17)展开。在此,如上所述,标记第二抗体与测定物质的反应产物优选不向第三部位(17)移动。然后,添加到第三部位(17)的检体液或展开液在分散结合性着色微粒时,在载体(13)上展开,并与从第二部位(16)展开而来的检体液发生冲突。通过该冲突,第二部位(16)的所有检体液都向第一部位(15)方向移动、展开,测定物质和标记第二抗体的结合物被第一部位的抗体捕获。在第二部位(16)的检体液持续移动到载体(13)的状态下,从第三部位(17)移动而来的液体的展开变得非常缓慢或成为几乎停止的状态。然后,在第二部位(16)的检体液几乎全部向第一部位方向移动的阶段,从第三部位(17)移动而来的液体开始以通常速度向第一部位方向移动、展开,并且结合性着色微粒被标记第二抗体的标记物捕获,该标记第二抗体与第一部位的第一抗体捕获到的测定物质结合,并确认显色。进一步,过量的检体液或展开液向载体(13)的延伸部分和/或吸水体(14)移动,并用作第一部位的清洗溶液,具有使颜色变得鲜明并终止反应的作用。
另外,在本发明的优选实施方式的测试条中,由于第二部位(16)以及其附近的测定物质与标记第二抗体的反应、以及第一部位(15)中的测定物质与标记第二抗体的结合物与所固定的抗体的反应,是在不存在着色微粒的状态下的反应,因此不会像一般的免疫层析法那样因空间位阻导致反应性降低,其能够高效地进行反应。此外,在本发明的一部分实施方式的测试条中,有时,标记第二抗体或者测定物质与标记第二抗体的结合物先与结合性着色微粒结合,但形成这样的结合物的量少,标记第二抗体或者测定物质与标记第二抗体的结合物的大部分先向第一部位(15)移动,因此不存在问题。另外,在第一部位通过测定物质所捕获的标记第二抗体的标记物与结合性着色微粒的反应是结合性物质结合到着色微粒的状态下的反应,因此,本发明的结合性着色微粒能够非常有效地进行反应。在一般的免疫层析法中,如果测定物质的浓度高,则大量的测定物质结合到着色微粒,成为对于第一部位的抗体具有高反应性的着色微粒,如果测定物质的浓度低,则结合到着色微粒的测定物质变少,因此成为对于第一部位的抗体的反应性低的着色微粒。与此相对,在本发明中,由于在着色微粒上预先担载有与能够结合到着色微粒的最大量的标记第二抗体的标记物反应的结合性物质,因此即使是结合性物质结合到着色微粒的状态下的反应,也与测定物质的浓度无关,对于在第一部位上所捕获的标记第二抗体的标记物具有高反应性。因此,能够与测定物质的浓度无关地在短时间内高效地反应,在着色微粒通过第一部位而背景大致变为白色的时刻,即,与测定物质的浓度无关,在3~5分钟的测定时间内能够进行与一般的免疫层析法同等以上的高灵敏度的测定。进一步,由于此时从第二部位展开的标记第二抗体也全部通过第一部位,不会进一步进行抗原抗体反应,因此具有即使超过测定时间也不会出现假阳性的优点。
图2是表示本发明的盒子的一个示例。本实施方式的盒子是用于容纳为了测定检体中所含的测定物质而使用的基于免疫层析法的测试条(29)的盒子、在此特别是用于容纳本发明的测试条(29)的盒子,其由覆盖测试条(29)的检查面的罩部(22)和载置测试条(29)的基部(21)构成,材质没有特别限定,可以由塑料等树脂形成。为了容纳测试条(29),罩部(22)构成为可以拆卸。
本发明的盒子设置了用于观察内部所容纳的测试条(29)的测定结果的开口部的判定窗(23),该测定结果可以通过目视或机械进行观察。进一步,在本盒子中,设置有用于将检体液导入到容纳于内部的测试条(29)的检体添加部(24)以及第二贯通孔(28),检体添加部和第二贯通孔通过沟槽部(26)连接。检体添加部24形成为凹状,进一步在其底面设置有凸部27。凹状的形状没有特别限定,但优选为圆柱或研钵状、或其组合的形状,优选底面为能够将滴加的检体全部接住的形状、大小,并且向沟槽部(26)赋予倾斜等,从而形成液体容易向沟槽部(26)移动的结构。
设置在检体添加部(24)的底面上的凸部(27)是从上部观察检体添加部(24)时比凹状的底面的面积小的突起物,凸部(27)的形状没有特别限定,但优选形成为圆柱状。进一步在凸部(27)上设置有第一贯通孔(25),用于将滴加的检体液导入容纳于内部的测试条(29),该贯通孔的直径或宽度形成为比一滴检体液的直径小。凸部(27)的高度和第一贯通孔(25)的直径或宽度根据希望通过第一贯通孔(25)的液体量来设定,考虑到水滴的尺寸、液滴数、容纳的测试条(29)的宽度等决定,但当测试条(29)的宽度为3~5mm的情况时,优选高度为0.1~5mm,直径或宽度为0.5~3mm。
从检体添加部(24)观察,第二贯通孔(28)设置在判定窗的相反侧,通过检体添加部(24)和沟槽部(26)连接以使得检体液能够移动。第二贯通孔(28)的大小没有特别限定,可以考虑容纳于内部的测试条29的宽度等来决定。例如当测试条(29)的宽度为4mm左右的普通宽度的情况时,优选第二贯通孔(28)的宽度与测试条(29)对齐,优选测试条(29)的长度方向为4~8mm左右的长方形贯通孔。
由于沟槽部(26)用于使未进入第一贯通孔(25)的检体移动到第二贯通孔(28)中,所以能够通过毛细管现象、梯度等使其移动,但是,优选在沟槽部(26)中设置无纺布、滤纸、玻璃纤维等的吸水性多孔载体,在这种情况时,优选以载体的一端与检体添加部(24)接触、另一端从第二贯通孔(28)与容纳于内部的测试条(29)接触的方式设置,为了固定吸水性多孔载体,优选在沟槽部(26)中安装盖子。在盖子的内侧,优选构成用于固定吸水性多孔载体的突起物、用于通过第二贯通孔(28)使吸水性多孔载体与容纳于内部的测试条(29)接触的突起物。另外,盖子也可以是构成检体添加部(24)的凹状的一部分。
图3是表示安装了盖子的示例。图3(a)及图3(b)是在沟槽部(26)上安装吸水性多孔载体(32)、盖子(31)仅覆盖沟槽部(26)的示例,取下盖子(31)的状态为图3(a),安装了盖子(31)的状态为图3(b)。另一方面,图3(c)以及图3(d)是安装有吸水性多孔载体(32)、盖子(31)覆盖沟槽部(26)、并且作为检体添加部(24)的凹状的一部分而成为一体的示例,取下盖子(31)的状态为图3(c),安装了盖子(31)的状态为图3(d)。
以本发明的盒子和本发明的测试条的组合使用的情况为例进行更详细的说明。本发明的盒子与本发明的测试条的各部位的位置关系为,盒子的判定窗以能够确认测试条的第一部位或第一部位和质控线的方式而设置,盒子的第一贯通孔设置在与测试条的第二部位的检体液的添加部位相对应的位置上,进一步,盒子的第二贯通孔设置在与测试条的检体液或展开液的添加部位相对应的位置。另外,在罩部(22)的内部表面上,优选设置有用于使测试条的载体和吸水体、载体和第二部位、载体和第三部位相互紧贴的突起物,还优选在第一贯通孔的出口设有突起物。
测定是通过将检体液滴加到检体添加部而开始,滴加到检体添加部的检体液,其一部分从凸部的第一贯通孔向位于测试条的第二部位的检体液的添加部位移动,无法通过第一贯通孔的剩余检体液从沟槽部的第二贯通孔向位于测试条的第三部位的检体液或展开液的添加部位移动,从而能够进行预定的反应。用于测定的检体液的液体量根据第二部位以及第三部位所使用的垫的大小、含水量等来设定,例如宽度为3~5mm、长度为70~80mm左右的测试条,1滴的液体量为15~30μl左右的情况时,优选为2~5滴。
通过在本发明的盒子中容纳本发明的测试条,构成本发明的免疫层析装置,但通过这样进行测定,需要在两个部位滴加检体液的本发明的测试条,也可以与常规的免疫层析法同样地通过在一个部位滴加检体的操作来实施。进一步,当向两个部位滴加检体液或展开液的情况时,如果不使向该两个部位滴加的时间和间隔恒定,则测定的再现性有可能降低,但是根据本发明的盒子或免疫层析装置,向两个部位供给检体液的时间和间隔由沟槽部的长度、设置在沟槽部的吸水性多孔载体的长度、吸水速度等决定,由于操作手法导致的偏差消失,因此能够带来提高测定的再现性的效果。
本发明的盒子不限于本发明的测试条,对于在两个部位滴加检体液或展开液的类型的测试条,都能够适当地使用。作为这样的测试条,可以列举日本特许公开2001-337091号公报记载的测试条、日本特许公开平10-300750号公报记载的测试条、以及日本特许公开2009-002822号公报记载的测试条等。在这些情况时,也可以得到与本发明的盒子和本发明的测试条的组合相同的效果。
作为测定中使用的检体,不仅可以使用通过试剂提取生物体试样而获得的提取检测液,而且血清、血浆、尿可以直接作为测定试样使用,其中,生物体试样从全血、血清、血浆、尿、鼻腔或者咽等采集。全血优选使用等渗溶液等的试剂稀释后使用,为了从稀释后的液体中除去血细胞成分,优选使用过滤器过滤,或者在测试条的第二部位和第三部位设置血细胞分离膜。测定物质可以是能够通过抗原抗体反应进行免疫测定的任意物质,可以列举蛋白质、病毒、细菌、激素等。
实施例
以下,基于实施例对本发明进行说明,但本发明并不限定于此。
实施例
(1)用于测定流感病毒的测试条的制备
1.生物素标记抗甲型流感抗体的制备
向2.5mg/ml的抗甲型流感病毒小鼠单克隆抗体(由meridian制造,产品编号c1733m)1ml中,添加6mg/ml的磺酸基-nhs-lc-lc-生物素(由thermofisherscientific制造)15μl,在室温下使反应进行30min。
2.bsa-链霉亲和素复合物的制备
在5mg/ml的牛血清白蛋白(bsa)1ml中,添加60mg/ml的s-乙酰巯基琥珀酸酐液50μl,在室温下使反应进行30min。然后,加入36mg/ml的盐酸羟胺1ml,在室温下使反应进行10min,用0.1m的磷酸缓冲液(ph6.0)进行置换,作为sh化bsa。
向5mg/ml的链霉亲和素1ml中,添加n-[(4-马来酰亚胺甲基)环己基羰氧基]磺基琥珀酰亚胺(由thermofisherscientific制造),在室温下使反应进行1小时,用0.1m磷酸缓冲液(ph6.0)进行置换,作为马来酰亚胺化链霉亲和素。
将sh化bsa和马来酰亚胺化链霉亲和素等摩尔混合,在室温下使反应进行1小时,从而制备bsa-链霉亲和素复合物。
3.胶体金标记链霉亲和素的制备
在胶体金悬浊液(由田中贵金属工业制造)3ml中,添加上述2中制备的2.5mg/ml的bsa-链霉亲和素复合体10μl,在室温下使反应进行30分钟。接着,添加5mg/ml的bsa3ml,在室温下使反应进行30分钟。通过离心分离法清洗胶体金,将其悬浮在0.3ml的10mmtris缓冲液(ph8.0)中。
4.抗流感抗体固定载体的制备
在硝酸纤维素膜(45mm×150mm、millipore制)上,将抗甲型流感病毒小鼠单克隆抗体(由meridian制造,产品编号c1736m)(1mg/ml)在1μl/cm的条件下,以线状涂布在硝酸纤维素膜的下端22mm位置处。涂布后在40℃下干燥30分钟,用0.5%的酪蛋白溶液浸渍,然后在40℃下干燥1小时从而制备抗流感抗体固定载体。
5.含有生物素标记抗体的垫的制备
将上述1中制备的2.5mg/ml的生物素标记抗甲型流感抗体1μl添加到300μl的含有2%的海藻糖的10mmtris缓冲液(ph8.0)中。将该溶液浸渍到玻璃纤维片(11mm×150mm,由millipore制备)中,进行冷冻干燥。
6.含有胶体金标记链霉亲和素的垫的制备
将上述3中制备的胶体金标记链霉亲和素悬浊液0.23ml浸渍到玻璃纤维片(5mm×150mm,由millipore制备)中,进行冷冻干燥。
7.免疫层析测试条的制备
从粘合剂片材(80mm×150mm)的下端11mm的位置贴合了抗流感抗体固定载体,并且从粘合剂片材的上端贴合了纤维素纤维垫(35mm×150mm)。接着,从粘合剂片材的下端7mm的位置处以与抗流感抗体固定载体部分重叠的方式粘贴含有胶体金标记链霉亲和素的垫,接着,从粘合剂片材的下端贴合了无纺布(8mm×150mm)。进一步,从粘合剂片材下端16mm的位置向上端侧粘贴10mm宽度的双面胶带,从粘合剂片材17mm的位置向上端侧贴合了含有生物素标记抗体的垫,切断成4mm宽度,从而制备免疫层析测试条。
8.免疫层析装置的制备
将上述7中制备的测试条容纳时,在距离下端的位置的23mm的位置处,在直径为3mm×高为2mm的凸部设置直径为1.6mm的第一贯通孔,进一步以所述下端的位置为基准,设置4mm×6mm的第二贯通孔,制备了在沟槽部设置有20mm×4mm的无纺布的盒子。在该盒子中容纳上述7中制备的测试条,作为用于测定甲型流感病毒的免疫层析装置。
(2)试样的调制和测定
使用含有0.5%triton-x100(注册商标)的50mmtris缓冲液(ph8.5)制备了甲型流感抗原溶液(由fizgerald制造)的稀释检体。稀释检体的稀释倍数如表1所示。将制备的稀释液放入滴眼器中,向本发明的盒子的检体添加部的凸部滴加3滴,开始反应。对从反应开始到判定为阳性或阴性为止的时间经过以及检出灵敏度进行了调查。
以下的比较例均以一般的免疫层析法为测定原理,使结合有着色微粒和抗流感病毒抗体的第一抗体与检体液中的流感病毒的结合物结合到固定抗流感病毒第二抗体来进行检出。
比较例1
作为比较对象1,使用市售的流感病毒抗原检出试剂immunoace-flu(注册商标)。使用试剂盒附带的提取液,以与实施例相同的方式制备了稀释检体。滴加3滴稀释检体,开始反应,对从反应开始到判定为阳性或阴性为止的时间经过以及检出灵敏度进行了调查。
比较例2
作为比较对象2,使用市售的流感病毒抗原检出试剂finvizoninfluenza(注册商标),以与比较例1相同的方式进行了试验。
比较例3
作为比较对象3,使用市售的流感病毒抗原检出试剂alsonic(注册商标),以与比较例1相同的方式进行了试验。
评价结果
实施例以及各比较例的结果示于表1。
反应开始后,随着时间的经过,通过目视对检出线的出现的有无进行确认,在确认到少量的线的情况时判定为“+”,在没有确认到线的情况时判定为“-”。表中,判定用括号()表示的是在各比较例中超过市售试剂盒指定的时间时的判定。
当稀释4000倍时,在所有的例子中,在3~4分钟内判定为“+”,即使将反应时间延长至15分钟,结果也没有变化。
当稀释8000倍时,实施例在3分钟内判定为“+”,与此相对,比较例1到判定为“+”为止时需要5分钟,比较例3中需要4分钟,进一步比较例2判定为“-”,表明本发明的灵敏度高。另外,在比较例2中,到判定为“+”为止时需要8分钟,该时间超过试剂盒指定的判定时间。
当稀释16000倍时,实施例在3分钟内判定为“-”,即使将反应时间延长至15分钟,判定也没有变化。在比较例中,在试剂盒指定的判定时间内全部判定为“-”,但当超过了试剂盒指定的判定时间的情况时,确认到判定为“+”的现象。
基于该结果,通过对本发明的实施例与常规的免疫层析法为测定原理的各比较例进行比较,结果发现本发明在以下方面优异。
关于测定灵敏度,在测定稀释8000倍的试样时,本发明与比较例相比,线的出现速度快,由此可以确认本发明的测定灵敏度比各比较例高。另外,如果试样的稀释倍数变高,则比较例中线的出现所需的时间变长,与此相对,本发明与稀释倍数无关,线的出现时间相同。该结果表明本发明与检体中的测定物质的浓度无关,具有能够在短时间内高灵敏度检出的优越性,可以说该装置是一种在临床检查中实用性高的装置。
接着,为了确认判定结果的稳定性,对指定的判定时间的结果和经过15分钟时的结果进行比较,本发明的判定结果没有发生变化,但在各比较例中,确认到判定结果发生了变化。在比较例的方法中,由于即使经过判定时间,反应仍在持续进行,因此如果延长反应时间,则获得的灵敏度变高,但相应地,判定时间变长,便利性降低,如果延长反应时间,则根据检体有可能会出现因非特异反应而导致的线,因此,从综合性能出发,设定了5~10分钟左右的反应时间。因此,在各比较例中,存在如果测定者不严格遵守反应时间,则会出现判定不正确的问题,与此相对,由于本发明不发生这样的现象,所以不需要严格的时间管理,在实际的临床现场等中使用时,很明显是一种便利性优异的方法。
[表1]
附图标记说明
11测试条
29测试条
12粘合剂片材
13载体
14吸水体
15第一部位
16第二部位
17第三部位
18质控线
21基部
22罩部
23判定窗
24检体添加部
25第一贯通孔
26沟槽部
27凸部
28第二贯通孔
31盖子
32吸水性多孔载体
- 还没有人留言评论。精彩留言会获得点赞!