一种可实时检测体液的柔性条带状pH传感器及其制备方法与流程
本发明涉及柔性传感器领域,且特别涉及一种可实时检测体液的柔性条带状ph传感器及其制备方法。
背景技术:
体液的检测在医疗诊断中发挥巨大作用,其中,人体液的酸碱度(ph值)可反映多种生化信息。例如:伤口渗出物反应伤口溃烂程度,泪液反应泪道感染,唾液反应口腔卫生,汗液反应人体身体状况,尿液反应肾脏疾病。而且使用汗液、唾液和尿液等非侵入式的体液诊断可使患者更为舒适。因此,需要对体液进行准确和实时分析的ph传感器。然而,目前市售的ph传感器均采用玻璃电极,价格较贵且不具备柔性。因此,如果能制备出一种成本低、性能好、舒适感好且柔韧性高的ph传感器对体液的检测具有重大意义。
技术实现要素:
本发明的目的在于提供一种可实时检测体液的柔性条带状ph传感器,此ph传感器的基底由柔性绝缘材料制成,电极线上涂覆有对氢离子敏感的负载金属纳米粒子的氮掺杂碳材料,灵敏度高、柔韧性好,且相比于玻璃电极,成本低。
本发明的另一目的在于提供一种可实时检测体液的柔性条带状ph传感器的制备方法,该制备方法材料简单易得,条件易控。
本发明解决其技术问题是采用以下技术方案来实现的。
本发明提供一种可实时检测体液的柔性条带状ph传感器,柔性基底上设有检测电极组件,所述检测电极组件包括并列设置的工作电极和参比电极,二者平行且互不接触;所述工作电极与所述参比电极的两端分别为工作区和电极连接区,且二者的工作区位于同侧,所述工作电极和所述参比电极的中部均覆盖有绝缘层,以使二者各自的工作区和电极连接区彼此绝缘;所述工作电极工作区设有对氢离子敏感的负载金属纳米粒子的氮掺杂碳材料。
进一步地,所述柔性基底为条带状,长度为1.5~5cm,宽度为0.5~1.5cm;所述工作电极和所述参比电极均为条状电极,长度均为1.2~4.5cm,宽度均为0.25~1mm;所述工作电极的工作区面积为1.0~5.0mm2;所述参比电极的工作区面积为0.5~5.0mm2。
本发明还提供一种上述的可实时检测体液的柔性条带状ph传感器的制备方法,其特征在于,包括以下步骤:
步骤一,在柔性基底的表面制备出所述参比电极和所述工作电极;
步骤二,在所述参比电极和所述工作电极的中部覆盖所述绝缘层,以使所述参比电极和所述工作电极各自的工作区和电极连接区彼此绝缘。
进一步地,所述柔性基底选自聚氯乙烯、聚碳酸酯、聚对苯二甲酸乙二醇酯、聚酯、纸、纸板、陶瓷和再生丝素蛋白中的一种或多种的复合物。
进一步地,在柔性基底的表面制备出所述参比电极和所述工作电极的步骤,具体包括:
s1,使用丝网印刷或喷墨印刷技术在所述柔性基底表面印刷出两条电极线;其中,所述电极线的材料选自石墨、石墨烯、碳纳米管、铂、钯、银、金中的一种或多种;
s2,在一条所述电极线的一端涂覆所述氮掺杂碳材料形成所述工作电极;在另一条所述电极线的一端涂覆银/氯化银材料形成所述参比电极;所述工作电极和所述参比电极的涂覆区域分别作为二者的工作区;其中,所述银/氯化银材料由银纳米粒子或银纳米线经fecl3溶液氯化制成。
进一步地,所述氮掺杂碳材料中的碳材料为石墨、多孔碳、碳纳米管或石墨烯。
进一步地,氮掺杂多孔碳由含有巯基的生物蛋白经碳化得到;其中,所述生物蛋白选自角蛋白、牛血清白蛋白、改性角蛋白、改性牛血清白蛋白、酪氨酸蛋白激酶、修饰蛋白激酶、β-乳球蛋白、修饰β-乳球蛋白、大豆蛋白11s、修饰大豆蛋白11s、人血清白蛋白、修饰人血清白蛋白、α球蛋白、修饰α球蛋白、肌动蛋白、修饰肌动蛋白、冠蛋白、修饰冠蛋白、纤维连接蛋白、修饰纤连蛋白、肌球蛋白、修饰肌球蛋白、血影蛋白、修饰血影蛋白、原肌球蛋白、改良原肌球蛋白、微管蛋白、修饰微管蛋白和修饰β球蛋白中的一种或多种。
进一步地,负载金属纳米粒子的氮掺杂多孔碳材料按照以下步骤制备:
s21,在含有生物蛋白和金属前驱体的混合液中加入碱液反应得到反应液,所述反应液中含有金属纳米粒子、生物蛋白质、碱性反应介质;将所述反应液静置反应一段时间后,干燥获得金属纳米粒子@生物蛋白;
s22,将所述金属纳米粒子@生物蛋白在100℃~1000℃条件下碳化,得到蛋白质基氮掺杂碳/金属纳米粒子复合材料。
进一步地,在步骤s22中,所述碳化步骤包括:
s221,在惰性气氛下,将所述金属纳米粒子@生物蛋白以1~5℃/min的升温速率升温至100~200℃维持1~4h;
s222,以1~10℃/min的升温速率升温至250~450℃保持2~5h;
s223,以3~7℃/min的升温速率升温至400~1000℃保持1~4h;以及
s224,以7~20℃/min的降温速率降温至20~30℃后取出,碳化产物经洗涤干燥后得到所述蛋白质基氮掺杂碳/金属纳米粒子复合材料。
进一步地,所述绝缘层由柔性疏水材料制成。
本发明实施例提供的可实时检测体液的柔性条带状ph传感器及其制备方法的有益效果是:
(1)本发明提供的可实时检测体液的柔性条带状ph传感器,该ph传感器是基于两电极的电化学系统,先通过测定工作电极和参比电极之间的开路电势,而后工作电极工作区的敏感材料的功能基团与氢离子发生反应,使得氢离子都向敏感材料移动,导致工作电极的电势发生变化,从而经过相应的换算得出体液的ph值。该ph传感器响应快、体积小,可用于分析人体体液的ph水平,即健康状况的检测。而且该ph传感器为柔性的,可通过柔性导管等装置,将该传感器放至导管中,通过喉管引入体内进行检测胃液等ph值的实时检测。
(2)本发明提供的可实时检测体液的柔性条带状ph传感器的制备方法,材料简单易得,条件易控,且使用的对氢离子敏感的材料为负载金属纳米粒子的氮掺杂碳材料。其中,属负载金属纳米粒子的氮掺杂多孔碳材料的效果最佳。该材料选择具有巯基(-sh)的生物蛋白(bp)材料作为还原剂和修饰剂,将金属离子还原成原子形式,随后形成金属纳米粒子(mnps)。而残余的蛋白质中的巯基则会和金属纳米粒子形成配位,从而对纳米粒子修饰性包裹,增加了纳米粒子的稳定性。将得到的金属纳米粒子@生物蛋白(mnps@bp)反应液冷冻干燥后高温碳化,获得金属纳米粒子负载的氮掺杂多孔碳材料(mnps@npc)。此方法制备的金属纳米粒子可以良好的分散于多孔碳基体中,因此可提供丰富的电化学活性位点。同时多孔碳基体具有高比表面积、高孔隙率特性,增大了氢离子与金属纳米粒子接触面积,促进了电荷和离子在电极表面快速转移,降低了电化学传输内阻,提高了传感器的灵敏度。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为实施例1提供的可实时检测体液的柔性条带状ph传感器的结构图;
图2为实施例1提供的ph传感器在不同ph值中的电势测试图;
图3为实施例1提供的ph传感器的灵敏度测试图。
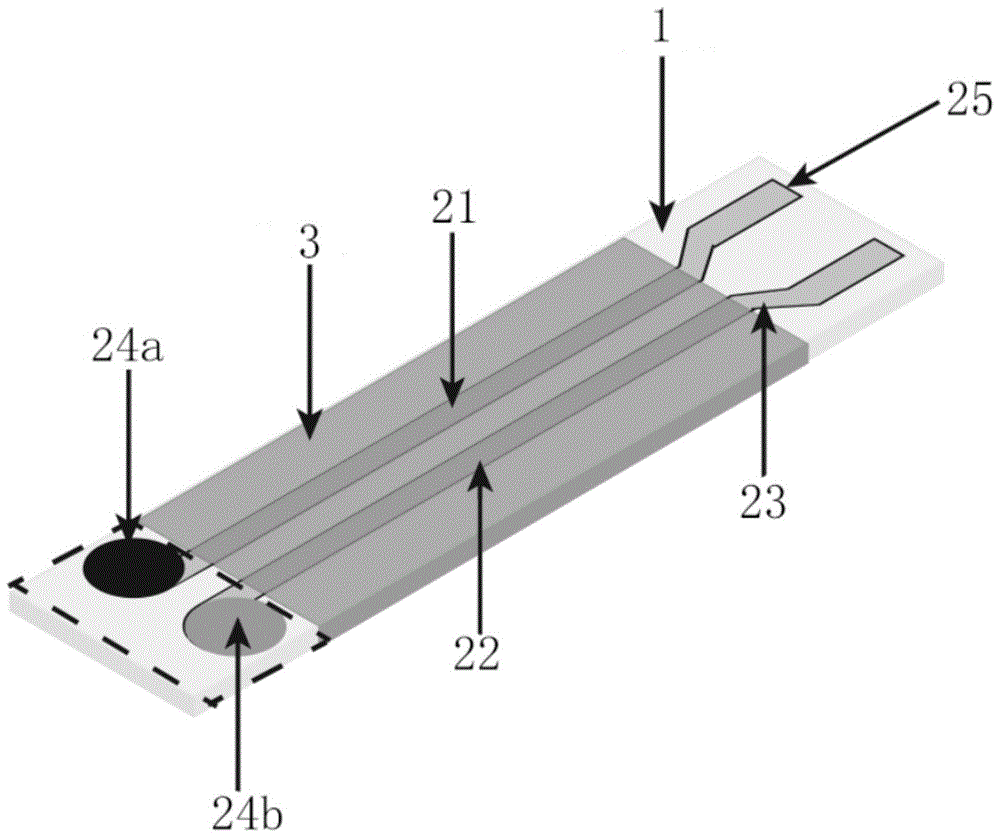
图标:1-柔性基底;21-工作电极;22-参比电极;23-电极线;24a-工作电极工作区;24b-参比电极工作区;25-电极连接区;3-绝缘层。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例的可实时检测体液的柔性条带状ph传感器及其制备方法进行具体说明。
本发明提供一种可实时检测体液的柔性条带状ph传感器,柔性基底1上设有检测电极组件,所述检测电极组件包括并列设置的工作电极21和参比电极22,二者平行且互不接触;所述工作电极21与所述参比电极22的两端分别为工作区和电极连接区25,且二者的工作区位于同侧,所述工作电极21和所述参比电极22的中部均覆盖有绝缘层3,以使二者各自的工作区24a、24b和电极连接区25彼此绝缘;所述工作电极工作区24a设有对氢离子敏感的负载金属纳米粒子的氮掺杂碳材料。本发明提供的ph传感器基于两电极的电化学系统,先通过测定工作电极21和参比电极22之间的开路电势,而后工作电极工作区24a的敏感材料的功能基团与氢离子发生反应,使得氢离子都向敏感材料移动,导致工作电极21的电势发生变化,从而经过相应的换算得出体液的ph值。而电极中间部分覆盖有绝缘层3,不仅可保护导电路径,还可限定传感器的工作区和电极连接区25,避免使用失误。该ph传感器响应快、体积小,可用于分析人体体液的ph水平,即健康状况的检测。而且该ph传感器为柔性的,可通过柔性导管等装置,将该传感器放至导管中,通过喉管引入体内进行检测胃液等ph值的实时检测。
进一步地,所述柔性基底1为条带状,长度为1.5~5cm,宽度为0.5~1.5cm;所述工作电极21和所述参比电极22均为条状电极,长度均为1.2~4.5cm,宽度均为0.25~1mm;所述工作电极工作区24a面积为1.0~5.0mm2;所述参比电极工作区24b面积为0.5~5.0mm2。本发明提供的ph传感器体积小,灵敏度高。
本发明还提供一种上述的可实时检测体液的柔性条带状ph传感器的制备方法,包括以下步骤:
步骤一,在柔性基底1的表面制备出所述参比电极22和所述工作电极21。
进一步地,所述柔性基底1选自聚氯乙烯、聚碳酸酯、聚对苯二甲酸乙二醇酯、聚酯、纸、纸板、陶瓷和再生丝素蛋白中的一种或多种的复合物。
更为优选地,在本发明较佳实施例中,选用条带状的聚对苯二甲酸乙二醇酯(pet)材料作为基底材料,此材料在较宽的温度范围内具有优良的物理机械性能,长期使用温度可达120℃,具有优良的柔韧性、电绝缘性、耐疲劳性、耐摩擦性和尺寸稳定性,且材料易得,成本低。使用前,需对pet进行预处理,其过程为:将6g氢氧化钠溶解在100ml乙醇和300ml去离子水中,再将pet浸入45℃的配置的氢氧化钠溶液中,浸渍1h后用去离子水洗涤3次,再在60℃条件下干燥,得到的pet就可作为柔性基底1使用。
进一步地,在柔性基底1的表面制备出所述参比电极22和所述工作电极21的步骤,具体包括:
s1,使用丝网印刷或喷墨印刷技术在所述柔性基底1表面印刷出两条电极线23;其中,所述电极线23的材料选自石墨、石墨烯、碳纳米管、铂、钯、银、金中的一种或多种。印刷技术有助于调节电极线23的厚度,可控范围在2~20μm。此外,还可以通过气相沉积方法来制备电极线23,这样电极线23的厚度可进一步减小,范围在0.5~2μm,这样制备出来的电极线23质地均匀,导电性好,材料更节约。
s2,在一条所述电极线23的一端涂覆所述氮掺杂碳材料形成所述工作电极21;在另一条所述电极线23的一端涂覆银/氯化银材料形成所述参比电极22;所述工作电极21和所述参比电极22的涂覆区域分别作为二者的工作区24a、24b;其中,所述银/氯化银材料由银纳米粒子或银纳米线经fecl3溶液氯化制成。银/氯化银材料化学性质稳定,与体液中的氢离子不反应,因此,参比电极22在检测ph值的过程中电势不发生改变。
进一步地,在本发明的较佳实施例中,选用聚萘酚或聚乙烯醇缩丁醛中的一种作为黏附材料将氮掺杂碳材料黏附在工作电极21上或将银/氯化银材料黏附在参比电极22上。工作电极21的黏附步骤为:将氮掺杂碳材料制备成一定浓度的溶液,在工作电极工作区24a上先涂覆聚萘酚或聚乙烯醇,而后通过滴涂的方式将氮掺杂碳材料置于工作电极工作区24a上,并进行烘干固定。参比电极22的黏附步骤为:将银/氯化银材料制备成一定浓度的溶液,在参比电极工作区24b上先涂覆聚萘酚或聚乙烯醇,而后通过滴涂的方式将银/氯化银材料置于参比电极工作区24b上,并进行烘干固定。
更进一步地,所述负载金属纳米粒子的氮掺杂碳材料中的碳材料为石墨、多孔碳、碳纳米管和石墨烯中的一种。
优选地,在本发明的较佳实施例中,选用负载金属纳米粒子的氮掺杂多孔碳材料作为对氢离子敏感材料。多孔碳结构不仅有利于氢离子工作电极工作区24a处的扩散,使氢离子与金属纳米粒子接触,加快催化反应;还可以作为纳米尺度的反应场所去限制金属纳米粒子的团聚,提高金属纳米粒子的分散性,提供更多的电化学活性位点给氢离子反应,提高了传感器的灵敏度。
更为优选地,在本发明的较佳实施例中,所述负载金属纳米粒子的氮掺杂多孔碳材料中的氮掺杂多孔碳由含有巯基的生物蛋白经碳化得到。此方法制备的金属纳米粒子可以良好的分散于多孔碳基体中,因此可提供丰富的电化学活性位点。同时多孔碳基体具有高比表面积、高孔隙率特性,增大了氢离子与金属纳米粒子的接触面积,促进了电荷和离子在电极表面快速转移,降低了电化学传输内阻。而采用本征含氮的蛋白质进行氮元素掺杂,掺杂效率高,且分布均匀,还提供更多的活性位点,进一步提高了传感器的灵敏度。
进一步地,由含有巯基的生物蛋白经碳化得到负载金属纳米粒子的氮掺杂多孔碳材料的制备方法,具体包括以下步骤:
s21,在含有生物蛋白和金属前驱体的混合液中加入碱液反应得到反应液,所述反应液中含有金属纳米粒子、生物蛋白质、碱性反应介质;将所述反应液静置反应一段时间后,干燥获得金属纳米粒子@生物蛋白(mnps@bp)。
进一步地,所述生物蛋白选自角蛋白、牛血清白蛋白、改性角蛋白、改性牛血清白蛋白、酪氨酸蛋白激酶、修饰蛋白激酶、β-乳球蛋白、修饰β-乳球蛋白、大豆蛋白11s、修饰大豆蛋白11s、人血清白蛋白、修饰人血清白蛋白、α球蛋白、修饰α球蛋白、肌动蛋白、修饰肌动蛋白、冠蛋白、修饰冠蛋白、纤维连接蛋白、修饰纤连蛋白、肌球蛋白、修饰肌球蛋白、血影蛋白、修饰血影蛋白、原肌球蛋白、改良原肌球蛋白、微管蛋白、修饰微管蛋白和修饰β球蛋白中的一种或多种。这些蛋白质均富含巯基,巯基使得这些蛋白质具有还原特性,可将金属离子还原成金属原子。
需要说明的是,上述所述的修饰蛋白或改良蛋白指的是由天然生物蛋白在相关酶作用下发生甲基化、乙酰化、磷酸化、腺苷酸化、泛素化、adp核糖基化等修饰过程后获得的改性蛋白,这些改性蛋白还是具有原来天然生物蛋白的巯基,因此可作为金属离子的还原剂。
更进一步地,在本发明较佳实施例中,所述生物蛋白溶液中的生物蛋白的浓度为2~6wt%,此浓度下,保证有足够量的生物蛋白作为还原剂还原金属且还有残余巯基对还原后的金属纳米粒子进行修饰性包裹。
更进一步地,在本发明的较佳实施例中,选用羊毛角蛋白作为还原剂,羊毛角蛋白来源广,易于制备,成本较低。
更进一步地,所述羊毛角蛋白按以下步骤进行制备以及纯化:将天然羊毛纤维分别在丙酮和乙醇中清洗2h,去除油脂。取12.5g脱脂羊毛纤维,加入250ml包含4m尿素、0.1m硫化钠和0.02μm十二醇硫酸钠的混合水溶液进行溶解,在50℃的温度下加热搅拌12h,然后真空过滤。最后在60℃条件下浓缩8h后,获得浓度为2~6wt%的羊毛角蛋白溶液。
进一步地,所述金属前驱体选自金属氯化物、金属硝酸盐、金属硫酸盐和金属乙酸盐一种,选择易溶于溶剂的金属前驱体,易在溶剂中形成金属离子,而后被含有巯基的生物蛋白还原成金属原子,随后形成金属纳米团簇。
更进一步地,所述金属纳米粒子为金、银、钯、铂、铜和镍中的一种或多种,贵金属纳米粒子相比过渡金属当中的其他金属纳米粒子催化性能更佳,且更稳定,是理想的催化剂材料。
优选地,在本发明的较佳实施例中,选用haucl4来制备金纳米粒子,金纳米粒子表面负电荷,与生物蛋白的正电荷基团因静电吸附而形成牢固结合,而且吸附后不会使生物蛋白变性,从而使生物蛋白可对金纳米粒子紧紧包裹,且金纳米粒子具有的高催化活性,是本发明的较佳选择。
进一步地,在本发明较佳实施例中,所述混合液的制备步骤包括:在剧烈搅拌的条件下将生物蛋白溶液与金属前驱体溶液混合,形成混合液。由于生物蛋白与金属离子的反应较为迅速,剧烈搅拌的目的是让混合液中形成大量的金属粒子晶核。如果搅拌转速过慢则会导致晶核聚集,影响催化活性。更为优选地,所述搅拌转速为850~1100rpm,搅拌时间为20~30min,使混合液中形成大量的金属粒子晶核,而后在恒定搅拌条件下使晶核成长到规定的纳米尺寸,同时逐滴加入碱液调节ph值并进行反应。所述金属纳米粒子的尺寸一般在1~100nm的范围内。
更进一步地,所述混合液中生物蛋白和金属前驱体的质量比为30~140:1。更为优选地,生物蛋白和金属前驱体的质量比为80~100:1,保证有足够多的生物蛋白对金属离子进行还原,并对金属纳米粒子进行包裹。
进一步地,在恒定搅拌条件下,在混合液中逐滴加入所述碱液将反应液的ph值调节至9~14,静置反应时间为2~48h;其中,所述碱液为氢氧化钠溶液。该步骤一是为了使金属粒子晶核进一步成长,二是为了让生物蛋白对形成的金属纳米粒子进行包裹,形成mnps@bp。
进一步地,静置反应结束后,需对反应液进行干燥得到固态金属纳米粒子@生物蛋白。所述干燥步骤包括:将静置反应后的所述反应液置于-80~-110℃条件下冷冻干燥6~72h。冷冻干燥可达到保持mnps@bp形貌和除水的目的。一旦冻干,mnps@bp形貌就不会再发生变化。
s22,将所述金属纳米粒子@生物蛋白在100℃~1000℃条件下碳化,得到蛋白质基氮掺杂碳/金属纳米粒子复合材料。
进一步地,所述碳化步骤具体包括:
s221,在惰性气氛下,将所述金属纳米粒子@生物蛋白以1~5℃/min的升温速率升温至100~200℃维持1~4h,用于除去mnps@bp的水分。更为优选地,在氩气气氛下,以2℃/min的升温速率升温至150℃维持3h来除去mnps@bp的水分,以免水分在碳化过程中对金属纳米粒子与生物蛋白的配位结合产生破坏。
s222,以1~10℃/min的升温速率升温至250~450℃保持2~5h。更为优选地,以5℃/min的升温速率升温至350℃保持3h,用以使生物蛋白形成初始共轭碳骨架。
s223,以3~7℃/min的升温速率升温至400~1000℃保持1~4h,更为优选地,以5℃/min的升温速率升温至700℃保持3h,用以使初始共轭碳骨架进一步转化为氮掺杂多孔碳基质。过高的碳化温度会破坏金属纳米粒子的形态,导致金属纳米粒子进行团聚,从而导致活性表面积减小,降低催化活性。过低的温度起不到碳化效果,共轭碳骨架以外的部分无法直接气化被除去,形成不了多孔结构。
s224,以7~20℃/min的降温速率降温至20~30℃后取出。更为优选地,以10℃/min的降温速率降温至20℃。取出用盐酸和去离子水洗涤碳化产物各三次,起到除杂效果。而后将清洗好的产物置于真空条件下充分干燥后得到所述蛋白质基氮掺杂碳/金属纳米粒子复合材料。
步骤二,在所述参比电极22和所述工作电极21的中部覆盖所述绝缘层3,以使所述参比电极和所述工作电极各自的工作区24a、24b和电极连接区25彼此绝缘。
进一步地,所述绝缘层3由柔性疏水材料制成。在本发明较佳实施例中,选用聚对苯二甲酸乙二醇酯、聚酰亚胺或者其他绝缘性良好的树脂材料作为绝缘层3,且具备柔性。通过在工作电极21与参比电极22中间部分涂覆绝缘层3,限定工作区与电极连接区25,同时也可防止整个传感器短路。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供可实时检测体液的柔性条带状ph传感器,按照以下步骤制成:
(1)取5ml5wt%的羊毛角蛋白溶液,在剧烈搅拌条件下加入haucl4溶液,而后在恒定搅拌条件下加入1m的氢氧化钠溶液,将ph值调节到12后在在38℃下放置12h。其中,反应液中羊毛角蛋白与haucl4的质量比为100:1。
(2)将反应液置于-80℃条件下进行48h的冷冻干燥,得到金纳米粒子@羊毛角蛋白。
(3)碳化:在氩气气氛下,将所述金纳米粒子@羊毛角蛋白以2℃/min的升温速率升温至150℃维持3h。而后以5℃/min的升温速率升温至350℃保持3h后再次以5℃/min的升温速率升温至700℃保持2h。最后以10℃/min的降温速率降温至20℃后取出。用盐酸和去离子水洗涤碳化产物各三次,置于真空条件下充分干燥后得到所述蛋白质基氮掺杂碳/金纳米粒子复合材料,将蛋白质基氮掺杂碳/金纳米粒子复合材料作为工作电极21的敏感材料。
(4)将6g氢氧化钠溶解在100ml乙醇和300ml去离子水中,再将长条状的pet浸入45℃的配置的氢氧化钠溶液中,浸渍1h后用去离子水洗涤3次,再在60℃条件下干燥,得到pet柔性基底1。
(5)采用喷墨打印的方法将石墨打印至pet柔性基底1的一面,形成两条电极线23。通过使用两条电极线23的同侧的一端都涂覆上聚萘酚,而后其中一条涂覆有聚萘酚的区域滴涂10μl的5mg/ml蛋白质基氮掺杂碳/金纳米粒子复合材料形成工作电极工作区24a。在另一条电极线23涂覆有聚萘酚的区域滴涂银/氯化银材料形成参比电极工作区24b。滴涂结束后进行烘干固定,最终形成工作电极工作区24a的面积与本参比电极工作区24b的面积的相等。
(6)最后在两条电极线23的中间部位涂覆聚对苯二甲酸乙二醇酯形成绝缘层3后,制备得到柔性条带状ph传感器。
实施例2
本实施例提供可实时检测体液的柔性条带状ph传感器,与实施例1的区别之处在于:
步骤(1)中,取5ml5wt%的丝素蛋白溶液作为蛋白质基氮掺杂碳/金纳米粒子复合材料中的蛋白质基。
实施例3
本实施例提供可实时检测体液的柔性条带状ph传感器,与实施例1的区别之处在于:
步骤(1)中,取5ml5wt%的混合蛋白溶液作为蛋白质基氮掺杂碳/金纳米粒子复合材料中的蛋白质基。其中混合蛋白溶液中包括丝素蛋白与羊毛角蛋白,这二者的质量比为3:7。
实施例4
本实施例提供可实时检测体液的柔性条带状ph传感器,与实施例1的区别之处在于:
步骤(1)中,取5ml5wt%的混合蛋白溶液作为蛋白质基氮掺杂碳/金纳米粒子复合材料中的蛋白质基。其中混合蛋白溶液中包括丝素蛋白与牛血清白蛋白,这二者的质量比为3:7。
实施例5
本实施例提供可实时检测体液的柔性条带状ph传感器,与实施例1的区别之处在于:
步骤(1)~(3)中,使用氮掺杂碳纳米管/金纳米粒子复合材料代替蛋白质基氮掺杂碳/金纳米粒子复合材料成为工作电极21的敏感材料。
实施例6
本实施例提供可实时检测体液的柔性条带状ph传感器,与实施例1的区别之处在于:
步骤(1)~(3)中,使用氮掺杂石墨烯/金纳米粒子复合材料代替蛋白质基氮掺杂碳/金纳米粒子复合材料成为工作电极21的敏感材料。
实施例7
本实施例提供可实时检测体液的柔性条带状ph传感器,与实施例1的区别之处在于:
步骤(5)中,采用喷墨打印的方法将金打印至pet柔性基底1的一面,形成两条电极线23。
实施例8
本实施例提供可实时检测体液的柔性条带状ph传感器,与实施例1的区别之处在于:
步骤(5)中,采用喷墨打印的方法将铂打印至pet柔性基底1的一面,形成两条电极线23。
实施例9
本实施例提供可实时检测体液的柔性条带状ph传感器,与实施例1的区别之处在于:
步骤(5)中,采用喷墨打印的方法将银打印至pet柔性基底1的一面,形成两条电极线23。
实施例10
本实施例提供可实时检测体液的柔性条带状ph传感器,与实施例1的区别之处在于:
步骤(5)中,工作电极工作区24a的面积是参比电极工作区24b的面积的两倍。
图2为实施例1提供的ph传感器在不同ph值中的电势测试图。从图中可发现,实施例1提供的ph传感器在4~7的ph值范围内,电势处于线性下降趋势,可通过不同的电势值,得出所测量到体液的ph值。线1表示初始ph值为4,而后在用实施例1提供的ph传感器测量过程中不断增加溶液的ph值直至7,发现ph传感器电势值随ph值的增大逐渐减小。线2表示初始ph值为7,而后在用实施例1提供的ph传感器测量过程中不断减小溶液的ph值直至4,发现ph传感器电势值随时ph值的减小逐渐增大。线1和线2几乎重叠在一起,说明了本实施例提供的ph传感器十分稳定,两次测量数据较为一致,测量数据准确。
图3为实施例1提供的ph传感器的灵敏度测试图。在图中可以发现,在短时间内对待测溶液的ph值进行改变,本实施例提供的ph传感器可以快速反应并得出相对应的电势结果,证明了本实施例提供的ph传感器灵敏度高。
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!