一种鉴定山茶花色芽变品种的方法与流程
本发明涉及一种利用花色及花瓣中花青苷成分与含量鉴定山茶花色芽变的方法,属于生物技术领域。
背景技术:
山茶(camelliajaponica)品种冬春季节开花,观赏价值高、适应性强,是园林绿化及盆栽重要的木本花卉,在国内外广泛应用。山茶花色变异丰富,其原始花色为红色,通过芽变可产生粉色、白色及复色品种,如通过芽变已从山茶‘红芙蓉’、‘红嫦娥彩’和‘红五宝’等开红色花的品种中选育出相应的粉色和白色品种。植物花色色素主要包括类黄酮、类胡萝卜素和生物碱,山茶属植物花色色素成分主要为类黄酮,包括山茶红色花瓣中的花青苷类和金花茶(c.nitidissima)类黄色花瓣中的黄酮醇类等。研究山茶及其芽变品种不同花色花瓣中花青苷成分与含量,明确山茶花色芽变与花青苷关系对山茶花色的芽变育种具有重要意义。
到目前为止,山茶属花青苷研究主要集中于部分山茶物种及开红色花的品种上,山茶品种花瓣中花青苷成分与花色的关系及不同花色形成机制尚不清楚。山茶花色主要为红色,通过芽变极易形成粉色和白色变异品种。芽变选育为山茶育种重要方法,但目前关于山茶及其粉色、白色芽变品种花色芽变的物质基础尚不清楚,极大地限制了山茶花色的芽变育种。因此必须寻找一种高效便捷的鉴定山茶花色芽变品种的方法,明确山茶花色芽变与花青苷之间的关系,为山茶花色芽变育种提供科学依据。目前,关于芽变品种的鉴定主要应用分子标记技术,如苹果、梨等果树中应用issr或ssr等分子鉴定其芽变,关于利用花色及花瓣中花青苷成分与含量鉴定山茶花色芽变品种方面尚未见相关报道。
本发明利用高效液相色谱–光电二极管阵列检测和超高效液相色谱–四极杆–飞行时间质谱联用技术对山茶品种红色花瓣及其粉色与白色芽变品种花瓣中花青苷成分与含量进行研究,结合花色表型分析,对山茶花色芽变进行有效鉴定,明确山茶花色芽变与花青苷之间的关系,揭示山茶花色芽变形成的物质基础,为山茶花色芽变育种提供科学依据。
技术实现要素:
本发明利用高效液相色谱–光电二极管阵列检测和超高效液相色谱–四极杆–飞行时间质谱联用技术对山茶品种红色花瓣及其粉色与白色芽变品种花瓣中花青苷成分与含量进行研究,结合花色表型分析,对山茶花色芽变进行有效鉴定,明确山茶花色芽变与花青苷之间的关系,揭示山茶花色芽变形成的物质基础,从而为山茶花色芽变育种提供科学依据。提出一种鉴定山茶花色芽变品种的方法。
为了实现上述目的,本发明采用的技术方案如下:
一种鉴定山茶花色芽变品种的方法,其特征在于:所述鉴定方法具体如下:
一种鉴定山茶花色芽变品种的方法,其特征在于:所述鉴定方法具体如下:
步骤1,花色测定:采集山茶品种测定花色的l*、色相a*值、色相b*值、彩度c*值和色调角h,花色测定位置为花瓣上表皮中央部位,光源为c/2°;每样品测量5朵花的花色,数据列表,取平均值;
步骤2,定性分析:取山茶品种新鲜花瓣0.6g,液氮研磨至粉末加提取液2ml,浸提24h后用0.22μm滤膜过滤,滤液保存在-20℃冰箱备用;
利用高效液相色谱–光电二极管阵列检测(hplc–dad)和超高效液相色谱–四极杆–飞行时间质谱(uplc–q–tof–ms)联用技术对花瓣中花青苷成分进行定性分析,联用技术采用超高效液相色谱系统和质谱系统,采用unifi1.8软件系统,色谱柱为acquitybehc18(2.1mm×100mm,1.7μm);流速:0.3ml·min-1,进样量:2μl,柱温40℃;以0.1%甲酸水溶液(a)和乙腈(b)为流动相,洗脱程序为0—1.5min,5%b;1.5—11min,5%—40%b;11—14min,40%—95%b;14—16.5min,95%b;16.5—16.8min,95%—5%b;16.8—20min,5%b;电喷雾电离离子源(esi),正离子模式,全离子扫描,扫描范围(m/z):50-1200u;脱溶剂气体为高纯度氮气,温度为450℃,流速为600l·h-1,毛细管电压为1kv,锥孔电压为40v;低能量扫描电压为6ev,高能量扫描电压为20—45ev;根据uplc–q–tof–ms图谱,检测到若干种花青苷成分,根据cy糖苷在513—520nm有特征吸收峰及碎片离子m/z287,推测若干种花青苷均为cy型花青苷;
步骤3,定量分析:运用hplc–dad方法,在525nm处检测花瓣中花青苷;采用标准品半定量法分别计算花瓣中含有的相对于标准品矢车菊素–3–o–β–葡萄糖苷(cyanidin-3-o-β-glucoside,cy3g)的花青苷含量,重复3次。
进一步的,采用分光色差仪对花色测定,ciel*a*b*体系中,l*表示花色明暗变化程度;色相a*值表示花瓣红、绿色变化,a*为正值时数值越大,花色越红;色相b*值表示花瓣黄蓝色变化程度;彩度c*表示色彩鲜艳程度,c*值越大,颜色越深;色调角h是对红、橙、黄、绿、青、蓝、紫7种颜色色调描述。
进一步的,白色、粉色和红色花瓣l*值的平均值分别为89.46、72.49和56.70,随花色加深l*值降低,花色明亮度降低;白色花瓣a*值介于-0.51—-0.93,平均值为-0.69;粉色花瓣a*值介于31.73—41.71,平均值为36.34;红色花瓣a*值介于48.71—55.91,平均值为52.11;随花色加深a*值升高,花瓣红色程度增加;白色花瓣b*值介于1.65—6.53,平均值为3.97;粉色花瓣b*值介于2.43—9.94,平均值为6.83;红色花瓣b*值介于13.85—21.94,平均值为18.11;随花色加深b*值升高,花瓣红色程度增加;白色、粉色和红色花瓣c*值平均值分别为4.07、35.09和51.69,随花色加深c*值升高,花瓣鲜艳程度增加;白色花瓣h值均处于90°—180°,平均值为98.93;粉色和红色花瓣h值均处于0°—90°,平均值分别为5.43和18.64。
山茶品种花色数据如下表:
进一步的,提取液中甲醇:水:甲酸:三氟乙酸(tfa)的体积比为70:27:2:1。
进一步的,步骤2中根据uplc–q–tof–ms图谱,检测到7种花青苷成分,根据cy糖苷在513—520nm有特征吸收峰及碎片离子m/z287,推测7种花青苷均为cy型花青苷。
进一步的,峰p1和峰p2质谱数据为分子离子m/z449,碎片离子m/z287(cy苷元特征质荷比),根据峰p1和峰p2与标准品cy3ga和cy3g共洗脱特性,及花青素半乳糖洗脱时间小于花青素葡萄糖苷特性;确定峰p1为矢车菊素–3–o–β–半乳糖苷(tr,8.33min),简称cy3ga,确定峰p2为矢车菊素–3–o–β–葡萄糖苷(tr,9.43min),简称cy3g;
峰p3—峰p7的a440/avis-max变化范围为32%—33%,确定其为3–o–糖苷类型;
峰p3—峰p7在311—316nm波长下肩峰的出现推定化合物被芳香酸酰化;峰p3和峰p4质谱数据为分子离子m/z611,碎片离子m/z449,287;m/z287为cy苷元特征质荷比,m/z611到m/z449丢失162u,m/z449到m/z287丢失162u,推定其为cy–3–o–咖啡酰型葡萄糖苷或半乳糖苷;
根据山茶中矢车菊素–3–o–[6–o–(e)–咖啡酰]–β–半乳糖苷(cy3gaecaf)和矢车菊素–3–o–[6–o–(e)–咖啡酰]–β–葡萄糖苷(cy3gecaf)的报道及峰p3洗脱时间小于峰p4,判断峰p3和峰p4分别为矢车菊素–3–o–[6–o–(e)–咖啡酰]–β–半乳糖苷和矢车菊素–3–o–[6–o–(e)–咖啡酰]–β–葡萄糖苷;
峰p5、峰p6和峰p7质谱数据为分子离子m/z595,碎片离子m/z449,287;m/z287为cy苷元特征质荷比,m/z595到m/z449丢失146u,m/z449到m/z287丢失162u,推定其为cy–3–o–p–香豆酰型葡萄糖苷或半乳糖苷;
根据山茶中矢车菊素–3–o–[6–o–(z)–p–香豆酰]–β–葡萄糖苷(cy3gzpc)、矢车菊素–3–o–[6–o–(e)–p–香豆酰]–β–半乳糖苷(cy3gaepc)和矢车菊素–3–o–[6–o–(e)–p–香豆酰]–β–葡萄糖苷(cy3gepc)的报道,以及顺式花青苷洗脱时间小于反式花青苷及花青素半乳糖苷洗脱时间小于花青素葡萄糖苷特性,判断峰p5、峰p6和峰p7分别为矢车菊素–3–o–[6–o–(z)–p–香豆酰]–β–葡萄糖苷、矢车菊素–3–o–[6–o–(e)–p–香豆酰]–β–半乳糖苷和矢车菊素–3–o–[6–o–(e)–p–香豆酰]–β–葡萄糖苷。
进一步的,步骤3中标准品矢车菊素–3–o–β–葡萄糖苷和矢车菊素–3–o–β–半乳糖苷(cyanidin-3-o-β-galactoside,cy3ga)购于sigma公司,纯度≥98%。
从而可以得到以下有益效果:
山茶各系列芽变品种中,白色花瓣中均未检测到花青苷,红色花瓣中花青苷成分与粉色花瓣相同,但其各成分含量及花青苷总量均显著高于其芽变品种的粉色花瓣;红色和粉色花瓣中主要花青苷成分为cy3g和cy3gepc;随花瓣颜色变淡,cy3ga和cy3g比例降低,其余花青苷比例升高。
芽变育种为山茶品种选育的重要方法,尤其山茶花色变异丰富,生产上大量应用的品种极易发生花色变异,通过芽变选育进而有望培育出花色各异的品种。本发明利用高效液相色谱–光电二极管阵列检测和超高效液相色谱–四极杆–飞行时间质谱联用技术对红色山茶品种及其粉色与白色芽变品种花瓣中花青苷成分与含量进行分析,结合花色表型分析,对山茶花色芽变进行有效鉴定,明确山茶花色芽变与花青苷之间的关系,揭示山茶花色芽变形成的物质基础,从而为山茶花色芽变育种提供科学依据。本发明为山茶花色芽变鉴定提供了一种科学有效的方法。与形态观察及issr、ssr等分子标记方法相比,本发明操作简便、经济适用,且稳定性强、可重复性高,适合于山茶花色芽变的高效鉴定,为山茶花色芽变育种提供了科学依据。
附图说明
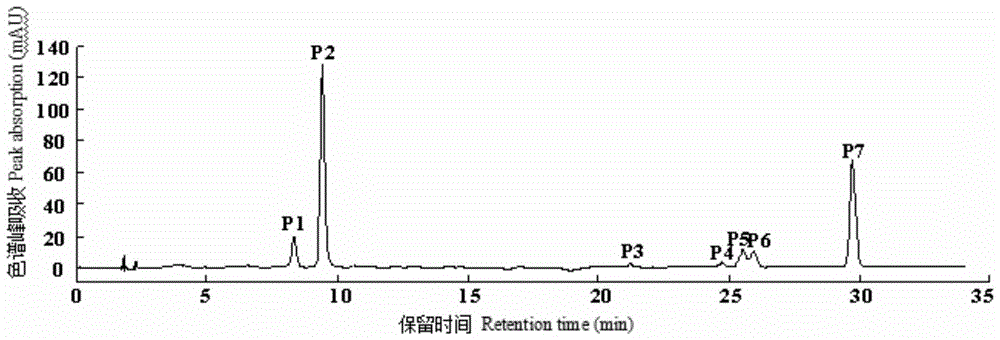
图1是山茶品种花青苷hplc图谱。
图2是山茶品种‘红芙蓉’及其芽变品种‘粉芙蓉’和‘白芙蓉’的花色图。
图3是山茶品种‘红嫦娥彩’及其芽变品种‘粉嫦娥彩’和‘白嫦娥彩’的花色图。
图4是山茶品种‘红五宝’及其芽变品种‘粉五宝’和‘白五宝’的花色图。
具体实施方式
下面结合附图对本发明做进一步的说明:
如图1-4所示,一种鉴定山茶花色芽变品种的方法,具体方法如下:
1花色测定:
花色测定按照国际照明委员会制定的ciel*a*b*表色系法,用分光色差仪(nf555,spectrophotometer,trisum)测定花色的l*、色相a*值、色相b*值、彩度c*值和色调角h。ciel*a*b*体系中,l*表示花色明暗变化程度;色相a*值表示花瓣红、绿色变化,a*为正值时数值越大,花色越红;色相b*值表示花瓣黄蓝色变化程度;彩度c*表示色彩鲜艳程度,c*值越大,颜色越深;色调角h是对红、橙、黄、绿、青、蓝、紫7种颜色色调描述。花色测定位置为花瓣上表皮中央部位,光源为c/2°。每样品测量5朵花的花色,取平均值。
2定性分析:
取山茶品种新鲜花瓣0.6g,液氮研磨至粉末,加甲醇:水:甲酸:三氟乙酸(tfa)(70:27:2:1,体积比)提取液2ml,浸提24h后用0.22μm滤膜过滤,滤液保存在-20℃冰箱备用。
利用高效液相色谱–光电二极管阵列检测(hplc–dad)和超高效液相色谱–四极杆–飞行时间质谱(uplc–q–tof–ms)联用技术对花瓣中花青苷成分进行定性与定量分析。acquitytmuplci-class超高效液相色谱系统(waterscorporation,milford,ma,usa),xevog2-xsqtofms质谱系统(waterscorporation,manchester,uk),unifi1.8软件系统。色谱柱为acquitybehc18(2.1mm×100mm,1.7μm)。流速:0.3ml·min-1,进样量:2μl,柱温40℃。以0.1%甲酸水溶液(a)和乙腈(b)为流动相,洗脱程序为0—1.5min,5%b;1.5—11min,5%—40%b;11—14min,40%—95%b;14—16.5min,95%b;16.5—16.8min,95%—5%b;16.8—20min,5%b。电喷雾电离离子源(esi),正离子模式,全离子扫描,扫描范围(m/z):50-1200u。脱溶剂气体为高纯度氮气,温度为450℃,流速为600l·h-1,毛细管电压为1kv,锥孔电压为40v。低能量扫描电压为6ev,高能量扫描电压为20—45ev。
利用hplc–dad和uplc–q–tof–ms对山茶品种花瓣中花青苷成分进行定性分析,根据uplc–q–tof–ms图谱,参考相关文献,对其主要花青苷成分进行结构鉴定。
共检测到7种花青苷成分(图1),其紫外–可见光谱及质谱数据见表1。
表1山茶品种花青苷成分的紫外-可见吸收光谱与质谱数据
注:cy3ga:矢车菊素–3–o–β–半乳糖苷;cy3g,矢车菊素–3–o–β-葡萄糖苷;cy3gaecaf,矢车菊素–3–o–[6–o–(e)–咖啡酰]–β–半乳糖苷;cy3gecaf,矢车菊素–3–o–[6–o–(e)–咖啡酰]–β–葡萄糖苷;cy3gzpc,矢车菊素–3–o–[6–o–(z)–p–香豆酰]–β–葡萄糖苷;cy3gaepc,矢车菊素–3–o–[6–o–(e)–p–香豆酰]–β–半乳糖苷;cy3gepc,矢车菊素–3–o–[6–o–(e)–p–香豆酰]–β–葡萄糖苷。下同。
根据cy糖苷在513—520nm有特征吸收峰及碎片离子m/z287,推测7种花青苷均为cy型花青苷。峰p1和峰p2质谱数据为分子离子m/z449,碎片离子m/z287(cy苷元特征质荷比),根据峰p1和峰p2与标准品cy3ga和cy3g共洗脱特性,及花青素半乳糖洗脱时间小于花青素葡萄糖苷特性,确定峰p1为矢车菊素–3–o–β–半乳糖苷(tr,8.33min),简称cy3ga,峰p2为矢车菊素–3–o–β–葡萄糖苷(tr,9.43min),简称cy3g。
峰p3—峰p7的a440/avis-max变化范围为32%—33%,确定其为3–o–糖苷类型;峰p3—峰p7在311—316nm波长下肩峰的出现推定化合物被芳香酸酰化。峰p3和峰p4质谱数据为分子离子m/z611,碎片离子m/z449,287。m/z287为cy苷元特征质荷比,m/z611到m/z449丢失162u,m/z449到m/z287丢失162u,推定其为cy–3–o–咖啡酰型葡萄糖苷或半乳糖苷;根据山茶中矢车菊素–3–o–[6–o–(e)–咖啡酰]–β–半乳糖苷(cy3gaecaf)和矢车菊素–3–o–[6–o–(e)–咖啡酰]–β–葡萄糖苷(cy3gecaf)的报道及峰p3洗脱时间小于峰p4,判断峰p3和峰p4分别为矢车菊素–3–o–[6–o–(e)–咖啡酰]–β–半乳糖苷和矢车菊素–3–o–[6–o–(e)–咖啡酰]–β–葡萄糖苷。
峰p5、峰p6和峰p7质谱数据为分子离子m/z595,碎片离子m/z449,287。m/z287为cy苷元特征质荷比,m/z595到m/z449丢失146u,m/z449到m/z287丢失162u,推定其为cy–3–o–p–香豆酰型葡萄糖苷或半乳糖苷。根据山茶中矢车菊素–3–o–[6–o–(z)–p–香豆酰]–β–葡萄糖苷(cy3gzpc)、矢车菊素–3–o–[6–o–(e)–p–香豆酰]–β–半乳糖苷(cy3gaepc)和矢车菊素–3–o–[6–o–(e)–p–香豆酰]–β–葡萄糖苷(cy3gepc)的报道,以及顺式花青苷洗脱时间小于反式花青苷及花青素半乳糖苷洗脱时间小于花青素葡萄糖苷特性,判断峰p5、峰p6和峰p7分别为矢车菊素–3–o–[6–o–(z)–p–香豆酰]–β–葡萄糖苷、矢车菊素–3–o–[6–o–(e)–p–香豆酰]–β–半乳糖苷和矢车菊素–3–o–[6–o–(e)–p–香豆酰]–β–葡萄糖苷。
3定量分析:
运用hplc–dad方法,在525nm处检测花瓣中花青苷。采用标准品半定量法分别计算花瓣中含有的相对于标准品矢车菊素–3–o–β–葡萄糖苷(cyanidin-3-o-β-glucoside,cy3g)的花青苷含量,重复3次。标准品矢车菊素–3–o–β–葡萄糖苷和矢车菊素–3–o–β–半乳糖苷(cyanidin-3-o-β-galactoside,cy3ga)购于sigma公司,纯度≥98%。
实施例1
1材料
采集山茶品种‘红芙蓉’及其芽变品种‘粉芙蓉’和‘白芙蓉’新鲜花朵测定其花色,其中‘粉芙蓉’剪取花瓣中粉色部分,‘白芙蓉’剪取花瓣中白色部分进行花色测定与定性定量分析。每材料选取生长状况一致的植株5株,每株取树冠外围盛开期花朵3朵。
2花色测定
花色测定按照上述方法进行。
山茶‘红芙蓉’及其芽变品种花色测定数据见表2,
表2山茶‘红芙蓉’及其芽变品种花色数据
注:a、b、c表示多重比较snk检验在p=0.05显著性水平下的差异显著。下同。
ciel*a*b*体系中,从红色‘红芙蓉’到粉色‘粉芙蓉’和白色‘白芙蓉’,随花瓣颜色变淡,其l*值逐渐升高,其中‘白芙蓉’显著高于‘红芙蓉’,花色明亮度增加;花瓣a*值、b*值和c*值均显著降低;‘红芙蓉’和‘粉芙蓉’花瓣h值处于0°—90°,‘白芙蓉’处于90°—180°。
3定性定量分析
按上述方法进行定性定量分析,在山茶‘红芙蓉’及其芽变品种中共检测到7种花青苷(表3),其中‘白芙蓉’白色花瓣中未检测到花青苷,‘红芙蓉’红色花瓣和‘粉芙蓉’粉色花瓣中均检测到7种花青苷,‘红芙蓉’中7种花青苷及总花青苷含量均显著高于‘粉芙蓉’,如‘红芙蓉’中主要花青苷cy3g、cy3gepc和总花青苷含量分别为‘粉芙蓉’的5.01倍、2.93倍和4.21倍。
表3山茶‘红芙蓉’及其芽变品种花青苷含量(μg·100mg-1)
注:“-”表示未鉴定出。下同。
山茶‘红芙蓉’及其芽变品种中,主要花青苷成分均为cy3g和cy3gepc,如‘红芙蓉’花瓣中cy3g和cy3gepc分别占68.06%和14.62%,合计为82.68%;‘粉芙蓉’花瓣中cy3g和cy3gepc分别占57.11%和21.01%,合计为78.12%。从‘红芙蓉’到‘粉芙蓉’和‘白芙蓉’,花瓣颜色变淡,cy3ga和cy3g比例降低,cy3gepc等花青苷成分比例升高,如‘红芙蓉’和‘粉芙蓉’和花瓣中cy3ga分别占8.73%和8.10%,cy3g分别占68.06%和57.11%,cy3gepc分别占14.62%和21.01%。可见,山茶‘红芙蓉’及其芽变品种主要花青苷为cy3g和cy3gepc;随花瓣颜色变淡,cy3ga和cy3g比例降低,其余花青苷比例升高(表4)。
表4山茶‘红芙蓉’及其芽变品种花青苷比例(%)
实施例2
1材料
采集山茶品种‘红嫦娥彩’及其芽变品种‘粉嫦娥彩’和‘白嫦娥彩’新鲜花朵测定其花色,其中‘粉嫦娥彩’剪取花瓣中粉色部分,‘白嫦娥彩’剪取花瓣中白色部分进行花色测定与定性定量分析。每材料选取生长状况一致的植株5株,每株取树冠外围盛开期花朵3朵。
2花色测定
花色测定按照上述方法进行。
山茶‘红嫦娥彩’及其芽变品种花色测定数据见表5,ciel*a*b*体系中,从红色‘红嫦娥彩’到粉色‘粉嫦娥彩’和白色‘白嫦娥彩’,随花瓣颜色变淡,其l*值逐渐升高,其中‘白嫦娥彩’显著高于‘红嫦娥彩’,花色明亮度增加;b*值和c*值均显著降低,a*值‘红嫦娥彩’和‘粉嫦娥彩’显著高于‘白嫦娥彩’;‘红嫦娥彩’和‘粉嫦娥彩’花瓣h值处于0°—90°,‘白嫦娥彩’处于90°—180°。
表5山茶‘红嫦娥彩’及其芽变品种花色数据
3定性定量分析
按上述方法进行定性定量分析,在山茶‘红嫦娥彩’及其芽变品种中共检测到5种花青苷(表6),其中‘白嫦娥彩’白色花瓣中未检测到花青苷,‘红嫦娥彩’红色花瓣和‘粉嫦娥彩’粉色花瓣中均检测到5种花青苷,‘红嫦娥彩’中5种花青苷及总花青苷含量均显著高于‘粉嫦娥彩’,如‘红嫦娥彩’中主要花青苷cy3g、cy3gepc和总花青苷含量分别为‘粉嫦娥彩’的6.00倍、2.90倍和4.41倍。
表6山茶‘红嫦娥彩’及其芽变品种花青苷含量(μg·100mg-1)
山茶‘红嫦娥彩’及其芽变品种中,主要花青苷成分均为cy3g和cy3gepc,如‘红嫦娥彩’花瓣中cy3g和cy3gepc分别占50.66%和22.17%,合计为72.83%;‘粉嫦娥彩’花瓣中cy3g和cy3gepc分别占37.23%和33.65%,合计为70.88%。从‘红嫦娥彩’到‘粉嫦娥彩’和‘白嫦娥彩’,花瓣颜色变淡,cy3ga和cy3g比例降低,cy3gepc等花青苷成分比例升高,如‘红嫦娥彩’和‘粉嫦娥彩’和花瓣中cy3ga分别占15.45%和13.37%,cy3g分别占50.66%和37.23%,cy3gepc分别占22.17%和33.65%。可见,山茶‘红嫦娥彩’及其芽变品种主要花青苷为cy3g和cy3gepc;随花瓣颜色变淡,cy3ga和cy3g比例降低,其余花青苷比例升高(表7)。
表7山茶‘红嫦娥彩’及其芽变品种花青苷比例(%)
实施例3
1材料
采集山茶品种‘红五宝’及其芽变品种‘粉五宝’和‘白五宝’新鲜花朵测定其花色,其中‘粉五宝’剪取花瓣中粉色部分,‘白五宝’剪取花瓣中白色部分进行花色测定与定性定量分析。每材料选取生长状况一致的植株5株,每株取树冠外围盛开期花朵3朵。
2花色测定
花色测定按照上述方法进行。
山茶‘红五宝’及其芽变品种花色测定数据见表8,ciel*a*b*体系中,从红色‘红五宝’到粉色‘粉五宝’和白色‘白五宝’,随花瓣颜色变淡,其l*值逐渐升高,其中‘白五宝’显著高于‘红五宝’,花色明亮度增加;花瓣a*值、b*值和c*值均显著降低;‘红五宝’和‘粉五宝’花瓣h值处于0°—90°,‘白五宝’处于90°—180°。
表8山茶‘红五宝’及其芽变品种花色数据
3定性定量分析
按上述方法进行定性定量分析,在山茶‘红五宝’及其芽变品种中共检测到6种花青苷(表9),其中‘白五宝’白色花瓣中未检测到花青苷,‘红五宝’红色花瓣和‘粉五宝’粉色花瓣中均检测到6种花青苷,‘红五宝’中6种花青苷及总花青苷含量均显著高于‘粉五宝’,如‘红五宝’中主要花青苷cy3g、cy3gepc和总花青苷含量分别为‘粉五宝’2.76倍、1.74倍和1.19倍。
表9山茶‘红五宝’及其芽变品种花青苷含量(μg·100mg-1)
山茶‘红五宝’及其芽变品种中,主要花青苷成分均为cy3g和cy3gepc,如‘红五宝’花瓣中cy3g和cy3gepc分别占30.15%和56.94%,合计为87.09%;‘粉五宝’花瓣中cy3g和cy3gepc分别占21.69%和65.08%,合计为86.77%。从‘红五宝’到‘粉五宝’和‘白五宝’,花瓣颜色变淡,cy3ga和cy3g比例降低,cy3gepc等花青苷成分比例升高,如‘红五宝’和‘粉五宝’和花瓣中cy3ga分别占0.87%和0.45%,cy3g分别占30.15%和21.69%,cy3gepc分别占56.94%和65.08%。可见,山茶‘红五宝’及其芽变品种主要花青苷为cy3g和cy3gepc;随花瓣颜色变淡,cy3ga和cy3g比例降低,其余花青苷比例升高(表10)。
表10山茶‘红五宝’及其芽变品种花青苷比例(%)
本文中应用了具体实例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!