一种基于稀土纳米材料荧光放大的循环肿瘤细胞检测试剂盒及其应用的制作方法
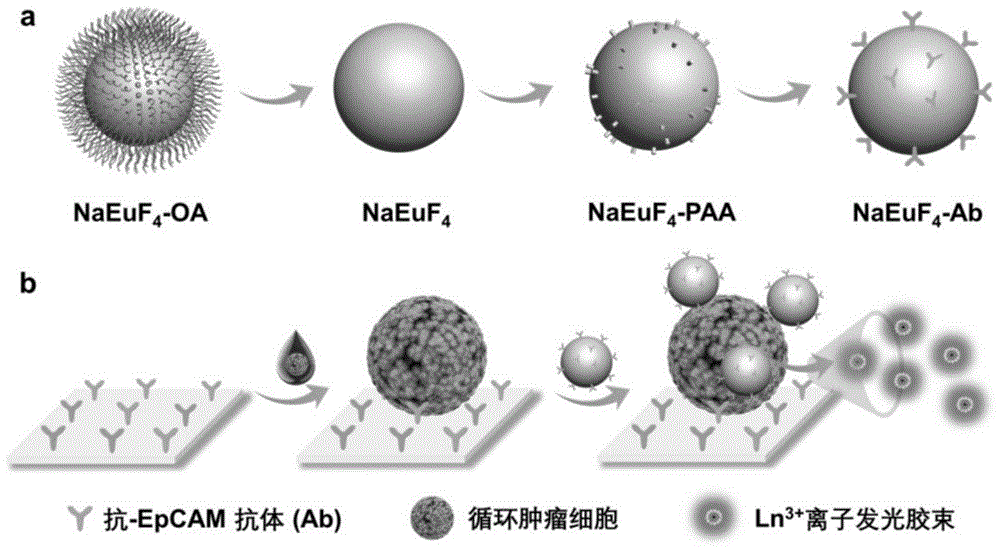
本发明涉及纳米荧光检测技术领域,更具体地说涉及一种基于稀土纳米材料荧光放大的循环肿瘤细胞检测试剂盒及其应用。
背景技术:
循环肿瘤细胞是指由原发灶脱落,侵入血液循环的肿瘤细胞。自1869年thomasashworth首次在癌症患者外周血中发现循环肿瘤细胞以来,越来越多的证据表明其与癌症的转移密切相关,可作为肿瘤转移复发的标志物。因此,循环肿瘤细胞的检测逐渐受到了人们的关注,成为研究热点。循环肿瘤细胞检测是指对肿瘤患者外周血中的循环肿瘤细胞进行分析的方法。作为一种液体活检方法,它可用于指导临床制定医疗方案、判断患者预后、评价疗效等,对于肿瘤患者的实时个体化医疗具有独特优势。但循环肿瘤细胞在血液中的数目非常稀少,只能以个位数计,这对其检测提出了极大的挑战。因此,建立稳定、高灵敏及高特异性的循环肿瘤细胞检测方法是开展其相关研究的关键。
利用纳米技术对物质进行检测,是一门融合了生物学、化学、药学和物理学的交叉学科,在肿瘤的监测和个性化治疗方面具有广阔的应用前景。近年来,出现了基于不同信号模式的循环肿瘤细胞的检测方法,如电化学、电感耦合等离子体质谱、拉曼光谱成像、比色法、荧光法等。其中,荧光检测由于其快速反应、高灵敏度、无破坏性和实时监测等优点,是循环肿瘤细胞检测方法中一个备受关注的领域。目前,有很多检测方法是基于荧光染料来对循环肿瘤进行检测。然而,在荧光染料标记检测循环肿瘤细胞过程中,最大的困难是血液复杂的生化环境和生物背景荧光的干扰。由于荧光标记大多激发和发射光谱间隔很小,且发射波长范围内大多会受到生物背景荧光的干扰,检测步骤复杂,检测灵敏度和准确度低。
技术实现要素:
针对上述现有技术中存在的不足,本发明提出一种基于稀土纳米材料荧光放大的循环肿瘤细胞检测试剂盒,包括捕获探针,荧光检测探针,增强液,所述荧光检测探针为针对循环肿瘤细胞抗原性表位的抗体修饰的稀土纳米材料。
根据本发明,所述荧光检测探针为纳米颗粒形态。
根据本发明,所述检测试剂盒进一步包括固相载体、包被液和封闭液。
根据本发明,所述捕获探针固定于固相载体;所述固定可以采用共价偶联、或物理吸附的方式固定。在本发明的一个具体实施方式中,所述捕获探针可以共价偶联的方式固定于固相载体上。将捕获探针共价偶联到固相载体上的方法,可采用本领域中已知的各种方法,包括但不限于,通过在捕获探针5’端连接上化学反应性基团,例如氨基、羧基、酰胺基等,经由这些化学反应性基团将捕获探针共价偶联到固相载体上。
根据本发明,所述固定包括采用包被液稀释所述捕获抗体,然后再将所述抗体溶液加入固相载体固定。在本发明的一个具体实施方式中,采用ph9.6的碳酸盐缓冲溶液作为包被液。根据本发明,所述固定还可以包括共价偶联后的封闭步骤。在本发明的一个具体实施方式中,在将捕获探针包被到固相载体上之后,进一步用封闭液封闭掉捕获探针上未反应的化学基团,可以降低后续检测中可能出现的假阳性。在本发明的一个具体实施方式中,所用的封闭液为牛血清白蛋白(bsa)溶液,例如为用0.1mol/l的碳酸盐缓冲液配制的bsa溶液(2%w/v)。
根据本发明,所述固相载体可以是检测领域中已知的各种固相载体,包括但不限于微孔板、磁性微球、金箔、高分子微球、酶标板、硝酸纤维素膜等。在本发明的一个具体实施方式中,所述固相载体为微孔板,例如96孔板。
根据本发明,所述捕获探针为针对循环肿瘤细胞抗原性表位的抗体,所述抗体可以与循环肿瘤细胞表面特异性标记物特异性结合。
根据本发明,所述荧光检测探针为针对循环肿瘤细胞抗原性表位的抗体修饰的稀土纳米材料,由于所述抗体可与循环肿瘤细胞表面的标记物特异性结合,这样能提高检测探针与循环肿瘤细胞结合的特异性和稳定性,降低检测的假阳性和假阴性。在本发明的一个具体实施方式中,所述捕获探针与修饰稀土纳米颗粒的抗体相同或不同,彼此独立地选自本领域已知的可与循环肿瘤细胞抗原性表位特异性结合的抗体,可以为单克隆抗体、多克隆抗体的任一种;例如彼此独立地选自与如下至少一种循环肿瘤细胞相关抗原结合的抗体:epcam,上皮角质蛋白(cks),上皮细胞膜特异性抗原,肿瘤细胞糖蛋白(tag)或特异性标志物(例如her2,抗乳球蛋白等);具体地,可选自抗epcam抗体,抗egfr抗体,抗细胞角蛋白ck-8、ck18和ck-19抗体,优选抗epcam抗体。
根据本发明,所述稀土纳米材料为上转换荧光纳米材料;示例性地,所述稀土纳米材料为xyf4纳米晶,所述x选自锂、钠、钾等中的一种或多种,所述y选自铕、钐、铽、镝中的一种或多种。在本发明的一个具体实施方式中,所述稀土纳米材料为naeuf4纳米晶。
根据本发明,所述荧光检测探针的合成方法可以采用本领域已知的各种抗体修饰稀土纳米材料的方法,包括但不限于静电吸附法,和/或化学配位法。
例如所述稀土纳米材料与有机配体结合,然后用化学配位法标记抗体,从而得到所述抗体修饰的稀土纳米材料。
根据本发明,所述荧光检测探针的合成方法包括:合成水溶性稀土纳米材料,用亲水性有机配体进行表面修饰,得到有机-稀土配合物,再加入活化剂活化,然后加入抗体进行标记,得到所述抗体修饰稀土纳米材料。在本发明的一个具体实施方式中,所述有机配体为聚丙烯酸(paa)、聚乙烯亚胺(pei)中的至少一种;所述活化剂选自碳二亚胺(edc)、n-羟基琥珀酰亚胺(nhs)、二甲基乙酰胺(dmac)中的至少一种。
在本发明的一个具体实施方式中,所述荧光检测探针合成方法中,所述水溶性稀土纳米材料与亲水性有机配体的质量比为(1-3):5,例如1:5、1.5:5、2:5,优选2:5;所述抗体与有机-稀土配合物的质量比为1:(100-1000),例如1:150、1:500、1:1000;所述活化剂与有机-稀土配合物的质量比为1:(0.5-5),例如1:1、1:2、1:3。
在本发明的一个具体实施方式中,所述荧光检测探针为:naeuf4纳米晶以静电吸附法装载paa,并用化学配位法标记抗体制备而成;示例性地,包括如下步骤:
1)将油溶性naeuf4纳米晶加入等量无水乙醇进行沉淀,加入氯仿、无水乙醇、超纯水和浓盐酸,除去纳米晶表面的油酸,加入去离子水溶解,得水溶性纳米晶;
2)取步骤1)合成的水溶性纳米晶,加入paa,超声,用去离子水离心洗涤,最后溶于去离子水中即可得paa装载的纳米晶;
3)取步骤2)得到的paa装载的纳米晶,加入碳二亚胺(edc)和n-羟基琥珀酰亚胺(nhs),混合均匀,用去离子水离心洗涤,溶于去离子水中后加入epcam抗体,混合均匀,用去离子水离心洗涤,溶解于hepes缓冲液中,得到靶向循环肿瘤细胞荧光检测探针,4℃保存备用。
根据本发明,所述增强液含有聚乙二醇辛基苯基醚tritonx-100、萘甲酸三氟丙酮、三正辛基氧膦和水。在本发明的一个具体实施方式中,所述增强液的组成为:每升增强液中含有1gtritonx-100,26.6mg萘甲酰三氟丙酮,193mg三正辛基氧膦,余量为水,ph2.3。
所述针对循环肿瘤细胞抗原性表位的抗体修饰的稀土纳米材料在制备循环肿瘤细胞检测试剂中的应用。
所述检测试剂盒在制备循环肿瘤细胞检测试剂中的应用。
本发明还提供所述检测试剂盒的使用方法,包括如下步骤:
(1)将捕获探针固定于固相载体;
(2)加入含有待测循环肿瘤细胞的样品;
(3)加入所述荧光检测探针;
(4)加入所述增强液;
(5)采用时间分辨荧光分析法检测荧光信号。
根据本发明,所述步骤(1)可以为:用所述包被液稀释捕获探针,然后固定于固相载体,用所述封闭液封闭。
在本发明所述的使用方法中,所述荧光检测探针添加至样品中的终浓度可以为30-50μg/ml,优选40μg/ml。
本发明还提供一种基于稀土纳米材料荧光放大的循环肿瘤细胞检测方法,所述方法包括以下步骤:
(1)提供捕获探针,所述捕获探针为针对循环肿瘤细胞抗原性表位的抗体;
(2)加入含有待测循环肿瘤细胞的样品;
(3)加入靶向循环肿瘤细胞的荧光检测探针,所述检测探针为抗体修饰的稀土纳米材料;
(4)加入增强液;
(5)采用时间分辨荧光分析法检测荧光信号。
根据本发明,所述含有待测循环肿瘤细胞的样品为来自生物体的血液、细胞悬浮液、胸水、腹水、脑脊液中的一种。
根据本发明,所述时间分辨荧光检测荧光信号步骤中,所述信号放大的原理是,当含有稀土纳米材料的荧光标记抗体靶向结合体系中已经存在的循环肿瘤细胞后,加入增强液,使稀土纳米材料溶解成稀土离子,并与增强液中的配体形成螯合物,生成新的信号分子,产生分子内和分子间能量传递,使得荧光信号的强度增强近百万倍,从而被检测到。
根据本发明,所述时间分辨荧光检测步骤中,可根据需要配制待测循环肿瘤细胞的标准品溶液进行检测,以待检测细胞数量为横坐标,荧光强度变化值为纵坐标,绘制标准曲线。再将待测样品置于荧光光谱仪中读取荧光强度值,依据标准曲线计算待测样品中循环肿瘤细胞的含量。
所述方法中,捕获探针、荧光探针、增强液等具有如上文所述的含义。
本发明的有益效果在于:
本发明提供了一种基于稀土纳米材料荧光放大的循环肿瘤细胞超灵敏检测方法和应用,所述检测方法具有如下优点:1)采用可特异性靶向循环肿瘤细胞表面抗原的标记物,如epcam抗体等作为捕获探针,对于循环肿瘤细胞具有良好的识别能力;2)不需要各种工具酶以及多步、复杂的信号放大步骤;采用稀土纳米材料作为标记物标记生物分子,无需提前做任何处理,在实验最后加入增强液便可使荧光增强近百万倍,极大地提高了检测灵敏度且操作十分简便,可直接在全血中对循环肿瘤细胞进行检测;3)由于所述稀土纳米材料的性质稳定、比表面积大、可修饰性强、成本低廉且每个纳米颗粒含有数千个稀土离子,极大提高了稀土离子的标记比率,受外源稀土离子的影响小,且不受抗凝剂的影响,适用性更广;4)本发明的方法具有很高的灵敏度,而且可用于复杂血液体系中循环肿瘤细胞的直接检测
附图说明
图1为本发明一个优选实施方式中所述的循环肿瘤细胞的检测原理图。
图2为实施例1制备得到的naeuf4纳米晶的透射电镜图。
图3为实施例1所述的循环肿瘤细胞检测方法对循环肿瘤细胞检测灵敏度的考察。
图4为实施例2所述的循环肿瘤细胞荧光探针对识别循环肿瘤细胞选择性的考察。
图5为实施例3所述的对于复杂血液体系样品中循环肿瘤细胞检测灵敏度的考察。
图6为实施例4所述的循环肿瘤细胞检测方法的潜在临床应用潜力的考察。
具体实施方式
以下结合附图和实施例对本发明作进一步的详细说明。但本领域技术人员了解,本发明的保护范围不仅限于以下实施例。根据本发明公开的内容,本领域技术人员将认识到在不脱离本发明技术方案所给出的技术特征和范围的情况下,对以上所述实施例做出许多变化和修改都属于本发明的保护范围。
以下实施例中,检测所述的透射电镜图的仪器型号为jem-2010,厂家为jeol。
以下实施例中,检测所述荧光信号分子的仪器为荧光酶标仪,型号为synergy4,厂家为biotek。
以下实施例中,pbs缓冲液的组成为:每升缓冲液中含有kcl0.2g,kh2po40.2g,nacl8g,na2hpo4·12h2o3.14g,ph7.4-7.6。
实施例1
对循环肿瘤细胞检测灵敏度的考察
1.实验所需的naeuf4循环肿瘤细胞荧光检测探针的制备方法:
1)称量50mg的paa,并将其溶解在1ml超纯水中,使其终浓度达到50mg/ml。随后加入1ml浓度20mg/ml的naeuf4纳米颗粒悬浮液(相当于加入纳米颗粒20mg),待超声波震荡半小时并混合均匀后,旋转过夜。离心并保留沉淀,最后溶于1ml超纯水中,配制成浓度为20mg/ml的naeuf4-paa悬浮液,室温保存备用。
2)将edc6mg、nhs14mg加入1ml浓度为20mg/ml的naeuf4-paa悬浮液中搅拌均匀,离心去上清,加入超纯水,混合均匀离心,然后将20μl浓度为1mg/ml的epcam抗体(相当于加入epcam0.02mg)加入到1ml浓度为20mg/ml的naeuf4-paa溶液中,4℃旋转2h,离心并溶解于1mlhepes缓冲液(50mm,ph7.4)中,得到naeuf4标记的循环肿瘤细胞荧光检测探针,于4℃保存备用。
图2给出了本实施例制备得到的naeuf4纳米晶的透射电镜图。
由图可知,所制得的纳米晶尺寸分布均一(粒径为19.5±0.8nm),且结晶性良好。
2.配制增强液
称取1gtritonx-100,26.6mg萘甲酰三氟丙酮,193mg三正辛基氧膦,加入蒸馏水定容至1l,用稀hcl调节ph2.3,备用。
3.考察naeuf4纳米晶荧光放大体系测定循环肿瘤细胞标准溶液的灵敏度,包括如下步骤:
1)包被:用0.05mol/l的碳酸盐缓冲液将捕获探针epcam抗体稀释至10μg/ml,在96孔聚苯乙烯板中,每孔加入100μl,37℃孵育1小时,弃去孔内液体,用pbs洗涤缓冲液洗3次。
2)封闭:用pbs缓冲液配制bsa溶液(2%w/v),每孔加入300μl,37℃孵育1小时,弃去孔内液体,用pbs洗涤缓冲液洗3次。
3)加样:培养mcf-7细胞,待其生长到一定数目,利用胰蛋白酶进行消化并收集细胞,用pbs配制成细胞悬浮液。分别将200μl含有2-1024个mcf-7的细胞悬浮液分别加入上述氨基酶标板中,在细胞培养箱中孵育2小时,pbs洗涤三次。
4)加入naeuf4循环肿瘤细胞荧光检测探针:加入用pbs配制的循环肿瘤细胞荧光检测探针(悬浮液中荧光检测探针的终浓度为40μg/ml),孵育1.5小时,pbs洗涤三次。
5)加增强液:每孔加入200μl增强液,采用时间分辨检测荧光信号,具体参数为:激发波长340nm,发射波长616nm,延迟时间和闸门时间被设置为200μs和2ms。
6)绘制标准曲线:以循环肿瘤细胞数目为横坐标,以每一循环肿瘤数目对应的荧光强度为纵坐标,绘制标准曲线。
图3给出了本实施例循环肿瘤细胞的数目与荧光强度的标准曲线。
由图可知,在2-1024个细胞范围内,循环肿瘤细胞的数目与荧光强度成线性相关,以空白平均值加3倍sd计,最低检测限为1个循环肿瘤细胞。
实施例2
对识别循环肿瘤细胞选择性的考察
1.实验所需试剂和仪器与实施例1相同,实验所需naeuf4循环肿瘤细胞荧光检测探针实施例1一致。
2.考察naeuf4纳米晶荧光放大体系测定循环肿瘤细胞的选择性,包括如下步骤:
1)包被:用0.05mol/l的碳酸盐缓冲液将捕获探针epcam抗体稀释至10μg/ml,在96孔聚苯乙烯板中,每孔加入100μl,37℃孵育1小时,弃去孔内液体,用pbs洗涤缓冲液洗3次。
2)封闭:用pbs缓冲液配制bsa溶液(2%w/v),每孔加入300μl,37℃孵育1小时,弃去孔内液体,用pbs洗涤缓冲液洗3次。
3)加样:培养epcam阳性的mcf-7细胞及epcam阴性的hela细胞,待其生长到一定数目,分别利用胰蛋白酶进行消化并收集细胞,用健康人血液配制成细胞悬浮液(5000个/ml)。分别将200μl含有1000个mcf-7及hela细胞的细胞悬浮液加入上述氨基酶标板中,在细胞培养箱中孵育2小时,pbs洗涤三次。
4)加入循环肿瘤细胞荧光检测探针:加入用pbs配制的循环肿瘤细胞荧光检测探针(悬浮液中荧光检测探针的终浓度为40μg/ml),孵育1.5小时,pbs洗涤三次。
5)加增强液:每孔加入200μl增强液,采用时间分辨荧光分析检测荧光信号,具体参数为:激发波长340nm,发射波长616nm,延迟时间和闸门时间被设置为200μs和2ms。
6)绘制荧光强度f-f0柱状图,其是以每种细胞的名称为横坐标,以每种靶标所得的荧光强度为纵坐标,其中,f是靶标荧光测定值,f0是背景荧光值,荧光强度f-f0用来反应不同靶标荧光值和背景值的变化,绘制柱状图。
图4给出了本实施例所述的识别循环肿瘤细胞的选择性的考察结果。
由图4可知,epcam阳性的mcf-7细胞及epcam阴性的hela细胞的荧光强度相比,二者的荧光强度有极显著差异,说明我们构建的的循环肿瘤细胞检测方案具有高特异性和良好的选择性。
实施例3
本实施例所述的方法对于复杂血液体系样品中循环肿瘤细胞检测灵敏度的考察
1.实验所需试剂和仪器与实施例1相同,实验所需naeuf4循环肿瘤细胞荧光检测探针实施例1一致。
2.复杂血液体系实验所使用的模型基质为健康血液样本。
3.考察naeuf4纳米晶荧光放大体系测定血液样本中循环肿瘤细胞的灵敏度,包括如下步骤:
1)包被:用0.05mol/l的碳酸盐缓冲液将捕获探针epcam抗体稀释至10μg/ml,在96孔聚苯乙烯板中,每孔加入100μl,37℃孵育1小时,弃去孔内液体,用pbs洗涤缓冲液洗3次。
2)封闭:用pbs缓冲液配制bsa溶液(2%w/v),每孔加入300μl,37℃孵育1小时,去孔内液体,用pbs洗涤缓冲液洗3次。
3)加样:培养mcf-7细胞,待其生长到一定数目,利用胰蛋白酶进行消化并收集细胞,用健康血液配制成细胞悬浮液来模拟血液循环肿瘤细胞。分别将200μl含有2-1024个mcf-7的细胞悬浮液加入上述氨基酶标板中,在细胞培养箱中孵育2小时,pbs洗涤三次。
4)加入循环肿瘤细胞荧光检测探针:加入用pbs配制的循环肿瘤细胞检测荧光探针(40μg/ml),孵育1.5小时,pbs洗涤三次。
5)加增强液:每孔加入200μl增强液,采用时间分辨检测荧光信号,具体参数为:激发波长340nm,发射波长616nm,延迟时间和闸门时间被设置为200μs和2ms。
6)绘制标准曲线:以循环肿瘤细胞数目为横坐标,以每一循环肿瘤数目对应的荧光强度为纵坐标,绘制标准曲线。
图5给出了本实施例循环肿瘤细胞的数目与荧光强度的标准曲线。
对于循环肿瘤细胞检测而言,主要的挑战是血液中复杂的生理环境和过少的循环肿瘤细胞数目。因此,我们将不同数目(2-1024)的mcf-7细胞加入健康血液中来模拟循环肿瘤细胞所处的复杂血液环境。接着,不经过任何预处理及富集作用,直接利用我们的循环肿瘤细胞检测方案对其进行检测。检测结果如图所示,在对于血液中的mcf-7细胞而言,细胞数目与荧光强度仍然呈现出正相关系,在2-1024个细胞之间具有良好的检测线性范围,以空白平均值加3倍sd计算检测限低至1个细胞。以上结果证明,在无任何富集手段及预处理的条件下,我们建立的循环肿瘤细胞检测方案可直接在血液中高灵敏度地检测到循环肿瘤细胞。
实施例4
本实施例所述的循环肿瘤细胞检测方法的潜在临床应用潜力的考察
1.实验所需试剂和仪器与实施例1相同,实验所需naeuf4循环肿瘤细胞荧光检测探针实施例1一致。
2.所使用的检测基质为15例乳腺癌患者血液样本。
3.实验所使用的标准工作曲线和实施例3实验方法一致。
4.考察naeuf4纳米晶荧光放大体系测定血液样本中循环肿瘤细胞的灵敏度,包括如下步骤:
1)包被:用0.05mol/l的碳酸盐缓冲液将捕获探针epcam抗体稀释至10μg/ml,在96孔聚苯乙烯板中,每孔加入100μl,37℃孵育1小时,弃去孔内液体,用pbs洗涤缓冲液洗3次。
2)封闭:用pbs缓冲液配制bsa溶液(2%w/v),每孔加入300μl,37℃孵育1小时,去孔内液体,用pbs洗涤缓冲液洗3次。
3)加样:将200μl血样加入上述氨基酶标板中,在细胞培养箱中孵育2小时,pbs洗涤三次。
4)加入检测探针naeuf4-ab:加入用pbs配制的循环肿瘤细胞荧光检测探针(40μg/ml),孵育1.5小时,pbs洗涤三次。
5)加增强液:每孔加入200μl增强液,采用时间分辨检测荧光信号,具体参数为:激发波长340nm,发射波长616nm,延迟时间和闸门时间被设置为200μs和2ms。
6)测定患者血样中的循环肿瘤细胞数目:以实施例3所得的工作曲线为标准曲线,计算患者血液样本所对应的循环肿瘤细胞数目。
所述计算方法为:将已知浓度为患者血液样本的测定荧光值带入标准曲线拟合公式:循环肿瘤细胞数目=2^((荧光强度+479.13565)/482.54485)即可求出循环肿瘤细胞数目。
经检测,15例患者中14例癌症患者检测到了循环肿瘤细胞,检出率为93.9%。如图6所示,然后我们分析了血液循环肿瘤细胞水平与癌症进展的相关性。14例癌症患者按照临床病理分析确定的癌症分期分为4组,即早期(3例)、中期(5例)、晚期(3例)和未知病理期(3例)。我们发现患者在中期(约15-190个细胞/ml)循环肿瘤细胞水平较高,早期(约10个细胞/ml)或晚期(约15-20个细胞/ml)循环肿瘤细胞水平相对较低。
需要指出的是,epcam表达的异质性可能影响循环肿瘤细胞的检测,尤其是对于可能下调epcam表达的晚期癌症患者。可通过选用其他特异性强的抗体,将其纳米探针功能化,使其具有多种合适的抗体,扩大本发明检测试剂盒和检测方法的适用范围,减小抗体种类的限制。尽管如此,我们成功地建立了一种新的循环肿瘤检测体系,无需任何常用的循环肿瘤细胞富集步骤,即可在真实血液中直接检测循环肿瘤细胞,并且这种时间分辨光致发光光谱trpl检测策略可以应用于多种癌症的精确诊断和预后。
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!