用于预测急性肝衰竭预后的标志物在制备预测急性肝衰竭预后评估试剂盒中的应用的制作方法
本发明涉及生物医学技术领域,具体涉及itih3和apo-c1在制备预测急性肝衰竭预后评估elisa试剂盒中的应用。
背景技术:
急性慢性肝功能衰竭(aclf)是属于乙型肝炎病毒感染住院后发生器官衰竭的肝硬化患者亚组的病症。hbv相关的aclf是肝功能衰竭的首要危险因素[1-3]。炎症疾病被认为是aclf发展的主要因素,尽管这种病症的病理生理学仍不清楚[4,5]。aclf的特征是快速进展,导致短期和中期死亡率高达50-90%[6]。该综合征的结果通过全身心脏和肝脏血流动力学来估计[7,8]。然而,如果aclf患者接受适当的治疗,其可能恢复原始肝功能状态的[9-11]。对于预测高死亡率aclf患者的预后或最佳治疗的发展因素存在迫切需求。
遗憾的是,在标准治疗程序后,尚未报道有效标志物预测aclf患者的预后。以前的大多数研究都集中在靶向分子作为预测aclf预后的潜在因素,尤其是炎症因子[12-14]。然而,其他独立研究中只有少数人得到了支持。
hbv引发的aclf是中国肝功能衰竭的主要类型,也是肝病患者死亡的主要原因[23]。中华医学会(cma)于2006年制定了肝衰竭诊断和治疗指南,并于2012年更新了修订版[24]。然而,aclf在中国肝衰竭诊断和治疗指南中的定义和治疗策略与美国和欧洲不同。可用评分系统的表现也被证明不适合中国的aclf患者,包括meld、sofa和apache[25-27]。不幸的是,很大一部分与hbv相关的aclf患者对标准治疗的反应较差,并且在住院后不久死亡。因此,寻找新的生物标志物来预测aclf患者的预后具有重要价值。
在过去几十年中,已经做出巨大努力来开发hbv-aclf的早期诊断和预后生物标志物。然而,它们大多数是炎症因子和/或免疫相关因子(il-6,il-8,sirs,solubest2,胱抑素c,中性粒细胞明胶酶相关脂质运载蛋白),这可能与各种病症有关,而不是hbv-aclf导致实用性差[28-32]。蛋白质组学是发现潜在的生物标志物有力技术,广泛用于肿瘤,心血管疾病和其他器官功能障碍[15-20]。然而,只有两个研究小组对hbv相关aclf的预后标志物进行了蛋白质组学研究,其中一个使用双向电泳(2-de),另一个使用同量异位标签进行相对和绝对定量(itraq)技术[21,22]。
2010年,ren等人在正常,慢性乙型肝炎和aclf样本中通过2-de鉴定了23种差异表达蛋白,并进一步验证了α-1-酸性糖蛋白可能作为hbv感染预后的候选标记[21]。2017年,zhou等人对来自健康对照,慢性乙型肝炎和hbv-aclf患者的血浆进行了高通量itraq分析,鉴定了42种差异表达的蛋白质,并进一步证实了6种蛋白质作为潜在的hbv-aclf生物标志物候选物的表达水平差异[22]。然而,他们两人都没有将蛋白质组数据与治疗后的结果联系起来。
参考文献:
[1]sarin,s.k.;kumar,a.;almeida,j.a.;chawla,y.k.;fan,s.t.;garg,h.;etal.acute-onchronicliverfailure:consensusrecommendationsoftheasianpacificassociationforthestudyoftheliver(apasl).hepatolint2009,3,269–282.
[2]olson,j.c.;wendon,j.a.;kramer,d.j.;vicente,a.;jalan,r.;garcia-tsao,g.;etal.intensivecareofthepatientwithcirrhosis.hepatology2011,54,1864–1872.
[3]jalan,r.;stadlbauer,v.;sen,s.;mookerjee,r.;davies,n.;hodges,s.;etal.naturalhistoryofacutedecompensationofcirrhosis:thebasisofthedefinition,prognosis,andpathophysiologyofacute-on-chronicliverfailure.hepatology2006,44,371a–372a.
[4]wang,k.;wu,z.b.;ye,y.n.;liu,j.;zhang,g.l.;su,y.j.;etal.plasmainterleukin-10:alikelypredictivemarkerforhepatitisbvirus-relatedacute-on-chronicliverfailure.hepatmon2014,14,e19370.doi:10.5812/hepatmon.19370.
[5]joseph,s.b.;castrillo,a.;laffitte,b.a.;mangelsdorf,d.j.;tontonoz,p.;reciprocalregulationofinflammationandlipidmetabolismbyliverxreceptors.natmed2003,9,213–219.
[6]jalan,r.;williams,r.acute-on-chronicliverfailure:pathophysiologicalbasisoftherapeuticoptions.bloodpurif2002,20,252–261.
[7]s-hawcross,d.l.;austin,m.j.;abeles,r.d.;mcphail,m.j.;yeoman,a.d.;taylor,n.j.;etal.theimpactoforgandysfunctionincirrhosis:survivalatacost?jhepatol2012,56,1054–1062.
[8]levesque,e.;hoti,e.;azoulay,d.;
[9]chien,r.n.;lin,c.h.;liaw,y.f.theeffectoflamivudinetherapyinhepaticdecompensationduringacuteexacerbationofchronichepatitisb.jhepatol2003,38,322–327.
[10]stadlbauer,v.;mookerjee,r.p.;hodges,s.;wright,g.a.;davies,n.a.;jalan,r.effectofprobiotictreatmentonderangedneutrophilfunctionandcytokineresponsesinpatientswithcompensatedalcoholiccirrhosis.jhepatol2008,48,945–951.
[11]fernández,j.;escorsell,a.;zabalza,m.;felipe,v.;navasa,m.;mas,a.;etal.adrenalinsufficiencyinpatientswithcirrhosisandseptics-hock:effectoftreatmentwithhydrocortisoneonsurvival.hepatology2006,44,1288–1295.
[12]lópez-velázquez,j.a.;chávez-tapia,n.c.;ponciano-rodríguez,g.;sánchez-valle,v.;caldwell,s.h.;uribe,m.;etal.bilirubinaloneasabiomarkerfors-hort-termmortalityinacute-on-chronicliverfailure:animportantprognosticindicator.,annhepatol,2013,13,98–104.
[13]liu,y.;han,t.;zhu,z.y.;li,y.thymosinβ4:anovelassessedbiomarkeroftheprognosisofacute-on-chronicliverfailurepatient?clinreshepatolgastroenterol2014,38,310–317.
[14]zhang,g.l.;zhang,t.;ye,y.n.;liu,j.;zhang,x.h.;xie,c.;etal.complementfactor3couldbeanindependentriskfactorformortalityinpatientswithhbvrelatedacute-on-chronicliverfailure.biomedresint2016,2016,3524842.doi:10.1155/2016/3524842.
[15]kisluk,j.;ciborowski,m.;niemira,m.;kretowski,a.;niklinski,j.proteomicsbiomarkersfornon-smallcelllungcancer.jpharmbiomedanal2014,101,40–49.doi:10.1016/j.jpba.2014.07.038.
[16]sallam,r.m.proteomicsincancerbiomarkersdiscovery:challengesandapplications.dismarkers2015,2015,321370.doi:10.1155/2015/321370.
[17]gregorich,z.r.;ge,y.top-downproteomicsinhealthanddisease:challengesandopportunities.proteomics2014,14,1195–1210.doi:10.1002/pmic.201300432.
[18]singh,s.a.;aikawa,e.;aikawa,m.currenttrendsandfutureperspectivesofstate-of-the-artproteomicstechnologiesappliedtocardiovasculardiseaseresearch.circj2016,80,1674–1683.doi:10.1253/circj.cj-16-0499.
[19]yang,q.;lu,h.;song,x.;li,s.;wei,w.itraq-basedproteomicsinvestigationofaqueoushumorfrompatientswithcoats'disease.plosone2016,11,e0158611.
[20]li,n.;xu,z.;zhai,l.;li,y.;fan,f.;zheng,j.;etal.rapiddevelopmentofproteomicsinchina:fromtheperspectiveofthehumanliverproteomeprojectandtechnologydevelopment.scichinalifesci2014,57,1162–1171.
[21]ren,f.;chen,y.;wang,y.;yan,y.;zhao,j.;ding,m.;etal.comparativeserumproteomicanalysisofpatientswithacute-on-chronicliverfailure:alpha-1-acidglycoproteinmaybeacandidatemarkerforprognosisofhepatitisbvirusinfection.jviralhepat2010,17,816–824.
[22]zhou,n.;wang,k.;fang,s.;zhao,x.;huang,t.;chen,h.;etal.discoveryofapotentialplasmaproteinbiomarkerpanelforacute-on-chronicliverfailureinducedbyhepatitisbvirus.frontphysiol2017,8,1009.doi:10.3389/fphys.2017.01009.
[23]sarin,s.k.;kumar,m.;lau,g.k.;abbas,z.;chan,h.l.;chen,c.j.;etal.asian-pacificclinicalpracticeguidelinesonthemanagementofhepatitisb:a2015update.hepatolint2016,10,1–98.
[24]liverfailureandartificiallivergroup,chinesesocietyofinfectiousdiseases,chinesemedicalassociation;severeliverdiseasesandartificiallivergroup,chinesesocietyofhepatology,chinesemedicalassociation.themanagementofliverfailure:update2012.jclinhepatol2013,3,210–216.
[25]kamath,p.s.;wiesner,r.h.;malinchoc,m.;kremers,w.;therneau,t.m.;kosberg,c.l.;etal.amodeltopredictsurvivalinpatientswithend-stageliverdisease.hepatology2001,33,464–470.
[26]vincent,j.l.;moreno,r.;takala,j.;willatts,s.;demendonca,a.;bruining,h.;etal.thesofa(sepsis-relatedorganfailureassessment)scoretodescribeorgandysfunction/failure.onbehalfoftheworkinggrouponsepsis-relatedproblemsoftheeuropeansocietyofintensivecaremedicine.intensivecaremed1996,22,707–710.
[27]knaus,w.a.;draper,e.a.;wagner,d.p.;zimmerman,j.e.apacheii:aseverityofdiseaseclassificationsystem.critcaremed1985,13,818–829.
[28]gustott.multipleorganfailureinsepsis:prognosisandroleofsystemicinflammatoryresponse.curropincritcare2011,17,153–159.
[29]cazzaniga,m.;dionigi,e.;gobbo,g.;fioretti,a.;monti,v.;salerno,f.thesystemicinflammatoryresponsesyndromeincirrhoticpatients:relationshipwiththeirin-hospitaloutcome.jhepatol2009,51,475–482.
[30]jiang,s.w.;wang,p.;xiang,x.g.;mo,r.d.;lin,l.y.;bao,s.s.etal.serumsolublest2isapromisingprognosticbiomarkerinhbv-relatedacute-on-chronicliverfailure.hepatobiliarypancreatdisint2017,16,181–188.
[31]wan,z.h.;wang,j.j.;you,s.l.;liu,h.l.;zhu,b.;zang,h.;etal.cystatincisabiomarkerforpredictingacutekidneyinjuryinpatientswithacute-on-chronicliverfailure.worldjgastroenterol2013,19,9432–9438.
[32]arizax,grauperai,collm,solàe,barretor,garcíae,etal.neutrophilgelatinase-associatedlipocalinisabiomarkerofacute-on-chronicliverfailureandprognosisincirrhosis.jhepatol2016,65,57–65.
[33]caldwell,s.h.;hoffman,m.;lisman,t.;macik,b.g.;northup,p.g.;reddy,k.r.;etal.coagulationdisordersandhemostasisinliverdisease:pathophysiologyandcriticalassessmentofcurrentmanagement.tripodia,sanyalaj;coagulationinliverdiseasegroup.hepatology2006,44,1039–1046.
[34]chen,e.q.;wang,m.l.;zhang,d.m.;shi,y.;wu,d.b.;yan,l.b.;etal.plasmaapolipoproteina-vpredictslong-termsurvivalinchronichepatitisbpatientswithacute-on-chronicliverfailure.scirep2017,7,45576.doi:10.1038/srep45576.
[35]malmendier,c.l.;lontie,j.f.;mathé,d.;adam,r.;bismuth,h.lipidandapolipoproteinchangesafterorthotopiclivertransplantationforend-stageliverdiseases.clinchimacta1992,209,169–177.
[36]miyata,y.;koga,s.;ibayashi,h.alterationsinplasmalevelsofapolipoproteina-ivinvariousclinicalentities.gastroenteroljpn1986,21,479–485.
[37]peng,l.;liu,j.;li,y.m.;huang,z.l.;wang,p.p.;gu,y.r.;etal.serumproteomicsanalysisandcomparisonsusingitraqintheprogressionofhepatitisb.expthermed2013,6,1169–1176.
[38]wu,s.h.;li,j.;jin,x.itraq-basedquantitativeproteomicanalysisrevealsimportantmetabolicpathwaysforarsenic-inducedliverfbrosisinrats.scirep2018,8,3267.doi:10.1038/s41598-018-21580-x.
[39]zheng,q.;wang,x.goeast:aweb-basedsoftwaretoolkitforgeneontologyenrichmentanalysis.nucleicacidsres2008,36,w358–w363.
[40]szklarczyk,d.;morris,j.h.;cook,h.;kuhn,m.;wyder,s.;simonovic,m.;etal.thestringdatabasein2017:quality-controlledprotein-proteinassociationnetworks,madebroadlyaccessible.nucleicacidsres2017,45,d362–d368.
技术实现要素:
针对现有技术的不足,本发明旨在提供一种用于预测急性肝衰竭预后的标志物在制备预测急性肝衰竭预后评估试剂盒中的应用。
为了实现上述目的,本发明采用如下技术方案:
用于预测急性肝衰竭预后的标志物在制备预测急性肝衰竭预后评估试剂盒中的应用,所述用于预测急性肝衰竭预后的标志物包括补体因子b、血浆蛋白酶c1抑制剂、凝血因子xii和载脂蛋白c-1。
本发明的有益效果在于:本发明首次提出的hbv-aclf比较蛋白质组学分析为住院当天和治疗后4周的hbv-aclf患者提供了生存和死亡患者的高通量itraq分析,为具有完全不同预后的hbv相关aclf患者的蛋白质组谱提供了新的见解,并确定了四种蛋白质——补体因子b(cfb)、血浆蛋白酶c1抑制剂(ppc1)、凝血因子xii(cf12)和载脂蛋白c-1(apo-ci)可以作为hbv-aclf的预后生物标志物。
附图说明
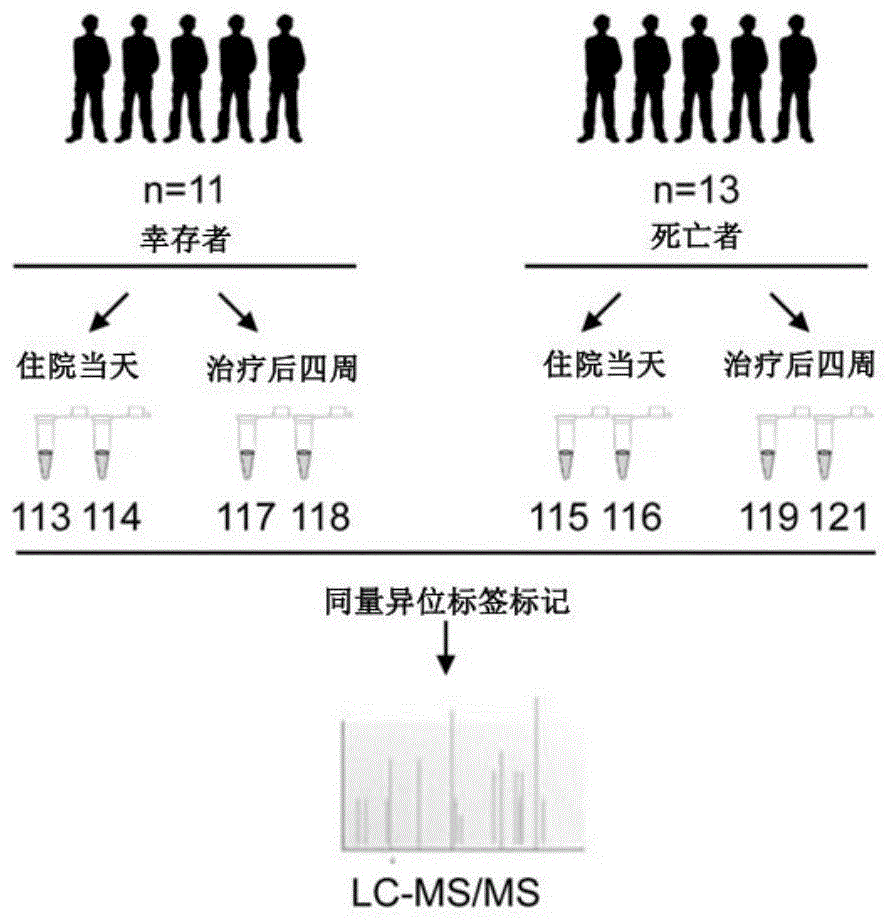
图1为本实施例2中研究生存组和死亡组hbv-aclf患者的蛋白质组谱的实验流程示意图;
图2为本实施例2中从s-h与d-h,s-f与d-f,s-h与s-f和d-h与d-f中鉴定的dep的火山图;
图3为本实施例2中从s-h与d-h,s-f与d-f,s-h与s-f和d-h与d-f鉴定的所有dep的维恩图和热图分析;
图4为本实施例2中从s-h与d-h,s-f与d-f,s-h与s-f和d-h与d-f鉴定的dep的kegg途径富集分析结果示意图;
图5为本实施例2中细胞成分类别的s-h与d-hdep的途径富集分析示意图;
图6为本实施例2中对s-h与d-h(a),s-f与d-f(b)的dap的蛋白质-蛋白质相互作用(ppi)网络分析示意图;
图7为本实施例2中对筛选出的差异基因扩大样本后的roc分析的结果示意图。
具体实施方式
以下将结合附图对本发明作进一步的描述,需要说明的是,本实施例以本技术方案为前提,给出了详细的实施方式和具体的操作过程,但本发明的保护范围并不限于本实施例。
实施例1
本实施例提供用于预测急性肝衰竭预后的标志物在制备预测急性肝衰竭预后评估试剂盒中的应用,所述用于预测急性肝衰竭预后的标志物包括补体因子b、血浆蛋白酶c1抑制剂、凝血因子xii和载脂蛋白c-1。
通过所述试剂盒,可以检测hbv-aclf患者的血清的补体因子b、血浆蛋白酶c1抑制剂、凝血因子xii和载脂蛋白c-1表达水平,从而可以对急性肝衰竭预后进行预测。
实施例2
本实施例通过实验对实施例1的技术方案进行验证。
一、hbv-aclf患者的实验设计及临床特征
根据纳入排除标准筛选,24名患者参与了这项研究,包括11名生存者(s组)和13名死亡者(d组)。这些患者的临床特征如表1所示。
表1与hbv相关的aclf患者的临床信息
*,p值<0.05;**,p值<0.01。白细胞,全血细胞;plt,血小板;alt,谷氨酸-丙酮酸转氨酶;tbil,总billrubin;che,胆碱酯酶;白蛋白;cr,肌酐;pt,凝血酶原时间;pta,凝血酶原活性;inr,国际标准化凝血时间比;fib,纤维蛋白原;儿童,儿童-turcotte-pugh;meld,终末期肝病的模型。
从表1可以看出,除凝血酶原时间(pts,p=0.021),国际标准化比率(inr,p=0.008)和终末期肝病模型(meld,p=0.001)外,所有检查因素在生存组和死亡组之间均无显著性。
本实施例中,实验工作流程如图1所示。在高丰度蛋白质耗尽后,将住院当天获得的s组血清蛋白样品(s-h)分成两个合并的重复样品,并标记113和114标签。115和116标签用于标记住院当天获得的d组血清蛋白样品(d-h)所分成的两个合并的重复样品。而治疗后4周的s组样品(s-f)为117和118,d组样品(d-f)为119和121。然后将同量异位标签标记的肽放在一起进行高通量lc-ms/ms分析。
二、由itraq鉴定的差异表达的蛋白质
通过itraq鉴定了总共519种蛋白质,其中280种被认为是高质量的定量蛋白质(95%具有定量信息≥2的机密肽)。将显著的差异表达阈值设定为至少2倍的变化并且p<0.05。火山图显示了s-h和d-h样品之间(图2a)、s-f和d-f之间(图2b)、s-h和s-f之间(图2c)、d-h和d-f之间(图2d)的所有高质量蛋白质的分布模式。显著的蛋白质表示为浅色斑点,而非显著的蛋白质表示为深色斑点。
鉴定了111个差异表达蛋白(dep),其中在s-h和d-h之间鉴定出42个dep,在s-f和d-f之间鉴定出55个,在s-h和s-f之间鉴定51个,在d-h和d-f之间鉴定了36个,如图3a所示。还提供了所有111个dep的热图,如图3b所示。在d-h和d-f样品之间鉴定出最少的dep(36),表明这些患者的不良治疗结果。
三、deps的生物信息学分析
值得注意的是,在s-h与d-h和s-f与d-f的dep中可同时鉴定出六种蛋白质,而在s-h与s-f和d-s与d-f的dep中未观察到(如图3a所示),这六种蛋白质分别为补体因子h、α间胰蛋白酶抑制剂重链h3、补体因子b、血浆蛋白酶c1抑制剂、凝血因子xii和载脂蛋白c-1。这六种蛋白质应该在s组和d组患者之间连续差异表达水平,不仅在住院当天,而且在治疗后4周,表明它们在存活和死亡hbv-aclf患者之间稳定差异表达。因此,六种蛋白质可被认为是预测hbv-aclf患者预后的候选标志物。在六种潜在的候选标志物中,补体因子h和α间胰蛋白酶抑制剂重链h3在s组中治疗四周后表现出降低的表达水平,表明它们在治疗前后的不稳定水平。然而,补体因子b、血浆蛋白酶c1抑制剂、凝血因子xii和载脂蛋白c-1在s组和d组中均显示治疗前后的非显著表达水平,表明它们是有希望的候选标志物。六种潜在的候选标志物的蛋白质鉴定信息如表2所示
表2
1每组的平均归一化表达水平。
为了更好地理解这些dep的功能,本实施例进行了kegg本体论,基因本体论(go)和蛋白质-蛋白质相互作用网络(ppi)分析。kegg途径富集分析显示,最丰富的途径(测试组百分比与参考设定百分比相比)是s-h对d-h、s-f对d-fs-h对s-f的补体和凝血级联,分别如图4a-4c所示,而非洲锥虫病为ds对d-f,如图4d所示。该结果再次表明死亡组对标准治疗例程具有不同的反应。
考虑到实验设计,s-h和d-h之间的dep具有最重要的生物学价值,用于预测hbv-aclf患者的预后。对于细胞成分类别,s-h与d-h之间的dep的go富集分析如图5所示。go术语的树视图的分支末端是血红蛋白复合物(go:0005833)、内吞囊泡腔(go:0071682)、突触小泡(go:0008021)、树突(go:0030425)、基底外侧血浆(go:0016323)和膜筏(go:0045121),表明生存和死亡hbv-aclf患者的蛋白质组谱之间最显著的差异。诊断位于囊泡和膜相关的细胞成分中。
图5中,显著富集的(fdrp值<0.05)go术语显示在彩色框中。黄色的成熟与每个术语的显著性水平相关。箭头类型的含义如下:红色箭头表示两个重要的术语;黑色箭头表示一个重要术语和一个非重要术语;黑色虚线箭头链接两个非重要的术语。
特殊dep组的蛋白质-蛋白质相互作用网络可以反映影响血清样品的感兴趣的生物因子的模式。为了本实施例的目的,显示了s-h与d-h、s-f与d-f的ppi分析,分别如图6a和图6b所示,图6中,将所需的最低交互分数设置为string数据库中的最高置信度(0.900),并隐藏网络中的断开连接的节点。与囊泡和膜细胞成分相关的蛋白质在治疗前后具有s组和d组之间dep的关键节点。值得注意的是,补体和凝血相关蛋白也在网络中显示出重要作用。
四、筛选出的差异基因扩大样本后的roc分析
扩大样本量(死亡n=10,生存n=9),采用elisa法验证了8个因子proteins、itih4、itih3、f12、cfh、cfb、apo-e、apo-c1在血清中的表达水平,如图7所示。
图7中,图7a所示为apo-c1在生存组与死亡组的分布,图7b所示为proteins在生存组与死亡组的分布,图7c所示为itih3在生存组与死亡组的分布。*,p<0.05。生存组与死亡组使用student'st检验。数据是apo-c1、proteins、itih3的平均值±sd表达。图7d所示为itih3roc曲线,曲线下面积(auc)为82.22%。图7e所示为apo-c1roc曲线,曲线下面积(auc)为77.78%。图7f为proteins的roc曲线,曲线下面积(auc)为75.56%。图7g所示为itih3+apo-c1双因子联合分析的roc曲线,曲线下面积(auc)为92.22%
从图7可以看出,有三个因子的roc曲线与预后存在显著相关性,曲线下面积大于0.75,所述三个因子分别为proteins、itih3、apo-c1。通过进一步做了双因子的关联分析,发现itih3、apo-c1双因子的关联分析的roc曲线与急性慢性肝衰竭预后存在极显著相关性,曲线下面积为0.922。数据表明itih3、apo-c1联合分析可以良好的预测急性肝衰竭预后。
五、总结
本实施例中,首次提出的hbv-aclf比较蛋白质组学分析为住院当天和治疗后4周的hbv-aclf患者提供了生存和死亡患者的高通量itraq分析。该实验设计将有助于鉴定与hbv-aclf患者标准治疗后预后性能相关的新蛋白质。
本实施例中,从存活和死亡hbv-aclf患者血浆中鉴定出518种蛋白质,这比其他任何研究都要多。严格的阈值条件(95%机密肽,定量信息≥2)用于蛋白质鉴定,以确保后续分析的可靠性,产生280种高质量蛋白质。分别在s-h与d-h,s-f与d-f,s-h与s-f、d-h与d-f之间鉴定出42,55,51和36个dep。在d-h和d-f样品之间鉴定出最少的dep(36),表明这些患者的不良治疗结果。然而,在s-h与d-h、s-f与d-f中不同表达的六种蛋白质显示出可用于预测hbv-aclf预后的潜力。
在s组和d组中,四种蛋白质——补体因子b(cfb)、血浆蛋白酶c1抑制剂(ppc1)、凝血因子xii(cf12)和载脂蛋白c-1(apo-ci)在治疗前后均表现出稳定的表达水平,并且在s组和d组之间差异表达,这使得它们成为预测hbv-预后的理想生物标志物候选物。
据报道,补体因子3是hbv-aclf患者死亡率的独立危险因素[14]。凝血障碍和止血在肝脏疾病中起重要作用[33]。已报道载脂蛋白涉及各种形式的肝病和肝移植,尤其是载脂蛋白a-v和a-iv[34-36]。此外,另一项基于itraq的蛋白质组学分析显示,乙型肝炎进展中补体因子和载脂蛋白参与肝功能衰竭[37]。
s-h与d-h的dep的生物信息学分析显示,补体和凝血级联是最显著富集的途径,这与先前的研究一致。此外,d-h与d-f的dep显示与其他dep不同的go和kegg功能分布模式,以及不同的ppi网络结构,表明该组患者的血浆蛋白质组谱与标准后的其他组相比发生了不同的变化。这一现象暗示了开发新型生物标志物候选物用于预测hbv-aclf预后的重要性。
六、材料与方法
6.1临床样本
2014年1月至2017年2月,共有45名hbv-aclf患者入选新疆医科大学附属中医医院肝病科。排除后,根据治疗结果,选择24例患者进行高通量蛋白质组学研究,其中11例为生存组,13例为死亡组。所有患者均根据肝功能衰竭的诊断和治疗指南(2012版)接受标准治疗。在住院当天(h)和治疗四周后(f)获得每位患者的血浆样品。
本实施例中的研究经新疆维吾尔自治区中医药伦理委员会批准(伦理委员会文件号:2013xe0137)。在注册之前,所有参与者都获得了书面知情同意书。
6.2、蛋白质提取和itraq分析
如前所述进行蛋白质提取,胰蛋白酶消化和itraq标记[38]。简而言之,使用proteo
通过高效液相色谱(hplc)(ultimate3000,dionex,thermo,s-hanghai,china)将fasp消化后的肽分成15个级分。在ms/ms分析之前,通过离线级分收集器和c18cartridge(sigma,s-hanghai,china)收集洗脱的肽级分并脱盐。使用absciextripletof5600plus质谱仪系统(absciex,s-hanghai,china)进行ms分析。
蛋白质通过proteinpilottm5.0鉴定。根据从uniprot(2017年10月1日)下载的智人蛋白质数据库自动搜索获得的数据。蛋白质的置信度阈值(未使用的protscore)设定为超过1.3。同时,超过2个匹配的肽具有95%置信区间用于蛋白质鉴定。
6.3、生物信息学分析
使用blast2go将所有鉴定的蛋白质定位于基因本体。go术语富集分析由goeast[39]进行。使用string分析蛋白质-蛋白质相互作用网络[40]。
6.4、统计分析
使用proteinpilottm5.0(absciex,s-hanghai,china)分析itraq数据,阈值为95%机密肽≥2(未使用分数>1.3)。所有统计分析均通过spss20.0进行。当p值<0.05且倍数变化>2时,确定不同的丰富蛋白质。
6.5、elisa实验及roc分析
采用elisa实验方法,扩大样本量(死亡n=10,生存n=9)验证了8个因子proteins、itih4、itih3、f12、cfh、cfb、apo-e、apo-c1的血清中的表达情况,并用spss20.0进行统计学分析。
七、结论
综上,本实施例提出了一种基于itraq的蛋白质组学分析,该分析来自住院当天和治疗后4周的hbv-aclf存活和死亡患者的血浆。确定了总共280种高质量蛋白质并提交给后续分析。kegg、go和ppi的生物信息学分析显示补体和凝血级联是最显著富集的途径。本实施例鉴定了四种蛋白质(cfb,ppc1,cf12和apo-ci),它们在治疗前后生存组和死亡组之间表现出稳定的不同表达水平,表明它们可能成为预测hbv-aclf预后的生物标志物候选物。本实施例中的数据为具有完全不同预后的hbv相关aclf患者的蛋白质组谱提供了新的见解,并确定了四种蛋白质作为hbv-aclf的预后生物标志物。
对于本领域的技术人员来说,可以根据以上的技术方案和构思,给出各种相应的改变和变形,而所有的这些改变和变形,都应该包括在本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!