一种同时检测基质金属蛋白酶-9和2的系统及其制备方法和应用与流程
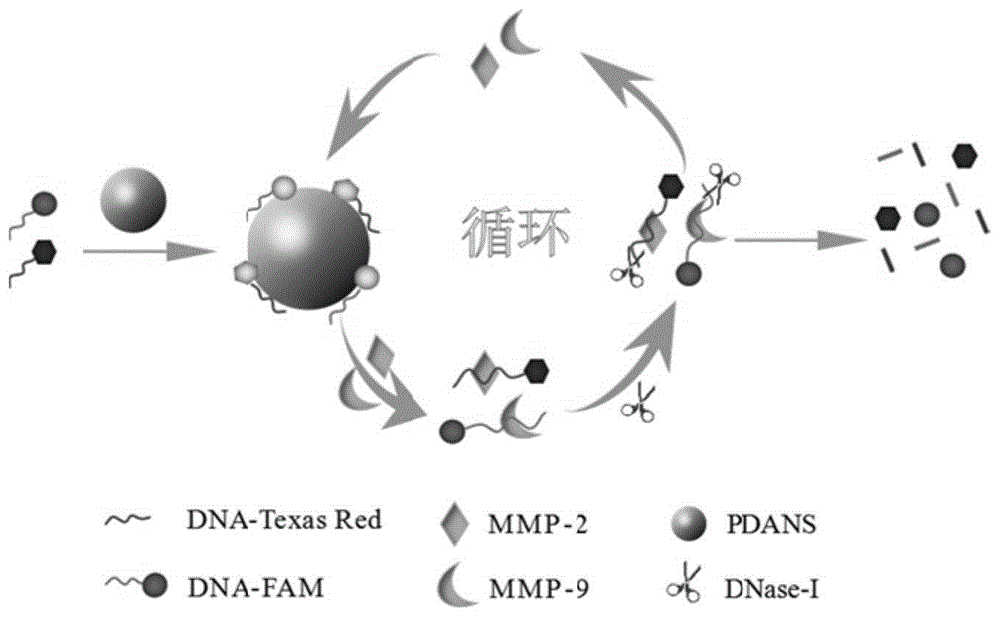
本发明属于生物医学检测领域,具体涉及一种同时检测基质金属蛋白酶-9和2的系统及其制备方法和应用。
背景技术:
:基质金属蛋白酶(mmps)一大类需要锌的酶,包括间质胶原酶、基质蛋白酶、明胶酶等,它们协同降解细胞外基质中的各种蛋白成分,在各种病理生理过程(包括胚胎发育、炎症、伤口愈合和纤维化)以及组织重塑中起着重要作用。其中ⅳ型胶原酶是其重要的一类,表现形式为基质金属蛋白酶-9(mmp-9)和基质金属蛋白酶-2(mmp-2),具有降解iv型基底膜胶原的能力。在肾纤维化发展过程中,肾小管基底膜(tbm)完整性被破坏是导致上皮-间质转化(emt)关键因素,而破坏tbm的两个最主要的蛋白酶便是mmp-9和mmp-2,这两个蛋白主要作用于iv型胶原蛋白,但恰好基底膜的最主要成分便是iv型胶原蛋白,在病理情况下,细胞会不断分泌产生mmp-9和mmp-2,从而导致tbm的破坏,进而促进肾纤维化发展进程。如果能够实现对mmp-9和mmp-2的检测,便一定程度上反映出tbm的完整性,从而可以实现对tbm的检测并加以干预,进一步实现药物预防和阻断emt过程,从而可以有效的缓解整个肾纤维化进程。现有mmp-9或/和mmp-2蛋白含量和活性检测主要通过提取细胞蛋白,组织匀浆蛋白,应用蛋白免疫印迹、免疫染色、凝胶酶谱等方法测定,但这些方法普遍存在步骤繁冗、耗时较长、检测成本较高、需要经过长期训练的技术人员操作等不足。目前血清或者尿液中mmp-9或/和mmp-2含量测定主要还是依赖于elisa试剂盒,极大地限制了mmp-9和mmp-2在临床上的检测。因此亟待发展一种能够实现更快速、特异、灵敏、简单的检测的新工具和新方法。技术实现要素:发明目的:针对现有技术存在的问题,本发明提供一种同时检测基质金属蛋白酶-9和2的系统,该系统可以快速、简便、灵敏度高和选择性高的基于脱氧核糖核酸酶-i(dnase-i)同时检测基质金属蛋白酶-9(mmp-9)和基质金属蛋白酶-2(mmp-2)。本发明还提供了一种同时检测基质金属蛋白酶-9和2的系统的制备方法和应用。技术方案:为了实现上述目的,如本发明所述一种同时检测基质金属蛋白酶-9和2的系统,包括聚多巴胺纳米微球-修饰荧光素的核酸适配体纳米传感器(pdans-aptamers)和脱氧核糖核酸酶;所述聚多巴胺纳米微球-修饰荧光素的核酸适配体纳米传感器由与修饰fam荧光素的基质金属蛋白酶-9(mmp-9)特异性结合的适配体(mmp-9-aptamer-fam)和修饰texasred荧光素的基质金属蛋白酶-2(mmp-2)特异性结合的适配体(mmp-2-aptamer-texasred),加入到聚多巴胺纳米微球(pdans)中形成。其中,所述修饰fam荧光素的基质金属蛋白酶-9特异性结合的适配体,其核苷酸序列如seqidno.1所示:5’-fam-tacggccgcacgaaaaggtgccccataactcaatgccga-3’;所述修饰texasred荧光素的基质金属蛋白酶-2特异性结合的适配体,其核苷酸序列如seqidno.2所示:5’-texasred-tcgccgtgtaggattaggccaggtatgggaacccggtaac-3’。其中,所述聚多巴胺纳米微球由盐酸多巴胺、tris-hcl缓冲液、异丙醇和氨水合成。作为优选,主要包括100mg盐酸多巴胺、100mltris-hcl缓冲液(10mmph7.4)、40ml异丙醇和氨水,ph为8.0。本发明所述的同时检测基质金属蛋白酶-9和2的系统的制备方法,包括如下步骤:(1)将tris-hcl缓冲液和异丙醇中加入氨水;搅拌使得溶液充分混匀;(2)取盐酸多巴胺溶于超纯水中,加入到上述(1)搅拌混匀的溶液中,避光继续搅拌;(3)将步骤(2)得到溶液离心弃去上清液,超纯水溶解沉淀,混匀,离心,弃去上清液,反复直至上清液澄清;(4)离心纯化后,沉淀即为聚多巴胺纳米微球(pdans),冷冻干燥成粉末备用;(5)构建与修饰fam荧光素的基质金属蛋白酶-9(mmp-9-aptamer-fam)特异性结合的适配体(aptamer)与修饰texasred荧光素的基质金属蛋白酶-2(mmp-2-aptamer-texasred)特异性结合的适配体(aptamer),加入到聚多巴胺纳米微球溶液中,混匀,形成聚多巴胺纳米微球-修饰荧光素的核酸适配体(pdans-aptamers)纳米传感器;(6)将基质金属蛋白酶-9(mmp-9)和基质金属蛋白酶-2(mmp-2)以及脱氧核糖核酸酶(dnase-i)加入到pdans-aptamers纳米传感器中反应,mmp-9和mmp-2分别和aptamer特异性结合,aptamer从pdans表面解离下来,dnase-i选择性水解aptamers,释放mmp-9和mmp-2,进行下一轮循环反应;(7)酶标仪读取荧光值,分别建立mmp-9和mmp-2浓度与荧光值的线性标曲得到同时检测基质金属蛋白酶-9和2的系统。其中,步骤(5)中所述聚多巴胺纳米微球(pdans)溶液浓度为0.3-0.6mg/ml,mmp-9-aptamer-fam和mmp-2-aptamer-texasred浓度分别为100-200nm。作为优选,步骤(5)中所述入聚多巴胺纳米微球(pdans)溶液浓度为0.3mg/ml,mmp-9-aptamer-fam和mmp-2-aptamer-texasred浓度分别为100nm构建纳米传感器。其中,步骤(6)中所述脱氧核糖核酸酶(dnase-i)浓度为5-20u,反应温度为37℃,反应时间为1-2h,反应缓冲液5-10mmcacl2、2-5mmmgcl2。作为优选,步骤(6)中所述脱氧核糖核酸酶(dnase-i)浓度为10u,反应温度为37℃,反应时间为1h,反应缓冲液5mmcacl2、2mmmgcl2。进一步地,步骤(7)利用酶标仪读取荧光信号,步骤(7)中所述mmp-9和mmp-2与荧光值的线性关系分别为:当mmp-9浓度在24~600pg/ml范围内符合线性方程y=0.0006x+0.3704,r2=0.9904;当mmp-2浓度在64~1600pg/ml范围内符合线性方程y=0.0001x+0.5358,r2=0.982,其中,y为酶标仪读数,x为mmp-9或mmp-2浓度。本发明所述同时检测基质金属蛋白酶-9和2的系统在制备检测同时检测基质金属蛋白酶-9和2试剂或者工具中的应用。本发明方法的原理阐述如下:本发明基于荧光能量共振转移(fret)效应构建了pdans-aptamers纳米传感器,pdans猝灭荧光素荧光,待测物(mmp-9和mmp-2)与其aptamer特异性结合后从pdnas表面解离,荧光恢复。加入dnase-i,水解aptamer,待测物游离,循环反应,实现荧光信号放大,提高了检测体系的灵敏度。(见图1)。为了解决现有mmp-9和mmp-2在疾病检测过程中存在的操作复杂、时间冗长、仪器昂贵等缺点,本发明提供了一种新型循环放大检测新系统和新方法。pdans作为一种广泛应用的新型材料,能够吸附单链dna(ssdna)且能保护ssdna免被酶切,同时还具有合成制备简单、猝灭荧光性能等优点。aptamer与目标蛋白(mmp-9和mmp-2)的特异性结合能力远远大于pdans对其的吸附能力,因此,当体系中存在目标蛋白时,可以竞争吸附在pdnas表面的适配体,使荧光恢复;为了进一步提高检测体系的灵敏度,应用dnase-i选择性水解aptamers,实现目标蛋白与aptamer的解离,可进行下一轮循环反应,实现荧光信号放大作用。分别在mmp-9和mmp-2特异性结合的aptamer链5’端修饰不同荧光素,以一定比例加入到pdans中,形成纳米传感器。当存在mmp-9和mmp-2时,蛋白酶与aptamers特异性结合,从pdans表面解吸附下来,fret效应减弱或消失,荧光恢复;与此同时,dnase-i会将竞争下来的aptamers水解,目标蛋白酶释放,进行下一轮循环反应,实现荧光信号放大。第一方面,本发明选用的dnase-i是一种可以消化单链或双链dna产生单脱氧核苷酸或单链或双链的寡脱氧核苷酸的核酸内切酶。不需要特别的识别位点,能够选择性降解aptamers和目标蛋白酶结合的aptamers,且不会降解吸附在pdans表面上的aptamers,实现目标蛋白酶的高效释放和循环。第二方面,本发明选用的pdans是一种新型材料,其来源稳定方便,合成简单易行,且具有高效的荧光猝灭性能。与此同时,pdans能够通过π-π堆积,氢键等作用将aptamers吸附在表面,实现荧光猝灭;此外,吸附在pdans表面的aptamers能被pdans保护而免被酶水解,只有从pdans表面解吸附下来的aptamers才会被水解,释放目标蛋白酶,实现荧光信号循环放大。第三方面,本发明构建的pdans-aptamers纳米传感器及其检测系统,可以同时检测两个蛋白,无需分开依次操作,可以同时操作,大大的节约了时间成本以及样品量。有益效果:与现有技术相比,本发明具有如下优点:本发明同时检测基质金属蛋白酶-9和2的系统基于dnase-i酶放大效应,提高了mmp-9和mmp-2蛋白酶检测灵敏度,在37℃自发反应,无需额外严苛的反应条件。目标蛋白酶(mmp-9和mmp-2)与其aptamers检测特异性:可对特异性蛋白有效结合,对于其他蛋白不具有良好的荧光恢复能力。aptamers与pdans结合:高效稳定,pdans比表面积大,成本低廉,pdans表面可以吸附大量aptamers链,进一步增大了荧光放大效果。本发明的检测系统基于荧光能量共振转移效应构建了聚多巴胺纳米微球-修饰荧光素的核酸适配体纳米传感器,pdans猝灭荧光素荧光,待测物与其aptamer特异性结合后从pdnas表面解离,荧光恢复。加入脱氧核糖核酸酶-i,水解aptamer,待测物游离,循环反应,实现荧光信号放大,提高了检测体系的灵敏度。mmp-9和mmp-2分别在24~600pg/ml和64~1600pg/ml范围内线性关系良好,检测限分别为9.6pg/ml和25.6pg/ml。利用本发明系统进行检测的方法具有高效、快速、简便、灵敏等优点。本发明的检测系统制备方法简单,反应条件温和,且成本低廉、易于批量制备,为同时检测基质金属蛋白酶-9和2的检测系统提供了一种新的工具和新的方法。附图说明图1为本发明mmp-9和mmp-2同时检测原理示意图;图2为实施例1制备得到的pdans透射电镜表征示意图;图3为实施例1制备得到的pdans动态光散射粒径变化示意图;图4为实施例1制备得到的pdans红外光谱表征示意图;图5为实施例2绘制的pdans浓度与荧光猝灭率的曲线图;图6为实施例3检测mmp-9线性标曲图;图7为实施例3检测mmp-2线性标曲图;图8为实施例4识别mmp-9的选择性考察结果示意图;图9为实施例4识别mmp-2的选择性考察结果示意图;图10为实施例5尿液中mmp-9含量变化考察结果示意图;图11为实施例5尿液中mmp-2含量变化考察结果示意图。具体实施方式下面结合具体实施例和附图对本发明进一步进行说明。以下实施例中,检测所述的酶标仪为:赛默飞酶标仪;合成所用的盐酸多巴胺、tris-hcl,检测所用的dnase-i酶为:北京索莱宝科技有限公司;检测所用的aptamers、与修饰fam荧光素的基质金属蛋白酶-9(mmp-9)特异性结合的适配体(mmp-9-aptamer-fam)和修饰texasred荧光素的基质金属蛋白酶-2(mmp-2)特异性结合的适配体(mmp-2-aptamer-texasred)由生工生物工程(上海)股份有限公司合成;mmp-9蛋白酶和mmp-2蛋白酶来自sigma公司。实施例1pdans合成成功验证制备pdans:(1)超纯水配制100ml10mmtris-hcl(ph7.4),将tris-hcl、异丙醇(40ml)加入到烧杯中,氨水稀释后,少量多次加入到烧杯中,ph试纸检测,最终溶液ph值为8.0左右,磁力搅拌器缓慢搅拌30min,使溶液充分混匀。(2)随后称取100mg盐酸多巴胺溶解到2ml超纯水中,将溶解的盐酸多巴胺缓慢加入到溶液中,搅拌30h,停止搅拌。(3)将步骤(2)得到的溶液转移至离心管中,10000rpm离心10min,弃去上清液,超纯水溶解沉淀,涡旋混匀,离心,弃去上清液,反复数次,直至上清液澄清。(4)步骤(3)离心纯化后,沉淀即为pdans,冷冻干燥成粉末备用。图2给出了实施例1制备得到的pdans透射电镜表征示意图。图3给出了实施例1制备得到的pdans动态光散射粒径表征示意图。图4给出了实施例1制备得到的pdans红外光谱表征示意图。由图2-4可知,tem和红外光谱均表明pdans合成成功,动态光散射(dls)显示合成的pdans平均粒径为295.3nm,表明pdans成功合成。实施例2构建pdans-aptamers纳米传感器1、分别在mmp-9-aptamer5’端修饰fam荧光素(mmp-9-aptamer-fam),mmp-2-aptamer5’端修饰texasred荧光素(mmp-2-aptamer-texasred),序列由上海生工技术公司合成。名称核苷酸序列mmp-9-aptamer-fam5’-fam-tacggccgcacgaaaaggtgccccataactcaatgccga-3’mmp-2-aptamer-texasred5’-texasred-tcgccgtgtaggattaggccaggtatgggaacccggtaac-3’构建pdans-aptamers纳米传感器包括以下步骤:(1)配制样品:用超纯水分别配制mmp-9-aptamer-fam和mmp-2-aptamer-texasred标准溶液1000nm备用;超纯水配制pdans标准溶液浓度2mg/ml。(2)进行反应:依次加入mmp-9-aptamer-fam和mmp-2-aptamer-texasred标准溶液使其终浓度分别为100nm;随后加入pdans使其终浓度分别为0.05mg/ml、0.15mg/ml、0.20mg/ml、0.30mg/ml、0.4mg/ml、0.5mg/ml、0.6mg/ml;缓冲液浓度为5mmcacl2,2mmmgcl2;反应体系200μl待测,缓冲液溶剂为水。(3)读数:酶标仪分别读取激发488nm/发射520nm和激发589nm/发射610nm处荧光数值。(4)绘制荧光猝灭曲线:根据公式计算猝灭率,qe(%)=(f0-f)/f0×100%,f0表示100nmmmp-9-aptamer-fam和100nmmmp-2-aptamer-texasred的荧光值,f表示加入pdans后的荧光值。以pdans浓度为横坐标,以计算得出的猝灭率为纵坐标,绘制荧光猝灭曲线。图5给出了pdans浓度与荧光猝灭率的曲线。由图5可知,随着pdans浓度增加,其荧光猝灭率越高,当pdans浓度达到0.3mg/ml时逐渐趋于平缓,达到猝灭平台期,猝灭率达到90%以上,因此选定0.3mg/mlpdans作为后续实验浓度。实施例3考察整个检测系统体系对mmp-9和mmp-2检测灵敏度实验1、本实验所需的序列(如实施例2):2、考察基于dnase-i放大体系测定mmp-9和mmp-2标准溶液的灵敏度,包括以下步骤:(1)配制样品:配制mmp-9浓度0.48~120ng/ml,使其浓度分别为0.48ng/ml,0.96ng/ml,2.4ng/ml,4.8ng/ml,12ng/ml,24ng/ml,60ng/ml,120ng/ml;mmp-2浓度1.28~320ng/ml,使其浓度分别为1.28ng/ml,2.56ng/ml,6.4ng/ml,12.8ng/ml,32ng/ml,64ng/ml,160ng/ml,320ng/ml;超纯水配制dnase-i酶2u/μl。(2)进行反应:依次加入mmp-9-aptamer-fam和mmp-2-aptamer-texasred标准溶液使其终浓度分别为100nm,随后加入pdans使其终浓度为0.3mg/ml,缓冲液离子浓度为5mmcacl2,2mmmgcl2形成纳米传感器,再分别加10μl上述(1)中配制的蛋白酶溶液,加5μl2u/μldnase-i酶,超纯水补齐使反应体系为200μl,构成整个检测系统体系。37℃静置孵育1h,酶标仪检测。(3)读数:酶标仪分别读取激发488nm/发射520nm和激发589nm/发射610nm处荧光数值。(4)绘制标准曲线:分别以mmp-9和mmp-2标准溶液浓度为横坐标,分别以520nm和610nm处荧光归一化数值为纵坐标绘制mmp-9和mmp-2标准曲线。图6和图7为检测mmp-9和mmp-2线性标曲结果。由图6和7可知,当mmp-9浓度在24~600pg/ml范围内符合线性方程y=0.0006x+0.3704,r2=0.9904;当mmp-2浓度在64~1600pg/ml范围内符合线性方程y=0.0001x+0.5358,r2=0.982,其中,y为酶标仪读数,x为mmp-9、mmp-2浓度,可用于mmp-9和mmp-2蛋白酶的检测。实施例4考察mmp-9和mmp-2蛋白酶特异性1、本实验所需的其他蛋白:血肌酐(scr)、胎牛血清(fbs)、尿素氮(bun)由sigma公司获得。2、考察基于dnase-i放大体系测定mmp-9和mmp-2特异性,包括以下步骤:(1)配制样品:分别配制相同浓度的蛋白即1200ng/mlscr、fbs、bun、mmp-9、mmp-2。(2)进行反应:依次加入mmp-9-aptamer-fam和mmp-2-aptamer-texasred标准溶液使其终浓度为100nm,随后加入pdans使其终浓度为0.3mg/ml,缓冲液浓度为5mmcacl2,2mmmgcl2形成纳米传感器,再分别加10μl1200ng/mlscr、fbs、bun、mmp-9、mmp-2,使其终浓度均为60ng/ml,加5μl2u/μldnase-i酶,超纯水补齐使反应体系为200μl,构成整个检测系统体系。37℃静置孵育1h,酶标仪检测。(3)读数:酶标仪分别读取激发488nm/发射520nm和激发589nm/发射610nm处荧光数值。(4)绘制柱状图:分别以每个蛋白名称为横坐标,分别以每种蛋白在520nm和610nm处荧光归一化数值为纵坐标绘制柱状图。图8和图9本实施例所述的识别mmp-9和mmp-2特异性的考察结果。由图8和9可知,目标蛋白(mmp-9和mmp-2)仅仅与特异性aptamer结合后荧光恢复;而其他蛋白无法与aptamer结合,因此无法使荧光恢复,上述结果证明了本实施所述检测体系有良好的特异性。实施例5考察uuo模型以及黄葵给药后小鼠尿液中mmp-9和mmp-2含量变化。1、手术结扎小鼠左侧输尿管,膀胱挤压法分别收集空白小鼠尿液,结扎1天小鼠尿液,结扎3天小鼠尿液,结扎5天小鼠尿液,结扎7天小鼠尿液,结扎14天小鼠尿液,黄葵给药14天后小鼠尿液;2、考察检测探针体系在尿液环境中测定mmp-9和mmp-2含量,步骤如下所示:(1)配制样品:收集尿液样本全部稀释10倍备用。(2)随行标曲:配制方法及实验方法和实施例3一致。(3)进行反应:依次加入mmp-9-aptamer-fam和mmp-2-aptamer-texasred标准溶液使其终浓度为100nm,随后加入pdans使其终浓度为0.3mg/ml,缓冲液离子浓度为5mmcacl2,2mmmgcl2形成纳米传感器,再分别加10μl上述(1)中稀释的尿液样品,加5μl2u/μldnase-i酶,超纯水补齐使反应体系为200μl,构成整个检测系统体系。37℃静置孵育1h,酶标仪检测。(4)读数:酶标仪分别读取激发488nm/发射520nm和激发589nm/发射610nm处荧光数值。(5)含量测定:以(2)所得随行工作曲线为标准曲线,计算加入尿液后,尿液中所含mmp-9和mmp-2含量。(6)所述计算方法为:将酶标仪测定值代入标准曲线拟合公式求出测量浓度c,即得到mmp-9和mmp-2含量。(7)绘制柱状图:分别以不同结扎天数和给药14天为横坐标,分别以不同组小鼠尿液中mmp-9和mmp-2含量数值为纵坐标绘制柱状图。图10给出了本实施所述的对于尿液样品中mmp-9含量变化考察结果。图11给出了本实施所述的对于尿液样品中mmp-2含量变化考察结果。由图10可以看出,mmp-9含量随着结扎天数增加而增大,与给药组相比,mmp-9含量有所减少;由图11可以看出,mmp-2含量随着结扎天数增加而下降,与给药组相比,mmp-2含量有所增加。由此表明,通过尿液中mmp-9和mmp-2含量变化一定程度上反应出肾纤维化的发展进程,同时给予保护药黄葵后能够有效缓解纤维化进程;表明mmp-9和mmp-2可作为肾纤维化标志物为临床及时诊断肾纤维化提供一种快速准确可靠的新方法同时本发明的检测系统为肾纤维化标志物mmp-9和mmp-2同时快速检测提供了一种新的工具和新的方法。实施例6实施例6整个检测系统体系构建如实施例3,不同之处在于,聚多巴胺纳米微球(pdans)溶液浓度为0.6mg/ml,mmp-9-aptamer-fam和mmp-2-aptamer-texasred浓度分别为200nm。脱氧核糖核酸酶(dnase-i)为5u,反应温度为37℃,反应时间为2h,反应缓冲液10mmcacl2、5mmmgcl2。实施例7实施例7整个检测系统体系构建如同实施例3,不同之处在于,聚多巴胺纳米微球(pdans)溶液浓度为0.5mg/ml,mmp-9-aptamer-fam和mmp-2-aptamer-texasred浓度分别为150nm。脱氧核糖核酸酶(dnase-i)为20u,反应温度为37℃,反应时间为1h,反应缓冲液8mmcacl2、3mmmgcl2。序列表<110>中国药科大学<120>一种同时检测基质金属蛋白酶-9和2的系统及其制备方法和应用<160>2<170>siposequencelisting1.0<210>1<211>39<212>dna<213>人工序列(artificialsequence)<400>1tacggccgcacgaaaaggtgccccataactcaatgccga39<210>2<211>40<212>dna<213>人工序列(artificialsequence)<400>2tcgccgtgtaggattaggccaggtatgggaacccggtaac40当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 作为基质金属蛋白质酶和tace抑制剂的邻-亚磺酰氨基杂芳基异羟肟酸的制备和应用的制作方法
- 中国汉族人基质金属蛋白酶-9基因重构、表达、纯化及其医学应用的制作方法
- 抗基质金属蛋白酶单抗Fab'药物偶联物及抗肿瘤作用的制作方法
- 抑制细胞基质金属蛋白酶的矢车菊苷配质低聚体和以此为有效成分的药物的制作方法
- 基质金属蛋白酶的反异羟肟酸酯抑制剂的制作方法
- 用作与基质金属蛋白酶相关疾病治疗剂的胱氨酸衍生物的制作方法
- 抑制基质-金属蛋白酶治疗肿瘤性疾病的组合物的制作方法
- 通过含乙炔基的化合物抑制基质金属蛋白酶的制作方法
- 作为基质金属蛋白质酶和TACE抑制剂的β-亚磺酰氨基异羟肟酸的制作方法
- 人源基质金属蛋白酶-13的激活剂检测试剂盒的制作方法