分离成功与否判定方法、粒子检测方法以及粒子分离装置与流程
本发明涉及分离成功与否判定方法、粒子检测方法以及粒子分离装置。
背景技术:
细胞反映被检者的疾病的状态等各种生物体的状态,以多样的目的成为测定对象。为了高效地测定细胞,要求浓缩目标细胞。例如,在将血中循环肿瘤细胞(circulatingtumorcell:ctc)、血管内皮细胞、骨髓液中的造血干细胞、孕妇的血液中含有的胎儿成红血细胞等样本中的稀有细胞作为对象时,从大量的细胞中高精度地分离目标细胞变得很重要。
作为将细胞分离的方法,在专利文献1中记载有使在曲线流路中流动的样本中的细胞沿着迪恩涡(deanvortices)移动,使ctc从其他细胞分离的方法。通过使样本以及鞘液流入图16所示的流路的注入口,从而ctc在排出口移动到曲线流路的内侧壁附近,rbc以及白血球移动到通道的外侧一半。由此,ctc从内侧的排出口被分离以及收集。
在先技术文献
专利文献1:日本特表2017-500006号公报
在如上所述分离试样并供临床检查的情况下,正确地进行分离工序变得很重要。但是,例如,由于在流路内产生的气泡、在流路内流动的血液中的成分凝固而引起的流路的即与形成有流路的芯片连接的分离装置中的流体机构的异常等主要原因,可能会导致无法适当地进行分离工序。在此,在临床检查中,在基于通过试样的分离而取得的稀有细胞来掌握疾病的症状的情况下,如果因分离工序未正确地进行而导致分离后的试样中包含的稀有细胞的数量变少,则可能会产生假阴性。
技术实现要素:
因此,本发明的目的在于提供一种能够判定是否正确地进行了试样的分离工序的方法以及装置。
用于解决课题的方案
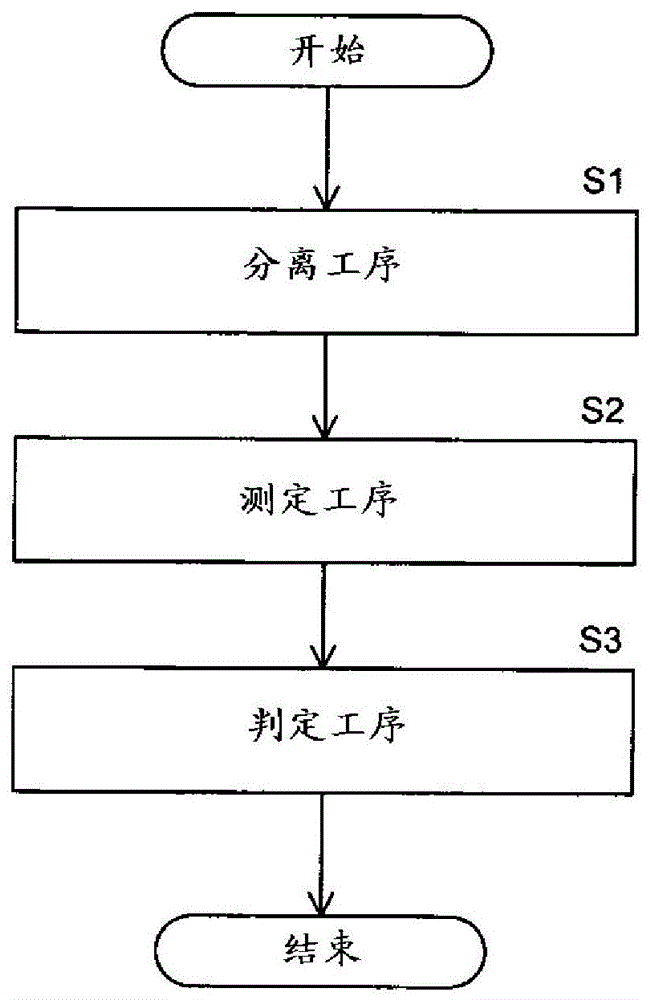
本发明的第一方案涉及分离成功与否判定方法。本方案涉及的分离成功与否判定方法包括:分离工序s1,在所述分离工序s1中,使包含第一粒子和第二粒子的试样21在流路110中流动,基于作用于试样21中包含的粒子的力的大小差异,将试样21分离为包含第一粒子的第一试样22和包含第二粒子的第二试样23;测定工序s2,在所述测定工序s2中,测定与第一试样22的量相关的第一信息和与第二试样23的量相关的第二信息;以及判定工序s3,在所述判定工序s3中,基于第一信息和第二信息,对分离工序s1成功与否进行判定。
第一试样的量是指第一试样的重量、体积,第二试样的量是指第二试样的重量、体积。第一信息是指可以基于第一信息导出第一试样的量的信息。作为第一信息,例如可以列举测得的第一试样的量自身的值、在第一试样的量的计算中可以使用的第一试样的流速等。第二信息是指可以基于第二信息导出第二试样的量的信息。作为第二信息,例如可以列举测得的第二试样的量自身的值、在第二试样的量的计算中可以使用的第二试样的流速等。
发明人发现,与第一试样的量相关的第一信息和与第二试样的量相关的第二信息反映第一试样和第二试样的分离状态。因此,根据本方案涉及的分离成功与否判定方法,可以基于在测定工序中测得的第一信息和第二信息,判定分离工序成功与否。
另外,若能够这样判定分离工序成功与否,则仅在试样适当地被分离为第一试样以及第二试样的情况下,能够向后段的工序供给第一试样。若仅在从试样适当地分离出第一试样的情况下将第一试样向后段的工序供给,则向后段的检测工序供给的测定试样中包含的第一粒子的个数接近分离前的试样中包含的第一粒子的个数。因此,例如,在第一粒子是稀有细胞,基于第一粒子的检测结果判断疾病的状态的情况下,对从分离前的试样中适当地分离并包含足够个数的第一粒子的测定试样进行检测。由此,在疾病的状态的判断中,可以抑制稀有细胞因分离而丧失且分离后的试样中包含的稀有细胞的个数少而产生的假阴性。
本方案涉及的分离成功与否判定方法在分离工序s1中,将试样21分离为第一粒子的存在比率比试样21中的第一粒子的存在比率大的第一试样22和第一粒子的存在比率比试样21中的第一粒子的存在比率小的第二试样23。存在比率是指试样中的第一粒子的数量/试样中的规定种类的粒子的数量。例如,在第一粒子是血中循环肿瘤细胞(ctc)的情况下,存在比率是试样中的ctc的数量/试样中的血液细胞的数量。
在本方案涉及的分离成功与否判定方法中,作用于试样中包含的每个粒子的力的大小差异是因粒子的特性的差异而产生的。
在该情况下,粒子的特性的差异是大小的差异、重量的差异、比重的差异中的至少一种。
本方案涉及的分离成功与否判定方法在分离工序s1中,通过使试样21在微流路110中流动,从而将试样21分离为第一试样22和第二试样23。这样一来,可以使用于进行分离工序的结构小型化。
本方案涉及的分离成功与否判定方法在分离工序s1中,通过使试样21在具有曲线部111的流路110中流动,从而将试样21分离为第一试样22和第二试样23。这样一来,能够以简单的结构有效地将试样分离为第一试样和第二试样。
本方案涉及的分离成功与否判定方法在分离工序s1中,基于在流路110内产生的速度分布,将试样21分离为第一试样22和第二试样23。这样一来,仅通过使试样在流路中流动,就可以将试样分离为第一试样和第二试样。
本方案涉及的分离成功与否判定方法在分离工序s1中,使包含样本以及鞘液的试样21在流路110中流动,第一试样22以及第二试样23包含样本以及鞘液。
在本方案涉及的分离成功与否判定方法中,测定工序s2在分离工序s1之后进行。由此,可以取得反映了分离工序后的状态的第一信息以及第二信息,因此,可以在判定工序中判定分离工序成功与否。
本方案涉及的分离成功与否判定方法在测定工序s2中,基于分别设置于供第一试样22流动的第一流路141以及供第二试样23流动的第二流路142的检测部151、152的检测信号,测定第一信息以及第二信息。根据检测部的检测信号,可以取得在第一流路中流动的第一试样的流速作为第一信息,可以取得在第二流路中流动的第二试样的流速作为第二信息。作为流速而取得的第一信息是可以基于第一信息导出第一试样的量的信息,作为流速而取得的第二信息是可以基于第二信息导出第二试样的量的信息。因此,基于第一信息和第二信息,可以判定分离工序成功与否。
在本方案涉及的分离成功与否判定方法中,第一信息是与第一试样22的重量或体积相关的信息,第二信息是与第二试样23的重量或体积相关的信息。
在本方案涉及的分离成功与否判定方法中,第一信息以及第二信息可以是能够导出重量或体积的信息。
在本方案涉及的分离成功与否判定方法中,第一信息以及第二信息可以是与压力或流速相关的信息。
本方案涉及的分离成功与否判定方法在判定工序s3中,基于根据第一信息以及第二信息算出的比率,判定分离工序s1成功与否。发明人发现,根据第一信息以及第二信息算出的比率反映第一试样和第二试样的分离状态。因此,可以基于算出的比率判定分离工序成功与否。
在该情况下,比率可以是第一信息以及第二信息之和相对于第一信息的比率、第一信息以及第二信息之和相对于第二信息的比率、第一信息相对于第一信息以及第二信息之和的比率、第二信息相对于第一信息以及第二信息之和的比率、第二信息相对于第一信息的比率、或第一信息相对于第二信息的比率。
本方案涉及的分离成功与否判定方法在判定工序s3中,对比率与规定的阈值进行比较来判定分离工序s1成功与否。
本方案涉及的分离成功与否判定方法在判定工序s3中,基于比率是否比规定的阈值大、或比率是否比规定的阈值小来判定分离工序s1成功与否。这样一来,在相当于第一粒子的粒子在第一试样中极多的情况或极少的情况下,可以判定分离工序未正确地进行。
本方案涉及的分离成功与否判定方法在判定工序s3中,基于比率是否在规定的范围内来判定分离工序s1成功与否。这样一来,在相当于第一粒子的粒子在第一试样中极多的情况以及极少的情况下,可以判定分离工序未正确地进行。
本方案涉及的分离成功与否判定方法在判定工序s3中,基于第一信息和第二信息之和来判定分离工序s1成功与否。若在分离工序中产生不良情况,则取得的第一试样以及第二试样的量可能会减少。在该情况下,由于未取得适当的量的第一试样以及第二试样,因此,分离工序未正确地进行。因此,在判定工序中,通过对与第一试样的量相关的第一信息和与第二试样的量相关的第二信息之和是否比规定的阈值大进行判定,从而可以进一步判定分离工序成功与否。
本方案涉及的分离成功与否判定方法当在判定工序s3中判定为未正确地进行分离工序s1的情况下,再次进行分离工序s1。这样一来,在未正确地进行分离工序的情况下,可以防止不适当的第一试样被供给到后段的处理,为了取得适当的第一试样,可以顺畅地再次开始分离工序。
在本方案涉及的分离成功与否判定方法中,试样21包含血液。
在本方案涉及的分离成功与否判定方法中,第一粒子是血中循环肿瘤细胞。
在本方案涉及的分离成功与否判定方法中,第二粒子包含从红血球、白血球以及血小板中选择的至少一种血球。
本发明的第二方案涉及粒子检测方法。本方案涉及的粒子检测方法利用流式细胞仪13或显微镜对在第一方案的分离成功与否判定方法中判定为正确地进行了分离工序s1的第一试样22进行测定,并检测试样21中包含的第一粒子。
根据本方案涉及的粒子检测方法,仅在判定为正确地进行了分离工序的情况下,基于第一试样,利用流式细胞仪或显微镜检测第一粒子。由此,向流式细胞仪或显微镜供给的测定试样中包含的第一粒子的个数与分离前的试样中包含的第一粒子的个数接近。因此,例如,在第一粒子是稀有细胞,基于稀有细胞的检测结果判断疾病的状态的情况下,对从分离前的试样中适当地分离并包含足够个数的第一粒子的测定试样进行检测。由此,在疾病的状态的判断中,可以抑制因分离后的试样中包含的稀有细胞的个数少而产生的假阴性。
本发明的第三方案涉及粒子分离装置。本方案涉及的粒子分离装置11具备:分离部104,所述分离部104使试样21在流路110中流动,基于作用于试样21中包含的粒子的力的大小差异,将试样21分离为第一试样22和第二试样23;测定部105,所述测定部105测定与第一试样22的量相关的第一信息和与第二试样23的量相关的第二信息;以及判定部101,所述判定部101基于第一信息和第二信息,对分离部104中的试样21的分离成功与否进行判定。
根据本方案涉及的粒子分离装置,可以起到与第一方案相同的效果。
在本方案涉及的粒子分离装置11中,分离部104可以构成为具备使试样21在流路110中流动的泵104a。
在本方案涉及的粒子分离装置11中,流路110可以形成于能够更换的芯片100。这样一来,无需进行清洗流路这样的繁杂作业,仅更换芯片就能够进行不同的试样的分离。
在本方案涉及的粒子分离装置11中,流路110可以构成为具备曲线部111。这样一来,能够以简单的结构有效地将试样分离为第一试样和第二试样。
本方案涉及的粒子分离装置11可以构成为具备显示判定部101的判定结果的显示部103。这样一来,操作者可以在视觉上掌握是否适当地进行了试样的分离。
发明效果
根据本发明,可以判定分离工序成功与否。
附图说明
图1是表示实施方式的分离成功与否判定方法的工序的流程图。
图2是用于说明实施方式的分离工序的示意图。
图3(a)是表示实施方式的芯片的结构的示意图,图3(b)是表示实施方式的微流路的截面的示意图。
图4(a)是表示实施方式的微流路的输出端部侧的端部的示意图,
图4(b)是用于说明实施方式的测定工序的示意图。
图5是表示实施方式的变形例的分离成功与否判定方法的工序的流程图。
图6(a)是在实施方式的分离成功与否判定方法的研究中制作出的散布图,图6(b)是在实施方式的分离成功与否判定方法的验证中制作出的散布图。
图7是表示实施方式的粒子检测方法的工序的流程图。
图8是用于说明实施方式的染色工序的示意图。
图9是用于说明实施方式的浓缩工序的示意图。
图10是用于说明实施方式的检测工序的示意图。
图11是表示实施方式的粒子检测系统的结构的示意图。
图12是表示实施方式的粒子分离装置的结构的示意图。
图13(a)、(b)是表示包括实施方式的粒子分离装置的显示输入部所显示的判定结果在内的画面的示意图。
图14是表示实施方式的染色浓缩装置的结构的示意图。
图15是表示实施方式的流式细胞仪的结构的示意图。
图16是用于说明关联技术的结构的示意图。
附图标记说明
11粒子分离装置
13流式细胞仪
21试样
22第一试样
23第二试样
100芯片
101控制部(判定部)
103显示输入部(显示部)
104分离部
104a泵
105测定部
110微流路(流路)
111曲线部
141第一流路
142第二流路
151、152压力检测部(检测部)
具体实施方式
以下的实施方式所示的分离成功与否判定方法、粒子检测方法以及粒子分离装置使包含第一粒子以及第二粒子的试样在流路中流动,基于作用于试样中包含的粒子的力的大小差异,将试样分离为包含第一粒子的第一试样和包含第二粒子的第二试样。具体而言,使试样在图3(a)所示的芯片100的微流路110中流动,在微流路110内,根据粒子的粒径使作用于粒子的力的大小不同,如图3(b)所示,使粒子流动的位置变化。由此,将试样分离而从图3(a)所示的出口131、132分别取得第一试样和第二试样。接着,测定与分离出的第一试样的量相关的第一信息和与第二试样的量相关的第二信息,基于第一信息和第二信息对分离工序成功与否进行判定。具体而言,使用图4(b)所示的压力检测部151、152,取得从出口131流出的第一试样的流速作为第一信息,并取得从出口132流出的第二试样的流速作为第二信息。此后,对基于第一信息和第二信息的比率进行计算,并基于算出的比率对分离工序成功与否进行判定。
在以下的实施方式中,列举试样包含血液的例子进行说明。但是,试样不限于血液,例如也可以是尿或骨髓液等。另外,在以下的实施方式中,列举第一粒子是血中循环肿瘤细胞(ctc)、第二粒子是白血球的例子。
第一粒子不限于ctc,也可以是ctc以外的细胞。第一粒子也可以是血管内皮细胞(circulatingendothelialcell:cec)或造血干细胞(hematopoieticstemcell:hsc)。第一粒子也可以是纳米囊泡、微囊泡、红血球、白血球、血小板、构成血浆的粒子或构成血清的粒子。纳米囊泡例如是外来体。构成血浆的粒子以及构成血清的粒子例如是蛋白质或微粒。另外,第一粒子也可以是异形淋巴细胞。
<分离成功与否判定方法>
图1是表示分离成功与否判定方法的工序的流程图。
实施方式的分离成功与否判定方法包括分离工序(步骤s1)、测定工序(步骤s2)以及判定工序(步骤s3)。以下,对操作者在各工序中向粒子分离装置输入指示,粒子分离装置根据被输入的指示来执行各工序的情况进行说明。需要说明的是,步骤s1~s3的全部工序既可以通过粒子分离装置自动进行,也可以通过操作者操作设备来进行。关于粒子分离装置,随后参照图12进行说明。
在以下的说明中,第一粒子是在后述的检测工序中作为检测对象、在后述的解析工序中作为解析对象的粒子,是目标粒子。将第一粒子、即ctc称为“第一细胞”,将第二粒子、即红血球、白血球、血小板等称为“第二细胞”。
在步骤s1的分离工序中,粒子分离装置将包含第一细胞以及第二细胞的试样分离为包含第一细胞的第一试样和包含第二细胞的第二试样。详细而言,在步骤s1的分离工序中,粒子分离装置使包含第一细胞以及第二细胞的试样在流路中流动,基于作用于试样中包含的粒子的力的大小差异,将试样分离为第一试样和第二试样。此时,粒子分离装置将试样分离为第一细胞的存在比率比试样中的第一细胞的存在比率大的第一试样和第一细胞的存在比率比试样中的第一细胞的存在比率小的第二试样。
作用于试样中包含的每个粒子的力的大小差异是因粒子的特性的差异而产生的。该情况下的粒子的特性是指形态特性和物性特性。形态特性例如是指粒子的大小。粒子的大小例如是指直径、半径、俯视时的面积、周围的长度等。物性特性是指重量、比重等。
图2是用于说明步骤s1的分离工序的示意图。
向粒子分离装置供给的试样是预先使红血球溶血的试样。刚从被检者采集的试样如第一状态所示是血液,具体而言是全血。第一状态的试样包含作为第一细胞的ctc和作为第二细胞的红血球、血小板以及白血球。在图2中,ctc用黑圈表示,红血球用圆圈表示,血小板用三角形表示,白血球用四边形表示。操作者在第一状态的试样中使用规定的试剂使红血球溶血,使用离心分离器进行离心分离并除去上清。由此,从第一状态的试样取得红血球大致消失的第二状态的试样。接着,第二状态的试样向粒子分离装置供给。
需要说明的是,粒子分离装置也可以进行使试样从第一状态变为第二状态的处理。例如,粒子分离装置也可以具备用于使红血球溶血的机构或离心分离器等。另外,例如,也可以在步骤s1的分离工序中,利用参照图3(a)在后面论述的芯片100,利用粒子的形态特性和物性特性的差异将红血球与其他粒子分离,进行使试样从第一状态变为第二状态的处理。另外,也可以省略使试样从第一状态变为第二状态的处理,将第一状态的试样视为第二状态来进行分离工序。
在步骤s1中,粒子分离装置在第二状态的试样中将第一细胞和第二细胞分离。具体而言,粒子分离装置基于分别作用于ctc、红血球、血小板以及白血球的力的大小差异,从第二状态的试样分离红血球、血小板以及白血球并除去。在实施方式中,利用因细胞的直径差异而产生作用于细胞的力的大小差异这种情况,通过使试样在流路中流动来进行分离。由此,第二状态的试样被分离为包含第一细胞的第一试样和包含第二细胞的第二试样。这样一来,如第三状态所示,取得包含第一细胞的第一试样。
如上所述,当在第一状态的血液中红血球被溶血并除去后进行试样的分离时,在试样的分离时,成为血液中大量含有的红血球预先被除去的状态。由此,在试样的分离中,可以将试样顺畅地分离为第一试样和第二试样。
在将图2的第二状态的试样分离为第一试样和第二试样时,使用图3(a)所示的芯片100。
图3(a)是表示芯片100的结构的示意图。
通过使试样在设置于芯片100的微流路110中流动,从而芯片100将试样分离为第一试样和第二试样。此时,芯片100将试样分离为第一试样和第二试样,以使第一试样中的第一粒子的存在比率比试样中的第一粒子的存在比率大。需要说明的是,存在比率是指试样中的第一粒子的数量/试样中的规定种类的粒子的数量。在第一粒子是ctc的情况下,存在比率例如是试样中的ctc的数量/试样中的血液细胞的数量、或试样中的ctc的数量/试样中的白血球的数量。作为存在比率的分母的试样中的规定种类的粒子的数量是任意的粒子的数量,在第一粒子的测定中不需要的任意的粒子只要从分离工序后的试样中也被除去一部分即可。在第一粒子为外来体的情况下,存在比率例如是试样中的外来体粒子的数量/试样中的血液细胞的数量。在第一粒子是构成血浆的蛋白质的情况下,存在比率例如是试样中的蛋白质分子的数量/试样中的血液细胞的数量。
芯片100具备微流路110、输入端部120以及输出端部130。微流路一般而言是指深度以及宽度为10μm~1000μm的范围的流路。芯片100例如通过在形成有与微流路110、输入端部120以及输出端部130对应的槽的薄板状部件上重叠其他板状部件而构成。实施方式的试样的分离基于被称为迪恩流分离(deanflowfractionation)的分离原理。
微流路110具有涡旋形状的曲线部111和直线部112、113。曲线部111的形状在与芯片100垂直的方向上观察的情况下呈圆弧形。直线部112、113的形状在与芯片100垂直的方向上观察的情况下呈直线状。输入端部120设置在微流路110的涡旋形状的中心侧端部,输出端部130设置在微流路110的与输入端部120相反的一侧端部。输入端部120经由直线部112与曲线部111相连,输出端部130经由直线部113与曲线部111相连。
输入端部120具备入口121、122。入口121、122由设置在构成芯片100的部件上的孔构成。入口121在微流路110的涡旋形状的外周侧经由直线部112与曲线部111连接。入口122在微流路110的涡旋形状的内周侧经由直线部112与曲线部111连接。输出端部130具备出口131、132。出口131、132由设置在构成芯片100的部件上的孔构成。出口131在微流路110的涡旋形状的内周侧经由直线部113与曲线部111连接。出口132在微流路110的涡旋形状的外周侧经由直线部113与曲线部111连接。
在将试样分离时,向入口121注入图2所示的第二状态的试样,向入口122注入鞘液。被注入到入口121的第二状态的试样的量例如是5ml,被注入到入口122的鞘液的量例如是45ml。而且,利用经由管与入口121、122连接的泵104a,对入口121、122施加正压。由此,被注入到入口121的试样和被注入到入口122的鞘液在微流路110内朝向输出端部130流动。试样以及鞘液在微流路110中流动,从出口131取得的第一试样以及从出口132取得的第二试样也包含试样以及鞘液。从出口131取得的第一试样的量例如是10ml,从出口132取得的第二试样的量例如是40ml。
图3(b)是图3(a)所示的微流路110的a-a'剖视图。在图3(b)中,右侧是涡旋形状的外周侧,左侧是涡旋形状的内周侧。
当第二状态的试样在微流路110中流动时,在微流路110内,如图3(b)所示,产生使细胞在与流路的朝向正交的方向上流动的位置变化的力。具体而言,根据细胞的直径而产生不同大小的升力fl和迪恩阻力fd。一般而言,在微流路中,流速以流路的截面中心的速度大、壁附近的速度变小的方式分布。在涡旋状的微流路110中,进而由于上述流速分布而如图3(b)中椭圆形的箭头所示,产生被称为迪恩涡的二次流。迪恩阻力fd和升力fl可以利用以下的式(1)、(2)表示。
[数1]
fl=ρg2clap4…(2)
μ:流体的粘度ρ:流体的密度
g:剪切速度ap:粒径cl:升力系数
g=umax/dh
umax:微流路的最大流速dh:水力直径
试样内的细胞一边沿着微流路110被冲走,一边通过升力fl和迪恩阻力fd在微流路110内根据直径的值而分布。
图4(a)是表示微流路110的输出端部130侧的端部的示意图。
当在微流路110中产生迪恩涡时,如图4(a)所示,在微流路110的输出端部130侧的端部,细胞根据直径的值而分布。这样一来,从出口131取得规定的直径以上的细胞。从出口131取得的试样是图2的第三状态的第一试样,从出口132取得的试样是图2的第二试样。
大部分的白血球的直径是10μm~15μm附近的值以下,大部分的癌细胞的直径是10μm~15μm附近的值以上。因此,在从图2的第二状态除去第二细胞时,优选将10μm~15μm附近的值作为截止值,除去直径比截止值小的细胞,取出直径为截止值以上的细胞。
这样,根据微流路110,能够以简单的结构将试样分离为第一试样和第二试样,可以使用于进行分离工序的结构小型化。另外,通过使试样在具有曲线部111的微流路110中流动来进行分离,因此,能够以简单的结构有效地将试样分离为第一试样和第二试样。另外,根据微流路110,基于在曲线部111内产生的速度分布进行分离,因此,仅通过使试样在微流路110中流动,就可以将试样分离为第一试样和第二试样。
需要说明的是,根据微流路110,也可以从试样中分离血浆作为第一试样。在该情况下,构成血浆的蛋白质、微粒成为第一粒子。由于作为第一粒子的蛋白质、微粒的直径小,因此,这些第一粒子向出口132被引导,从出口132取得血浆。
回到图1,在步骤s2的测定工序中,粒子分离装置基于在分离工序中得到的第一试样和第二试样,测定与第一试样的量相关的第一信息和与第二试样的量相关的第二信息。
第一试样的量是指第一试样的重量、体积,第二试样的量是指第二试样的重量、体积。第一信息是指可以基于第一信息导出第一试样的量的信息。作为第一信息,例如可以列举第一试样的量自身的值、在第一试样的量的计算中可以使用的第一试样的流速、第一试样流动的流路的压力等。第二信息是指可以基于第二信息导出第二试样的量的信息。作为第二信息,例如可以列举第二试样的量自身的值、在第二试样的量的计算中可以使用的第二试样的流速、第二试样流动的流路的压力等。在实施方式中,第一试样的量是第一试样的重量,第一信息是第一试样的流速。另外,第二试样的量是第二试样的重量,第二信息是第二试样的流速。
图4(b)是用于说明步骤s2的测定工序的示意图。
在芯片100的出口131连接有第一流路141。在出口131经由第一流路141连接有用于收容第一试样的容器。第一流路141将从出口131流出的第一试样向用于收容第一试样的容器引导。第一流路141是管。同样地,在芯片100的出口132连接有第二流路142。在出口132经由第二流路142连接有用于收容第二试样的容器。第二流路142将从出口132流出的第二试样向用于收容第二试样的容器引导。第二流路142是管。
在第一流路141设置有用于测定在第一流路141内流动的第一试样的流速的压力检测部151。压力检测部151检测第一流路141内的压力。同样地,在第二流路142设置有用于测定在第二流路142内流动的第二试样的流速的压力检测部152。压力检测部152检测第二流路142内的压力。在压力检测部151、152连接有运算部153。运算部153基于压力检测部151、152的检测信号,取得第一流路141内的流速以及第二流路142内的流速。
需要说明的是,也可以代替压力检测部151、152而设置对第一流路141内的压力进行检测而取得流速的流速检测部、以及对第二流路142内的压力进行检测而取得流速的流速检测部。
在此,测得的第一试样的流速是可以导出第一试样的重量的信息。即,通过将第一流路141中的第一试样的流速、第一流路141的截面积、第一试样在第一流路141内流动的时间、以及第一试样的比重相乘,从而可以导出第一试样的重量。同样地,测得的第二试样的流速是可以导出第二试样的重量的信息。即,通过将第二流路142中的第二试样的流速、第二流路142的截面积、第二试样在第二流路142内流动的时间、以及第二试样的比重相乘,从而可以导出第二试样的重量。
需要说明的是,测得的第一试样的流速不仅用于导出重量,而且可以通过将测得的第一试样的流速、第一流路141的截面积、以及第一试样在第一流路141内流动的时间相乘来导出第一试样的体积。同样地,测得的第二试样的流速是可以导出第二试样的体积的信息。
根据压力检测部151的检测信号,可以取得在第一流路141中流动的第一试样的流速作为第一信息,根据压力检测部152的检测信号,可以取得在第二流路142中流动的第二试样的流速作为第二信息。作为流速而取得的第一信息是可以基于第一信息导出第一试样的量的信息,作为流速而取得的第二信息是可以基于第二信息导出第二试样的量的信息。因此,可以基于第一信息和第二信息,在后段的判定工序中判定分离工序成功与否。
这样的测定工序在分离工序之后进行。具体而言,在芯片100中分离结束,对从出口131、132流出的第一试样和第二试样测定流速。由此,可以取得反映了分离工序后的状态的第一信息以及第二信息,因此,可以在判定工序中判定分离工序成功与否。
回到图1,在步骤s3的判定工序中,粒子分离装置基于第一信息和第二信息,对步骤s1的分离工序成功与否进行判定。
在此,发明人发现,与包含第一细胞的第一试样的量相关的第一信息和与包含第二细胞的第二试样的量相关的第二信息反映第一试样和第二试样的分离状态。因此,在步骤s3的判定工序中,可以基于在步骤s2的测定工序中测得的第一信息和第二信息,判定步骤s1的分离工序成功与否。更详细地说,发明人发现,根据第一信息以及第二信息算出的比率反映第一试样和第二试样的分离状态。因此,可以基于根据第一信息以及第二信息算出的比率,判定分离工序成功与否。需要说明的是,关于根据第一信息以及第二信息算出的比率反映分离状态这种情况,在发明人随后进行的研究中进行说明。
在实施方式中,根据第一信息以及第二信息算出的比率是第一信息以及第二信息之和相对于第一信息的比率。即,实施方式的比率是(第一信息+第二信息)/第一信息。
需要说明的是,算出的比率也可以是第一信息以及第二信息之和相对于第二信息的比率、第一信息相对于第一信息以及第二信息之和的比率、第二信息相对于第一信息以及第二信息之和的比率等。即,比率也可以是(第一信息+第二信息)/第二信息、第一信息/(第一信息+第二信息)、第二信息/(第一信息+第二信息)。另外,算出的比率也可以是第二信息相对于第一信息的比率、第一信息相对于第二信息的比率等。即,比率也可以是第二信息/第一信息、第一信息/第二信息。
在步骤s3的判定工序中,粒子分离装置基于如上所述算出的比率是否比规定的阈值大、或如上所述算出的比率是否比规定的阈值小,对分离工序成功与否进行判定。是在比率比规定的阈值大的情况下判定为正确地进行了分离工序、还是在比率比规定的阈值小的情况下判定为正确地进行了分离工序,根据比率的运算式而变化。在这样进行判定时,在相当于第一细胞的粒子在第一试样中极多的情况或极少的情况下,可以判定分离工序未正确地进行。
需要说明的是,粒子分离装置也可以基于如上所述算出的比率是否在规定的范围内来判定分离工序成功与否。在这样进行判定时,在相当于第一细胞的粒子在第一试样中极多的情况以及极少的情况下,可以判定分离工序未正确地进行。
在此,作为分离工序未正确地进行的主要原因,例如可以列举由在微流路110内产生的气泡、在微流路110内流动的血液中的成分凝固而引起的微流路110的即微流路110的成形不良、与芯片100连接的粒子分离装置中的流体机构的异常等。与此相对,在如上所述进行测定工序以及判定工序时,可以掌握由于这些主要原因而未适当地进行分离工序的情况。
若如上所述可以判定分离工序成功与否,则仅在试样适当地被分离为第一试样以及第二试样的情况下,可以向后段的工序供给第一试样。这样,若仅在从试样适当地分离出第一试样的情况下向后段的工序供给第一试样,则例如向后段的检测工序供给的测定试样中包含的第一细胞的个数与分离前的试样中包含的第一细胞的个数接近。因此,例如,在第一细胞是稀有细胞,基于第一细胞的检测结果判断疾病的状态的情况下,对从分离前的试样中适当地分离并包含足够个数的第一细胞的测定试样进行检测。由此,在疾病的状态的判断中,可以抑制稀有细胞因分离而丧失且分离后的试样中包含的稀有细胞的个数少而产生的假阴性。
需要说明的是,图1所示的分离成功与否判定方法也可以如图5那样进行。
图5是表示实施方式的变形例的分离成功与否判定方法的工序的流程图。
在分离成功与否判定方法的变形例中,与图1相比,代替步骤s3而追加步骤s4,在步骤s4的后段追加步骤s5。
在步骤s4的判定工序中,粒子分离装置与上述同样地,基于第一信息和第二信息对分离工序成功与否进行判定。并且,在步骤s4的判定工序中,粒子分离装置基于第一信息以及第二信息之和,对分离工序成功与否进行判定。具体而言,粒子分离装置判定第一信息以及第二信息之和是否比规定的阈值大,从而判定分离工序成功与否。这样,在步骤s4的判定工序中,进行与分离工序相关的两个判定。
在此,若在分离工序中芯片100或向芯片100送入试样的泵104a等产生不良情况,则取得的第一试样以及第二试样的量可能会减少。在该情况下,由于未取得适当的量的第一试样以及第二试样,因此,分离工序未正确地进行。因此,在步骤s4的判定工序中,通过对与第一试样的量相关的第一信息和与第二试样的量相关的第二信息之和是否比规定的阈值大进行判定,从而可以进一步判定分离工序成功与否。
在步骤s5中,粒子分离装置根据与在步骤s4中进行的分离工序相关的两个判定结果,判定是否适当地进行了分离工序。粒子分离装置在基于第一信息和第二信息判定为正确地进行了分离工序,并且判定为第一信息以及第二信息之和比规定的阈值大的情况下,判定为适当地进行了分离工序。在该情况下,图5的处理结束。
另一方面,当在两个判定的至少一方判定为未正确地进行分离工序的情况下,粒子分离装置使处理回到步骤s1。在该情况下,如果残留有能够向芯片100供给的第二状态的试样,则粒子分离装置使用第二状态的试样再次进行步骤s1以后的处理。如果没有能够向芯片100供给的第二状态的试样,则操作者从被检者再次取得血液,对第二状态的试样进行精制。接着,粒子分离装置使用精制后的第二状态的试样再次进行步骤s1以后的处理。另外,也可以将通过分离工序取得的第一试样再次供给到分离工序。
这样,当在步骤s5中判定为分离工序不适当的情况下再次进行分离工序时,可以防止不适当的第一试样被供给到后段的处理,为了取得适当的第一试样,可以顺畅地再次开始分离工序。
<分离成功与否判定方法的研究>
接着,对发明人进行的分离成功与否判定方法的研究进行说明。该研究包括以下所示的顺序1~6。
1.试样的调制
将由ctc模型细胞株得到的ctc用规定的试剂染色。接着,以包含数个~数百个左右的ctc的方式将ctc添加到pbs中,调制出相当于图2的第二状态的试样。ctc的计数使用显微镜通过目视进行。调制出12种这样的试样。
2.试样的分离
将在顺序1中调制出的12种试样分别供给到粒子分离装置,在粒子分离装置中使用图3(a)所示的芯片100,将试样分离为第一试样和第二试样。在此,在分离12种试样中的几个试样时,通过在粒子分离装置中使用于收容第二试样的容器的设置位置在上下方向上移动,从而使芯片100的微流路110内的压力变化,有意地使分离工序产生不良情况。
3.第一试样和第二试样的重量的测定
对于12种试样的每种试样,使用电子天平测定在顺序2中分离出的第一试样和第二试样的重量。因此,在该研究中,第一信息是第一试样的重量,第二信息是第二试样的重量。
4.比率的计算
将基于第一信息以及第二信息的比率设为(第一信息+第二信息)/第一信息,对于12种试样的每种试样算出比率。
5.回收率的计算
对于12种试样的每种试样,使用显微镜通过目视对第一试样中包含的ctc进行计数,将第一试样中包含的ctc的个数除以在上述顺序1中取得的试样中包含的ctc的个数,从而算出回收率。
6.散布图的制作以及一次线性回归式和确定系数的计算
图6(a)是在分离成功与否判定方法的研究中制作出的散布图。如图6(a)所示,制作出在顺序4中取得的比率和在顺序5中取得的回收率的散布图。在散布图中,对于12种试样,描绘了由比率和回收率构成的点。在图6(a)的散布图中,如上所述在分离几个试样时有意地使分离工序产生不良情况,因此,在几个试样中回收率变低。基于制作出的散布图,计算一次线性回归式和确定系数。一次线性回归式的斜率为-0.25,确定系数为0.8851。
在通过以上的顺序1~6制作出的散布图中,确定系数为接近1的值,因此,可以说针对12种试样描绘的点大致沿着一次线性回归式排列。这样,发明人发现在比率与回收率之间存在相关关系。
进而,发明人发现,由于在比率与回收率之间存在相关关系,因此,可以基于比率来评价试样的分离的精度。例如,在图6(a)所示的例子的情况下,可知为了实现回收率为70%左右以上,比率优选至少为6.0以下。进而,可知为了在cv10%的范围内实现回收率70%,比率优选为5.1以下。因此,在上述判定工序中,可以基于比率是否比规定的阈值小来判定分离工序成功与否。而且,若判定为比率比规定的阈值小,则可以判定为正确地进行了分离工序。
另外,可知在图6(a)所示的例子的情况下,为了实现回收率70%左右,至少比率优选为4.0~6.0。进而,可知为了在cv10%的范围内实现回收率70%,比率优选为4.6~5.1。因此,在上述判定工序中,判定比率是否在规定的范围内,若判定为比率在规定的范围内,则可以判定为正确地进行了分离工序。在此,在回收率过高的情况下,有可能在第一试样中大量含有不需要的细胞。但是,若判定比率是否在规定的范围内,则即便在第一试样中大量含有不需要的细胞的情况下,也可以适当地判定分离工序未正确地进行。
需要说明的是,在基于第一信息以及第二信息的比率是第一信息/(第一信息+第二信息)的情况下,在上述判定工序中,可以基于比率是否比规定的阈值大来判定分离工序成功与否。另外,在比率是第一信息/(第一信息+第二信息)的情况下,判定所使用的范围以及阈值与参照图6(a)已说明的值不同。这样,判定所使用的范围以及阈值根据比率的运算式来设定。
另外,在本研究中,第一信息以及第二信息是重量,但如上所述在第一信息以及第二信息是流速的情况下,判定所使用的范围以及阈值与第一信息以及第二信息是重量的情况不同。即,重量是将流速、截面积、试样流动的时间以及试样的比重相乘而得到的。因此,如果在重量的计算中相乘的参数中的规定参数的值反映在预先用于判定的范围以及阈值中,则用于判定的范围以及阈值与参照图6(a)已说明的值不同。这样,用于判定的范围以及阈值根据第一信息以及第二信息的种类来设定。
<分离成功与否判定方法的验证>
接着,对发明人进行的分离成功与否判定方法的验证进行说明。该验证由以下所示的顺序1~6构成。
1.试样的调制
将由癌细胞的细胞株得到的癌细胞用规定的试剂染色。接着,以包含数个~数百个左右的癌细胞的方式将癌细胞添加到健康人的血液中,调制出相当于图2的第一状态的试样。癌细胞的计数使用显微镜通过目视进行。调制出95种这样的试样。作为癌细胞的细胞株,使用肺癌细胞株“a549tt”、乳腺癌细胞株“sk-br-3”以及乳腺癌细胞株“hcc1569dp”。
2.试样的分离
将在顺序1中调制出的95种试样分别供给到粒子分离装置,在粒子分离装置中使用图3(a)所示的芯片100,将试样分离为第一试样和第二试样。
3.第一试样和第二试样的重量的测定
对于95种试样的每种试样,使用电子天平测定在顺序2中分离出的第一试样和第二试样的重量。因此,在该验证中,第一信息是第一试样的重量,第二信息是第二试样的重量。
4.比率的计算
将基于第一信息以及第二信息的比率设为(第一信息+第二信息)/第一信息,对于95种试样的每种试样算出比率。
5.回收率的计算
对于95种试样的每种试样,使用显微镜通过目视对第一试样中包含的癌细胞进行计数,将第一试样中包含的癌细胞的个数除以在上述顺序1中取得的试样中包含的癌细胞的个数,从而算出回收率。
6.散布图的制作
图6(b)是在分离成功与否判定方法的验证中制作出的散布图。如图6(b)所示,制作出在顺序4中取得的比率和在顺序5中取得的回收率的散布图。在散布图中,对于95种试样中的、可以在cv10%的范围内实现回收率70%的23种试样,描绘了由比率和回收率构成的点。
在通过以上的顺序1~6制作出的散布图中,作为阈值,设定了在上述分离成功与否判定方法的研究中取得的5.1。在该情况下,如图6(b)所示,在全部的试样中,比率比阈值小。因此,可知,根据针对比率而设定的阈值,对于适当地回收了第一细胞的23种试样,能够无误地判定正确地进行了分离工序。因此,暗示如下情况:基于在临床检查中实际从被检者采集到的试样,可以判定分离工序成功与否。
<粒子检测方法>
接着,说明粒子检测方法。
图7是表示粒子检测方法的工序的流程图。
粒子检测方法包括与图1相同的步骤s1~s3、以及步骤s11~s14。以下,对操作者在各工序中向粒子检测系统的各装置输入指示,粒子检测系统的各装置根据被输入的指示来执行各工序的情况进行说明。需要说明的是,步骤s1~s3、s11~s14的全部工序既可以通过粒子检测系统自动进行,也可以通过操作者操作设备来进行。关于粒子检测系统,随后参照图11以后的图进行说明。
由于步骤s1~s3与参照图1已说明的处理相同,因此,以下对步骤s11~s14进行说明。在步骤s11~s14的工序中,供给在步骤s3的判定工序中判定为适当地进行了试样的分离的情况下的第一试样。
在步骤s11的染色工序中,粒子检测系统为了进行流式细胞仪中的检测,对第一试样中包含的第一细胞进行染色。
图8是用于说明步骤s11的染色工序的示意图。
在步骤s11中,粒子检测系统将用于染色的试剂混合到第三状态的第一试样中,对第一细胞的目标部位进行染色。具体而言,目标部位被荧光色素荧光标记。在实施方式中,作为染色对象的目标部位是核、her2基因、以及17号染色体的着丝粒区(cep17)。如图8的上部的图所示,在第三状态下,核、her2基因以及cep17均未被染色。通过进行步骤s11的染色工序,从而如图8的下部的图所示,核、her2基因以及cep17分别被不同的荧光色素染色。这样一来,第一试样从第三状态向第四状态转移。
需要说明的是,在上述染色工序中,被染色的目标部位只要是细胞的部位即可。被染色的目标部位不限于基因、核,例如也可以是细胞的蛋白质、细胞质、细胞膜、细胞膜上的表面抗原。目标部位的染色不限于基于原位杂交或特异性染色来进行,也可以通过基于抗原抗体反应的免疫染色来进行。在目标部位是基因的情况下,不限于her2基因或cep17,也可以是其他的基因区域。在实施方式中,细胞的染色如上所述是指对细胞的基因、核、蛋白质、细胞质、细胞膜、表面抗原等进行染色。
在上述染色工序中,也可以代替细胞的基因以及核的染色而进行细胞的蛋白质以及细胞质的染色。另外,也可以与细胞的基因以及核的染色一起进行细胞的蛋白质以及细胞质的染色。在对细胞质内存在的蛋白质进行染色的情况下,优选对细胞质进行染色。作为细胞质内存在的蛋白质,可以列举来自前列腺癌的ctc中存在的psa、来自肺癌的ctc中存在的细胞角蛋白等。
需要说明的是,在即便不进行染色工序、在后段的步骤s13的检测工序中也可以进行第一细胞的检测的情况下,也可以省略染色工序。
回到图7,在步骤s12的浓缩工序中,粒子检测系统从第一试样得到第一细胞的浓度增加的测定试样。
图9是用于说明步骤s12的浓缩工序的示意图。
在步骤s12中,粒子检测系统对第四状态的第一试样进行离心分离等处理,除去离心分离后的第一试样的上清。由此,在第四状态的第一试样中包含的细胞残留的状态下液量降低,第一细胞的浓度增加。这样一来,第四状态的第一试样成为第五状态的测定试样。在浓缩工序中,以使测定试样中包含的细胞的浓度成为规定的浓度的方式浓缩第一试样。
通过浓缩工序,测定试样中包含的细胞的浓度成为规定的浓度,因此,在后段的检测工序中,可以适当且高效地进行流式细胞仪的检测。
回到图7,在步骤s13的检测工序中,粒子检测系统将在浓缩工序中得到的测定试样供给到流式细胞仪来检测第一细胞。
图10是用于说明步骤s13的检测工序的示意图。
在步骤s13中,粒子检测系统将第五状态的测定试样供给到流式细胞仪,通过设置于流式细胞仪的拍摄部,对从测定试样中包含的细胞产生的荧光进行拍摄。由此,针对测定试样中包含的每个细胞取得荧光图像。另外,流式细胞仪基于取得的荧光图像,判定her2基因是否扩增,检测her2基因扩增的阳性细胞作为ctc。
需要说明的是,在检测工序中,也可以代替流式细胞仪而利用显微镜进行ctc的检测。在该情况下,例如,操作者使用显微镜通过目视来检测her2基因扩增的阳性细胞。
如上所述,在步骤s11~s14的工序中,供给在步骤s3的判定工序中判定为适当地进行了试样的分离的情况下的第一试样。接着,在步骤s13中,基于在判定工序中判定为适当地进行了试样的分离的情况下的第一试样,利用流式细胞仪检测第一细胞。由此,向流式细胞仪供给的测定试样中包含的第一细胞的个数与分离前的试样中包含的第一细胞的个数接近。因此,例如,在第一细胞是稀有细胞,基于第一细胞的检测结果判断疾病的状态的情况下,对从分离前的试样中适当地分离并包含足够个数的第一细胞的测定试样进行检测。由此,在疾病的状态的判断中,可以抑制因分离后的试样中包含的稀有细胞的个数少而产生的假阴性。
回到图7,在步骤s14的解析工序中,粒子检测系统进行在检测工序中检测到的第一细胞的解析。具体而言,进行了第一细胞的检测的流式细胞仪取得第一细胞的数量、由拍摄部拍摄到的全部细胞中的第一细胞的比例等。
需要说明的是,在第一细胞是血管内皮细胞(cec)的情况下,在解析工序中,解析cec中包含的蛋白质即nfκb在细胞内的局部存在。具体而言,在染色工序中,cec经由与在cec显现的抗体特异性结合的cd146的标记抗体进行荧光标记,nfκb经由与nfκb特异性结合的标记抗体进行荧光标记。在检测工序中,拍摄基于cec的荧光,并拍摄基于nfκb的荧光。接着,基于荧光图像来检测cec。在解析工序中,判定作为信号分子的nfκb是否局部存在于核内,判定有无cec的激活。
另外,在第一细胞是来自肺癌的ctc,目标部位是细胞角蛋白的情况下,在检测工序中,基于细胞角蛋白存在于细胞质内的量进行第一细胞的检测。接着,在解析工序中,取得第一细胞的数量、第一细胞的比例。
另外,在第一粒子是外来体的情况下,在解析工序中,解析内包于外来体的mrna、mirna、蛋白质、构成外来体膜的脂质、蛋白质等。另外,在第一粒子是构成血浆的粒子的情况下,在分离工序中取得血浆作为第一试样,基于在分离工序中取得的血浆,在检测工序中进行与凝固检查相关的测定或与免疫检查相关的测定。与凝固检查相关的测定使用凝固测定装置进行,与免疫检查相关的测定使用免疫测定装置进行。接着,在解析工序中,基于测定结果进行血浆的分析。
<粒子检测系统>
接着,对用于进行图7的步骤s1~s3、s11~s14的各工序的粒子检测系统10进行说明。
图11是表示粒子检测系统10的结构的示意图。粒子检测系统10具备粒子分离装置11、染色浓缩装置12以及流式细胞仪13。
粒子分离装置11使用容器t1所收容的第二状态的试样21进行步骤s1的分离工序、步骤s2的测定工序以及步骤s3的判定工序,得到容器t2所收容的第一试样22和容器t3所收容的第二试样23。染色浓缩装置12使用容器t2所收容的第一试样22进行步骤s11的染色工序以及步骤s12的浓缩工序,得到容器t4所收容的测定试样24。流式细胞仪13使用容器t4所收容的测定试样24进行步骤s13的检测工序以及步骤s14的解析工序。
需要说明的是,粒子检测系统10由多个装置构成,但也可以由一个装置构成。
图12是表示粒子分离装置11的结构的示意图。粒子分离装置11具备控制部101、存储部102、显示输入部103、分离部104以及测定部105。
控制部101由cpu构成。控制部101基于存储部102中存储的程序进行各种处理。控制部101与粒子分离装置11内的各部分连接,接收来自各部分的信号来控制各部分。存储部102由ram、rom、硬盘等构成。显示输入部103由触摸屏式的显示器构成。需要说明的是,也可以代替显示输入部103而设置由液晶显示器构成的显示部和由鼠标、键盘构成的输入部。
被供给到了粒子分离装置11的第二状态的试样21被移送到分离部104。分离部104具备用于对芯片100的输入端部120施加正压的泵104a。操作者按照试样21的分离,更换芯片100,将新的芯片100设置于分离部104。芯片100是能够更换的部件。分离部104使第二状态的试样21向入口121流动,并且使鞘液向入口122流动。此时,分离部104通过驱动泵104a,从而将正压施加于入口121、122。由此,在微流路110中流动的试样21的速度被确定,试样21被分离为第一试样22和第二试样23。
微流路110形成于能够更换的芯片100。由此,无需进行按照试样21的分离来清洗微流路110这样的繁杂作业,仅更换芯片100就能够进行不同的试样21的分离。另外,分离部104通过使试样21在微流路110中流动,从而将试样21分离为第一试样22和第二试样23。由此,可以使用于分离试样21的结构小型化。
如参照图4(b)已说明的那样,芯片100的出口131、132分别与第一流路141和第二流路142相连。测定部105具备:设置于第一流路141的压力检测部151、设置于第二流路142的压力检测部152、以及对流速进行计算的运算部153。测定部105使压力检测部151、152检测压力,基于压力检测部151、152的检测信号使运算部153计算流速。由此,测定部105取得第一信息和第二信息。
控制部101基于在测定部105中测得的第一信息和第二信息,对分离部104中的试样21的分离成功与否进行判定。接着,控制部101使显示输入部103显示试样21的判定结果。
图13(a)、(b)是表示包括粒子分离装置11的显示输入部103所显示的判定结果在内的画面的示意图。
控制部101在判定为正确地进行了试样21的分离时,如图13(a)所示,使显示输入部103显示包含在分离工序中正确地进行了试样21的分离这种意思的画面。另一方面,控制部101在判定为未正确地进行试样21的分离时,如图13(b)所示,使显示输入部103显示包含在分离工序中未正确地进行试样21的分离这种意思的画面。
由此,操作者可以在视觉上掌握是否适当地进行了试样21的分离。另外,操作者在掌握了未适当地进行分离的情况下,可以防止通过不适当的分离得到的第一试样22被供给到后段的装置。
回到图12,从出口131流出并通过了第一流路141的第一试样22被收容于容器t2。从出口132流出并通过了第二流路142的第二试样23被收容于容器t3。实施方式的第二试样23由于不用于后段的处理,因此,被丢弃。这样一来,取得第三状态的第一试样22,粒子分离装置11的处理结束。
图14是表示染色浓缩装置12的结构的示意图。染色浓缩装置12具备控制部201、存储部202、显示输入部203、染色部204以及浓缩部205。
控制部201由cpu构成。控制部201基于存储部202中存储的程序进行各种处理。控制部201与染色浓缩装置12内的各部分连接,接收来自各部分的信号来控制各部分。存储部202由ram、rom、硬盘等构成。显示输入部203由触摸屏式的显示器构成。
染色部204具备加热部204a等。染色部204如参照图8已说明的那样,对第三状态的第一试样22进行染色处理而取得第四状态的第一试样22。在染色部204取得的第四状态的第一试样22被移送到浓缩部205。浓缩部205具备离心分离器205a和分注部205b。浓缩部205将第四状态的第一试样22分注到规定的容器,利用离心分离器205a进行第四状态的第一试样22的离心分离。接着,浓缩部205利用分注部205b除去离心分离后的容器内的上清。由此,如参照图9已说明的那样,第四状态的第一试样22被浓缩。浓缩部205将除去上清后的第一试样22作为测定试样24移送到容器t4。这样一来,取得第五状态的测定试样24,染色浓缩装置12的处理结束。
图15是表示流式细胞仪13的结构的示意图。流式细胞仪13具备控制部301、存储部202、显示输入部303以及测定部304。此外,流式细胞仪13包括:用于吸引容器t4内的测定试样24的吸引管、用于将所吸引的测定试样24移送到流动池310的流路、以及用于回收从流动池310排出的测定试样24的流路。
控制部301由cpu构成。控制部301基于存储部302中存储的程序进行各种处理。控制部301与流式细胞仪13内的各部分连接,接收来自各部分的信号来控制各部分。存储部302由ram、rom、硬盘等构成。显示输入部303由触摸屏式的显示器构成。
测定部304具备流动池310、光源321~324、聚光透镜331~334、分色镜341~343、聚光透镜351、光学单元352、聚光透镜353以及拍摄部354。测定部304向包含被荧光标记的多种目标部位的测定试样24照射光,并检测波长不同的多种荧光。在图15的测定部304中,示出相互正交的xyz轴。
测定试样24在流动池310的流路311中向z轴正方向流动。光源321~324向在流动池310中流动的测定试样24照射光。光源321~324由半导体激光光源构成。从光源321~324射出的光分别是波长λ11~λ14的激光。聚光透镜331~334分别对从光源321~324射出的光进行聚光。分色镜341使波长λ11的光透过,并反射波长λ12的光。分色镜342使波长λ11、λ12的光透过,并反射波长λ13的光。分色镜343使波长λ11~λ13的光反射,并使波长λ14的光透过。这样一来,波长λ11~λ14的光相对于在流动池310的流路311中流动的测定试样24向y轴正方向进行照射。
在此,分别标记核和两个基因的荧光色素从通过照射波长λ11的激发光而产生波长λ21的荧光的荧光色素、通过照射波长λ12的激发光而产生波长λ22的荧光的荧光色素、通过照射波长λ13的激发光而产生波长λ23的荧光的荧光色素中选择。通过分别拍摄波长λ21~λ23的荧光,从而可以取得与作为目标部位的核和两个基因相关的荧光图像。
当向在流动池310中流动的测定试样24照射波长λ11~λ14的光时,从对ctc的目标部位进行标记的荧光色素产生荧光。另外,当向在流动池310中流动的测定试样24照射波长λ14的光时,该光透过细胞。透过了细胞的波长λ14的光用于明视野图像的生成。
聚光透镜351对从测定试样24产生的波长λ21~λ23的荧光和透过了测定试样24的波长λ14的光进行聚光。光学单元352具有组合了4个分色镜而得到的结构。光学单元352的4个分色镜以相互稍微不同的角度反射波长λ21~λ23的荧光和波长λ14的光,在拍摄部354的受光面上分离。聚光透镜353对波长λ21~λ23的荧光和波长λ14的光进行聚光。
拍摄部354由tdi(timedelayintegration:时间延迟积分)照相机构成。拍摄部354对波长λ21~λ23的荧光和波长λ14的光进行拍摄,从而生成与波长λ21~λ23的荧光分别对应的荧光图像和与波长λ14的光对应的明视野图像。控制部301使存储部302存储由拍摄部354生成的荧光图像以及明视野图像。
在此,拍摄部354由tdi照相机构成,因此,对由拍摄部354的受光面接收到的荧光进行累计而生成荧光图像以及明视野图像。由此,可以提高细胞的荧光图像以及明视野图像的品质。
控制部301基于存储部302中存储的荧光图像,如参照图10已说明的那样进行阳性判定而检测ctc。具体而言,控制部301在由标记her2基因的荧光色素产生的荧光图像和由标记cep17的荧光色素产生的荧光图像中提取亮点。控制部301按每个细胞,将基于her2基因的亮点数除以基于cep17的亮点数,在算出的值比1大的情况下,判定为在该细胞中her2基因扩增。接着,控制部301将her2基因扩增的阳性细胞作为ctc而检测。接着,控制部301取得检测到的ctc的数量、由拍摄部354拍摄到的全部细胞中的ctc的比例等。
需要说明的是,实施方式的流式细胞仪13是基于拍摄图像进行细胞的检测的、所谓成像流式细胞仪,但并不限于此,也可以是利用光检测器检测从细胞产生的光并基于光检测器的检测信号来检测细胞的流式细胞仪。
- 还没有人留言评论。精彩留言会获得点赞!