孕妇母血清甲胎蛋白预测妊娠期肝内胆汁淤积症的风险模型建立方法与流程
本发明涉及医学检测领域,主要是一种孕妇母血清甲胎蛋白预测妊娠期肝内胆汁淤积症的风险模型建立方法。
背景技术:
妊娠期肝内胆汁淤积症(intrahepaticcholestasisofpregnancy,icp)是在妊娠早中孕期发展的肝脏的一种相对良性胆汁淤积性病理,是一种肝特异性疾病,发病率0.02-2.40%[1],其特征是皮肤发痒和血清胆汁酸水平升高[1-3]。通常,icp首先在妊娠28-30周时以瘙痒的形式出现,尤其是在夜间,近一半的患者通常在出现瘙痒后的1-4周内出现黄疸,患有icp的女性的血清虹膜素水平明显更高[4]。icp的病因尚不清楚,wei等[5]认为hif-1α,redd1和mtor可能在icp患者胎盘对缺氧和氧化应激的反应中起重要作用,并调节葡萄糖的代谢。更多研究表明icp可能与遗传(abcb4,exr,abcc2基因)[3,6-8],激素(雌激素,孕酮)[9-10]和环境因素的多因素造成。目前治疗icp的首选药物是基于熊去氧胆酸治疗[11-12],以减少瘙痒和肝功能损害,一旦达到胎儿肺成熟时,应考虑在37至38周内提早分娩,以减少胎儿死亡,减少新生儿发病率和死亡率的风险。血清胆汁酸升高是该疾病的唯一的实验室指标[13]。而采用母血清papp-a、afp、freeβ-hcg和胎儿nt预测icp较少报道。仅见tanay等[14]通过比较icp和正常孕妇的早孕期和中孕期唐氏综合征(down'ssyndrome,ds)生化筛查指标,结果表明papp-amom值降低表明发生icp的风险增加,而其他标记的变化不足以预测icp。相反aksandesteli等[15]研究结果表明低papp-amom水平不被认为是妊娠并发症icp。同样türkmen等[16]认为就早孕期和中孕期孕妇血清筛查结果而言,icp与正常孕妇之间无显着差异。目前母血清papp-a、afp、freeβ-hcg和胎儿nt的联合检查被广泛应用于筛查胎儿ds、18三体(edwardssyndrome,es)和开放性神经管缺陷(openneuraltubedefects,ontd)等领域,因此,本发明采用病例对照回顾性研究方法,在早中孕期ds产前筛查的基础上,选择健康胎儿孕妇和临床诊断icp的孕妇作为研究对象,探索papp-a、afp、freeβ-hcg和胎儿nt水平与icp的相关性和诊断价值。
技术实现要素:
本发明的目的在于克服现有技术存在的不足,而提供一种母血清afp和freeβ-hcg对icp的预测风险模型建立方法。
本发明的目的是通过如下技术方案来完成的。一种孕妇母血清甲胎蛋白预测妊娠期肝内胆汁淤积症的风险模型建立方法,该方法包括如下步骤:
(1)、根据有无妊娠期肝内胆汁淤积症将孕妇分为病例组和对照组,纳入病例组是指经临床确诊妊娠期肝内胆汁淤积症的孕妇,对照组为随机抽取同时期胎儿发育正常的孕妇;
(2)、采用时间分辩免疫荧光法检测2组孕妇血清的afp水平,使用afp的mom值结合预产年龄构建风险计算模型,根据roc曲线确定最佳截断值(cut-off)、曲线下面积(auc);
(3)、检测时,采用时间分辩免疫荧光法检测待测孕妇血清的afp水平,使用afp结合预产年龄构建的风险计算模型进行筛查,当待测孕妇血清的afp的mom值结合预产年龄建模预测的auc超过设定的阀值,则判定待测孕妇为妊娠期肝内胆汁淤积症。
更进一步的,风险计算模型为:类lifecycle风险值通过将预产年龄风险值与对应正态分布似然比值相乘计算,
年龄方程:riskage=0.000627+exp-16.2395+0.286*(age-0.5)
其中riskage为预产年龄风险值,age为预产年龄;
似然比计算:
一维正态分布的似然计算公式:
其中σ为对应指标标准差,ρ为两指标相关系数,μ为样本均值,此处x指代afpmom值的对数,最终icp风险值:
本发明的有益效果为:孕妇血清的afp的mom值结合预产年龄筛查妊娠期肝内胆汁淤积症具有较高的灵敏度和特异度,可以成为预测妊娠期肝内胆汁淤积症新的标志物;孕妇血清的afp的mom值结合预产年龄构建的风险计算模型筛查妊娠期肝内胆汁淤积症有较大的临床价值。
附图说明
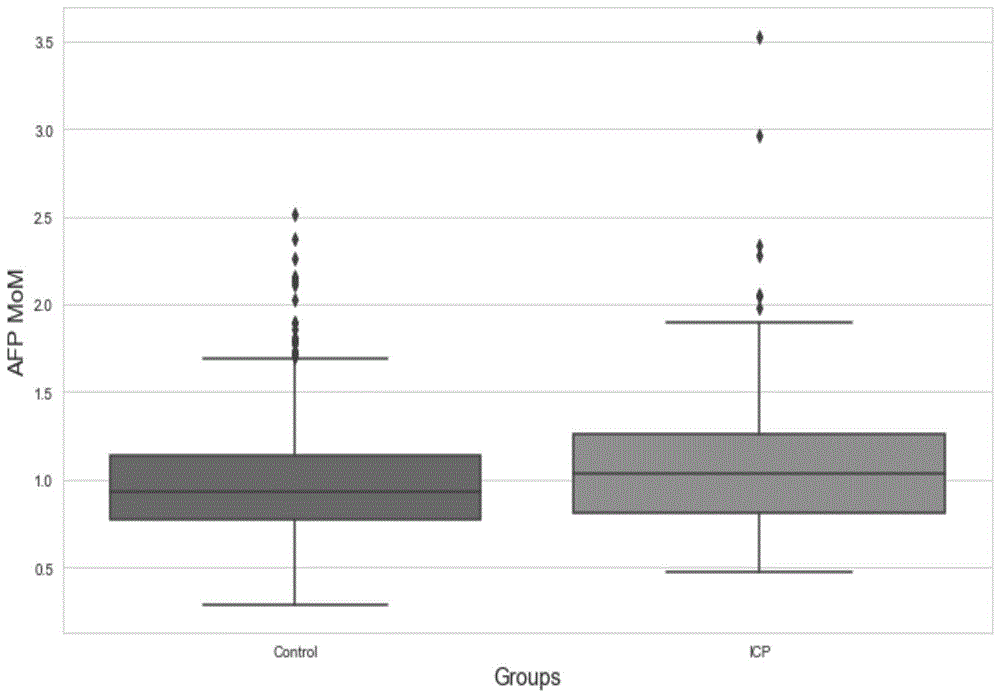
图1为两组孕妇afpmom水平比较图;
图2为建模前后2种预测方案诊断icp的roc曲线图。
具体实施方式
下面将结合附图对本发明做详细的介绍:
本发明探讨妊娠9~13+6周(早孕期)和15~20+6周(中孕期)母血清甲胎蛋白(maternalserumalpha-fetoprotein,msafp)、游离人绒毛膜促性腺激素β亚基(freeβsubunitofhumanchorionicgonadotropin,freeβ-hcg)、妊娠相关血浆蛋白a(pregnancyassociatedplasmaproteina,papp-a)、和胎儿颈部透明层(nuchaltranslucency,nt)水平与妊娠期肝内胆汁淤积症(intrahepaticcholestasisofpregnancy,icp)的相关性及诊断价值。本发明公开了一种孕妇母血清甲胎蛋白预测妊娠期肝内胆汁淤积症的风险模型建立方法,该方法包括如下步骤:
(1)、根据有无妊娠期肝内胆汁淤积症将孕妇分为病例组和对照组,纳入病例组是指经临床确诊妊娠期肝内胆汁淤积症的孕妇,对照组为随机抽取同时期胎儿发育正常的孕妇;
(2)、采用时间分辩免疫荧光法检测2组孕妇血清的afp水平,使用afp的mom值结合预产年龄构建风险计算模型,根据roc曲线确定最佳cut-off、auc;
(3)、检测时,采用时间分辩免疫荧光法检测待测孕妇血清的afp水平,使用afp结合预产年龄构建的风险计算模型进行筛查,当待测孕妇血清的afp的mom值结合预产年龄建模预测的auc超过设定的阀值,则判定待测孕妇的胎儿为妊娠期肝内胆汁淤积症。
1.对象与方法
1.1对象:收集了2015年1月至2018年10月期间参加早孕期和中孕期产前筛查的121375例孕妇,以及后期产科住院分娩的孕妇29096例孕妇资料,以孕妇姓名、出生日期、手机号和住院号相匹配原则,从杭州市妇产科医院(杭州市妇幼保健院)的医院信息系统(his)和产前筛查系统中导出excel数据,经剔除重复检测结果后,采用病例对照方法,选取符合匹配的入列数据共896例孕妇资料,其中,正常孕妇613例、icp283例。年龄分为<25岁、25~34岁和≥35岁三组,早孕孕周按≤80d、81~87d、88~94d、≥95d分为4组,中孕孕周按≤109d、109~115d、116~122d、123~129d、≥130d分为5组。所有研究对象均为单胎妊娠,在进行检查前,均知情同意并签字,本研究经医院医学伦理委员会讨论并同意。
1.2诊断和排除标准
1.2.1病例诊断:依据血清肝功能升高,胆汁酸和其他标志性胆酸(cg)或胆酸水平等标准进行诊断[17]。
1.2.2排除标准:双胎、多胎妊娠;吸烟;试管婴儿;随访结果为ds、es和ontd以及其他出生缺陷;免疫治疗及输血史;孕期特殊用药史;合并慢性高血压、心脏病、肾病、糖尿病、甲状腺功能亢进或减退、结缔组织病、血液病等慢性病史;资料信息不全者;孕妇信息与血清标本不匹配者。
1.3方法
1.3.1取材和筛查指标及方案在杭州市59家有产前筛查采血资质医院分别抽取妊娠9~13+6周和妊娠15~20+6周空腹静脉血2ml~3ml,30min后分离血清标本并保存于2℃~8℃冰箱,于1周内送检,筛查指标和方案:①早孕期检测母血清papp-a和freeβ-hcg水平,超声测量胎儿nt厚度;②中孕期检测母血清afp和freeβ-hcg;③早中孕联合筛查方案采用四联筛查方案,即将该孕妇在中孕期检测的afp、freeβ-hcg结果数据匹配其早孕期检测的papp-a和nt结果,联合计算ds、es和ontd的筛查风险率。
1.3.2试剂和仪器使用1235autodelfia自动时间分辨荧光免疫分析仪(美国perkinelmer公司)进行检测,papp-a试剂(批号:649875),freeβ-hcg单一试剂盒(批号:648233),afp/freeβ-hcg双标记试剂盒(批号:644147)、增强液、洗液、质控品和标准品(perkinelmer)。测定方法采用时间分辨荧光免疫(delfia)法,检测步骤按说明书进行。
1.3.3nt厚度测定方法及筛查标准,采用volusone8超声仪(美国ge医疗公司)进行超声检测,参照英国胎儿医学协会标准[18-19]进行:取得胎儿的正中矢状面图,并在胎儿自然姿势时测量;将影像放大,使影像只显示胎儿头部及上胸;在皮肤与颈椎上的软组织之间最宽的透明处测量。胎儿nt参考范围nt厚度<2.5mm为筛查正常组,≥2.5mm为筛查异常组。
1.3.4质控室内质控品(批号656538,perkinelmer)由低值和高值2个不同水平定值质控血清,有效期内使用。室间质评为每年参加卫生部临床检验中心组织的室间质评活动2次并取得合格证书。检测和随访人员均接受岗前统一培训,并取得卫生主管部门的资质证书。
1.3.5papp-a、afp、freeβ-hcg和nt水平表示:以孕周较准的中位数倍数(multipleofmedian,mom)表示所测量的papp-a、afp、freeβ-hcg和nt水平。
1.3.6建立不同模型对icp预测效率进行比较使用由afp结合预产年龄构建的风险计算模型方案(类lifecycle风险值截断方案)相比于原单独使用afpmom值的单截断方案,afp的mom值服从多元正态分布f(afpmom),按照风险计算模型的建模方法[20],可以计算得出各指标分布的对应参数,模型通过计算分布似然作为icp风险。使用相同的原理分别构建三个模型:模型一:afpmom值单联;模型二:afpmom值和预产年龄单联。
1.4统计学分析:采用ibm-spss24.0statisties(usaibm-spss)进行统计学处理。数据正态性检验采用one-samplekolmogorov-smirnov检验,papp-a、freeβ-hcg等数据呈偏态分布,以中位数及百分位数[m(p2.5,p97.5)]表示,年龄、nt数据呈正态分布以均数±标准差(x±s)表示。偏态分布数据,两组或多组间的比较采用mann-whitneyu或mann-whitneyh检验。正态分布数据,两组或多间的比较采用独立t检验或方差分析。采用二元logistic回归分析计算各相关变量比值比(or)及95%置信区间(ci)。利用roc曲线确定cut-off、auc,对afp的诊断价值进行评价。并计算afp的最佳cut-off、auc、约登指数。p<0.05时认为差异具有统计学意义。此时auc最大且灵敏度较高的风险模型具有更优秀的诊断价值。
2.结果
2.1基础指标比较
icp组年龄为29.18±2.80岁,高于对照组的28.33±2.79岁,差异有统计学意义(t=4.209,p<0.001);不同年龄间进一步两两比较,两组孕妇不同年龄间ds、es风险间有相关性(x2=33.411,p<0.001,x2=7.728,均p=0.021),两组中孕期孕妇不同年龄间的afpmom水平差异无统计学意义(x2=2.385,p=0.304),两组早中孕期孕妇不同年龄间的freeβ-hcgmom水平差异均有统计学意义(x2=7.898,p=0.019,x2=6.810,p=0.033);icp组的中孕期孕天118.00(110.00~130.00)天高于对照组的117.00(108.00~128.00)天,差异有统计学意义(z=20.356,p=0.018);不同中孕期孕天间进一步两两比较,两组孕妇不同中孕期孕天间afpmom、freeβ-hcgmom水平差异均无统计学意义(x2=5.853,p=0.210,x2=4.448,均p=0.349);icp组的早孕期体质量、中孕期体质量和中孕期孕天与对照组相同,差异均无统计学意义(z=0.177,z=0.261,z=0.623,均p〉0.05);见表1。
表1icp和对照组孕妇基础资料比较
2.2两组孕妇papp-a、afp、freeβ-hcg和nt水平比较
icp组的afp水平分别为1.03(0.52~1.97)mom,高于对照组0.93(0.53~1.76)mom,差异有统计学意义(z=3.824,p<0.001),见图1和表2;icp组的papp-a、nt和中孕期freeβ-hcg水平高于对照组[0.97mom、0.94mom和1.08mom比0.96mom、0.93mom和1.03mom],差异均无统计学意义(z=1.108,t=0.848,z=0.636,均p>0.05);icp组的早孕期freeβ-hcg水平低于对照组(0.98mom比1.07mom),差异无统计学意义(z=1.154,p=0.249),见表2。
表2icp和对照组孕妇papp-a、freeβ-hcg和afp等指标结果比较
2.3二元logistic回归分析结果
采用二元logistic回归模型,分析结果发现:孕妇afp和年龄的or分别为2.223(95%ci:1.471~3.359)和1.113(95%ci:1.057~1.172),是icp的危险因素,见表3。
表3孕妇预产年龄和afpmom与icp的二元logistic分析
2.4afp预测icp的临床价值
icp作roc曲线,afpmom值对icp的auc为0.579(95%ci:0.539~0.620,p<0.001),当afp的cut-off为1.01mom时,对应的灵敏度、特异度和约登指数,分别为0.530、0.622和0.152。见表4和图2。
表4建模前后afpmom值对icp的诊断价值
2.5afp结合预产年龄预测icp的价值
如果afpmom结合预产年龄构建模型预测icp的auc为0.612(95%ci:0.572~0.652,p〈0.001),具体建模过程如下:
类lifecycle风险值计算方法[20]
预产年龄方程[21]:
年龄方程:riskage=0.000627+exp-16.2395+0.286*(age-0.5)
其中riskage为预产年龄风险值,age为预产年龄;
似然比计算:
一维正态分布的似然计算公式:
其中σ为对应指标标准差,ρ为两指标相关系数,μ为样本均值,此处x指代afpmom值的对数,最终icp风险值:
2.6不同预测方案比较类lifecycle风险值截断方案与afpmom值的单截断方案比较其中以afpmom结合预产年龄构建模型预测icp的auc最高为0.612高于afp单独预测icp的0.579诊断价值,见图2。
3.讨论
icp主要是指是以是皮肤发痒和血清胆汁酸水平升高的常见妊娠期合并症之一[2-3]。临床诊断主要是通过实验室检测血清胆汁酸水平升高来确诊[13,22]。目前母血清papp-a、afp、freeβ-hcg和胎儿nt的联合检查技术被广泛应用于筛查胎儿ds、es、ontd、腹裂和脐膨出等领域的产前筛查[23-25],而采用母血清papp-a、afp、freeβ-hcg和胎儿nt预测icp较少报道。因此,本发明主要通过检测213例icp和同时期613例正常孕妇的papp-a、afp、freeβ-hcg和胎儿nt水平与icp的相关性和诊断价值进行回顾性探讨。
本发明结果显示,icp组的afp水平分别为1.03(0.52~1.97)mom,高于对照组0.93(0.53~1.76)mom,差异有统计学意义(z=3.824,p<0.001);然而r.
本研究结果还显示,孕妇afpmom和预产年龄的or分别为2.223(95%ci:1.471~3.359)和1.113(95%ci:1.057~1.172),孕妇afpmom对icp发生的影响大于预产年龄因素,如果afpmom结合预产年龄建模预测的auc为0.612(95%ci:0.572~0.652,p〈0.001),大于afpmom和预产年龄单指标因素,基于afpmom值对icp的auc、灵敏度和特异度均不高,在临床诊断时应该要结合其它实验室检测指标进行决策。
另外,本研究基础资料部分结果显示,两组孕妇不同年龄间ds、es风险间差异均有统计学意义(x2=33.411,p<0.001,x2=7.728,p=0.021),但两组孕妇在不同年龄和不同孕于间的afpmom水平差异无统计学意义(均p>0.05),说明本研究icp和对照组间在papp-a、afp、freeβ-hcg和胎儿nt水平,不会随孕妇的不同年龄、体质量和孕天的变化而影响本次结果。
总之,中孕期妇女afpmom和预产年龄是icp的危险因素,afpmom结合预产年龄建模预测icp的auc最大,可辅助诊断晚期孕妇发生icp可能。而早孕期的papp-a、nt和早中孕期的freeβ-hcg对icp无诊断价值。
参考文献
[1]ghoshs,chaudhuris.intra-hepaticcholestasisofpregnancy:acomprehensivereview[j].indianjournalofdermatology,2013,58(4):327.
[2]kremerae,wolfk,
[3]maeviv,andreevdn,dichevadt,etal.[intrahepaticcholestasisofpregnancy:state-of-the-art].[j].klinmed(mosk).2015,93(6):25-30.
[4]kirbasa,daglark,timurh,etal.maternalcirculatinglevelsofirisininintrahepaticcholestasisofpregnancy[j].journalofmaternal-fetalandneonatalmedicine,2015,29(21):3483-3487.
[5]weiw,huyy.expressionofhypoxia-regulatedgenesandglycometabolicgenesinplacentafrompatientswithintrahepaticcholestasisofpregnancy[j].placenta,2014,35(9):732-736.
[6]abcb4mutationsinadultpatientswithcholestaticliverdisease:impactandphenotypicexpression[j].journalofgastroenterology,2016,51(3):271-280.
[7]henkelsa,squiresjh,ayersm,etal.expandingetiologyofprogressivefamilialintrahepaticcholestasis[j].worldjournalofhepatology,2019,11(5):450-463.
[8]gautherotj,delautier,danièle,maubertma,etal.phosphorylationofabcb4impactsitsfunction:insightsfromdisease-causingmutations[j].hepatology,2014,60(2):610-621.
[9]nikolovav,hayyehsa,papacleovouloug,etal.intrahepaticcholestasisofpregnancylevelsofsulfatedprogesteronemetabolitesdownregulatehepaticlxr[a].[j].hepatology,2013,57(2):716-726.
[10]abu-hayyehs,martinez-becerrap,sheikhaksh,etal.inhibitionofna+-taurocholateco-transportingpolypeptide-mediatedbileacidtransportbycholestaticsulfatedprogesteronemetabolites[j].journalofbiologicalchemistry,2010,285(22):16504-16512.
[11]lofthouseem,torrensc,manousopouloua,etal.ursodeoxycholicacidinhibitsuptakeandvasoconstrictoreffectsoftaurocholateinhumanplacenta[j].thefasebjournal,2019,33(7):8211-8220.
[12]geenesv,anita
[13]mannalb,ovadiac,
[14]tanayta,ahmett,tolgaa,etal.couldfirst-andsecond-trimesterbiochemicalmarkersfordownsyndromehavearoleinpredictingintrahepaticcholestasisofpregnancy?[j].archivesofmedicalscience,2018,14(4):846-850.
[15]aksandesteli,g,sahin-uysal,n,cok,t,etal.firsttrimestermaternalserumpapp-alevelsandassociatedpregnancycomplicationsinintrahepaticcholestasisofpregnancy[j].clinexpobstetgynecol,2016,43(5):673-677.
[16]türkmen,gg,timurh,yilmazz,etal.effectofintrahepaticcholestasisofpregnancyonmaternalserumscreeningtests[j].journalofneonatal-perinatalmedicine,2016,9(4):411-415.
[17]pradhanm,shaoy.clinicalgradingofintrahepaticcholestasispregnancy[j].journalofthenepalmedicalassociation,2013,52(190):413-419.
[18]bestwickjp,huttlywj,waldnj.distributionofnuchaltranslucencyinantenatalscreeningfordown\"ssyndrome[j].journalofmedicalscreening,2010,17(2):jmedscreen.2010;17(1):8-12.
[19]bestwickjp,huttlywj,waldnj.theestimationofmediannuchaltranslucencyvaluesbetween10and14weeksofpregnancy[j].journalofmedicalscreening,2014,21(2):110-112.
[20]roystonp,thompsonsg.model-basedscreeningbyriskwithapplicationtodown'ssyndrome[j].statisticsinmedicine,1992,11(2):257-268.
[21]cucklehs,waldnj,thompsonsg.estimatingawoman'sriskofhavingapregnancyassociatedwithdown'ssyndromeusingherageandserumalpha-fetoproteinlevel[j].bjog:aninternationaljournalofobstetrics&gynaecology,1987,94(5):387-402.
[22]manzottic,casazzag,stimact,etal.totalserumbileacidsorserumbileacidprofile,orboth,forthediagnosisofintrahepaticcholestasisofpregnancy[j].cochranedatabasesystrev,2019,7:cd012546.
[23]santorumm,wrightd,syngelakia,etal.accuracyoffirsttrimestercombinedtestinscreeningfortrisomies21,18and13[j].ultrasoundinobstetrics&gynecology,2017.49(6):714-720.
[24]waldnj,watthc,hackshawak.integratedscreeningfordown'ssyndromebasedontestsperformedduringthefirstandsecondtrimesters[j].newenglandjournalofmedicine,1999,341(7):461-467.
[25]cheny,zhangw,lus,etal.maternalserumalphafetoproteinandfreeβ-hcgofsecondtrimesterforscreeningoffetalgastroschisisandomphalocele[j].zhejiangdaxuexuebao.yixueban=journalofzhejianguniversity.medicalsciences,2017,46(3):268-273.
[26]r.
[27]elorantaml,heinonens,kirkinenp.intrahepaticcholestasisofpregnancyhasnoeffectonmaternalserumsecondtrimesteralpha-fetoproteinandhcg[j].actaobstetriciaetgynecologicascandinavica,2000,79(7):548-552.
可以理解的是,对本领域技术人员来说,对本发明的技术方案及发明构思加以等同替换或改变都应属于本发明所附的权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!