用于胎盘或胎儿健康的循环生物标志物的制作方法
领域
本发明总体上涉及临床管理哺乳动物(包括人类)的妊娠的方案。本发明提供了有助于临床妊娠管理的诊断靶和试剂,从而能够改善在胎盘功能不全(placentalinsufficiency)环境中发育的胎儿的产前(pre-natal)和产后(post-natal)健康结果。
背景
作者在本说明书中引用的出版物的文献目录细节按字母顺序收集在说明书的最后部分。
本说明书中对任何在先出版物(或从其获得的信息)或任何已知事物的提及,不是并且也不应被视为认可或承认或以任何形式暗示该在先出版物(或从其获得的信息)或已知事物形成本说明书所涉及的所属领域中的公知常识的一部分。
胎儿生长受限(fetalgrowthrestriction,fgr),也称为宫内生长受限(intrauterinegrowthrestriction,iugr),代表产后健康不佳的主要原因,是人类死产的主要原因,并给儿童和家庭留下终身遗留问题。fgr是胎儿未能达到其遗传上预先确定的生长潜力。fgr代表了一种非常严重的妊娠并发症,并且如上所述,是死产的最大风险因素——死产是一种毁灭性的悲剧,影响了澳大利亚1:130的妊娠。此外,每年在澳大利亚出生约27,000个fgr或小于胎龄(sga;出生体重<第10百分位数(centile))婴儿。fgr和出生时为sga是胎盘功能不全的相关结果。
fgr也是围产期发病率的主要决定因素,其中低出生体重婴儿经历较差的神经发育结果(miller等人.(2016)thejournalofphysiology594:807-823)。此外,fgr与以后的生活中的不良结果相关:生长受限的学龄儿童具有更高比率的受损的认知、记忆、注意力和大运动能力(miller等人.(2016)同上)。它的影响可以持续终生——成年人具有较高的主要慢性病诸如心血管疾病、中风和糖尿病的患病率(barker和osmond(1986)lancet1:1077-1081;cooper等人.(1997)annalsoftherheumaticdisease56:17-21;hales和barker(1992)diabetologia35:595-601;barker(1998)clinicalscience95:115-128;barker(2000)theriogenology53:555-574)。胎盘功能不全可导致胎儿慢性低氧血症和降低的营养供应,其最终导致胎儿生长减缓和不良脑发育,这本身可以导致神经问题。这些都是fgr和sga婴儿的特征。
当胎盘不能为胎儿提供足够的氧气和营养交换时发生胎盘功能不全(mifsud和sebire(2014)fetaldiagnosisandtherapy36:117-128)。胎儿通过以下作出响应:减少其生长和重新分配资源以确保生存;将血液输送到重要器官诸如脑。当这些生存适应失败时,死产发生。对能够可靠地检测不良的胎儿生长和胎盘功能存在需求,使得能够在死产发生前及时分娩。减轻fgr的健康负担的一个主要障碍是无法准确鉴定sga胎儿,其中fgr病例更为常见。
目前检测fgr的方法差得惊人。用于fgr的最常用的筛查测试是使用卷尺(tapemeasure)检测妊娠中的sga胎儿。测量母体腹部以评估子宫的大小,并且如果怀疑胎儿较小,则进行超声。然而,这种方法具有的在正常体重的女性中检测sga的灵敏度(即检出率)仅为约20%,在超重或肥胖的女性中甚至更低。预期向所有妊娠晚期的女性提供超声可能可靠地挑选出所有的小婴儿,但已经显示出这种方法具有的针对出生时的sga的检出率仅为46%(fadigas等人.(2015)ultrasoundinobstetricsandgenecology45:559-565)–57%(sovio等人.(2015)lancet386:2089-2097),即使在理想的研究环境下也是如此(fadigas等人.(2015)同上)。普遍超声的成本和可及性使得广泛采用行不通,突出了对更好地鉴定受fgr影响的妊娠的新工具的明确需求。超声仍然是妊娠管理诸如检测巨大胎儿(fetalmacrosomia)中的有价值的工具。巨大胎儿是其中新生儿具有显著大于平均值的出生体重(即体重通常超过4kg)的状况,其可导致出生并发症并增加新生儿受伤的风险。
概述
本文教导了一种监测胎盘健康的测定,所述测定能够确定胎盘功能不全的水平或状态。该信息对于成功的临床妊娠管理至关重要,以便检测fgr和sga婴儿。可靠地检测包括胎盘功能不全在内的这样的状况的能力,可以实现临床干预,诸如密切的胎儿监测和提早分娩。本发明教导了生物标志物spint1和syndecan1,单独地或共同地是胎盘健康状态的标志物。任一种或两者的低水平是胎盘功能不全的指示物。任一种或两种生物标志物的升高的水平也可以是不利地影响胎儿的状况诸如巨大胎儿的指示物。
因此,本文实现了一种确定雌性哺乳动物受试者中的胎盘健康状态的测定,该方法包括确定spint1和/或syndecan-1的母体循环水平,其中spint1和/或syndecan-1的浓度相对于对照的降低或随时间的降低或者比率相对于对照的变化或随时间的变化指示胎盘功能不全,并且spint-1和/或syndecan-1的升高是胎盘功能充足(placentalsufficiency)的量度或胎盘功能充足方面的改善的量度。
本文还实现了一种用于妊娠哺乳动物受试者的临床管理方案,该方案包括确定循环spint1和/或syndecan-1的水平,其中spint1和/或syndecan-1与对照或统计学上验证的水平相比随时间的降低或者反映spint1和/或syndecan-1的水平降低的比率变化指示胎盘功能不全,并且其中胎儿被监测或进行提早分娩。
因此,本文实现了一种确定雌性哺乳动物受试者中的胎盘健康状态的测定,该方法包括确定spint1和/或syndecan-1的母体循环水平,其中spint1和/或syndecan-1的浓度相对于对照的降低或随时间的降低或者比率相对于对照的变化或随时间的变化指示胎盘功能不全,并且spint-1和/或syndecan-1的升高是胎盘功能充足的量度或胎盘功能充足方面的改善的量度。
本文还教导了一种检测雌性哺乳动物受试者中的异常胎儿体重诸如巨大儿(macrosomia)的测定,该方法包括确定spint1和/或syndecan-1的母体循环水平,其中spint1和/或syndecan-1的浓度相对于对照的升高或随时间的升高或者比率相对于对照的变化或随时间的变化指示潜在的巨大儿。
本文还实现了一种用于妊娠哺乳动物受试者的临床管理方案,该方案包括确定循环spint1和/或syndecan-1的水平,其中spint1和/或syndecan-1与对照或统计学上验证的水平相比随时间的降低或者反映spint1和/或syndecan-1的水平降低的比率变化指示胎盘功能不全,并且其中胎儿被监测或进行提早分娩。
本文还教导了一种用于妊娠哺乳动物受试者中的巨大儿的临床管理方案,该方案包括确定循环spint1和/或syndecan-1的水平,其中spint1和/或syndecan-1与对照或统计学上验证的水平相比随时间的升高或反映spint1和/或syndecan-1水平升高的比率变化指示巨大儿,其中胎儿被监测或进行提早分娩。
生物标志物的浓度或水平的确定能够建立基于相对于对照的浓度的诊断规则(diagnosticrule)。可选地,诊断规则基于统计和机器学习算法或分析函数或分析方法或其他数据处理手段的应用。这样的算法或分析函数或分析方法或其他数据处理手段使用生物标志物和在训练数据(具有已知的胎盘功能充足性状态)中观察到的胎盘功能充足性状态之间的关系来推断随后用于预测具有未知状态的患者的状态的关系。可以使用提供患者患有胎盘功能不全的概率指数(indexofprobability)的算法或分析函数或分析方法或其他数据处理手段。算法或分析函数或分析方法或其他数据处理手段可以执行多变量或单变量分析函数或其他统计操作。
因此,在一种实施方案中,本发明提供了基于统计和机器学习算法或分析函数或分析方法或其他数据处理手段的应用的诊断规则。这样的算法或分析函数或分析方法或其他数据处理手段使用生物标志物和在训练数据(具有已知的胎盘功能充足性状态)中观察到的胎盘功能充足或功能不全的状态之间的关系来推断随后用于预测具有未知的胎盘功能充足性状态的患者的状态的关系。数据分析领域的从业技术人员认识到,可以使用许多不同形式的训练数据中的关系的推断,而不会实质上改变本发明。
本发明还构思了用于检测受试者中胎盘功能不全或胎盘健康状态或功能障碍的生物标志物的组(panel),所述组包括与生物标志物特异性结合的剂(agent)以确定生物标志物的水平并且然后任选地使水平经历从第一数据知识库(firstknowledgebaseofdata)生成的算法或分析函数或分析方法或其他数据处理手段,所述生物标志物选自spint1、syndecan-1、spint1和syndecan-1二者或者spint1或syndecan-1中的一种与至少一种其他生物标志物,所述第一数据知识库包括来自具有关于状况的已知状态的受试者的相同生物标志物的水平,其中所述算法或分析函数或分析方法或其他数据处理手段提供受试者具有或不具有胎盘功能不全的概率指数。
本文教导的测定包括确定spint1、syndecan-1、spint1和syndecan-1的水平和/或确定spint1和/或syndecan-1与至少一种其他生物标志物的水平。
提及至少一种其他生物标志物包括但不限于以下的一种或更多种:胎盘生长因子(plgf)、可溶性fms样酪氨酸激酶-1(sflt)和/或血管内皮生长因子(vegf)以及其他生物标志物和/或胎盘功能不全或其结果诸如fgr的生理化学参数(例如超声数据)。
在一种实施方案中,哺乳动物受试者是人类女性。然而,本发明扩展到兽医学应用。通常,确定全血、血浆或血清中的循环spint1和/或syndecan-1。还可以测试其他流体,包括腹水、淋巴液或尿液。
在一种实施方案中,在受试者被确定为患有胎盘功能不全的情况下,对妊娠进行临床管理以使胎儿的健康结果最大化。这包括提早分娩胎儿。类似地,如果在进行或不进行超声或其他生理化学测试的情况下表明巨大胎儿是由于spint1和/或syndecan-1的升高引起的,则可指示婴儿的提早分娩。
本发明的测定扩展到胎盘功能不全或其结果诸如fgr的生物标志物蛋白或经由编码生物标志物的rna和/或循环rna标志物的直接或间接检测。
虽然在一种实施方案中本发明涉及监测生物标志物水平的降低作为胎盘功能不全的指示物,升高的spint1和/或syndecan-1水平的检测则用作巨大胎儿的指示物或预测物,并且这形成了本发明的一部分。
表1提供了遍及本说明书使用的缩写列表。
表1
缩写
附图简述
一些附图包含颜色表示或实体。彩色照片可根据请求从专利权人或从适当的专利局获得。如果从专利局获得,可能会收取费用。
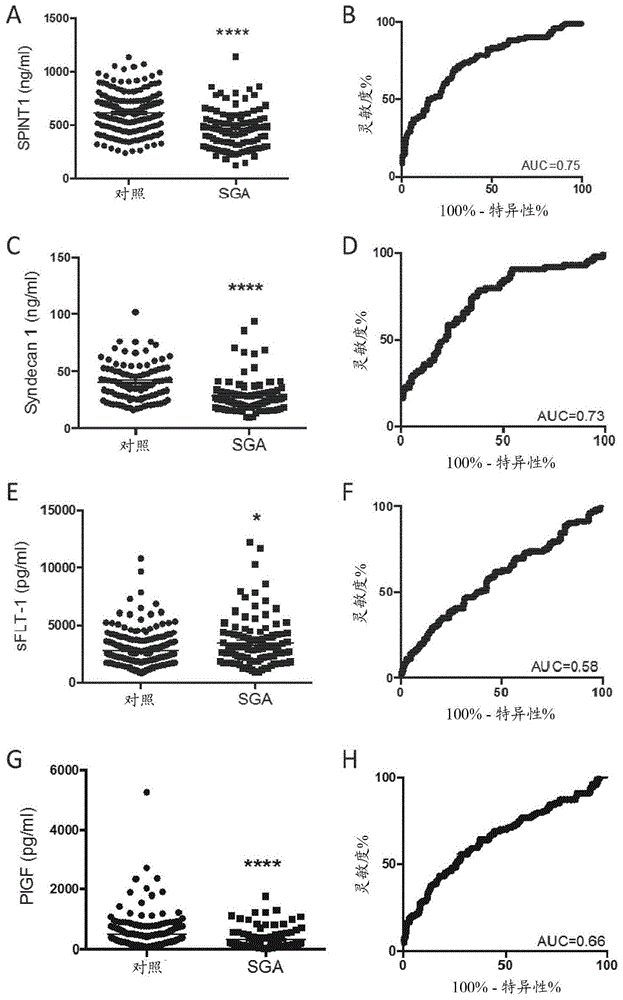
图1a至图1p是示出了使用商购可得的elisa测量的血浆中的循环spint1和syndecan-1的图解表示。spint1来自sigmaaldrich并且syndecan-1来自thermofisherscientific。sflt-1和plgf使用来自roche的诊断测试测定进行测量。病例对照队列选自提供妊娠36周时的血液样品的患者。spint1水平(n=210名对照,n=104名sga)在分娩sga婴儿(相对于胎龄,出生体重<第10百分位数)的患者中的显著降低(a),具有0.75的受试者操作曲线下面积(auc)(b)。当测量病例对照队列(n=99名对照,n=89名sga)中的syndecan-1时,还发现随后分娩sga婴儿的女性中的syndecan-1显著降低(c),具有0.73的auc(d)。相比之下,循环sflt-1(n=207名对照,n=102名sga)在分娩sga婴儿的女性中显著增加(e),具有0.58的auc(f),而循环plgf(n=210名对照,104名sga)显著减少(g),具有0.66的auc(h)。随后,本发明人继续在由妊娠36周时收集的1004个样品组成的样品集中验证来自病例对照队列的结果。920名对照和其中母亲随后分娩sga婴儿的84名病例。本发明人发现,随后分娩sga婴儿的女性中的循环spint1显著降低(i),具有0.74的auc(j)。类似地,分娩sga婴儿的女性中的syndecan-1显著降低(k),具有0.65的auc(l)。然后评估了母体循环中的这些蛋白可能降低的时间在妊娠中有多早。为此,选择了病例对照队列,并在妊娠28周时测量循环spint1(n=130名对照,n=104名sga)和syndecan-1(n=100名对照,n=84名sga)。在妊娠28周时,随后分娩sga婴儿的女性中的spint1已经显著降低(m),具有0.69的auc(n)。类似地,在妊娠28周时syndecan-1显著降低(o),具有0.69的auc(p)。数据表示为平均值+/-sem-每个符号表示个体患者*p<0.05,****p<0.0001。
图2a到图2d是示出每个研究婴儿的出生体重百分位数的图解表示,出生体重百分位数根据母体胎次(maternalparity)、预定(booking)体重、身高、婴儿性别和以天计的确切胎龄定制。为了确定出生体重和循环spint1水平之间是否存在关系,对两个数据集进行绘图。图2a显示,妊娠36周时的循环母体spint1与随后的婴儿出生百分位数相关——在b图中绘制了1004名患者中的每一名的这种相关性,其中存在统计学上显著的相关性。c图示出,妊娠36周时的循环母体spint1(n=145)与出生后几天内测量的新生儿瘦体重(leanmass)显著相关。d图示出,虽然36周时的spint1与新生儿瘦体重相关,但与也在出生后几天内测量的皮褶体脂百分比(skinfoldbodyfatpercentage)(n=145)不相关。
图3a至图3p是示出确定人类sga病例中的胎盘spint1是否改变的观察研究的图解表示。为此,从对照、先兆子痫或sga妊娠选择胎盘的队列。使用定量rt-pcr测量spint1mrna,并且显示出在妊娠<34周时分娩其婴儿的患者中,pe和sga队列中的spint1mrna与对照相比均显著降低(a)。在从妊娠>34周时分娩的患者收集的胎盘中未检测到spint1mrna表达的变化(b)。使用蛋白质印迹和商购可得的抗体评估spint1蛋白表达(c、d)。在妊娠<34周时(c)和妊娠>34周时(d)二者收集的样品中,来自分娩sga婴儿的女性的胎盘中的spint1蛋白显著降低。生长受限通常与胎盘功能不全和胎盘供氧不良(导致胎盘低氧)相关。本发明人评估了将原代胎盘细胞(从足月人类胎盘分离的细胞滋养层细胞)暴露于低氧条件(对于低氧,1%的氧气,以及对于常氧,8%的氧气)是否会改变spint1mrna和蛋白表达以及蛋白分泌。本发明人最初通过qrt-pcr评估了mrna表达(e),并且发现原代胎盘细胞暴露于低氧导致显著降低的spint1mrna表达,且通过蛋白质印迹测量的细胞蛋白观察到类似发现(f)。使用与用于测量血液中的血浆spint1相同的elisa测量了spint1向浸浴胎盘细胞的培养基中的分泌,并且发现当使得胎盘细胞低氧时,培养基中spint1的水平也显著降低(g)。因此,发现强有力的证据证明胎盘低氧降低了spint1。鉴于先前小鼠中缺乏spint1可能与胎盘发育不良相关的证据,本发明人接下来着手评估在htr8胎盘细胞系中使用sirna敲低来使spint1沉默是否会影响使用xcelligence系统实时评估的细胞增殖。事实上,当htr8细胞中的spint1被沉默时,发现增殖受损(n)。接下来,本发明人想知道对增殖的这种影响是否可能是凋亡增强的结果。为了确定这一点,使htr8细胞中的spint1沉默,然后收集蛋白并通过蛋白质印迹测量凋亡标志物bax、bcl2和裂解的胱天蛋白酶3。虽然发现spint1蛋白表达如预期地显著降低(上面的图示出了sispint下的条带的缺乏),但凋亡标志物的表达没有显著变化,表明spint1被沉默时降低的增殖不是增加的凋亡的结果(o)。β-肌动蛋白用作上样对照。接下来试图评估增强spint1是否会改变htr8胎盘细胞系增殖。为此,将被称为sri31215的商购可得的spint1模拟物(glixxlaboratories)施加到htr8细胞,并使用xcelligence系统监测它们的增殖。事实上,发现5um或10um的sri31215增强htr8增殖(p)。数据表示为平均值+/-sem-每个符号代表个体患者或小鼠*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
图4a至图4c是示出循环syndecan-1随婴儿出生百分位数增加的图解表示(a)。母体syndecan-1与出生后几天测量的新生儿瘦体重(b)和皮褶体脂百分比(c)显著相关。
图5a至图5e是示出确定人类sga病例中的胎盘syndecan-1是否改变的观察研究的图解表示。为此,从对照、先兆子痫或sga妊娠选择胎盘的队列(用于测量spint1的同一队列)。使用定量rt-pcr测量syndecan-1mrna,并且显示出在妊娠<34周时分娩其婴儿的患者中,先兆子痫(pe)和小于胎龄(sga)队列中的胎盘syndecan-1mrna与对照相比均显著增加(a)。随后测量蛋白表达。用于蛋白质印迹的商业抗体产生3条不同的条带,所述条带可能对应于syndecan-1的不同同种型。这些条带的密度计分析(densiometricanalysis)表明,在sga胎盘中,85kda(b)和80kda(c)的条带没有变化,而33kda的条带显著减少(d)。随后测量妊娠>34周时分娩的胎盘中的syndecan-1mrna表达,并且发现表达无显著变化(e)。数据表示为平均值+/-sem-每个符号代表个体患者,*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
图6a至图6f是确定胎盘syndecan-1是否因低氧而变化以及使其表达沉默是否改变细胞增殖的功能研究的示意表示。a图、b图和c图示出,在原代人类滋养层中,在低氧下,syndecan-1mrna(a)显著减少,而细胞蛋白没有差异(b)。在低氧下,分泌的syndecan-1蛋白显著减少(c)。在暴露于低氧的妊娠小鼠中,胎盘内的鼠syndecan-1没有变化(d、e)。当使用sirna使胎盘细胞系htr8细胞中的syndecan-1沉默时,细胞增殖受损(f)。数据表示为平均值+/-sem-每个符号代表个体患者*p<0.05,**p<0.01。
图7a至图7e示出了36周时的血浆spint1与胎盘功能不全的临床标志物相关。妊娠36周时的血浆spint1浓度与子宫动脉(ua)多普勒流动阻力(a)、新生儿瘦体重(b)和胎盘重量(c)相关。其婴儿随后出生时出生体重低于第10百分位数的女性中的血浆spint1浓度逐步降低(d)。36周时的血浆spint1浓度与出生百分位数相关(e)。将队列1和队列2两者的spint1mom合并,并根据出生百分位数进行分组。d图和e图描绘了中位数+/-四分位距。每个个体符号(c-e)代表一个患者。****p<0.0001,相对于对照(mann-whitney)。
图8a至图8d示出了spint1水平与脐动脉阻力,以及婴儿体脂百分比或脂肪量(fatmass)不相关。使用peapod空气置换体积描记装置(airdisplacementplethysmographydevice)评估了整个flag队列中的子队列的出生后婴儿身体组成。36周时的循环spint1水平与脐动脉搏动指数(a)、体脂百分比(b)或脂肪量(c)之间没有关系。测量了在<34周时分娩<第10百分位数的婴儿的女性的血浆和血清样品中的spint1浓度,并将其与来自健康对照的血浆和血清样品的spint1浓度进行比较(血浆和血清样品在同一次血液抽取时获得)。数据显示,虽然具有sga的女性的血清中的spint1显著降低,但变化程度远小于血浆中观察到的。个体符号代表个体患者。****p<0.0001,*p<0.05。
图9a至图9j示出了spint1或plgf与胎盘功能不全的临床标志物之间的相关性强度的比较。在36周时,血浆spint1浓度表现出具有与plgf相比更强的与出生体重百分位数(a对比f)、胎盘重量(b对比g)、瘦体重(c对比h)和子宫动脉阻力(d对比i)的相关性。这两种分子都与脐动脉阻力无关(e和j)。个体符号代表个体患者。
图10a至图10h示出了从多达2040名女性获得的更大样品队列中spint1或syndecan-1与胎盘功能不全的多种临床参数之间的相关性。每个符号代表个体患者。d图,数据表示为中位数+/-四分位距。****p<0.0001。
图11a至图11c验证了n=2040的整个队列(n=1827名对照,n=213名病例)中在28周时的spint1变化。数据证实,分娩sga婴儿的女性中在28周时的循环spint1显著降低(a),具有0.60的auc(b)。妊娠28周时,spint1与出生体重百分位数持续相关(c)。每个符号代表个体患者。****p<0.0001。
图12a至图12d验证了较大队列中36周时的血浆spint1的变化,并显示出与胎盘功能不全的标志物的相关性。妊娠36周时的血浆spint1浓度与子宫动脉(ua)多普勒流动阻力(a,n=325)、新生儿瘦体重(b,n=281)和胎盘重量(c,n=378)相关。其婴儿随后出生时出生体重低于第10百分位数的女性中的血浆spint1浓度逐步降低(d)。d图描绘了中位数+/-四分位距。每个个体符号(a-d)代表一个患者。****p<0.0001,相对于对照。
图13a至图13d示出了在澳大利亚墨尔本的梅西女子医院(mercyhospitalforwomen)分娩(剖腹产(caesareansection)或引产)当天收集的n=556个样品的独立队列中测量的spint1和syndecan-1。在这个队列中,我们证实了怀有sga婴儿的女性中的spint1(a、b)也显著降低,具有0.66的auc(n=47名sga,n=509名对照)。类似地,该队列中怀有sga婴儿的女性中的syndecan-1也显著降低(c、d),具有0.644的auc。
详述
遍及本说明书,除非上下文另外要求,否则词语“包含/包括(comprise)”或变形词诸如“包含/包括(comprises)”或“包含/包括(comprising)”将被理解为暗示包括所陈述的要素或整数或方法步骤,或者要素或整数或方法步骤的组,但不排除任何其他要素或整数或方法步骤,或者要素或整数或方法步骤的组。
除非上下文另外清楚地规定,否则如本说明书中使用的单数形式“一(a)”、“一(an)”和“该/所述(the)”包括复数方面。因此,例如,提及“一(a)种生物标志物”包括单一生物标志物以及两种或更多种生物标志物;提及“一(an)种测定”包括单一测定以及两种或更多种测定;提及“该/所述(the)公开内容”包括由公开内容教导的单一方面以及多于一个方面;等等。术语“发明”涵盖了在本文教导和实现的各方面。本发明的“形式”涵盖了本文预期的任何变体和衍生物。本发明的所有方面和形式在权利要求书的范围内实现。
除非另有明确指示,否则在本申请中指定的各种范围内的数值的使用被陈述为近似值,如同在所陈述范围内的最小值和最大值都以词“约”开头。以这种方式,高于和低于所陈述范围的微小变化可用于实现与范围内的值大体上相同的结果。此外,这些范围的公开内容意在作为包括最小值和最大值之间的每个值的连续范围。此外,本发明扩展到两种或更多种标志物的比率,提供了与胎盘功能不全的风险水平相关的数值。
本发明涉及一种确定妊娠哺乳动物受试者中生物标志物spint1和/或生物标志物syndecan-1中的一种或任一种或两种的循环水平的测定。spint1和/或syndecan-1可以分别地或一起被测定,所述测定可以单独进行或与一种或更多种其他生物标志物和/或一种或更多种生理化学参数(诸如来自超声的数据)组合地进行。认为这些生物标志物当以降低的水平存在时是胎盘功能不全的指示物。认为当升高时,这些生物标志物单独地或与一种或更多种生物标志物和一种或更多种生理化学参数(诸如来自超声的数据)组合地指示胎儿体重异常,包括但不限于巨大胎儿。
术语“测定”包括但不限于用于确定spint1和/或syndecan-1的水平或周转率(velocity)的方法、方案、步骤或一系列步骤和/或过程。可以将spint1和/或syndecan-1的水平与标准化对照进行比较,或者可以将spint1和/或syndecan-1的水平与统计学上验证的预先确定的水平进行比较。标准化对照的实例是相同年龄和体质特征的正常妊娠雌性受试者中的水平。周转率包括任一生物标志物的水平的增加或减少的比率或程度。spint1和/或syndecan-1的水平或周转率可以表示为浓度水平,所述浓度水平以皮克、纳克、微克或毫克/循环流体体积(通常以毫升计,尽管可以以任何体积量表示)的量计,但不限于此。可选地,生物标志物的水平或周转率以彼此之间的比率和/或两者之一与另一种生物标志物(诸如胎盘生长因子(plgf)或可溶性fms样酪氨酸激酶-1(sflt)或血管内皮生长因子(vegf)等其他标志物)之间的比率的形式有理化。
spint1和/或syndecan-1的水平或周转率也可以通过但不限于多变量或单变量算法或其他分析函数进行分析,以建立与对照或统计学上验证的预先确定的水平进行比较的值。
本质上,本发明教导了在妊娠雌性哺乳动物受试者中,spint1和/或syndecan-1水平或周转率的降低指示胎盘功能不全。取决于启动的临床干预是什么,可以在整个妊娠过程中监测和/或在预先确定的阶段(包括早期妊娠(firsttrimester)、中期妊娠(secondtrimester)或晚期妊娠(thirdtrimester)时间段的任何时间)测量spint1和/或syndecan-1的水平。为避免疑问,可在整个妊娠时间段的任何妊娠时间点或时间窗进行测定。经由生物标志物或生物标志物的组合检测胎盘功能不全的能力将灵敏度和特异性提高到远高于物理测量、超声、检查和/或出生体重或预测的胎儿体重的水平。这些都被包含在术语“生理化学参数”中。
因此,本文实现了一种确定雌性哺乳动物受试者中的胎盘健康状态的测定,该方法包括确定spint1和/或syndecan-1的循环水平,其中spint1和/或syndecan-1的浓度相对于对照的降低或随时间的降低或者比率相对于对照的变化或随时间的变化指示胎盘功能不全,并且spint-1和/或syndecan-1的升高是胎盘功能充足的量度或胎盘功能充足方面的改善的量度。
如本文使用的,术语“指示”(例如,指示胎盘功能不全或指示胎盘功能充足)是指要考虑的迹象或指征或因素,而不是其本身的明确证据,并且通常是指增加的特定状况存在的可能性。例如,spint1和/或syndecan-1的水平或浓度相对于对照的降低或随时间的降低或者比率相对于对照的变化或随时间的变化,通常与增加的胎盘功能不全的可能性相关。同样,spint1和/或syndecan-1的水平或浓度相对于对照的升高或随时间的升高或者比率相对于对照的变化或随时间的变化,通常与增加的胎盘功能充足的可能性相关。
在一种实施方案中,测定确定了雌性哺乳动物受试者中的胎盘健康状态,该方法包括确定spint1的循环水平,其中spint1的浓度相对于对照的降低或随时间的降低或者比率相对于对照的变化或随时间的变化指示胎盘功能不全,并且spint-1的升高是胎盘功能充足的量度或胎盘功能充足方面的改善的量度。
在一种实施方案中,测定确定了雌性哺乳动物受试者中的胎盘健康状态,该方法包括确定syndecan-1的循环水平,其中syndecan-1的浓度相对于对照的降低或随时间的降低或者比率相对于对照的变化或随时间的变化指示胎盘功能不全,并且syndecan-1的升高是胎盘功能充足的量度或胎盘功能充足方面的改善的量度。
在一种实施方案中,测定确定了雌性哺乳动物受试者中的胎盘健康状态,该方法包括确定spint1和至少一种其他生物标志物的循环水平,其中spint1的浓度相对于对照的降低或随时间的降低和至少一种其他生物标志物相对于对照的变化或随时间的变化或者比率相对于对照的变化或随时间的变化指示胎盘功能不全,并且spint-1的升高和至少一种其他生物标志物的变化是胎盘功能充足的量度或胎盘功能充足方面的改善的量度。
在一种实施方案中,测定确定了雌性哺乳动物受试者中的胎盘健康状态,该方法包括确定syndecan-1和至少一种其他生物标志物的循环水平,其中syndecan-1的浓度相对于对照的降低或随时间的降低和至少一种其他生物标志物相对于对照的变化或随时间的变化或者比率相对于对照的变化或随时间的变化指示胎盘功能不全,并且syndecan-1的升高和至少一种其他生物标志物的变化是胎盘功能充足的量度或胎盘功能充足方面的改善的量度。
本文实现了一种确定雌性哺乳动物受试者中的胎盘健康状态的测定,该方法包括确定spint1和/或syndecan-1的母体循环水平,其中spint1和/或syndecan-1的浓度相对于对照的降低或随时间的降低或者比率相对于对照的变化或随时间的变化指示胎盘功能不全,并且spint-1和/或syndecan-1的升高是胎盘功能充足的量度或胎盘功能充足方面的改善的量度。
本文还教导了一种检测雌性哺乳动物受试者中的异常胎儿体重诸如巨大儿的测定,该方法包括确定spint1和/或syndecan-1的母体循环水平,其中spint1和/或syndecan-1的浓度相对于对照的升高或随时间的升高或者比率相对于对照或随时间的变化指示潜在的巨大儿。
本文还实现了一种检测雌性哺乳动物受试者中的异常胎儿体重的测定,所述方法包括确定spint1和/或syndecan-1的母体循环水平,其中spint1和/或syndecan-1的浓度相对于对照的升高或随时间的升高或者比率相对于对照的变化或随时间的变化指示潜在的高胎儿体重,并且spint1和/或syndecan-1的浓度相对于对照的降低或随时间的降低或者比率相对于对照的变化或随时间的变化指示潜在的低胎儿体重或小于胎龄或胎儿生长受限。
本发明扩展到任何哺乳动物受试者,诸如人类、非人类灵长类动物、农场动物(例如绵羊、牛、马、猪、羊驼(alpaca)、美洲驼(llama))、竞赛动物(例如马、骆驼或灵缇犬)或家养动物(例如狗或猫)。竞赛马科动物包括夸特马、纯种马、阿拉伯马和温血马。因此,本发明具有在人类和兽医学临床实践中的应用。
在一种实施方案中,哺乳动物受试者是妊娠人类女性。在另一种实施方案中,哺乳动物受试者是妊娠母马(mare)。在又另一种实施方案中,哺乳动物受试者是妊娠的纯种母马。
测定的结果可与一种或更多种与受试者相关的风险因素结合使用,以进一步帮助做出诊断。术语“风险因素”是指包括统计学上增加异常胎儿体重风险的任何因素。与异常胎儿体重相关的风险因素包括但不限于母体年龄、孕前体重指数、教育状况、吸烟、饮酒、体外受精、妊娠期贫血、先兆子痫、糖尿病、胎龄、妊娠体重增加、新生儿性别、巨大胎儿的历史、低胎儿体重或小于胎龄或胎儿生长受限的历史。
因此,本文教导了一种确定妊娠人类女性受试者中的胎盘健康状态的测定,该方法包括确定spint1和/或syndecan-1的循环水平,其中spint1和/或syndecan-1的浓度相对于对照的降低或随时间的降低或者比率相对于对照的变化或随时间的变化指示胎盘功能不全,并且spint-1和/或syndecan-1的升高是胎盘功能充足的量度或胎盘功能充足方面的改善的量度。
在一种实施方案中,测定确定了妊娠人类女性受试者中的胎盘健康状态,该方法包括确定spint1的循环水平,其中spint1的浓度相对于对照的降低或随时间的降低或者比率相对于对照的变化或随时间的变化指示胎盘功能不全,并且spint-1的升高是胎盘功能充足的量度或胎盘功能充足方面的改善的量度。
在一种实施方案中,测定确定了妊娠人类女性受试者中的胎盘健康状态,该方法包括确定syndecan-1的循环水平,其中syndecan-1的浓度相对于对照的降低或随时间的降低或者比率相对于对照的变化或随时间的变化指示胎盘功能不全,并且syndecan-1的升高是胎盘功能充足的量度或胎盘功能充足方面的改善的量度。
在一种实施方案中,测定确定了妊娠人类受试者中的胎盘健康状态,该方法包括确定spint1和至少一种其他生物标志物的循环水平,其中spint1的浓度相对于对照的降低或随时间的降低和至少一种其他生物标志物相对于对照的变化或随时间的变化或者比率相对于对照的变化或随时间的变化指示胎盘功能不全,并且spint-1的升高和至少一种其他生物标志物的变化是胎盘功能充足的量度或胎盘功能充足方面的改善的量度。
在一种实施方案中,测定确定了妊娠人类受试者中的胎盘健康状态,该方法包括确定syndecan-1和至少一种其他生物标志物的循环水平,其中syndecan-1的浓度相对于对照的降低或随时间的降低和至少一种其他生物标志物相对于对照的变化或随时间的变化或者比率相对于对照的变化或随时间的变化指示胎盘功能不全,并且syndecan-1的升高和至少一种其他生物标志物的变化是胎盘功能充足的量度或胎盘功能充足方面的改善的量度。
本文还实现了一种用于妊娠人类受试者的临床管理方案,该方案包括确定循环spint1和/或syndecan-1的水平,其中spint1和/或syndecan-1与对照或统计学上验证的水平相比随时间的降低或者反映spint1和/或syndecan-1水平降低的比率变化指示胎盘功能不全,并且其中胎儿被监测或进行提早分娩。
本文还教导了一种用于妊娠人类受试者中的巨大儿的临床管理方案,该方案包括确定循环spint1和/或syndecan-1的水平,其中spint1和/或syndecan-1与对照或统计学上验证的水平相比随时间的升高或者反映spint1和/或syndecan-1水平升高的比率变化指示巨大儿,其中胎儿被监测并可能进行提早分娩。
术语“受试者”包括患者、妊娠母体和育龄雌性。
确定了母体循环流体中的生物标志物,所述母体循环流体包括全血、血浆和血清。还可测定其他循环流体,诸如淋巴液、腹水或尿液。生物标志物可以与诸如通过超声获得的生理化学数据一起或组合进行测定。
测定可以以任何数目的方式进行,包括直接测量生物标志物或使用生物标志物的配体的间接测量。“配体”包括生物标志物的抗体和受体。方便地,测定是免疫测定诸如elisa,并使用抗体特异性结合spint1或syndecan-1并直接或间接检测spint1或syndecan-1。测定可以是定量的。测定也可以是遗传测定,诸如检测编码生物标志物的rna和/或其他循环rna种类(或非rna核酸种类),其指示胎盘功能不全或其相关状况诸如fgr。
因此,提供了用于胎盘功能不全的鉴定的快速、有效和灵敏的测定。胎盘功能不全的状况包括由胎盘功能不全直接或间接引起的结果,诸如fgr和sga婴儿。在一种特定的实施方案中,测定能够早期检测胎盘功能不全。尽管如此,本发明不仅仅限于胎盘功能不全的早期检测,因为测定可用于妊娠的任何妊娠阶段。此外,认为升高的spint1和/或syndecan-1水平或者指示其中一种或两种升高的比率是巨大胎儿的指示物。
如本文其他地方所述,本发明人还令人惊讶地发现,妊娠雌性受试者中的spint1的循环水平与胎盘功能不全的临床参数相关,所述临床参数诸如取样时的子宫血流(子宫动脉多普勒速度)(r2=0.111;p<0.0001)、新生儿瘦体重(r2=0.064;p<0.0001)、胎盘重量(r2=0.087;p<0.0001)和胎盘表面积(r2=0.028;p<0.013)。
鉴定了可用于检测胎盘功能不全或评估胎盘健康水平的循环生物标志物。生物标志物是spint1(也称为肝细胞生长因子激活物抑制剂-1;hai-1)和syndecan-1。提及“spint1”和“syndecan-1”包括其修饰形式或同源物形式。修饰形式包括衍生物、多态变体、截短形式(截短物)和聚集或多聚体形式或具有扩展元件(expansionelement)(例如氨基酸扩展元件)的形式。为简洁起见,这种修饰形式和同源物形式通过提及任何生物标志物或一些生物标志物或所有生物标志物而被包括在内。
在一种实施方案中,spint1包括seqidno:1(genbank登记号:ab000095.1)的氨基酸序列,或与其具有至少70%序列同一性的氨基酸序列:
在一种实施方案中,syndecan-1包括seqidno:2(genbank登记号:aj551176.1)的氨基酸序列,或与其具有至少70%序列同一性的氨基酸序列:
spint1的修饰形式或同源物形式对本领域技术人员来说是熟悉的,其说明性实例描述于genbank登记号:nm_001032367.1至np_001027539.1(同种型2前体)、nm_003710.3至np_003701.1(同种型2前体)和nm_181642.2至np_857593.1(同种型1前体),其内容通过引用以其整体并入本文。
syndecan-1的修饰形式或同源物形式对本领域技术人员来说也是熟悉的,其说明性实例描述于genbank登记号:xm_005262622.2至xp_005262679.1(同种型x3)、genbank登记号:xm_005262620.4至xp_005262677.1(同种型x1)和genbank登记号:xm_005262621.3至xp_005262678.3(同种型x2),其内容通过引用以其整体并入本文。syndecan-1的修饰形式或同源物形式的另外的说明性实例在romaris等人(1999,thejournalofbiologicalchemistry,274,18667-18674)中描述,该文献的内容通过引用以其整体并入本文。
提及“至少70%序列同一性”包括在例如最佳比对或最佳匹配分析后70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性。因此,在一种实施方案中,spint1的氨基酸序列包括与如本文描述的seqidno:1至少85%、优选地至少86%、优选地至少87%、优选地至少88%、优选地至少89%、优选地至少90%、优选地至少91%、优选地至少92%、优选地至少93%、优选地至少94%、优选地至少95%、优选地至少96%、优选地至少97%、优选地至少98%、优选地至少99%或更优选地100%的序列同一性。在另一种实施方案中,syndecan-1的氨基酸序列包括与如本文描述的seqidno:2至少85%、优选地至少86%、优选地至少87%、优选地至少88%、优选地至少89%、优选地至少90%、优选地至少91%、优选地至少92%、优选地至少93%、优选地至少94%、优选地至少95%、优选地至少96%、优选地至少97%、优选地至少98%、优选地至少99%或更优选地100%的序列同一性。
如本文使用的术语“同一性”、“相似性”、“序列同一性”、“序列相似性”、“同源性”、“序列同源性”等意指在比对的序列中的任何特定氨基酸残基位置,比对的序列之间的氨基酸残基相同。如本文使用的术语“相似性”或“序列相似性”指示在比对的序列中的任何特定位置,序列之间的氨基酸残基为相似的类型。例如,亮氨酸可以取代异亮氨酸或缬氨酸残基。如本文别处所述,这可称为保守取代。在一种实施方案中,通过对其中包含的任何氨基酸残基进行一个或更多个保守取代的方式,spint1和syndecan-1的修饰形式或同源物形式分别具有不同于seqidno:1和2的氨基酸序列。
在一些实施方案中,关于肽序列的序列同一性涉及在比对序列并引入空位(如有必要)以实现最大同源性百分比并且不考虑任何保守取代作为序列同一性的一部分后,候选序列中与对应的肽序列中的残基相同的氨基酸残基的百分比。无论是n-末端还是c-末端延伸,还是插入,都不应被解释为降低序列同一性或同源性。用于对两个或更多个氨基酸序列进行比对并确定它们的序列同一性或同源性的方法和计算机程序是本领域技术人员熟知的。例如,两个氨基酸序列的同一性或相似性的百分比可以容易地使用算法例如blast、fasta或smith-waterman算法来计算。用于确定氨基酸序列“相似性”的技术是本领域技术人员熟知的。一般来说,“相似性”是指两个或更多个肽序列在适当位置的精确氨基酸与氨基酸比较,其中氨基酸是相同的或具有相似的化学和/或物理性质,诸如电荷或疏水性。然后可以确定比较的肽序列之间所谓的“相似性百分比”。一般来说,“同一性”是指两个肽序列的精确氨基酸与氨基酸对应。也可以通过确定它们的“同一性百分比”比较两个或更多个肽序列。两个序列的同一性百分比可以描述为两个比对的序列之间的精确匹配数除以较短序列的长度,再乘以100。smith和waterman,advancesinappliedmathematics2:482-489(1981)的局部同源性算法提供了核酸序列的近似比对。该算法可以扩展到使用由dayhoff(atlasofproteinsequencesandstructure,m.o.dayhoffed.,5suppl.3:353-358,nationalbiomedicalresearchfoundation,washington,d.c.,usa)开发并由gribskov(nucl.acidsres.14(6):6745-6763,1986)标准化的评分矩阵与肽序列一起使用。用于计算序列间同一性或相似性百分比的合适程序在本领域中是公知的。用于对齐比较窗(comparisonwindow)的序列的最佳比对可通过算法的计算机化实现(wisconsingeneticssoftwarepackage发布7.0中的gap、bestfit、fasta和tfasta,geneticscomputergroup,575sciencedrivemadison,wi,usa)或通过检查来进行并且最佳比对由选择的多种方法中的任一种产生(即,导致比较窗的最高同源性百分比)。还可参考如例如由altschul等人,(1997,nucl.acidsres.25:3389)公开的blast程序家族。序列分析的详细讨论可见于ausubel等人.("currentprotocolsinmolecularbiology",johnwiley&sonsinc,1994-1998,第15章)的19.3单元。
如本文描述的,spint1和syndecan-1的修饰形式或同源物形式包括非人类同种型。非人类同种型的说明性实例包括灵长类动物,伴侣动物诸如猫和狗等,役用动物(workinganimal)诸如马、驴等,家畜诸如绵羊、牛、山羊、猪等,实验室试验动物诸如兔、小鼠、大鼠、豚鼠、仓鼠等,以及圈养野生动物诸如动物园和野生动物园中的野生动物、鹿、野狗等的天然spint1和syndecan-1同种型。
因此,本文实现的另一方面是用于确定受试者中的胎盘功能充足性状态的测定,该测定包括确定来自受试者的循环生物样品中选自spint1和syndecan-1的生物标志物的浓度,其中生物标志物水平相对于对照的改变提供了胎盘功能充足性状态的指示。在一种实施方案中,spint1和/或syndecan-1的降低指示胎盘功能不全或发展胎盘功能不全的倾向。
在一种可选的实施方案中,本发明构思了一种用于确定受试者中的胎盘功能充足性状态的测定,该测定包括确定来自受试者的循环生物样品中选自spint1和syndecan-1的生物标志物的浓度;使所述水平经历从第一数据知识库生成的算法或分析函数或分析方法或其他数据处理手段,所述第一数据知识库包括来自具有关于胎盘功能充足性的已知状态的受试者或受试者队列的相同生物标志物的水平,其中所述算法或分析或数据处理手段提供受试者具有或不具有胎盘功能不全或胎盘功能充足的概率指数。提及“算法”包括执行但不限于多变量或单变量分析函数的算法。
上文的方面也适用于通过筛查升高的spint1和/或sydnecan-1水平检测或监测巨大胎儿。
生物标志物的浓度或水平的确定能够建立基于相对于对照的浓度的诊断规则。可选地,诊断规则基于统计和机器学习算法的应用。这样的算法使用生物标志物和在训练数据(具有已知的胎盘功能充足性状态)中观察到的胎盘功能充足性状态之间的关系来推断随后用于预测具有未知状态的患者的状态的关系。可以使用提供患者具有胎盘功能不全的概率指数的算法。如上所述,算法可以执行但不限于多变量或单变量分析函数。可选地,使数据经历分析或分析函数或处理。
因此,在一种实施方案中,本发明提供了基于统计和机器学习算法的应用的诊断规则。这样的算法使用生物标志物和在训练数据(具有已知的胎盘功能充足性状态)中观察到的胎盘功能充足或胎盘功能不全的状态之间的关系来推断随后用于预测具有未知的胎盘功能充足性状态的患者的状态的关系。数据分析领域的从业技术人员认识到,可以使用许多不同形式的训练数据中的关系的推断,而不会实质上改变本发明。也可采用其他分析方法来分析数据,并鉴定生物标志物和/或生理化学参数与胎盘功能不全或其相关状况诸如fgr之间的相关性。
因此,本发明构思了训练数据知识库生成算法或分析函数或分析方法或其他数据处理手段的用途,该训练数据知识库包括来自具有已知的胎盘功能充足性状态的受试者的选自以下的生物标志物水平:spint1、syndecan-1、spint1和syndecan-1二者或者spint1或syndecan-1中的一种和至少一种其他生物标志物,所述算法或分析函数或分析方法或其他数据处理手段在输入包括来自具有未知的胎盘功能充足性状态的患者的相同生物标志物的水平的第二数据知识库后提供预测胎盘性质的概率指数。还可以使用其他分析函数。
如上所述,“受试者”通常是人类女性。然而,本发明扩展到兽医学应用。
术语“训练数据”包括生物标志物相对于对照的水平的知识。“对照”包括与具有适当的胎盘功能充足性或具有已知胎盘功能不全的受试者中的生物标志物水平的比较,或者可以是基于试验的统计学上确定的水平。统计学上确定的水平可以是已经被验证为与胎盘功能充足或与胎盘功能不全关联或相关的统计学上验证的预先确定的水平或截止值。术语“水平”还涵盖生物标志物水平的比率及其周转率。
“训练数据”还包括spint1和/或syndecan-1中的一种或更多种的浓度。数据可以包括关于生物标志物之一或两者的增加或减少的信息。
本发明还构思了用于检测受试者中的胎盘功能不全或胎盘健康状态或功能障碍的生物标志物的组,该组包括与生物标志物特异性结合的剂来确定生物标志物的水平并且然后任选地使水平经历从第一数据知识库生成的算法或分析函数或分析方法或其他数据处理手段,该生物标志物选自spint1、syndecan-1、spint1和syndecan-1二者或者spint1或syndecan-1中的一种与至少一种其他生物标志物,所述第一数据知识库包括来自具有关于状况的已知状态的受试者的相同生物标志物的水平,其中算法提供受试者具有或不具有胎盘功能不全的概率指数。
生物标志物(spint1和/或syndecan-1)的水平或浓度提供了在本文中被称为“第二数据知识库”的输入测试数据。第二数据知识库被认为是相对于对照的,或者被输入到由“第一数据知识库”生成的算法中,所述“第一数据知识库”包括具有已知胎盘功能充足或胎盘功能不全的受试者中的生物标志物水平的信息。第二数据知识库来自具有关于胎盘功能充足或胎盘功能不全的未知状态的受试者。算法或分析函数或分析方法或其他数据处理手段的输出是受试者具有特定水平的胎盘功能充足或胎盘功能不全的概率或风险因素(在本文中被称为概率指数)。算法或分析函数或分析方法或其他数据处理手段可以执行多变量或单变量分析函数或其他统计操作。
与生物标志物“特异性结合”的剂通常包括免疫相互作用分子(immunointeractivemolecule),诸如抗体或杂交体(hybrid)、衍生物,包括其重组或修饰形式或其抗原结合片段。剂也可以是受体或其他配体。抗体或受体可以对来自特定哺乳动物物种的生物标志物有特异性,或者如果它们交叉反应,可以从不同物种产生。所有这些剂有助于确定生物标志物的水平。关于水平的信息是算法的输入数据。
因此,本发明还提供了针对spint1、syndecan-1、spint1和syndecan-1两者或者spint1或syndecan-1中的一种与至少一种其他生物标志物的固定化的配体的组。
配体,诸如生物标志物特异性的抗体,能够定量或定性检测或确定生物标志物的水平。提及“水平”包括作为重量/体积、活性/体积或单位/体积或其他方便的表示方式的浓度以及水平的比率和周转率。
如上所述,“样品”通常是循环母体流体,诸如全血、血浆或血清。可选地,样品是正在进行组织学检查的组织样品,或者是腹水、淋巴液或尿液。
如上所述,“配体”或“结合剂”等术语是指能够与spint1或syndecan-1上的表位特异性地或基本上特异性地(即具有有限的交叉反应性)结合的任何化合物、组合物或分子。“结合剂”通常具有单一的特异性。尽管如此,本文也构思了对spint1和syndecan-1两者都具有多重特异性的结合剂。结合剂(或配体)通常是抗体,诸如单克隆抗体或其衍生物或类似物,但也包括但不限于:fv片段;单链fv(scfv)片段;fab’片段;f(ab’)2片段;人源化抗体和抗体片段;骆驼化抗体和抗体片段;和前述的多价形式。如果合适,也可以使用多价结合试剂,包括但不限于:单特异性或双特异性抗体;诸如二硫键稳定的fv片段、scfv串联体[(scfv)2片段]、二抗体(diabody)、三抗体(tribody)或四抗体(tetrabody),它们通常是共价连接或以其他方式稳定(即亮氨酸拉链或螺旋体稳定的)scfv片段。“结合剂”也包括适体,如本领域描述的。
制备抗原特异性结合剂(包括抗体及其衍生物和类似物以及适体)的方法在本领域是公知的。多克隆抗体可以通过对动物免疫接种产生。单克隆抗体可以根据标准(杂交瘤)方法制备。抗体衍生物和类似物,包括人源化抗体,可以通过从编码单克隆抗体的dna分离dna片段,并根据标准方法将合适的v区亚克隆到合适的表达载体中来重组地制备。噬菌体展示和适体技术在文献中进行了描述并且允许具有亲和力和非常低的交叉反应性的抗原特异性结合试剂的体外克隆扩增。噬菌体展示试剂和系统商购可得,并且包括从piscataway,newjersey的amershampharmaciabiotech,inc.商购可得的重组噬菌体抗体系统(rpas),以及从marcoisland,florida的mobitec,llc商购可得的pskan噬菌粒展示系统。适体技术描述于例如且不限于美国专利第5,270,163号;第5,475,096号;第5,840,867号和第6,544,776号。
eclia、elisa和luminexlabmap免疫测定是检测生物标志物水平的合适测定的实例。在一个实例中,第一结合试剂/抗体附接于表面,并且含有可检测基团的第二结合试剂/抗体与第一抗体结合。可检测基团的实例包括,例如且不限于:荧光染料、酶、用于结合第二结合试剂的表位(例如,当第二结合试剂/抗体是通过荧光标记的抗小鼠抗体检测的小鼠抗体时),例如抗原或结合对的成员,诸如生物素。表面可以是平坦表面,诸如在典型的栅格型阵列(例如,但不限于,96孔板和平坦微阵列)的情况下,或者是非平坦表面,例如使用涂覆的珠阵列技术,其中每“种”珠用例如荧光染料(诸如美国专利第6,599,331号、第6,592,822号和第6,268,222号中描述的luminex技术)或量子点技术(例如,如美国专利第6,306,610号中描述的)标记。这样的测定也可被视为实验室信息管理系统(lims)。
在珠类型的免疫测定中,可以使用luminexlabmap系统。labmap系统包括内部用两种有不同光谱的荧光染料染色的聚苯乙烯微球。使用这些荧光染料的精确比率,创建了由具有特定光谱地址(spectraladdress)的100个不同微球组组成的阵列。每个微球组在其表面可以具有不同的反应物。因为微球组可以通过它们的光谱地址进行区分,所以它们可以组合,允许在单个反应容器中同时测量多达100种不同的分析物。与报告物分子偶联的第三种荧光染料定量了微球表面发生的生物分子相互作用。当微球通过luminex分析仪中的两个分开的激光器时,微球在快速流动的流体流中被单独询问。高速数字信号处理基于微球的光谱地址对其进行分类,并在几秒钟内对每个样品定量表面上的反应。
如本文使用的,“免疫测定(immunoassay)”是指免疫测定(immuneassays),通常但不排他地为夹心测定,能够检测和定量期望的生物标志物,即spint1、syndecan-1、spint1和syndecan-1二者或者spint1或syndecan-1中的一种与至少一种其他生物标志物。
从确定spint1、syndecan-1、spint1和syndecan-1二者或者spint1或syndecan-1中的一种与至少一种其他生物标志物的循环流体水平的测定产生的数据,可用于确定受试者中胎盘功能不全状态的可能性或进展。将包括生物标志物水平的数据输入与对照进行比较,或者将其输入到算法中,该算法提供受试者已经或将要发展胎盘功能不全的可能性的风险值。
在本公开内容的上下文中,“循环流体”包括可以根据本文描述的方法进行分析的任何血液级分(fraction),例如血清或血浆。测量特定生物标志物的血液水平,意指可以测试任何合适的血液级分以确定血液水平,并且可以将数据报告为该级分中存在的值。本文考虑的其他流体包括腹水、淋巴液和尿液。
本发明还涵盖一种组合物,该组合物包含从妊娠哺乳动物受试者获得的样品和与spint1或syndecan-1特异性结合的抗体。在一些实施方案中,组合物包含与spint1特异性结合的抗体和与syndecan-1特异性结合的抗体。合适地,样品是循环母体流体,诸如全血、血浆或血清。可选地,样品是正在进行组织学检查的组织样品,或者是腹水、淋巴液或尿液。一种或更多种抗体适合用可检测的基团或物质进行标记。
如上文描述的,提供了用于诊断胎盘健康或功能障碍状态的方法,该方法通过确定特定生物标志物的水平,并将该水平用作算法中的第二数据知识库,该算法利用第一数据知识库或具有已知胎盘健康的患者中的相同生物标志物的水平生成。还提供了检测胎盘功能障碍的方法,包括确定受试者的样品中特定所鉴定的生物标志物的存在和/或周转率。“周转率”意指患者的样品(母体循环流体)中生物标志物浓度随时间的变化。
在一种实施方案中,本发明构思了一种用于监测患者中的妊娠进展的方法,该方法包括:
(a)提供来自患者的循环流体样品;
(b)确定spint1、syndecan-1、spint1和syndecan-1二者或者spint1或syndecan-1中的一种与至少一种其他生物标志物的水平,并使所述水平经历算法或分析函数或分析方法或其他数据处理手段,以提供患者具有胎盘功能充足或胎盘功能不全的概率指数;和
(c)在稍后的时间点重复步骤(a)和(b),并将步骤(b)的结果与步骤(c)的结果进行比较,其中概率指数的差异指示胎盘健康的进展。
在一种实施方案中,在稍后的时间点增加的发展胎盘功能障碍的概率指数可以指示状况正在进展,并且治疗(如果适用)无效。相比之下,在稍后的时间点下降的概率指数可以指示胎盘功能充足性正在改善,并且治疗(如果适用)是有效的。治疗可以包括婴儿的提前或提早分娩。
如本文使用的,术语“提前分娩(earlydelivery)”和“提早分娩(earlierdelivery)”在本文中可互换使用,是指在妊娠受试者经历自然分娩之前的胎儿分娩,并包括分娩辅助干预,诸如引产。提前或提早分娩可以是早产(pre-term)(例如,妊娠37周之前)、足月(term)(例如,妊娠37周、38周、39周、40周、41周或42周)或过期(post-term)(例如,妊娠42周之后),并且包括阴道分娩、器械分娩(产钳或真空分娩)或剖腹产。在具体实施方案中,术语“提前分娩”和“提早分娩”是指妊娠38周、38.5周或39周的分娩辅助干预(例如,引产)。
如上所述,抗体可用于依赖于生物标志物的抗原决定簇和抗体之间的结合相互作用的许多免疫测定中的任何一种。这样的测定的实例是放射免疫测定、酶免疫测定(例如eclia、elisa)、免疫荧光、免疫沉淀、乳胶凝集、血凝和组织化学测试。抗体可用于检测和定量样品中的生物标志物的水平,以确定胎盘功能充足或胎盘功能不全的水平。
抗体或循环流体样品可以固定在能够固定细胞、抗体等的载体或固体支持物上。例如,载体或支持物可以是硝酸纤维素、或玻璃、聚丙烯酰胺、辉长岩和磁铁矿。支持物材料可以具有任何可能的构型,包括球形(例如珠)、圆柱形(例如试管或孔的内表面,或杆的外表面)或扁平形(例如薄片(sheet)、测试条(teststrip))。也可以采用间接方法,其中通过引入第二抗体来放大第一抗原-抗体反应,该第二抗体对与生物标志物蛋白反应的抗体具有特异性。举例来说,如果对生物标志物蛋白具有特异性的抗体是兔igg抗体,则第二抗体可以是用本文所述的可检测物质标记的山羊抗兔γ球蛋白。
当使用放射性标记作为可检测物质时,可通过放射自显影术定位生物标志物。放射自显影术的结果可以通过多种光学方法确定放射自显影中颗粒的密度,或通过对颗粒计数来定量。
本文所描述的本发明的方法也可以使用微阵列诸如寡核苷酸阵列、mrna阵列、cdna阵列、基因组dna阵列或组织阵列进行。存在于母体循环流体中并且与胎盘功能不全或其相关状况诸如fgr或sga婴儿直接或间接相关的任何核酸种类均可被测定。
在一种实施方案中,本发明的方法包括检测编码spint1、syndecan-1、spint1和syndecan-1二者、或者spint1或syndecan-1中的一种与至少一种其他生物标志物的核酸分子的表达,并基于表达水平确定生物标志物的水平。可选地,可以测定与胎盘功能不全或其相关状况诸如fgr或sga婴儿直接或间接相关的另一种核酸种类(例如除了mrna之外的rna种类)。本领域技术人员可以构建核苷酸探针,用于检测样品中编码生物标志物的mrna序列或其他rna种类。合适的探针包括基于编码来自生物标志物区域的至少五个连续氨基酸的核酸序列的核酸分子,优选地它们包含15至30个核苷酸。核苷酸探针可以用可检测物质诸如提供足够信号并具有足够半衰期的放射性标记诸如32p、3h、44c等标记。可以使用的其他可检测物质包括由特定标记的抗体识别的抗原、荧光化合物、酶、对标记的抗原有特异性的抗体,和发光化合物。可以根据探针与待检测的核苷酸的杂交和结合率以及可用于杂交的核苷酸的量来选择合适的标记。标记的探针可以与固体支持物诸如硝酸纤维素过滤器或尼龙膜上的核酸杂交,如sambrook等人,molecularcloning,alaboratorymanual.(2nded.),1989中一般描述的。核酸探针可用于检测例如人类细胞中编码生物标志物的基因。核苷酸探针还可用于诊断涉及spint1和/或syndecan-1的胎盘病症,用于监测这样的病症的进展,或用于监测治疗。在一种实施方案中,探针用于诊断和监测胎盘功能充足或功能不全的进展。
探针可用于杂交技术,以检测编码生物标志物蛋白的基因的表达。该技术通常包括使从患者或其他细胞来源的样品获得的核酸(例如,mrna或其他rna种类)在有利于探针与核酸中的互补序列特异性退火的条件下与探针接触和孵育。孵育后,除去未退火的核酸,并检测与探针杂交的核酸的存在(如果有的话)。
mrna的检测可以包括将mrna转化为cdna和/或使用扩增方法诸如聚合酶链式反应(pcr)扩增特定的核苷酸序列,然后使用本领域技术人员已知的技术分析扩增的分子。本领域技术人员可常规地设计合适的引物。
本文描述的杂交和扩增技术可用于测定编码生物标志物的基因的表达的定性和定量方面。例如,可以从已知表达编码生物标志物的基因或以其他方式与胎盘功能不全相关的细胞类型或组织分离rna,并利用杂交(例如标准northern分析)或本文所述的pcr技术进行测试。技术可用于检测可能由正常或异常选择性剪接引起的转录物大小差异。技术可用于检测在正常个体中检测到的相对于表现出涉及生物标志物蛋白或基因的胎盘功能不全症状的那些个体的全长和/或选择性剪接转录物水平之间的定量差异。
因此,本发明提供了一种检测受试者中的胎盘健康状态的方法,该方法包括:
(a)提供来自患者的循环流体样品;
(b)从样品或样品内的细胞提取核酸分子,所述核酸分子包括编码生物标志物或其部分的mrna或其他rna种类;
(c)使用聚合酶链式反应扩增提取的mrna或rna;
(d)确定编码生物标志物的mrna或其他rna种类的水平;和
(e)使生物标志物的水平经历算法或分析函数或分析方法或其他数据处理手段,所述算法或分析函数或分析方法或其他数据处理手段提供患者具有胎盘功能充足或胎盘功能不全的概率指数。
本文描述的方法可以通过利用预包装的诊断试剂盒来执行,所述预包装的诊断试剂盒包含执行本发明的任何方法的必需试剂。例如,试剂盒可包含本文描述的至少一种特定核酸或抗体,其可方便地用于例如临床环境中,以筛查和诊断患者,并筛查和鉴定表现出发展胎盘功能障碍倾向的那些个体。试剂盒还可以包含用于在聚合酶链式反应中扩增编码生物标志物的核酸的核酸引物。试剂盒还可以包含可用于本发明的方法的核苷酸、酶和缓冲液以及电泳标志物,诸如200bp的梯状条带(ladder)。试剂盒还包含用于实施本发明的方法的详细说明。
本发明还提供了一种基于算法的筛选测定,用于筛选来自患者的循环流体样品。通常,基于生物标志物的水平(或编码生物标志物的基因的表达水平)收集输入数据,并经过算法评估水平的任何升高或降低的统计显著性,然后将该信息作为输出数据。本发明涵盖用于评估输入数据的计算机软件和硬件。
本发明的测定允许整合到现有的或新开发的病理学架构或平台系统中。例如,本发明构思了一种允许用户确定受试者的关于胎盘功能充足或胎盘功能不全的水平的状态的方法,该方法包括:
(a)经由通信网络从用户接收呈spint1、syndecan-1、spint1和syndecan-1二者或者spint1或syndecan-1中的一种与至少一种其他生物标志物的水平或浓度的形式的数据;
(b)经由算法或分析函数或分析方法或其他数据处理手段处理受试者数据,所述算法或分析函数或分析方法或其他数据处理手段提供疾病指数值;
(c)根据疾病指数值与预先确定的值比较的结果确定受试者的状态;和
(d)经由通信网络向用户传送受试者的状态的指示。
方便地,方法通常还包括:
(a)让用户使用远程终端站确定数据;和
(b)经由通信网络将数据从终端站传送到基站。
基站可以包括第一处理系统和第二处理系统,在这种情况下,方法可以包括:
(a)将数据传送到第一处理系统;
(b)将数据传送到第二处理系统;和
(c)使第一处理系统执行算法函数以生成疾病指数值。
方法还可以包括:
(a)将算法函数的结果传送到第一处理系统;和
(b)使第一处理系统确定受试者的状态。
在这种情况下,方法还包括以下至少一项:
(a)通过第一防火墙在通信网络和第一处理系统之间传送数据;和
(b)通过第二防火墙在第一处理系统和第二处理系统之间传送数据。
第二处理系统可以耦合到适于存储预先确定的数据和/或算法的数据库,方法可以包括:
(a)查询数据库以从数据库获得至少所选择的预先确定的数据或访问来自数据库的算法;和
(b)将所选择的预先确定的数据与主题数据进行比较,或者生成预测的概率指数。
提及上文概述的“算法”或“算法函数”包括进行但不限于多变量或单变量分析函数。也可以或可选地执行其他分析函数。除了上文描述的那些之外,可以实现许多不同的架构和平台。应当理解,可以使用适合于实现本发明的任何形式的架构。一种技术是分布式架构的使用。这可以通过降低数据带宽成本和要求,以及确保如果一个基站变得堵塞或发生故障,其他终端站可以接管,来提高系统的效率。这也允许加载共享等,以确保随时可以访问系统。
在上述方面,术语“数据”意指生物标志物的水平或浓度或周转率。这可以单独测定,或与物理、化学或生理化学参数(诸如从超声或其他物理测试程序获得的数据)组合测定。“通信网络”包括互联网。当使用服务器时,服务器通常是客户端服务器,或者更具体地是简单对象应用协议(soap)。
本测定可作为另外的妊娠期间测试或独立测试纳入本诊断架构中。例如,测定可以与超声或物理测量相关联。
一旦信息可用,数据可用于妊娠的临床管理方案。这可能包括比本来计划更早地分娩婴儿的决策。
因此,提供了一种用于妊娠哺乳动物受试者的临床管理方案,该方案包括确定循环spint1和/或syndecan-1的水平,其中spint1和/或syndecan-1与对照或统计学上验证的水平相比随时间的降低或者反映spint1和/或syndecan-1水平降低的比率变化指示胎盘功能不全,并且其中胎儿被监测或进行提早分娩。
在一种实施方案中,提供了一种用于妊娠哺乳动物受试者的临床管理方案,该方案包括确定循环spint1的水平,其中spint1与对照或统计学上验证的水平相比随时间的降低或者反映spint1水平降低的比率变化指示胎盘功能不全,并且其中胎儿被监测或进行提早分娩。
在一种实施方案中,提供了一种用于妊娠哺乳动物受试者的临床管理方案,该方案包括确定循环syndecan-1的水平,其中syndecan-1与对照或统计学上验证的水平相比随时间的降低或者反映syndecan-1水平降低的比率变化指示胎盘功能不全,并且其中胎儿被监测或进行提早分娩。
在一种实施方案中,提供了一种用于妊娠哺乳动物受试者的临床管理方案,该方案包括确定循环spint1和至少一种其他生物标志物的水平,其中spint1与对照或统计学上验证的水平相比随时间的降低和至少一种其他生物标志物与对照或统计学上验证的水平相比的变化或者反映spint1和至少一种其他生物标志物水平降低的比率变化指示胎盘功能不全,并且其中胎儿被监测或进行提早分娩。
在一种实施方案中,提供了一种用于妊娠哺乳动物受试者的临床管理方案,该方案包括确定循环syndecan-1和至少一种其他生物标志物的水平,其中syndecan-1与对照或统计学上验证的水平相比随时间的降低和至少一种其他生物标志物与对照或统计学上验证的水平相比的变化或者反映syndecan-1和至少一种其他生物标志物水平降低的比率变化指示胎盘功能不全,并且其中胎儿被监测或进行提早分娩。
本文还实现了一种用于妊娠哺乳动物受试者的临床管理方案,该方案包括确定循环spint1和/或syndecan-1的水平,其中spint1和/或syndecan-1与对照或统计学上验证的水平相比随时间的降低或者反映spint1和/或syndecan-1水平降低的比率变化指示胎盘功能不全,并且其中胎儿被监测或进行提早分娩。
本文还教导了一种用于妊娠哺乳动物受试者中的巨大儿的临床管理方案,该方案包括确定循环spint1和/或syndecan-1的水平,其中spint1和/或syndecan-1与对照或统计学上验证的水平相比随时间的升高或者反映spint1和/或syndecan-1水平升高的比率变化指示巨大儿,其中胎儿被监测或进行提早分娩。
如上所述,虽然有兽医学应用,在一种实施方案中,哺乳动物受试者是妊娠人类女性受试者。测试的样品是循环母体流体。
因此,提供了一种用于妊娠人类女性受试者的临床管理方案,该方案包括确定循环spint1和/或syndecan-1的水平,其中spint1和/或syndecan-1与对照或统计学上验证的水平相比随时间的降低或者反映spint1和/或syndecan-1水平降低的比率变化指示胎盘功能不全,并且其中胎儿被监测或进行提早分娩。
在一种实施方案中,提供了一种用于妊娠人类女性受试者的临床管理方案,该方案包括确定循环spint1的水平,其中spint1与对照或统计学上验证的水平相比随时间的降低或者反映spint1水平降低的比率变化指示胎盘功能不全,并且其中胎儿被监测或进行提早分娩。
在一种实施方案中,提供了一种用于妊娠人类女性受试者的临床管理方案,该方案包括确定循环的syndecan-1的水平,其中syndecan-1与对照或统计学上验证的水平相比随时间的降低或者反映syndecan-1水平降低的比率变化指示胎盘功能不全,并且其中胎儿被监测或进行提早分娩。
在一种实施方案中,提供了一种用于妊娠人类女性受试者的临床管理方案,该方案包括确定循环spint1和至少一种其他生物标志物的水平,其中spint1和至少一种其他生物标志物与对照或统计学上验证的水平相比随时间的降低或者反映spint1和至少一种其他生物标志物水平降低的比率变化指示胎盘功能不全,并且其中胎儿被监测或进行提早分娩。
本文还实现了一种用于妊娠人类受试者的临床管理方案,该方案包括确定循环spint1和/或syndecan-1的水平,其中spint1和/或syndecan-1与对照或统计学上验证的水平相比随时间的降低或者反映spint1和/或syndecan-1水平降低的比率变化指示胎盘功能不全,并且其中胎儿被监测或进行提早分娩。
本文还教导了一种用于妊娠人类受试者中的巨大儿的临床管理方案,该方案包括确定循环spint1和/或syndecan-1的水平,其中spint1和/或syndecan-1与对照或统计学上验证的水平相比随时间的升高或者反映spint1和/或syndecan-1水平升高的比率变化指示巨大儿,其中胎儿被监测或进行提早分娩。
在一种实施方案中,提供了一种用于妊娠人类女性受试者的临床管理方案,该方案包括确定循环syndecan-1和至少一种其他生物标志物的水平,其中syndecan-1和至少一种其他生物标志物与对照或统计学上验证的水平相比随时间的降低或者反映syndecan-1和至少一种其他生物标志物水平降低的比率变化指示胎盘功能不全,并且其中胎儿被监测或进行提早分娩。
在一种实施方案中,本发明包括一种用于确定受试者中的巨大胎儿的状态的测定,该测定包括确定来自受试者的循环生物样品中选自spint1和syndecan-1的生物标志物的浓度;使所述水平经历从第一数据知识库生成的算法或分析函数或分析方法或其他数据处理手段,所述第一数据知识库包括来自具有关于巨大胎儿的已知状态的受试者或受试者队列的相同生物标志物的水平,其中所述算法或分析或数据处理手段提供受试者具有或不具有巨大胎儿的婴儿的概率指数。
如本文所述,无论是由于胎盘功能充足或胎盘功能不全的水平,还是作为巨大胎儿的标志物,spint1和/或syndecan-1的水平都是胎儿健康的指示物。因此,本文包括筛选和确定与对照相比较低或较高的spint1和/或syndecan-1水平,以监测或检测fgr或sga婴儿(如果spint1和/或syndecan-1低)或巨大胎儿(如果spint1和/或syndecan-1高)。
如本文其他地方所述,本发明人基于不同的spint1mom截止值水平开发并验证了不同低出生体重范围的4等级风险评估模型。例如,<0.63的循环spint1mom(从妊娠约35-37周测量)代表高风险(等级1);0.63至1.1代表正常风险(等级2);1.1到1.6代表较低的风险(等级3);并且>1.6代表分娩具有低出生体重的新生儿的最低风险(等级4)。最高等级(等级1)与女性分别分娩出生体重<第3、<第5、<第10和<第20百分位数的新生儿的14.1%、19.7%、28.2%和46.5%风险相关。相比之下,最低等级(等级4)与处于这些胎儿体重百分位数的出生新生儿的0.0%至6.6%风险相关。因此,在一种实施方案中,如果受试者具有小于约0.63(mom)的循环水平spint1,则妊娠雌性受试者被确定为处于分娩低出生体重新生儿的高风险。在另一种实施方案中,如果受试者具有大于约1.1(mom)的循环水平spint1,则妊娠雌性受试者被确定为处于分娩低出生体重新生儿的低风险。
本文还提供了一种用于妊娠雌性受试者的临床管理方案,该方案包括确定循环spint1的水平,其中在妊娠约35周至约37周时小于约0.63mom的循环spint1浓度指示分娩低出生体重婴儿的风险升高,并且其中胎儿被监测或进行提早分娩。
在另一种实施方案中,提供了一种用于妊娠人类受试者的临床管理方案,该方案包括确定循环spint1的水平,其中在妊娠约36周时小于约0.63mom的循环spint1浓度指示分娩低出生体重婴儿的风险升高,并且其中胎儿被监测或进行提早分娩。
如本文其他地方所述,本发明人令人惊讶地发现,与随后未分娩sga婴儿的女性相比,随后分娩sga婴儿的女性中的妊娠约27周至29周时的spint1和syndecan-1的水平已经显著更低。因此,应当理解,本文公开的测定、方法和方案可以使用从妊娠约27周至约36周的妊娠哺乳动物受试者获得的样品中测量的spint1和/或syndecan-1水平来进行。“约27周至约36周”包括妊娠约27周,优选地约28周,优选地约29周,优选地约30周,优选地约31周,优选地约32周,优选地约33周,优选地约34周,优选地约35周,或约36周。
因此,在一种实施方案中,提供了一种用于妊娠哺乳动物受试者的临床管理方案。如本文所描述的测定、方法或方案包括确定从受试者在妊娠约27周至约36周、优选地妊娠约27周至约29周、或更优选地妊娠约28周的时间点获得的样品中的循环spint1的水平。
在一种实施方案中,该方案还包括监测被鉴定为具有胎盘功能不全和/或处于低出生体重风险的受试者的胎儿或者使其进行提早分娩。
在某些实施方案中,使用本发明的测定、方法或方案监测受试者,以确定胎盘功能不全或其相关状况诸如fgr或sga或巨大儿的存在或不存在,以提供是否可能需要提早分娩胎儿的指示物。监测通常通过系列测试进行。在一些情况下,使用本文描述的方法根据需要(例如,基于需要)监测妊娠受试者。可选地,或者此外,可以每周、每月或者以任何预先指定的间隔对妊娠受试者进行监测。在一些情况下,每24小时监测妊娠受试者至少一次。在一些情况下,每1天至30天监测妊娠受试者至少一次。在一些情况下,每至少1天监测妊娠受试者至少一次。在一些情况下,每至多30天监测妊娠受试者至少一次。在一些情况下,每1天至5天、1天至10天、1天至15天、1天至20天、1天至25天、1天至30天、5天至10天、5天至15天、5天至20天、5天至25天、5天至30天、10天至15天、10天至20天、10天至25天、10天至30天、15天至20天、15天至25天、15天至30天、20天至25天、20天至30天或者25天至30天监测妊娠受试者至少(任选地平均)一次。在一些情况下,每1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、28、29、30或31天监测妊娠受试者至少一次。在一些情况下,每1、2或3个月监测妊娠受试者至少一次。在一些情况下,经由本文描述的方法监测妊娠受试者的频率不超过1周、10天、2周、3周或1个月。换句话说,本文描述的一些方法的预测值可持续至少一周、至少10天、至少两周、至少三周或至少一个月具有临床用途。
不希望被理论或操作模式所束缚,认为胎儿的提前分娩可以与婴儿在短期遭受并发症(例如呼吸窘迫)或在长期遭受并发症(例如iq和注意力缺陷)方面的更大风险相关。特别是,已知在妊娠37周之前分娩会带来显著增加的风险,并且可能基于spint1和/或syndecan-1以及任选地一个或更多个其他生理化学参数和/或风险因素来作出是否用分娩辅助干预(例如引产)进行干预的决策。还已知的是,37-38周的分娩具有可管理但非零的风险,并且可能基于具体情况进行考虑。相比之下,已知在约38.5-39.5周分娩与胎儿并发症的显著风险不相关。此外,临床试验表明,引产也与对母亲的医疗干预诸如剖腹产或器械辅助出生的风险增加无关(grobman等人.nejm2018,379:513-523)。
因此,在特定的实施方案中,使用本发明的测定、方法或方案从妊娠约35-37周定期地(如关于以上实例描述的)监测妊娠受试者,并且在测定、方法或方案的结果指示胎盘功能不全或胎儿生长受限或巨大胎儿的基础上,在妊娠约38周和妊娠约39周之间对胎儿进行提前分娩。认为这样的干预可以减少死产(妊娠38周后死产的风险显著增加)、在其中存在疑似的巨大胎儿的妊娠中的胎儿或母体损伤(在足月妊娠时妊娠未经引产,并一直持续到顺产发生)(boulvain等人.lancet2015;385(9987):2600-2605)以及否则可能在妊娠39周后发生的其他并发症的可能性。相比之下,如果在这些实施方案中,测定、方法或方案的结果指示胎盘功能充足和/或预期体重在正常范围内,则不对胎儿进行提前分娩,并且允许妊娠受试者继续直到后期妊娠。
如本文其他地方示出的,本发明人令人惊讶地发现,妊娠雌性受试者中的spint1和/或syndecan-1的循环水平指示低出生体重的风险,注意到早至妊娠约27-29周的spint1和/或syndecan-1的低水平的妊娠雌性受试者处于分娩低出生体重(小于胎龄)新生儿的显著风险。这些发现可以应用于出生体重计算器;也就是说,应用于一种预测新生儿出生体重的装置或方法,所述装置或方法通过将妊娠雌性受试者中的spint1和/或syndecan-1的循环水平与已知新生儿出生体重的雌性受试者的spint1和/或syndecan-1的预先确定的循环水平相关联来进行。因此,本公开内容扩展至预测新生儿的出生体重的方法,该方法包括(i)确定来自妊娠雌性受试者的样品中的spint1和/或syndecan-1的循环水平;(ii)提供相同物种的多于一个妊娠雌性受试者的spint1和/或syndecan-1的循环水平与新生儿出生体重之间的预先确定的相关性;和(iii)基于步骤(ii)的预先确定的相关性,根据步骤(i)中确定的spint1和/或syndecan-1的循环水平预测新生儿的出生体重。
本公开内容还扩展到用于预测新生儿的出生体重的装置,该装置包括(i)接收器,所述接收器可操作以接收生物标志物信息,其中所述生物标志物信息是来自妊娠雌性受试者的样品中的spint1和/或syndecan-1的循环水平;以及(ii)出生体重确定器,所述出生体重确定器可操作以使用所述生物标志物信息提供代表新生儿出生体重的预测的输出;其中所述预测的出生体重基于相同物种的多于一个妊娠雌性受试者的spint1和/或syndecan-1的循环水平与新生儿出生体重之间的预先确定的相关性。
在一种实施方案中,在(a)相同物种的多于一个妊娠雌性受试者的spint1和/或syndecan-1的循环水平和(b)新生儿出生体重之间的预先确定的相关性由约0.020至0.060的回归系数(r2)定义。在一种实施方案中,预先确定的相关性由约0.026到约0.52的回归系数定义。在一种实施方案中,预先确定的相关性由约0.52的回归系数定义。
如本文其他地方所述,本发明人意外地发现,妊娠雌性受试者中的spint1的循环水平与胎盘功能不全的临床参数诸如新生儿瘦体重(r2=0.064;p<0.0001)和胎盘重量(r2=0.087;p<0.0001)相关。因此,本公开内容扩展至确定妊娠雌性哺乳动物受试者中的胎盘重量和胎盘表面积的测定,该方法包括确定spint1和/或syndecan-1的母体循环水平,其中spint1和/或syndecan-1的浓度相对于对照的降低或随时间的降低或者比率相对于对照的变化或随时间的变化指示较低的胎盘重量和较低的胎盘表面积。本文还实现了一种用于妊娠哺乳动物受试者的临床管理方案,该方案包括确定spint1和/或syndecan-1的母体循环水平,其中spint1和/或syndecan-1的浓度相对于对照的降低或随时间的降低或者比率相对于对照的变化或随时间的变化指示较低的胎盘重量和较低的胎盘表面积,并且其中胎儿被监测或进行提早分娩。
本公开内容还扩展至确定新生儿的瘦体重的测定,该方法包括确定妊娠雌性哺乳动物受试者中的spint1和/或syndecan-1的循环水平,其中spint1和/或syndecan-1的浓度相对于对照的降低或随时间的降低或者比率相对于对照的变化或随时间的变化指示新生儿具有较低的瘦体重。本文还实现了一种用于妊娠哺乳动物受试者的临床管理方案,该方案包括确定spint1和/或syndecan-1的母体循环水平,其中spint1和/或syndecan-1的浓度相对于对照的降低或随时间的降低或者比率相对于对照的变化或随时间的变化指示新生儿具有较低的瘦体重,并且其中胎儿被监测或进行提早分娩,和/或使受试者暴露于治疗以增加新生儿的瘦体重。
实施例
参考以下的非限制性实施例来进一步描述本文公开的方面。
实施例1
胎盘特异性蛋白
胎儿纵向生长评估(fetallongitudinalassessmentofgrowth,flag)研究被设计为检查所测量的在妊娠28周和36周时母体血液中编码胎盘特异性基因的mrna及其蛋白质对足月fgr的预测能力。纵向样品收集自2000名妊娠女性;10.5%随后产下sga(<第10百分位数)婴儿。在18个月内,使用elisa,针对51种表面蛋白中的28种从前1000个flag样品系统地选择1:1病例对照集(即105名sga病例和105名匹配对照)。spint1被鉴定为胎盘功能不全的有希望的新候选标志物。
spint1是一种调控参与组织重塑的细胞表面和细胞外丝氨酸蛋白酶的蛋白酶抑制剂(tanaka等人.(2005)molcellbiol25:5687-5698)。spint1最初被鉴定为肝细胞生长因子激活物的抑制剂。它也称为hai-1。spint1在胎盘发育中的重要性通过以下事实被突出:由于失败的胎盘发育和功能,spint1敲除小鼠具有严重的生长受限和胚胎致死(tanaka等人.(2005)同上)。spint1敲除小鼠具有受损的迷路层形成——迷路层在母体/胎儿交换中至关重要。直到现在,本领域还没有考虑到改变的spint1可能在人类fgr中具有的潜在作用。另一种胎盘特异性蛋白是syndecan-1。本发明确定,spint1和syndecan-1是胎盘功能不全的新标志物。
实施例2
作为fgr的标志物的spint1和syndecan-1
spint1作为fgr的标志物的表现优于胎盘生长因子(plgf)。迄今为止,plgf被认为是胎盘功能不全的最强生物标志物。plgf被胎盘高度表达,并且降低的循环水平与fgr相关(benton等人.(2012)amjobstetgynecol206(163):e161-167;griffin等人.(2015)ultrasoundinobstetricsandgenecology46:182-190)。
图1a至图1p是示出了使用商购可得的elisa测量的血浆中的循环spint1和syndecan-1的图解表示。spint1来自sigmaaldrich并且syndecan-1来自thermofisherscientific。sflt-1和plgf使用来自roche的诊断测试测定进行测量。病例对照队列选自提供妊娠36周时的血液样品的患者。spint1水平(n=210名对照,n=104名sga)在分娩sga婴儿(<第10百分位数;1a、1b)的患者中显著降低,具有0.75的受试者操作曲线下面积(auc)。当测量病例对照队列(1c、1d;n=99名对照,n=89名sga)中的syndecan-1时,还发现随后分娩sga婴儿的女性中的syndecan-1显著降低,具有0.73的auc。相比之下,循环sflt-1(1e、1f;n=207名对照,n=102名sga)在分娩sga婴儿的女性中显著增加,具有0.58的auc,而循环plgf(1g、1h;n=210名对照,104名sga)显著减少,具有0.66的auc(h)。spint1和syndecan-1的优越临床测试特征通过比plgf更好的roc曲线下面积(auc)被证明。数据表示为平均值+/-sem-每个符号代表个体患者*p<0.05,****p<0.0001。
仅测量plgf并未产生足够有效以整合到临床护理中的诊断测试。测量30-34周时的plgf加上评估母体风险因素,对于鉴定5周内分娩的sga婴儿仅具有58%的灵敏度,并且对于超过5周分娩的sga婴儿仅具有34%的灵敏度(特异性为90%)[bakalis等人.(2015)ultrasoundinobstetricsandgynecology46:2089-215]。当在妊娠35-37周测量时,具有出生体重<第5百分位数的婴儿的女性中的plgf水平也显著较低,但是plgf水平对单独的母体风险因素评估用于检测sga的预测能力增加令人惊讶的少的预测能力(fadigas等人.(2015)ultrasoundinobstetricsandgynecology46:191-197)。参考图1a至1p。接下来,在由妊娠36周时收集的1004个样品组成的样品集中验证来自病例对照队列的结果。920名对照和其中母亲随后分娩sga婴儿的84名病例。随后分娩sga婴儿的女性中的循环spint1显著降低,具有0.74的auc(图1i、1j)。值得注意的是,spint1的auc没有降低—与病例/对照集的0.75相比,其为0.74。类似地,分娩sga婴儿的女性中的syndecan-1保持显著降低,具有0.65的auc(图1k、1l)。
接下来,目的是评估这些蛋白在注定具有sga胎儿的那些人中在妊娠早期的母体循环中是否可能降低。为此,选择了病例对照队列,并且我们测量了妊娠28周时的循环spint1(n=130名对照,n=104名sga)和syndecan-1(n=100名对照,n=84名sga)。在妊娠28周时,随后分娩sga婴儿的女性中的spint1已经显著降低,具有0.69的auc(图1m、1n)。类似地,在妊娠28周时,注定分娩sga胎儿的那些人中的syndecan-1显著降低,具有0.69的auc(图1o、1p)。考虑到具有降低的血浆spint1和syndecan-1的女性可能直到10-12周后才分娩她们的sga婴儿,这是一个特别有意义的发现。值得注意的是,妊娠28周时的plgf水平没有显著变化。数据表示为平均值+/-sem-每个符号代表个体患者,****p<0.0001。
当测量1000名女性中的循环spint1浓度时,发现在整个连续出生体重百分位数中它都是强相关的(2a、2b),表明循环spint1水平和胎儿大小之间的密切的连续的关系。
使用peapod机器测量一个子集的婴儿出生时的体脂质量和瘦体重,并且还通过用卡尺测量在婴儿的三头肌中部(mid-triceps)和肩胛下区域的水平处的皮下脂肪来估计体脂百分比。发现spint1与新生儿瘦体重相关(2c),但与皮褶体脂百分比不相关(2d)。
总之,这些数据提供了令人信服的证据,表明循环spint1和syndecan-1是临床上有用的胎儿生长生物标志物。
实施例3
fgr胎盘中的spint1降低和通过低氧引起的spint1降低
本实施例确定了fgr胎盘中的spint1是否降低,以及这是否是循环水平降低的原因。图3a至图3p是示出确定人类sga病例中的胎盘spint1是否改变的观察研究的图解表示。为此,从对照、先兆子痫或sga妊娠选择胎盘的队列。使用定量rt-pcr测量spint1mrna,并且显示出在妊娠<34周时分娩其婴儿的患者中,先兆子痫和sga队列中的spint1mrna与对照相比均显著降低。在从妊娠>34周时分娩的患者收集的胎盘中未检测到spint1mrna表达的变化。使用蛋白质印迹和商购可得的抗体评估spint1蛋白表达。在妊娠<34周时和妊娠>34周时二者收集的样品中,来自分娩sga婴儿的女性的胎盘中的spint1蛋白显著降低。数据表示为平均值+/-sem-每个符号代表个体患者或小鼠,*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
鉴于胎盘功能不全的特征为慢性胎盘低氧,接下来评估了低氧是否会降低胎盘的spint1表达。将原代人类滋养层(即从新鲜分娩的胎盘分离的胎盘细胞)暴露于1%(低氧)或8%(常氧)氧气(o2)。
下一步骤是评估原代胎盘细胞(从足月人类胎盘分离的细胞滋养层细胞)暴露于低氧条件(对于低氧,1%v/v氧气,以及对于常氧,8%v/v氧气)是否会改变spint1mrna和蛋白表达以及蛋白分泌。最初通过qrt-pcr评估了mrna表达,并且我们发现原代胎盘细胞暴露于低氧导致显著降低的spint1mrna表达(3e),且通过蛋白质印迹测量的细胞蛋白观察到类似发现(3f)。接下来,使用与测量血液中的血浆spint1相同的elisa测量了spint1向浸浴胎盘细胞的培养基中的分泌,并且我们发现当使得胎盘细胞低氧时,培养基中spint1的水平也显著降低(3g)。因此,获得了强有力的证据,证明胎盘低氧降低了spint1转录和蛋白产生。
在由母体低氧引起的fgr小鼠模型中评估了spint1。在这个模型中,妊娠小鼠在e14-19暴露于低氧(10%吸入o2)或常氧(21%吸入o2)[higgins等人.(2016)thejournalofphysiology594:1341-1356],然后在e19.5(注意,小鼠的足月为约第20天)被屠宰(culled)。妊娠母鼠暴露于低氧显著损害迷路区形成(相当于人类胎盘中的胎盘界面(placentalinterface)),降低胎儿毛细血管的表面积和密度,并损害基质交换和流向生长中的胎儿-胎盘单元(feto-placentalunit)的血流。首先示出,在测量spint1mrna的胎盘中具有低氧诱导的生长受限胎儿,但胎盘重量没有变化(3h、3i)。随后表明,在暴露于低氧的小鼠胎盘中,的确胎盘spint1mrna表达显著降低(3j)。然后测量了胎盘spint1蛋白表达。我们再次证实这种低氧降低了胎儿体重,但没有降低胎盘重量(3k、3l)。在这组动物研究中,我们证实了胎盘spint1蛋白在低氧下也显著降低(3m)。因此,获得了强有力的证据,表明sga婴儿胎盘中的spint1降低,并且spint1的降低可与胎盘低氧相关。
因此,这些数据表明,低氧降低了胎盘spint1表达,并且生长受限胎儿的胎盘中的spint1显著降低。因此,在我们的flag队列中观察到的降低的循环spint1浓度可能是胎盘起源的。
本发明人接下来着手评估在htr8胎盘细胞系中使用sirna敲低使spint1沉默是否会影响使用xcelligence系统实时评估的细胞增殖。事实上,当htr8细胞中的spint1被沉默时,发现增殖受损(3n)。
本发明人试图确定降低的增殖是否可能是凋亡增强的结果,使htr8细胞中的spint1沉默,然后收集蛋白并通过蛋白质印迹测量凋亡标志物bax、bcl2和裂解的胱天蛋白酶3(3o)。虽然发现spint1蛋白表达如预期地显著降低(上面的图示出了sispint下的条带的缺乏),但凋亡标志物的表达没有显著变化,表明spint1被沉默时降低的增殖不是增加的凋亡的结果。β-肌动蛋白用作上样对照。
本发明人还试图确定增强spint1是否会改变htr8胎盘细胞系增殖。为此,将被称为sri31215的商购可得的spint1模拟物(glixxlaboratories)施加到htr8细胞,并使用xcelligence系统监测增殖。发现5um或10um的sri31215增强htr8增殖。
实施例4
spint1对正常胎盘功能至关重要
本实施例的目的是:表征fgr胎盘中蛋白裂解酶(matriptase)的表达,并评估胎盘spint1降低对分离的滋养层细胞中蛋白裂解酶活性的影响;评估降低的胎盘spint1对正常人类胎盘细胞功能(包括滋养细胞合体化(syncytialization)、侵袭和增殖)的影响;并使用条件性胎盘spint1敲除小鼠模型来表征正常胎盘发育对spint1依赖性的精确时机。
一般实验方法:正常和fgr胎盘样品从通过剖腹产进行分娩的女性收集(以避免分娩(labour)的混淆作用)。早期妊娠样品从选择性终止妊娠的病例获得。使用两种胎盘原代组织类型:1)人类胎盘外植体(5mm3胎盘块)和2)来自足月或早期妊娠胎盘的原代分离的滋养层细胞(kaitu'u-lino等人.(2014)pregnancyhypertension4:287-295)。从雄性和雌性妊娠二者获得相等数量的胎盘。用于滋养层分离、胎盘外植体培养、rna提取、qpcr或蛋白质印迹的方法的细节在kaitu'u-lino等人.(2014)同上;brownfoot等人.(2015)amjobstetgyneocol;brownfoot等人.(2015)hypertension66:687-697;kaitu'u-lino等人.(2012)theamericanjournalofpathology180:888-894;tong等人.(2015)hypertension66:1073-1081;onda等人.(2017)hypertension69:457-468;kaitu'u-lino等人.(2017)hypertension70:1014-1024中公开。
统计学(对于整个文件):使用参数检验比较正态分布数据;用非参数检验比较非正态分布数据。原代滋养层实验重复4-5次,并且胎盘外植体研究重复5-7次(因为存在增加的变异性)。对来自不同患者的样品进行生物学重复,并且每个实验一式三份地进行。对来自生物学重复实验的中位数(或平均值)进行统计分析。对于动物研究,使用线性混合模型重复测量,其考虑了每个胎儿是一窝中的重复测量。
表征fgr胎盘中蛋白裂解酶的表达并评估胎盘spint1降低对分离的滋养层细胞中的蛋白裂解酶活性的影响。作为蛋白酶抑制剂,spint1靶向3种已知的蛋白酶—其中一种是蛋白裂解酶。小鼠中的spint1敲除导致失败的胎盘发育、胚胎致死和升高的蛋白裂解酶水平。同时敲除spint1和蛋白裂解酶挽救了胎盘发育和胚胎致死,证明增加的蛋白裂解酶活性对胎盘缺陷和胚胎致死作出贡献(szabo等人.(2007)oncogene26:1546-1556;szabo等人.(2014)plosgenetics10:e1004470)。表征了fgr胎盘中蛋白裂解酶的mrna、蛋白表达和定位(图2中使用的相同队列)。评估了使spint1沉默对人类胎盘细胞中的蛋白裂解酶活性的影响。使用sirna使分离的原代滋养层中的spint1沉默,并且使用商购可得的测定测量蛋白裂解酶活性,以确定活性是否如在小鼠胎盘中所观察到的那样增加。评估了足月滋养层和早期妊娠滋养层。降低的spint1的第二种模型由胎盘低氧诱导。将分离的原代滋养层暴露于低氧(1%氧气)降低了spint1(图3)。将原代滋养层和胎盘外植体暴露于低氧(1%氧)或常氧(8%氧),以降低spint1表达并测量对蛋白裂解酶活性的影响。
这提供了首个证据证明降低的spint1导致原代人类胎盘细胞中的过度蛋白裂解酶活性。
评估降低的胎盘spint1表达对胎盘细胞侵袭、迁移和滋养细胞合体化的影响。胎盘功能不全和fgr与不良的胎盘生长相关,包括降低的滋养层侵袭、迁移和增殖。此外,来自小鼠模型的证据(tanaka等人.(2005)同上;szabo等人.(2007)同上)表明spint1在母体/胎儿界面,即迷路区的建立中的至关重要的作用。评估了spint1敲低对滋养层侵袭、迁移和增殖的影响。提供了证据证明,使滋养层细胞系htr8细胞中的spint1沉默导致增殖降低。使用xcelligence评估了spint1敲低(使用sirna)对htr8和早期妊娠滋养层迁移、侵袭和增殖的影响。首先在分离的足月滋养层中评估滋养细胞合体化。这些细胞在培养物中自发进行滋养细胞合体化(kaitu'u-lino等人.(2014)同上)。使用sirna使spint1沉默,并测量随时间推移对滋养细胞合体化的影响,测量随时间推移对滋养细胞合体化的影响通过测量该过程的标志物(包括人类绒毛膜促性腺激素;经由elisa)和e-钙粘蛋白的损失(pcr、蛋白质印迹和免疫荧光)来进行。还确定了胎盘spint1降低是否增加凋亡(胱天蛋白酶3和9,bcl2和bax表达,经由蛋白质印迹)。
这证明了人类胎盘细胞中spint1表达的损失导致受损的胎盘细胞功能和发育。
使用条件性胎盘spint1敲除小鼠模型表征正常鼠胎盘发育中的spint1。本发明人可以通过慢病毒转导基因(或shrna)到继续形成胎盘(滋养外胚层)的细胞中,促进基因在小鼠胎盘中特异性的敲低或过表达[onda等人.(2017)同上]。然后将转导的胚泡转移到接受者母鼠中(onda等人.(2017)同上;kumasawa等人.(2010)procnatlacadsciusa),允许形成遗传修饰的胎盘,其中母亲和幼仔不受影响。这个模型是为了使spint1仅在胎盘中沉默。
来自tanaka等人.(2005)同上和szabo等人.(2007)同上的数据证明,在小鼠中敲除spint1导致胚胎第(e)9.5天的失败的胎盘发育和生长受限,并在第e10.5-12.5天之间导致胚胎致死。使用了可以在整个妊娠期间以特定的预定间隔敲低胎盘spint1表达的条件性慢病毒。这通过在慢病毒质粒骨架中包含诱导型四环素启动子来实现,该启动子仅在母亲接受多西环素时被诱导(fan等人.(2012)endocrinology153:5637-5644)。使用诱导型启动子,展示了这一技术。使用了具有对多西环素的高度敏感性的加荧光标签的多西环素响应性反式激活蛋白(fan等人.(2012)同上;moutier等人.(2003)transgenicresearch12:369-373)。在小鼠中,迷路区从约e8.5-9发育,此时绒毛开始延伸和分支(anson-cartwright等人.(2000)natgenet25:311-314)。鉴于spint1敲除小鼠中的迷路区的缺乏(tanaka等人.(2005)同上),在e6.5、e8.5、e9.5、e10.5、e11.5和e12.5开始将多西环素纳入饮用水中;摄取含有多西环素的水使慢病毒活化,导致spint1表达在这些特定的妊娠时被沉默。使用了两个对照组:1)转移了含有空的慢病毒的胚泡的小鼠,以作为任何多西环素作用的对照;和2)转染了spint1shrna但未接受多西环素的小鼠。在引入多西环素或媒介物对照后4天,屠宰妊娠母鼠,以评估:1)胎盘和循环spint1mrna(pcr)和蛋白表达(蛋白质印迹)以确认敲低;2)荧光定位以确认滋养层转染;3)胎盘大小和形态学;和4)胎仔数、胎儿生长(包括胎儿重量、冠-臀长(crown-rumplength)、四肢、以及肝和脑重量,以评估生长受限的对称性和脑保护效应(brainsparingeffect))。测量胎盘参数,包括迷路发育标志物(e-钙粘蛋白和β-连环蛋白),并评估滋养层密度、母体血液间隙(bloodspace)和胎儿血管。
这决定了胎盘发育需要spint1的精确妊娠窗,并建立了新的胎儿生长受限小鼠模型。这些数据共同证明,降低的胎盘spint1增加了人类细胞中的蛋白酶蛋白裂解酶的表达和活性,这继而损害了胎盘发育。此外,开发了条件性spint1敲低小鼠模型,该小鼠模型用作新的fgr小鼠模型,其可用于测试潜在的治疗。
实施例5
spint1作为胎盘功能不全的潜在诊断标志物
spint1是fgr的新标志物。改善妊娠的所有阶段中的fgr检测是改善围产期结果的关键第一步,但是目前缺乏可靠的筛查策略。如之前概述的,spint1作为临床上有用的诊断生物标志物具有巨大的潜力,在flag队列中早在足月sga婴儿分娩前12周就显著降低。虽然plgf是研究最广泛的胎盘功能不全的标志物之一,但来自flag的数据表明它表现得不如spint1好。近年来,plgf和抗血管生成分子sflt-1的比率已被评估以确定其生物标志物的潜力,有报告称这一比率与增加的死产风险相关(chaiworapongsa等人.(2013)obstetgynecol208(287):e281-287,e215)。使用36周的样品测量plgf和sflt-1,并确定作为生物标志物测试的灵敏度(以固定的90%特异性)。发现,尽管plgf或sflt1/plgf比率在预测fgr方面表现有限(modest)(灵敏度分别为29%和27%),但单独的spint1已经具有40%的灵敏度。有趣的是,将spint1添加到sflt1/plgf比率将注定出生为sga的婴儿的检测显著地提高到48%:为用当前常规护理(卷尺和选择性超声)检测的数字的多于两倍,并且事实上接近通用超声的检出率(paiva等人.(2011)jclinendocrinolmetab96:e1807-1815;moutier等人.(2003)同上)。因此,提出将spint1与sflt1/plgf组合,代表一种临床上有用的血液测试。
flag数据表明,spint1+/-sflt1/plgf有望成为用于足月sga的有用生物标志物。这一发现值得在独立队列中进行验证,但它对确定这种生物标志物方法在改善早产fgr的检测方面是否具有临床效用也是有用的。这是重要的,因为这些妊娠受益于加强的监测,并且这是用于未来治疗干预的试验的候选物。因此,使用了一个队列,该队列提供了确定28周时的spint1是否是sga的有用预测物的机会,包括具有严重早发fgr的那些人。测量pigf+/-sflt1还允许我们评估它是否可以提高这些提出的生物标志物的预测性能。认为在该队列中的注定要分娩sga胎儿的那些人中,28周时的spint1更低。
实施例6
syndecan-1
参见图4a-图4c。如对于spint1观察到的,妊娠36周时测量的循环母体syndecan-1(表示为中位数倍数(multiplesofthemedian;mom))表现为与出生百分位数正相关。还对出生时的胎儿参数进行了评估,并发现妊娠36周时测量的循环母体syndecan-1与新生儿瘦体重和皮褶体脂百分比二者显著相关。
图5a至图5e是示出确定人类sga病例中的胎盘syndecan-1是否改变的观察研究的图解表示。为此,从对照、先兆子痫(pe)或sga妊娠选择胎盘的队列(用于测量spint1的同一队列)。使用定量rt-pcr测量syndecan-1mrna,并且显示出在妊娠<34周时分娩其婴儿的患者中,pe和sga队列二者中的胎盘syndecan-1mrna与对照相比均显著增加。随后测量蛋白表达。用于蛋白质印迹的商业抗体产生3条不同的条带,所述条带可能对应于syndecan-1的不同同种型。这些条带的密度计分析表明,在sga胎盘中,85kda和80kda的条带没有改变,而33kda的条带显著减少。随后测量妊娠>34周时分娩的胎盘中的syndecan-1mrna表达,并且发现表达无显著变化。数据表示为平均值+/-sem-每个符号代表个体患者,*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
鉴于sga和胎盘低氧之间的相关性,图6a至图6f是使用图3中测定spint1的相同样品来显示胎盘低氧对syndecanmrna和蛋白表达的影响的图解表示。qrt-pcr表明,低氧诱导了syndecan1mrna表达的显著降低(a)。虽然蛋白质印迹显示总蛋白表达没有显著变化(b),但来自暴露于低氧的原代胎盘细胞的syndecan-1蛋白分泌显著减少(c)。
还测量了在从暴露于低氧的妊娠小鼠获得的胎盘中的鼠syndecan-1表达以及与小胎儿的相关性。在我们发现鼠spint1表达降低的那些相同样品中,我们发现syndecan-1mrna(6d)或蛋白表达(6e)没有显著变化。
当胎盘细胞系htr8s中的syndecan-1被沉默(使用sirna)时,存在降低的细胞增殖(6f;使用xcelligence系统测量)。
实施例7
巨大儿
本文提出,升高的spint1和/或syndecan-1水平是巨大胎儿的指示物。生物标志物之一或两者的水平如本文描述的单独地检测和测量,或与其他生物标志物的水平和/或生理化学数据(诸如来自超声的数据)以及与胎儿或产后体重相关的结果组合地检测和测量。超重的婴儿,包括出生时体重超过4kg的婴儿,被认为是巨大婴儿。检测子宫内潜在巨大婴儿的能力可以帮助临床妊娠管理。
实施例8
spint1是胎盘功能不全的诊断标志物
本研究调查了从澳大利亚墨尔本的一家三级转诊医院前瞻性收集的来自妊娠28周(27+0–29+0)和36周(35+0–37+0天)时妊娠女性的血液样品中spint1与胎盘功能不全的多种临床参数之间的相关性。本研究获得了慈善健康研究伦理委员会(mercyhealthresearchethicscommittee)的批准(伦理批准号r14/12),并从所有参与者获得了书面知情同意。
将该队列大致对半分开,以发现并随后验证生物标志物,包括spnt1。来自第一批997名连续招入的参与者的样品构成队列1(表2),并且来自第二批999名连续招入的参与者的样品构成队列2(表3)。
表2:队列1的母体特征和妊娠结果。如果是正态分布数据,数据表示为平均值(标准差),如果不是正态分布数据,则数据表示为中位数[第25-75百分位数],并且如果是分类数据,则数据表示为数字(%)。小于胎龄定义为出生体重<第10百分位数:
表3:队列2的母体特征和妊娠结果。如果是正态分布数据,数据表示为平均值(标准差),如果不是正态分布数据,则数据表示为中位数[第25-75百分位数],并且如果是分类数据,则表示为数字(%)。小于胎龄定义为出生体重<第10百分位数:
flag研究中的347名未生育过的女性也被招入以进行更透彻的研究(flagb队列)。她们在妊娠36周时进行了超声评估,以测量子宫、脐带和胎儿大脑中动脉的血流阻力。在可能的情况下,在出生4天内通过使用peapod装置进行空气置换体积描记法研究来测量新生儿身体组成(瘦体重和脂肪量)。
对女性进行资格筛选,并邀请她们参与其口服葡萄糖耐量测试,该测试通常在妊娠约28周提供,以测试妊娠期糖尿病。年龄超过18岁、具有单胎妊娠和正常中期妊娠胎儿形态学检查的说英语的女性有资格参与。血液取样时,来自怀疑有sga胎儿的女性的样品不被排除在外。参与者捐献妊娠27+0至29+0周和/或35+0至37+0周(包括端点)时的血液样品。将全血收集在10ml乙二胺四乙酸管中。将血浆储存在-80℃,直到进行样品分析时。
母体特征和妊娠结果由对任何蛋白水平不知情的一名临床医师在审查每名参与者的病历、研究结果和医院数据库条目后获得。使用grow软件1(www.gestation.net)为婴儿出生体重指定定制的百分位数,所述grow软件1基于优化的胎儿体重标准生成“足月最佳体重”,所述优化的胎儿体重标准根据以下进行调整:母体身高、体重和胎次;婴儿性别;和确切的胎龄。澳大利亚grow数据集的系数通过本地数据集获知;多元回归模型具有一个常数,针对每个调整的变量增加或减少该常数的权重。sga被定义为定制的出生体重<第10百分位数。将sga病例中的循环蛋白水平与对照进行比较。
一些未生育过的参与者也参与了本文中称为flagb的基于超声的flag研究组(arm)。为此,对347名女性进行了36(35+0-37+0)周超声评估,其中将经腹彩色和脉冲波多普勒用于测量平均母体子宫动脉搏动指数(pi)和脐动脉pi。在胎儿呼吸暂停和不活动的时间段期间进行测量,其中受声波的作用的角度(angleofinsonation)接近于零。在远离脐带插入部位(cordinsertionsite)的脐带自由环(freeloopofumbilicalcord)中测量脐动脉pi。对于母体子宫动脉,将探头放置在每个髂窝中,并且在子宫动脉穿过髂外动脉1cm内记录波形2。pi值以一式三份进行测量,并计算平均值。获得了右侧和左侧血管二者的平均子宫动脉pi值,并将这些值取平均值以提供总的平均pi。对于每一个pi值,确定了妊娠依赖的百分位数(如果是正态分布的),或中位数倍数(mom)。治疗临床医师对子宫动脉pi结果不知情。
使用来自队列2的数据(队列1中发现的标志物的验证运行),单独或组合测量潜在标志物的诊断性能,以预测出生时出生体重百分位数<第20、<第10、<第5和<第3;以及出生时出生体重<第5百分位数但还需要保育入院(nurseryadmission)的新生儿。特异性设置在约90%,这相当于10%的筛查阳性率。
在妊娠36周时在347名未生育过的女性的亚组(分布跨越队列1和队列2)中进行超声,然后对出生后的新生儿进行空气置换体积描记法(peapod)(flagb)。spint1与妊娠36周时测量的子宫动脉呈负相关(图7a),但与脐动脉多普勒速度不呈负相关(图8a),并且与新生儿瘦体重呈正相关(图7b),但与脂肪量不呈正相关(图8b、图8c)。spint1还与胎盘重量强相关(图2c)。相比之下,pigf和胎盘功能不全的这些指示物之间的相关性要么不显著,要么更为有限(图9)。我们还发现,在对照(>第10百分位数)和递减的出生体重百分位数之间,血浆spint1浓度逐步降低(图7d)。36周时的血浆spint1浓度跨所有出生体重百分位数连续相关(图7e)。
这些数据表明,循环spint1浓度与若干临床参数相关,所述若干临床参数与来自不同国家的高风险队列中的胎盘功能不全相关。
实施例9
syndecan-1和spint1被验证为胎盘功能不全的诊断标志物
本研究中展示的数据在更大的样品队列中说明了spint1或syndecan-1与胎盘功能不全的多种临床参数之间的相关性。这些数据包括上文描述的一些数据,其被扩展到包括多达2040名女性的整个队列。
当在36周时在n=1996个样品的整个队列(1785名对照、211名sga病例)中验证spint1时,数据证实,随后分娩sga婴儿的女性中的spint1浓度显著降低(图10a),具有0.688的auc(图10b)。当检查n=1996的整个队列时,证实了与出生百分位数的强相关性(图10c-图10d)。
类似地,当在整个队列中验证syndecan-1时,随后分娩sga婴儿的女性中的syndecan-1浓度显著降低(图10e),具有0.61的auc(图10f)。数据还显示了在整个队列中与出生百分位数的相关性(图10g-图10h)。
图11a至图11c中所示的数据验证了n=2040的整个队列(n=1827名对照、n=213名病例)中在28周时的spint1变化。数据证实,分娩sga婴儿的女性中在28周时的循环spint1显著降低(图11a),具有0.60的auc(图11b)。妊娠28周时,spint1与出生体重百分位数持续相关(图11c)。
图12a至图12d中示出的数据验证了较大队列中36周时的血浆spint1的变化,并显示出与胎盘功能不全的标志物的相关性。妊娠36周时的血浆spint1浓度与子宫动脉(ua)多普勒流动阻力(图12a,n=325)、新生儿瘦体重(图12b,n=281)和胎盘重量(图12c,n=378)相关。其婴儿随后出生时出生体重低于第10百分位数的女性中的血浆spint1浓度逐步降低(图12d)。
图13a至图13d中示出的数据验证了从女性分娩其婴儿当天收集的样品的独立队列中的血浆spint1和syndecan-1的变化。怀有sga婴儿(婴儿小于第10百分位数;图13a、图13b,n=47名sga和n=509名对照)的女性中的spint1显著减少。类似地,怀有sga婴儿的相同女性中的syndecan-1也显著减少(图13c、图13d)。
实施例10
开发和验证诊断测试以预测低出生体重—4等级风险评估模型
基于不同的spint1mom截止值水平,开发了不同低出生体重范围的4等级风险模型(队列2),然后进行了验证(队列1)。当在队列2中开发测试时,这些截止值水平是任意选择的。研究者前瞻性地同意设置这些阈值,这些阈值随后被应用于队列1进行验证。对于统计分析,根据分布将数据归纳为平均值(sd)、中位数[第25-75百分位数]、中位数(最小值、最大值)和数字(%)。sga状态之间的假设检验使用针对连续数据的mann-whitney秩和检验,和针对分类数据的fisher精确检验。使用数据的受试者操作特征曲线下面积(roc面积)、在90%特异性的灵敏度以及阳性患病率(ppv)和阴性患病率(npv)评估预测性能,所述预测性能被表示为点估计和基于wilson的95%置信区间。显著性水平设置为0.05,并且针对多重比较未进行调整。所用的统计软件是statav15(statacorp.2017.stata统计软件:发布15.collegestation,tx:statacorpllc)和diagt程序(summarystatisticsfordiagnostictests.p.t.seedanda.tobias.重印于statatechnicalbulletinreprints,vol.10,pp.90–93.,来自http://fmwww.bc.edu/repec/bocode/d,最后一次访问为2018年11月1日)或graphpadprism6(graphpadsoftware,lajolla,ca)。
队列2中妊娠36周时的循环spint1浓度<0.63mom,鉴定出具有升高的分娩低出生体重婴儿的风险的组(表1)。值得注意的是,46.5%筛查阳性的具有<第20的出生体重百分位数。我们在来自flag研究的队列1中验证了这一spint1截止值的诊断测试性能(表4)。
表4:spint1mom<0.63在检测出生时不同程度的低出生体重新生儿中的诊断性能。队列2(n=999)用于将spint1mom的阈值设置为<0.63,并且队列1(n=997)用于验证该设置阈值的测试性能。
使用队列2,基于不同的spint1mom浓度开发了4等级风险模型(表5)。
表5:用于具有不同低出生体重截止值的新生儿分娩的4等级风险模型的开发和验证。风险模型通过选择队列2中妊娠35+0-37+0周时的妊娠女性中测量的循环水平spint1mom浓度的不同阈值来开发。然后将相同的设置阈值应用于队列1。
处于最高风险等级的那些人(队列2的7.1%,具有最低的spint1mom)分别具有14.1%、19.7%、28.2%和46.5%的分娩出生体重<第3、<第5、<第10和<第20百分位数的新生儿的风险。相比之下,处于最低风险等级的那些人(队列1的9.1%)分别具有0.0%、1.1%、1.1%和6.6%的分娩<第3、<第5、<第10和<第20百分位数的新生儿的风险。该模型在队列1中得到验证,具有非常相似的诊断性能(表7)。
如果循环spint1浓度在等级1(最高风险)内,分娩在这些出生体重百分位数的婴儿的比率与队列中基线群体患病率相比升高了2-5倍。它们与等级2的背景群体患病率相似,在等级3中,群体患病率为约一半,并且在等级4非常低(表7)。
这些数据展示了4等级风险模型的开发和验证,该模型鉴定出处于分娩低出生体重百分位数新生儿的高风险或低风险的队列,其中,其想必也鉴定出低体重和处于增加的死产风险的未出生胎儿。这种4等级风险模型能够为略低于一半的进行测试的群体分配不同于基线患病率的风险水平(等级1、等级3和等级4)。这种4等级风险模型可用于诊所,其中处于等级1的那些人可以被提供计划的到期分娩,并且可以使处于等级3-4内的那些人安心。
本领域技术人员将理解,除了具体描述的那些内容之外,本文描述的公开内容易于进行变化和修改。应理解,本公开内容涵盖所有这样的变化和修改。本公开内容还实现本说明书中单独地或共同地提及或指出的所有步骤、特征、组合物和化合物,以及所述步骤或特征或组合物或化合物的任何两个或更多个的任何和所有组合。
参考文献
anson-cartwrightetal.(2000)natgenet25:311-314
bakalisetal.(2015)ultrasoundinobstetricsandgenecology46:2089-215
barker(1998)cliicalscience95:115-128
barker(2000)theriogenology53:555-574
barkerandosmond(1986)lancet1:1077-1081
bentonetal.(2012)amjobstetgynecol206(163):e161-167
brownfootetal.(2015)amjobstetgyneocol
brownfootetal.(2015)hypertension66:687-697
chaiworapongsaetal.(2013)obstetgynecol208(287):e281-287,e215
cooperetal.(1997)annalsoftherheumaticdisease56:17-21
fadigasetal.(2015)ultrasoundinobstetrisandgenecology45:559-565
fadigasetal.(2015)ultrasoundinobstetricsandsynecology46:191-197
fanetal.(2012)endocrinology153:5637-5644
griffinetal.(2015)ultrasoundinobstetricsandgenecology46:182-190
halesandbarker(1992)diabetologia35:595-601
higginsetal.(2016)thejournalofphysiology594:1341-1356
kaitu′u-linoetal.(2012)theamericanjournalofpathology180:888-894
kaitu′u-linoetal.(2014)pregnancyrypertension4:287-295
kaitu′u-linaoetal.(2017)hypertension70:1014-1024
kumasawaetal.(2010)procnatlacadsciusa
milleretal.(2016)thejournalofphysiology594:807-823
mifsudandsebire(2014)fetaldiagnosisandtherapy36:117-128
moutieretal.(2003)transgenicresearch12:369-373
ondaetal.(2017)hypertension69:457-468
paivaetal.(2011)jclinendocrinolmetab96:e1807-1815
sovioetal.(2015)lancet386:2089-2097
szaboetal.(2007)oncogene26:1546-1556
szaboetal.(2014)plosgenetics10:e1004470
tanakaetal.(2005)molcellbiol25:5687-5698
tongetal.(2015)hypertension66:1073-1081。
- 还没有人留言评论。精彩留言会获得点赞!