细胞外囊泡的回收方法与流程
1.本发明涉及细胞外囊泡的回收方法等。
背景技术:
2.细胞外囊泡(extracellular vesicles:ev)是从各种各样的细胞中分泌的、具有膜结构的微小的囊泡,存在于血液等的体液中或细胞培养液中。被分泌至细胞外的细胞外囊泡中含有外泌体(exosome)、核外颗粒体(ectosome)、凋亡小泡(apoptotic bleb)。由于细胞外囊泡是含有承担细胞间的信息传达等的功能的各种物质的多样的集团,因此出于诊断、新药研发等的目的而正在被解析。因此,需要开发对这样的解析有用的细胞外囊泡的回收方法。例如,专利文献1中记载了使用了螯合剂的细胞外囊泡的回收方法。
3.现有技术文献
4.专利文献
5.[专利文献1]国际公开第2018/070479号
技术实现要素:
[0006]
本发明所要解决的技术问题
[0007]
如果能从含有细胞外囊泡的样品中高效率地回收细胞外囊泡,则该方法有望应用于诊断、新药研发等。细胞外囊泡主要通过使用针对细胞外囊泡标志物的抗体的免疫沉淀法或超离心法来进行回收。但是,在这样的方法中,细胞外囊泡并非一定能够高效率地回收,另外,由于被回收的细胞外囊泡是非特异性浓缩的,其品质会有波动。
[0008]
因此,本发明的目的是开发能够回收细胞外囊泡的新方法。
[0009]
解决技术问题的技术手段
[0010]
本发明者们深入研究的结果,发现通过在特定的聚合物的存在下,从含有细胞外囊泡的样品中分离细胞外囊泡,能够高效率地回收细胞外囊泡,从而完成了本发明。
[0011]
也就是说,本发明如下。
[0012]
[1]、一种细胞外囊泡的回收方法,其包含:
[0013]
在聚合物的存在下,从含有细胞外囊泡的样品中分离细胞外囊泡的步骤。
[0014]
[2]、项[1]所述的方法,其中,
[0015]
聚合物在20~30℃下1~20重量%水溶液中的粘度为1.5mpa
·
s以上的值。
[0016]
[3]、项[1]或[2]所述的方法,其中,
[0017]
聚合物为纤维素衍生物或具有含羰基的亲水性基团的聚乙烯基衍生物。
[0018]
[4]、项[3]所述的方法,其中,
[0019]
聚合物为至少1个羟基的氢原子被羧烷基或羟烷基取代的纤维素衍生物或至少1个氢原子被内酰胺取代的聚乙烯基衍生物。
[0020]
[5]、项[4]所述的方法,其中,
[0021]
聚合物为羧甲基纤维素、羟乙基纤维素,羟丙基纤维素、羟丙基甲基纤维素或聚乙
烯基吡咯烷酮。
[0022]
[6]、项[1]~[5]中的任一项所述的方法,其中,
[0023]
聚合物具有10kda以上的重均分子量。
[0024]
[7]、项[1]~[6]中的任一项所述的方法,其中,
[0025]
从含有细胞外囊泡的样品中分离细胞外囊泡时的聚合物的浓度为0.01~10.00重量%。
[0026]
[8]、项[1]~[7]中的任一项所述的方法,其进一步包含:
[0027]
将含有细胞外囊泡的样品与螯合剂混合的步骤。
[0028]
[9]、项[1]~[8]中的任一项所述的方法,其中,
[0029]
细胞外囊泡是外泌体。
[0030]
[10]、项[1]~[9]中的任一项所述的方法,其中,
[0031]
所述分离通过使用了细胞外囊泡膜结合物质的分离方法或含有细胞外囊泡的样品的超离心方法进行。
[0032]
[11]、项[10]所述的方法,其中,
[0033]
细胞外囊泡膜结合物质是针对四跨膜蛋白的抗体或针对细胞外基质金属蛋白酶诱导物质的抗体。
[0034]
[12]、项[11]所述的方法,其中,
[0035]
细胞外囊泡膜结合物质是针对cd9、cd63、cd81或cd147的抗体。
[0036]
[13]、项[1]~[12]中的任一项所述的方法,其中,
[0037]
含有细胞外囊泡的样品是血液样品、尿或唾液。
[0038]
[14]、一种细胞外囊泡的分析方法,其包含以下的步骤:
[0039]
(1)在聚合物的存在下,从含有细胞外囊泡的样品中分离细胞外囊泡的步骤;和
[0040]
(2)分析被分离的细胞外囊泡的步骤。
[0041]
[15]、项[14]所述的方法,其进一步包含:
[0042]
向含有细胞外囊泡的样品中添加螯合剂的步骤。
[0043]
[16]、项[14]或[15]所述的方法,其中,
[0044]
对被分离的细胞外囊泡中的蛋白质或核酸进行分析。
[0045]
[17]、一种试剂盒,其包含聚合物和细胞外囊泡膜结合物质。
[0046]
[18]、项[17]所述的试剂盒,其进一步包含螯合剂。
[0047]
发明的效果
[0048]
根据本发明,通过使用特定的聚合物,可以以高效率并且高纯度回收细胞外囊泡。
附图说明
[0049]
[图1]图1是表示,实施例1中,以pbs、edta/egta
‑
pbs(“ed/eg”)或各浓度的各种cmc
‑
pbs稀释的血清检查材料的、通过使用抗cd9抗体进行的免疫沉淀法而得的样品的基于生物素化抗cd9抗体的免疫印迹的图。
[0050]
[图2]图2是表示,实施例2中,使以pbs或各浓度的cmc
‑
pbs稀释的血清检查材料在4℃下一晚或在37℃下1小时与抗cd9抗体进行免疫沉淀而得的样品的基于生物素化抗cd9抗体的免疫印迹的图。
[0051]
[图3]图3是表示,实施例3中,以pbs、edta/egta
‑
pbs(“ed/eg”)或cmc
‑
pbs稀释的血清检查材料的、通过使用抗cd9抗体进行的免疫沉淀法而得的样品的基于纳米颗粒跟踪分析测得的粒子数测定结果的图。
[0052]
[图4]图4是表示,实施例4中,将含有血清和5种抗凝固剂(肝素、edta、柠檬酸(citrate)、acd(酸
‑
柠檬酸
‑
葡萄糖、acid
‑
citrate
‑
dextrose)、cpd(柠檬酸
‑
磷酸
‑
葡萄糖、citrate phosphate dextrose))的血浆用pbs、cmc
‑
pbs、edta/egta
‑
pbs(“ed/eg”)或edta/egta/cmc
‑
pbs(“ed/eg/c”)稀释的检查材料的、通过使用抗cd9抗体进行的免疫沉淀法而得的样品的基于生物素化抗cd9抗体的免疫印迹的图。
[0053]
[图5a]图5a是表示,实施例5中,以pbs、cmc
‑
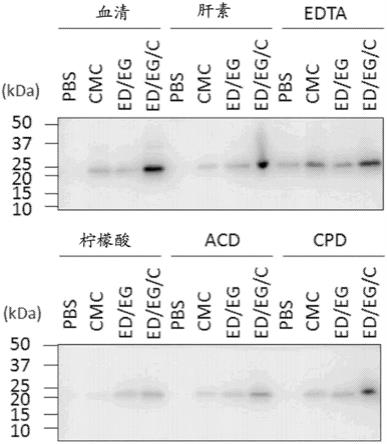
pbs、edta/egta
‑
pbs(“ed/eg”)或edta/egta/cmc
‑
pbs(“ed/eg/c”)稀释的血清检查材料的、通过使用抗四跨膜蛋白抗体(抗cd63抗体和抗cd81抗体)进行的免疫沉淀法而得的样品的基于抗四跨膜蛋白抗体(抗cd63抗体和抗cd81抗体)的免疫印迹的图。
[0054]
[图5b]图5b是表示,实施例5中,以pbs、cmc
‑
pbs、edta/egta
‑
pbs(“ed/eg”)或edta/egta/cmc
‑
pbs(“ed/eg/c”)稀释的血清检查材料的、通过使用抗cd147抗体进行的免疫沉淀法而得的样品的基于生物素化抗cd9抗体的免疫印迹的图。
[0055]
[图6]图6是表示,实施例6中,将体液(尿和唾液,2个样品分别表示为“#1”和“#2”)以pbs、cmc
‑
pbs、edta/egta
‑
pbs(“ed/eg”)或edta/egta/cmc
‑
pbs(“ed/eg/c”)稀释的检查材料的、通过使用抗cd9抗体进行的免疫沉淀法而得的样品的基于生物素化抗cd9抗体的免疫印迹的图。
[0056]
[图7a]图7a是表示,实施例7中,以pbs、各浓度的各种hec
‑
pbs或cmc
‑
pbs稀释的血清检查材料的、通过使用抗cd9抗体进行的免疫沉淀法而得的样品的基于生物素化抗cd9抗体的免疫印迹的图。
[0057]
[图7b]图7b是表示,实施例7中,以pbs、各浓度的各种hpc
‑
pbs或cmc
‑
pbs稀释的血清检查材料的、通过使用抗cd9抗体进行的免疫沉淀法而得的样品的基于生物素化抗cd9抗体的免疫印迹的图。
[0058]
[图7c]图7c是表示,实施例7中,以pbs、各浓度的各种hpmc
‑
pbs或cmc
‑
pbs稀释的血清检查材料的、通过使用抗cd9抗体进行的免疫沉淀法而得的样品的基于生物素化抗cd9抗体的免疫印迹的图。
[0059]
[图8]图8是表示,实施例8中,以pbs或各浓度的各种pvp
‑
pbs稀释的血清检查材料的、通过使用抗cd9抗体进行的免疫沉淀法而得的样品的基于生物素化抗cd9抗体的免疫印迹的图。
[0060]
[图9a]图9a是表示,实施例9中,使以pbs或cmc
‑
pbs稀释的血清检查材料在35~60℃的各温度下与抗cd9抗体进行免疫沉淀而得的样品的基于生物素化抗cd9抗体的免疫印迹的图。
[0061]
[图9b]图9b是表示,实施例9中,使以cmc
‑
pbs稀释的血清检查材料在35~60℃的各温度下与抗cd63抗体进行免疫沉淀而得的样品的基于抗cd63抗体的免疫印迹的图。
[0062]
[图9c]图9c是表示,实施例9中,使以cmc
‑
pbs稀释的血清检查材料在35~60℃的各温度下与抗cd81抗体进行免疫沉淀而得的样品的基于抗cd81抗体的免疫印迹的图。
[0063]
[图10]图10是表示,实施例11中,以pbs、cmc
‑
pbs(“cmc”)、edta/egta
‑
pbs(“ed/
eg”)或edta/egta/cmc
‑
pbs(“ed/eg/c”)稀释的人类肺癌细胞h2228的培养上清液的、通过使用抗cd9抗体或抗cd63抗体进行的免疫沉淀法而得的样品的eml4
‑
alkmrna检测量(表示相对于以pbs稀释的样品的倍率变化)的图。
[0064]
本发明的具体实施方式
[0065]
本发明提供细胞外囊泡的回收方法。
[0066]
细胞外囊泡是,从各种各样的细胞中分泌的、具有膜结构的微小的囊泡。作为细胞外囊泡,例如可以举出外泌体、核外颗粒体和凋亡小泡。优选细胞外囊泡是外泌体。细胞外囊泡还可以根据其尺寸而规定。细胞外囊泡的尺寸,例如为30~1000nm,优选50~300nm,更优选80~200nm。细胞外囊泡的尺寸的测定可以通过例如基于细胞外囊泡的布朗运动的方法、光散射法和电阻法等进行。优选细胞外囊泡的尺寸的测定通过nanosight(malvern instruments公司制)进行。
[0067]
本发明的回收方法,包含以下的步骤:
[0068]
(1)在聚合物的存在下,从含有细胞外囊泡的样品中分离细胞外囊泡的步骤。
[0069]
含有细胞外囊泡的样品是含有细胞外囊泡的任意样品。优选含有细胞外囊泡的样品是生物学上的液体样品。含有细胞外囊泡的样品,在用于本发明的方法前,也可以进行其他的处理。作为这样的处理,例如可以举出离心分离、提取、过滤、沉淀、加热、冷冻、冷藏和搅拌。
[0070]
作为一种实施形态,含有细胞外囊泡的样品是培养上清液。培养上清液可以是细胞培养上清液也可以是组织培养上清液。作为培养的细胞或组织的生物来源,例如,可以举出哺乳动物(例如,人类、猴子等的灵长类;小鼠、大鼠、兔子等的啮齿类;牛、猪、山羊等的家畜;以及马、绵羊等的使役动物)、鸟类(例如,鸡)等的动物、昆虫、微生物(例如,细菌类)、植物和鱼类。优选生物是人类等的哺乳动物。
[0071]
在别的实施形态中,含有细胞外囊泡的样品是体液。体液是源自如上述的生物的体液。作为体液,例如,可以举出血液样品(例如,全血、血清和血浆)、尿、唾液、淋巴液、组织液、脑脊髓液、腹水、汗、精液、泪液、粘液、乳汁、胸腔液、气管支肺胞清洗液和羊水。优选体液是血液样品、尿或唾液。作为血浆,例如,可以举出肝素血浆、柠檬酸血浆、氟化钠血浆、含有acd(acid
‑
citrate
‑
dextrose)或cpd(citrate phosphate dextrose))的血浆。一般来说,就细胞外囊泡的回收而言,与培养上清液相比,在混入比培养上清液更多量的蛋白质(例如,白蛋白、溶菌酶、乳铁蛋白、组氨素、过氧化物酶、凝集素、防御素、免疫球蛋白)的体液(例如,血液、尿、唾液)中更为困难。另一方面,根据本发明的方法,从含有细胞外囊泡的样品中的细胞外囊泡的回收量增加,即使是从这样的体液中,也能够将细胞外囊泡以高效率并且高纯度回收。
[0072]
本发明使用的聚合物,优选是水溶性聚合物。“水溶性聚合物”是指,对于4~80℃(优选4~37℃)的水的溶解度在0.01重量%以上的聚合物。水溶性聚合物对于4~80℃(优选4~37℃)的水的溶解度,可以优选为0.05重量%以上,更优选0.1重量%以上。
[0073]
为了达成本发明的目的,聚合物可以例如,在20~30℃下1~20重量%水溶液中的粘度为1.5mpa
·
s以上的值。作为聚合物在上述条件下的粘度,可以优选5mpa
·
s以上,更优选10mpa
·
s以上,再更优选20mpa
·
s以上,再更优选30mpa
·
s以上,特别优选35mpa
·
s以上。作为聚合物在上述条件下的粘度,可以优选30000mpa
·
s以下,更优选20000mpa
·
s以
下,再更优选10000mpa
·
s以下,再更优选5000mpa
·
s以下,特别优选1000mpa
·
s以下。更具体而言,作为聚合物在上述条件下的粘度,可以优选5~30000mpa
·
s,更优选10~20000mpa
·
s,再更优选20~10000mpa
·
s,再更优选30~5000mpa
·
s,特别优选35~1000mpa
·
s。
[0074]
为了达成本发明的目的,聚合物例如,作为将聚合物溶解在磷酸缓冲生理盐水(pbs)中以达到2重量%的pbs溶液的30℃下的粘度,可以是1.5mpa
·
s以上的值。作为聚合物在上述条件下的粘度,可以优选5mpa
·
s以上,更优选10mpa
·
s以上,再更优选20mpa
·
s以上,再更优选30mpa
·
s以上,特别优选35mpa
·
s以上。作为聚合物在上述条件下的粘度,可以优选30000mpa
·
s以下,更优选20000mpa
·
s以下,再更优选10000mpa
·
s以下,再更优选5000mpa
·
s以下,特别优选1000mpa
·
s以下。更具体而言,作为聚合物在上述条件下的粘度,可以优选5~30000mpa
·
s,更优选10~20000mpa
·
s,再更优选20~10000mpa
·
s,再更优选30~5000mpa
·
s,特别优选35~1000mpa
·
s。
[0075]
聚合物的粘度,例如,可以通过检测使液体样品通过旋转体旋转时在转子的外围产生的液体的粘度摩擦扭矩的方法(使用旋转粘度计的方法)或在充满样品的测定管内,使落下锤自由落下,测量其落下时间的方法(使用落球粘度计的方法)进行测定。另外,聚合物的粘度,例如,在液体样品中放入振动体(粘度感应器)使之振动时,感应器的振动振幅随着液体粘度的增大而因其粘性抵抗而被抑制、降低,但是可以通过克服此抑制力,增加振动子驱动电流以保持一定的振幅,测定此时的输入电流量的方法(使用振动粘度计的方法)进行测定。
[0076]
聚合物的粘度,例如,可以使用粘性解析装置(例如,rheology spectrometer skr100,大和科学公司)测定。
[0077]
聚合物例如可以是纤维素衍生物、具有亲水性基团的聚乙烯基衍生物、聚醚化合物。
[0078]
纤维素衍生物是指纤维素的至少1个羟基的氢原子被亲水性基团所取代的纤维素衍生物。作为纤维素衍生物中亲水性基团,例如可以举出羧烷基(例如,羧基c
1~6
烷基),羟烷基(例如,羟基c
1~6
烷基)。纤维素衍生物中的亲水性基团优选是羧烷基或羟烷基。
[0079]
作为羧烷基,例如,可以举出羧基甲基、羧基乙基(1
‑
羧基乙基、2
‑
羧基乙基)、羧基丙基(1
‑
羧基丙基、2
‑
羧基丙基、3
‑
羧基丙基)、羧基异丙基(1
‑
羧基
‑2‑
甲基乙基、2
‑
羧基
‑2‑
甲基乙基)、羧基丁基(1
‑
羧基丁基、2
‑
羧基丁基、3
‑
羧基丁基、4
‑
羧基丁基)、羧基叔丁基、羧基戊基(1
‑
羧基戊基、2
‑
羧基戊基、3
‑
羧基戊基、4
‑
羧基戊基、5
‑
羧基戊基)、羧基己基(1
‑
羧基己基、2
‑
羧基己基、3
‑
羧基己基、4
‑
羧基己基、5
‑
羧基己基、6
‑
羧基己基)。
[0080]
作为羟烷基,例如可以举出,羟基甲基、羟基乙基(1
‑
羟基乙基、2
‑
羟基乙基)、羟基丙基(1
‑
羟基丙基、2
‑
羟基丙基、3
‑
羟基丙基)、羟基异丙基(1
‑
羟基
‑2‑
甲基乙基、2
‑
羟基
‑2‑
甲基乙基)、羟基丁基(1
‑
羟基丁基、2
‑
羟基丁基、3
‑
羟基丁基、4
‑
羟基丁基)、羟基叔丁基、羟基戊基(1
‑
羟基戊基、2
‑
羟基戊基、3
‑
羟基戊基、4
‑
羟基戊基、5
‑
羟基戊基)、羟基己基(1
‑
羟基己基、2
‑
羟基己基、3
‑
羟基己基、4
‑
羟基己基、5
‑
羟基己基、6
‑
羟基己基)。
[0081]
作为纤维素衍生物的具体例,可以举出羧甲基纤维素(cmc)、羟乙基纤维素(hec),羟丙基纤维素(hpc)或羟丙基甲基纤维素(hpmc)。
[0082]
纤维素衍生物中也包含纳米纤维素衍生物。纳米纤维素衍生物是指后述的纳米纤
维素的衍生物。
[0083]
具有亲水性基团的聚乙烯基衍生物是指至少1个氢原子被亲水性基团所取代的聚乙烯基衍生物,优选亚甲基单元中的1个氢原子被亲水性基团所取代的聚乙烯基衍生物。作为聚乙烯基衍生物的亲水性基团,例如,可以举出含有羰基的亲水性基团、含有羧基的亲水性基团、含氮亲水性基团、含有环(碳环或杂环)的亲水性基团。聚乙烯基衍生物的亲水性基团优选为含有羰基的亲水性基团、含氮亲水性基团或含有杂环的亲水性基团,更优选内酰胺(例如,α
‑
内酰胺,β
‑
内酰胺,γ
‑
内酰胺,δ
‑
内酰胺,ε
‑
内酰胺)。作为具有亲水性基团的聚乙烯基衍生物的具体例,可以举出聚乙烯基吡咯烷酮。
[0084]
聚醚化合物是指重复单元的主链上包含醚结构的聚合物。作为聚醚化合物,例如,可以举出聚亚烷基氧基化合物(例如,聚c
1~6
亚烷氧基化合物)。作为聚亚烷基氧基化合物,例如,可以举出聚乙二醇、聚丙二醇。聚亚烷基氧基化合物优选为聚乙二醇。
[0085]
纳米纤维素是指具有纳米量级的纤维宽度的纤维状纤维素。纳米纤维素的纤维宽度,例如可以是500nm以下,优选200nm以下,更优选100nm以下,再更优选50nm以下,再更优选10nm以下,特别更优选5nm以下。
[0086]
纤维素衍生物,具有亲水性基团的聚乙烯基衍生物和聚醚化合物中也包含它们的盐。作为盐,例如,可以举出金属(例如,锂、钠、钾、铷和铯等的一价的金属以及钙、镁和锌等的二价的金属)的盐以及无机碱基(例如,氨)的盐。
[0087]
为了达成本发明的目的,聚合物例如,可以具有10kda以上的重均分子量。作为聚合物的重均分子量,可以优选12kda以上,更优选14kda以上,再更优选16kda以上,再更优选18kda以上,特别优选20kda以上。作为聚合物的重均分子量,可以优选5000kda以下,更优选3000kda以下,再更优选2000kda以下,再更优选1000kda以下,特别优选500kda以下。更具体而言,作为聚合物的重均分子量,可以优选12~5000kda,更优选14~3000kda,再更优选16~2000kda,再更优选18~1000kda,特别优选20~500kda。
[0088]
细胞外囊泡的分离步骤中聚合物的浓度,只要是与不含聚合物时相比能够以高效率回收细胞外囊泡,并且是聚合物能够溶解在分离步骤使用的溶液中的浓度即可,没有特别限定。这样的浓度,因聚合物的种类而不同,例如可以是0.01~10.00重量%,优选0.05~7.50重量%,更优选0.10~5.00重量%。
[0089]
在细胞外囊泡的分离步骤中,细胞外囊泡从含有细胞外囊泡的样品的液相中被分离。也就是说,细胞外囊泡在不与聚合物共沉淀的状态下,通过后述的分离手法,从含有细胞外囊泡的样品中被分离。因此,本发明中的分离步骤,与使用了共沉淀性聚合物的共沉淀法的分离(例如,聚乙二醇沉淀)不同。因此,本发明使用的聚合物优选非共沉淀性聚合物。
[0090]
在本发明的回收方法中,由于聚合物在分离步骤存在即可,因此本发明的回收方法可以包含将含有细胞外囊泡的样品和聚合物混合的步骤。例如,可以在将含有细胞外囊泡的样品和聚合物混合后,再从该含有细胞外囊泡的样品中分离细胞外囊泡。另外,例如,使用使用了后述的细胞外囊泡膜结合物质的分离方法时,可以向含有细胞外囊泡膜结合物质的溶液中预先添加聚合物,再向其中添加含有细胞外囊泡的样品。
[0091]
本发明的回收方法可以进一步包含将含有细胞外囊泡的样品和螯合剂混合的步骤。此时,由于在本发明的回收方法中,在聚合物和螯合剂的存在下,从含有细胞外囊泡的样品中分离细胞外囊泡即可,因此例如,可以向含有细胞外囊泡的样品中同时添加聚合物
和螯合剂,也可以在向含有细胞外囊泡的样品中添加聚合物后再添加螯合剂,也可以在向含有细胞外囊泡的样品中添加螯合剂后再添加聚合物。另外,例如,使用使用了后述的细胞外囊泡膜结合物质的分离方法时,可以向含有细胞外囊泡膜结合物质的溶液中预先添加聚合物和螯合剂,再向其中添加含有细胞外囊泡的样品。
[0092]
螯合剂是具有能够与金属离子配位结合的配位部分的化合物或其盐。配位部分的个数,优选2个以上,更优选3个以上(例如,3个或6个)。作为充当配位部分的配位原子,例如,可以举出氧原子、磷原子、氮原子、硫原子和氯原子。配位原子优选氧原子或磷原子,更优选氧原子。作为充当配位部分的配位基,例如,可以举出具有所述配位原子的基团。配位基,优选羧酸基或磷酸基,更优选羧酸基。
[0093]
作为螯合剂,例如,可以举出草酸、羟乙基亚氨基二乙酸(hida)、氨三乙酸(nta)、羟乙基乙二胺三乙酸(hedta)、乙二胺四乙酸(edta)、乙二胺四(亚甲基膦酸)(edtmp)、乙二醇醚二胺四乙酸(egta)以及它们的盐。作为盐,例如,可以举出金属盐(例如,钠盐、钾盐等的一价的金属盐和钙盐、镁盐等的二价的金属盐)、无机盐(例如,氟化物、氯化物、溴化物、碘化物等的卤化物盐和铵盐)、有机盐(例如,被烷基取代的铵盐)和酸加成盐(例如,与硫酸、盐酸、氢溴酸、硝酸、磷酸等的无机酸的盐和与酢酸、草酸、乳酸、柠檬酸、三氟甲磺酸、三氟乙酸等的有机酸等的盐)。本发明中,也可以将含有2种以上(例如,2种、3种、4种、5种)的螯合剂的混合物用于含有细胞外囊泡的样品的分离。
[0094]
螯合剂可能是通过抑制杂质对细胞外囊泡的吸附来显示以高纯度回收细胞外囊泡的效果(国际公开第2018/070479号)。因此,通过在聚合物和螯合剂的存在下从含有细胞外囊泡的样品中分离细胞外囊泡,能够对细胞外囊泡的回收效率提高赋予相乘效果。由于上述的螯合剂中的任何一种都显示出以高纯度回收细胞外囊泡的效果,通过与聚合物的并用,能够赋予同质的相乘效果。
[0095]
细胞外囊泡的分离步骤中螯合剂的浓度,只要是能够抑制杂质对细胞外囊泡的吸附,并且是螯合剂能够溶解在分离步骤使用的溶液中的浓度即可,没有特别限定。这样的浓度,因螯合剂的种类而不同,例如,是1mm~200mm。优选螯合剂的浓度可以是10mm以上、15mm以上、20mm以上、30mm以上、40mm以上或50mm以上。这样的浓度也因螯合剂的种类而不同,可以是200mm以下、180mm以下、160mm以下、140mm以下、120mm以下或100mm以下。
[0096]
在聚合物的存在下的、从含有细胞外囊泡的样品中的细胞外囊泡的分离(步骤(1)),例如,可以通过使用了细胞外囊泡膜结合物质的分离方法或超离心法进行。使用了细胞外囊泡膜结合物质的分离,也可以在分析方法(例如,后述的免疫测定法)的过程中进行。使用细胞外囊泡膜结合物质分离细胞外囊泡时,通过混合细胞外囊泡膜结合物质和含有细胞外囊泡的样品,使细胞外囊泡膜结合物质与细胞外囊泡结合,接下来就可以通过将细胞外囊泡膜结合物质结合的细胞外囊泡从样品中分离而回收细胞外囊泡。另外,细胞外囊泡的分离通过超离心法进行时,通过超离心法使含有细胞外囊泡的样品中的细胞外囊泡沉淀,接下来,就可以通过弃去上清液而回收细胞外囊泡。进一步而言,细胞外囊泡的分离在分析方法的过程中进行时,能够随着分析方法(例如,elisa等的免疫测定法)中的溶液的除去或固相的清洗而分离细胞外囊泡。具体而言,在免疫测定法中,可以随着与细胞外囊泡的抗体的结合以及包含含有细胞外囊泡的样品的溶液的除去和/或固相的清洗而分离细胞外囊泡。分离优选为离析或纯化。因此,本发明的回收方法还可以作为离析或纯化方法利用。
[0097]
本发明的回收方法中使用的细胞外囊泡膜结合物质是对细胞外囊泡标志物具有亲和性的物质。作为细胞外囊泡标志物,例如,可以举出四跨膜蛋白(细胞外囊泡膜特异性4次跨膜蛋白质,例如可以举出cd9、cd63、cd81)、细胞外基质金属蛋白酶诱导物质(cd147)、癌胚抗原(carcinoembryonic antigen、cea)、热休克蛋白(hsp)70、hsp90、主要组织相容性复合体(mhc)i、肿瘤敏感性基因(tsg)101、溶酶体关联膜蛋白(lamp)1、细胞间粘附分子(icam)
‑
1、整合素、神经酰胺、胆固醇、磷脂酰丝氨酸、alix、annexins、caveolin
‑
i、flotillin
‑
i、rab蛋白质、epcam等。细胞外囊泡标志物优选四跨膜蛋白、细胞外基质金属蛋白酶诱导物质。另外细胞外囊泡标志物优选为cd9、cd63、cd81或cd147。作为细胞外囊泡膜结合物质,例如,可以举出抗体(例如,单克隆抗体、多克隆抗体)和其抗原结合性片段、适体、磷脂酰丝氨酸结合蛋白、神经酰胺结合蛋白。抗原结合性片段只要是对作为对象的细胞外囊泡标志物保持结合性的抗体片段即可,可以举出fab、fab’、f(ab’)2、scfv等。细胞外囊泡膜结合物质优选为抗体或其抗原结合性片段,更优选单克隆抗体或其抗原结合性片段。另外,在回收细胞外囊泡时使用的细胞外囊泡膜结合物质可以是一种也可以是多种的组合。
[0098]
细胞外囊泡膜结合物质,为了更容易地分离细胞外囊泡而可以与固相结合。作为固相,例如可以使用琼脂糖凝胶珠、琼脂糖珠、磁性珠或塑料板。可以使用本行业人员周知的常规方法将细胞外囊泡膜结合物质固定化到固相上。
[0099]
本发明的回收方法中,通过使用了细胞外囊泡膜结合物质的分离方法回收细胞外囊泡时,聚合物至少在细胞外囊泡膜结合物质与含有细胞外囊泡的样品混合时存在即可。例如,使用磁性珠时,在聚合物的存在下,通过混合与磁性珠结合的细胞外囊泡膜结合物质和含有细胞外囊泡的样品,使细胞外囊泡膜结合物质和含有细胞外囊泡的样品中的细胞外囊泡结合,将磁性珠用永久磁石或电磁石等集磁,接下来,通过弃去含有不与磁性珠结合的成分的上清液,就能够将与磁性珠结合的细胞外囊泡从含有细胞外囊泡的样品中分离出来。将磁性珠集磁的方法,可以使用本行业人员周知的方法。另外,例如,使用琼脂糖凝胶珠或琼脂糖珠时,在聚合物的存在下,通过混合与这些珠结合的细胞外囊泡膜结合物质和含有细胞外囊泡的样品,使细胞外囊泡膜结合物质和含有细胞外囊泡的样品中的细胞外囊泡结合,通过离心分离,使珠沉淀,通过弃去含有不与磁性珠结合的成分的上清液,就能够将与磁性珠结合的细胞外囊泡从含有细胞外囊泡的样品中分离出来。关于通过离心分离而使珠沉淀的方法,可以使用本行业人员周知的方法。
[0100]
关于通过使用了细胞外囊泡膜结合物质的分离方法从含有细胞外囊泡的样品中分离细胞外囊泡时,混合细胞外囊泡膜结合物质和含有细胞外囊泡的样品时的温度,只要是细胞外囊泡膜结合物质和含有细胞外囊泡的样品形成的混合物以液体存在的温度即可,可以是0~100℃。这样的温度,例如可以是4℃以上,优选15℃以上,更优选35℃以上,进一步优选40℃以上。另外,这样的温度例如可以是80℃以下,优选70℃以下,更优选60℃以下,进一步优选50℃以下。更具体而言,这样的温度,例如可以是4~80℃,优选15~70℃,更优选35~60℃,进一步优选40~50℃。使细胞外囊泡膜结合物质和细胞外囊泡结合的时间,只要是细胞外囊泡膜结合物质足以与细胞外囊泡结合的时间即可,没有特别限制,例如,可以是1分钟以上、5分钟以上、10分钟以上或20分钟以上。另外,这样的时间可以是24小时以下、18小时以下、8小时以下、4小时以下、2小时以下或1小时以下。
[0101]
本发明的回收方法中,通过超离心法回收细胞外囊泡时,聚合物在将含有细胞外囊泡的样品进行超离心分离时存在即可,例如,多次进行超离心分离时,有至少1次的超离心分离在聚合物的存在下进行即可。超离心分离可以使用超离心机进行。通过超离心分离施加的重力,例如可以是10000
×
g~200000
×
g,优选70000
×
g~150000
×
g。超离心分离的时间,例如是0.5~24小时,优选1~5小时。超离心分离的温度,例如是4~30℃。超离心分离可以进行1次或多次(例如,2次、3次)。
[0102]
本发明还提供细胞外囊泡的分析方法。
[0103]
本发明的分析方法包含以下步骤:
[0104]
(1)在聚合物的存在下,从含有细胞外囊泡的样品中分离细胞外囊泡的步骤;和
[0105]
(2)分析被分离的细胞外囊泡的步骤。
[0106]
本发明的分析方法中的步骤(1),可以与本发明的回收方法中的步骤(1)同样地进行。
[0107]
在步骤(2)中,对被分离的细胞外囊泡进行分析。作为被分析的对象,例如,可以举出细胞外囊泡中含有的成分(例如,细胞外囊泡的内部所含有的成分、细胞外囊泡的膜成分、存在于细胞外囊泡的膜表面的成分)和细胞外囊泡自身(粒子)。
[0108]
分析细胞外囊泡中所含有的成分时,分析是成分的检测或定量。这样的分析还是一种成分或多种成分的分析。作为被分析的成分,例如,可以举出蛋白质、核酸(例如,rna、dna)、糖、脂质、氨基酸、维生素、多胺和肽。通过在聚合物的存在下从含有细胞外囊泡的样品中分离细胞外囊泡,可以提高细胞外囊泡的回收量。因此,根据本发明的分析方法,能够以高精度分析细胞外囊泡中的蛋白质、核酸等的成分。
[0109]
成分的分析可以通过该领域中公知的任意方法进行。
[0110]
被分析的成分是蛋白质时,作为分析方法,例如,可以举出免疫测定法、质谱法。作为免疫测定法,例如,可以举出直接竞争法、间接竞争法和三明治法。另外,作为这样的免疫测定法,可以举出化学发光免疫测定法(clia)[例如,化学发光酶免疫测定法(cleia)]、免疫比浊法(tia)、酶免疫测定法(eia)(例如,直接竞争elisa、间接竞争elisa和三明治elisa)、放射免疫测定法(ria)、乳胶凝集反应法、荧光免疫测定法(fia)和免疫层析法、免疫印迹、免疫染色、荧光活化细胞分选(fluorescence activated cell sorting,facs)。分析多种成分时,可以进行蛋白质组分析。
[0111]
被分析的成分是核酸时,作为分析方法,例如,可以举出使用探针的杂交法、使用逆转录酶的逆转录(rt)反应、使用引物(例如,2、3或4个引物)的基因扩增法(例如,定量pcr、rt
‑
pcr等的pcr法)、测序、质谱法。
[0112]
被分析的成分是蛋白质和核酸以外的成分时,作为分析方法,例如,可以举出免疫测定法、质谱法。分析多种成分时,可以进行代谢组学分析。
[0113]
本发明的分析方法,可以用于细胞外囊泡所含有的标志物的检测。作为细胞外囊泡所含有的标志物,例如,可以举出作为细胞外囊泡的存在指标的标志物、作为癌等的疾病的指标的标志物(例如,诊断标志物、疾病的风险评价标志物)。作为细胞外囊泡的存在的指标的标志物,例如,可以举出四跨膜蛋白(细胞外囊泡膜特异性4次跨膜蛋白质,例如,cd9、cd63、cd81)、细胞外基质金属蛋白酶诱导物质(cd147)、癌胚抗原(carcinoembryonicantigen,cea)、热休克蛋白(hsp)70,hsp90、主要组织相容性复合体
tesque公司#07326
‑
95(平均分子量不明),sigma
‑
aldrich公司#c5678(平均分子量90kda),#c4888(平均分子量250kda))对ev回收的效果。ev回收使用抗cd9抗体进行。
[0125]
将健康人血清在20000
×
g、4℃下离心15分钟后,将200μl的血清用200μl的pbs(2.9mm nah2po4、9.0mm na2hpo4、137mm nacl)、edta/egta
‑
pbs(使血清稀释后的各终浓度达到50mm的方式而含有edta和egta的pbs)(ed/eg)或终浓度0.2~2.5重量%的cmc
‑
pbs(使血清稀释后的各终浓度达到0.2~2.5重量%的方式而溶解了cmc的pbs)稀释,添加固定了抗cd9抗体(本公司制)的磁性珠(dynabeads m
‑
280tosylactivated(life technologies公司))以达到0.26mg/ml。在4℃下旋转反应一晚后,将磁性珠用pbs
‑
t清洗3次,用样品缓冲液(bio
‑
rad公司)稀释以作为免疫印迹用样品。在免疫印迹用样品中,包含外泌体的样品通过sds处理而破坏外泌体,外泌体的标志物蛋白(例如,cd9)被放出到样品溶液中。以使用生物素化的抗cd9抗体(本公司制)的免疫印迹法对免疫沉降效率进行了解析(图1)。在全部4种cmc中,与pbs稀释样品相比,观察到了ev回收效率提高的效果。
[0126]
实施例使用的cmc的各物理性质值如以下的表1所示。
[0127]
[表1]
[0128]
表1.实施例使用的cmc的列表
[0129][0130]
(实施例2)
[0131]
对cmc(sigma
‑
aldrich公司#c4888)的浓度(0.06重量%~1.0重量%的终浓度)和反应温度(4℃,37℃)对ev回收赋予的效果进行了探讨。
[0132]
将健康人血清在20000
×
g、4℃下离心15分钟后,将200μl的血清用200μl的pbs或cmc
‑
pbs(使血清稀释后的各终浓度达到0.06~1.0重量%的方式而溶解了cmc的pbs)稀释,添加固定了抗cd9抗体(本公司制)的磁性珠(dynabeads m
‑
280tosylactivated(life technologies公司))以达到0.26mg/ml。在进行4℃下一晚或37℃下1小时的旋转反应后,将磁性珠用pbs
‑
t清洗3次,用样品缓冲液(bio
‑
rad公司)稀释以作为免疫印迹用样品。以使用生物素化的抗cd9抗体的免疫印迹法对ev的回收效率进行了解析(图2)。在反应温度4℃和37℃下,cmc的终浓度在0.25重量%~1重量%的范围内,与pbs稀释样品相比,观察到了ev回收效率提高的效果。
[0133]
(实施例3)
[0134]
使用纳米颗粒跟踪分析(nanosight lm10,quantum design公司)对cmc(sigma
‑
aldrich公司#c4888)对ev回收的效果进行了探讨。
[0135]
将200μl的健康人血清在20000
×
g、4℃下离心15分钟后,将其上清液用200μl的pbs、edta/egta
‑
pbs(使血清稀释后的各终浓度达到50mm的方式而含有edta和egta的pbs)(ed/eg)或cmc
‑
pbs(使血清稀释后的各终浓度达到0.5重量%的方式而溶解了cmc的pbs)(cmc)稀释,添加固定了抗cd9抗体(本公司制)的磁性珠(dynabeads m
‑
280tosylactivated(life technologies公司))以达到0.26mg/ml。37℃下旋转反应30分钟后,将磁性珠用pbs
‑
t清洗3次,用40μl brub(britton&robinson universal buffer)(ph2.6)反应5分钟后,通过用20μl的1mtris
‑
hcl(ph8.0)中和,使得细胞外囊泡从抗体磁性珠粒子处游离。用qubit protein assay(life technologies公司)定量总蛋白质浓度后,添加pbs 450μl,通过nanosight对粒子数进行了解析(图3)。在用cmc稀释的条件下,观察到了ev的总回收粒子数和相对于总蛋白质的粒子数的增加,显示了细胞外囊泡以高纯度被回收。
[0136]
(实施例4)
[0137]
对在含有血清和5种抗凝固剂(肝素、edta、柠檬酸(citrate)、acd(酸
‑
柠檬酸
‑
葡萄糖;acid
‑
citrate
‑
dextrose)、cpd(柠檬酸
‑
磷酸
‑
葡萄糖;citratephos phatedextrose))的血浆中,cmc(sigma
‑
aldrich公司#c4888)的对ev回收的效果进行了探讨。
[0138]
将含有200μl的健康人血清和抗凝固剂的健康人血浆在20000
×
g、4℃下离心15分钟后,将其上清液用200μl的pbs、edta/egta
‑
pbs(使血清或血浆稀释后的各终浓度达到50mm的方式而含有edta和egta的pbs)(ed/eg)、cmc
‑
pbs(使血清或血浆稀释后的终浓度达到0.5重量%的方式而溶解了cmc的pbs)(cmc)或edta/egta/cmc
‑
pbs(使血清或血浆稀释后各自的终浓度达到37.5mm/37.5mm/0.5重量%的方式而含有edta、egta和cmc的pbs)(ed/eg/c)稀释,添加固定了抗cd9抗体(本公司制)的磁性珠(dynabeads m
‑
280 tosylactivated(life technologies公司))以达到0.26mg/ml。37℃下旋转反应1小时后,将磁性珠用pbs
‑
t清洗3次,用样品缓冲液(bio
‑
rad公司)稀释以作为免疫印迹用样品。以使用生物素化的抗cd9抗体的免疫印迹法对免疫沉降效率进行了解析(图4)。无论哪种抗凝固剂,在血浆检查材料中都观察到了cmc带来的ev回收效率提高的效果。另外,通过将cmc和螯合剂组合,使ev回收效率进一步提高。
[0139]
(实施例5)
[0140]
探讨了cmc(sigma
‑
aldrich公司#c4888)对使用了cd9以外的2种四跨膜蛋白(cd63和cd81)和细胞外基质金属蛋白酶诱导物质(cd147)的抗体的ev回收赋予的效果。
[0141]
将200μl的健康人血清在20000
×
g、4℃下离心15分钟后,将其上清液用200μl的pbs、edta/egta
‑
pbs(血清稀释后的各终浓度为50mm)(ed/eg)、cmc
‑
pbs(血清稀释后的终浓度为0.5重量%)(cmc)或edta/egta/cmc
‑
pbs(血清稀释后各自的终浓度为37.5mm/37.5mm/0.5重量%)(ed/eg/c)稀释,添加固定了抗cd63抗体(8a12:cosmo bio公司)、抗cd81抗体(m38:abcam公司)和抗cd147抗体(mem
‑
m6/1:abcam公司)的各抗体的磁性珠(dynabeads m
‑
280tosylactivated(life technologies公司))以达到0.26mg/ml。4℃下旋转反应一晚后,将磁性珠用pbs
‑
t清洗3次,用样品缓冲液(bio
‑
rad公司)稀释以作为免疫印迹用样品。通过使用抗cd63抗体(本公司制)、抗cd81抗体(12c4:cosmo bio公司)和生物素化抗cd9抗体(本公司制)的免疫印迹法对ev回收效率进行了解析(图5a和图5b)。在使用了针对cd63、cd81和cd147的抗体时也观察到了cmc带来的ev回收效率提高的效果。另外,通过将cmc和螯合剂组合,使ev回收效率进一步提高。
[0142]
(实施例6)
[0143]
对在2种体液(尿和唾液)中,cmc(sigma
‑
aldrich公司#c4888)的对ev回收的效果进行了探讨。
[0144]
将200μl的健康人尿和唾液(2个样品分别以“#1”和“#2”表示。)在15000
×
g、4℃下
离心15分钟,用0.22μm过滤器进行过滤后,用200μl的pbs、edta/egta
‑
pbs(尿或唾液稀释后的各终浓度为50mm)(ed/eg)、cmc
‑
pbs(尿或唾液稀释后的终浓度为0.5重量%)(cmc)或edta/egta/cmc
‑
pbs(尿或唾液稀释后各自的终浓度为37.5mm/37.5mm/0.5重量%)(ed/eg/c)稀释,添加固定了抗cd9抗体(本公司制)的磁性珠(dynabeads m
‑
280tosylactivated(life technologies公司))以达到0.26mg/ml。37℃下旋转反应1小时后,将磁性珠用pbs
‑
t清洗3次,用样品缓冲液(bio
‑
rad公司)稀释以作为免疫印迹用样品。以使用生物素化的抗cd9抗体的免疫印迹法对免疫沉降效率进行了解析(图6)。不仅是血清、血浆,在尿和唾液中也观察到了cmc带来的ev回收效率提高的效果。
[0145]
(实施例7)
[0146]
对下述表2所示的纤维素衍生物(0.13重量%~4.0重量%的各终浓度)对ev回收的效果进行了探讨。
[0147]
将健康人血清在20000
×
g、4℃下离心15分钟后,将200μl的血清以200μl的pbs、cmc
‑
pbs(血清稀释后的终浓度为0.5重量%)(cmc)或溶解在pbs中的纤维素衍生物(血清稀释后的各终浓度为0.13~4.0重量%)稀释,添加固定了抗cd9抗体(本公司制)的磁性珠(dynabeads m
‑
280tosylactivated(life technologies公司))以达到0.26mg/ml。37℃下旋转反应1小时后,将磁性珠用pbs
‑
t清洗3次,用样品缓冲液(bio
‑
rad公司)稀释以作为免疫印迹用样品。以使用生物素化的抗cd9抗体的免疫印迹法对ev的回收效率进行了解析(图7a~c)。在cmc以外的3种纤维素衍生物中,与pbs稀释样品相比,也观察到了ev回收效率提高的效果(hec在0.13重量%~2.0重量%的范围、hpc在0.25重量%~4.0重量%的范围、hpmc在0.25重量%~2.0重量%的范围中)。
[0148]
[表2]
[0149]
表2.实施例使用的纤维素衍生物的列表(制造者都是sigma
‑
aldrich公司)
[0150][0151]
(实施例8)
[0152]
对下述表3所示的聚乙烯基吡咯烷酮(1重量%、2重量%、4重量%的各终浓度)对ev回收的效果进行了探讨。
[0153]
将健康人血清在20000
×
g、4℃下离心15分钟后,将200μl的血清以200μl的pbs或溶解在pbs中的聚乙烯基吡咯烷酮(血清稀释后的各终浓度为1.0~4.0重量%)稀释,添加固定了抗cd9抗体(本公司制)的磁性珠(dynabeadsm
‑
280 tosylactivated(life technologies公司))以达到0.26mg/ml。37℃下旋转反应1小时后,将磁性珠用pbs
‑
t清洗3次,用样品缓冲液(bio
‑
rad公司)稀释以作为免疫印迹用样品。以使用生物素化的抗cd9抗体的免疫印迹法对ev的回收效率进行了解析(图8)。聚乙烯基吡咯烷酮在1.0重量%~4.0重量%的范围内观察到了,与pbs稀释样品相比,ev回收效率提高的效果。
[0154]
[表3]
[0155]
表3.实施例使用的聚乙烯基吡咯烷酮(pvp)的列表
[0156][0157]
(实施例9)
[0158]
对cmc(sigma
‑
aldrich公司#c4888)在35℃到60℃的各反应温度下对ev回收的效果进行了探讨。
[0159]
将健康人血清在20000
×
g、4℃下离心15分钟后,将100μl的血清用100μl的pbs或cmc
‑
pbs(血清稀释后的终浓度为0.5重量%)稀释,添加固定了抗cd9抗体(本公司制)、抗cd63抗体(8a12:cosmo bio公司)或抗cd81抗体(12c4:cosmo bio公司)的磁性珠(dynabeads m
‑
280tosylactivated(life technologies公司))以达到0.26mg/ml。在各反应温度下反应5分钟后,将磁性珠用pbs
‑
t清洗3次,用样品缓冲液(bio
‑
rad公司)稀释以作为免疫印迹用样品。通过使用生物素化的抗cd9抗体(本公司制)、抗cd63抗体(本公司制)和抗cd81抗体(12c4:cosmo bio公司)的免疫印迹法对ev的回收效率进行了解析(图9a~图9c)。通过添加cmc,在35℃到60℃的各反应温度下观察到了ev回收效率提高的效果。进一步而言在40℃以上的高温条件下通过添加cmc,观察到了更高的ev回收效率提高效果。另外,cmc带来的ev回收效率提高效果在短时间的反应中也观察到了其效果。
[0160]
(实施例10)
[0161]
对实施例7使用的纤维素衍生物和实施例8使用的聚乙烯基吡咯烷酮的pbs溶液中的粘度进行了测定。具体而言,对于将各纤维素衍生物或聚乙烯基吡咯烷酮溶解至pbs中以达到2重量%而调制的各pbs溶液,使用粘性解析装置rheology spectrometer skr100(大和科学公司),在30℃、测定时间60秒下,将在200rpm、400rpm、600rpm、800rpm的各旋转速度下测定的结果求平均而求得(表4)。
[0162]
[表4]
[0163]
表4.实施例使用的纤维素衍生物以及聚乙烯基吡咯烷酮的粘度
[0164][0165]
(实施例11)
[0166]
探讨了使用cmc(sigma
‑
aldrich公司#c4888)和四跨膜蛋白(cd9和cd63)的抗体的免疫沉降法对ev回收以及从ev中检测标志物(eml4
‑
alk融合基因)rna的效果。
[0167]
将以无血清培养基培养了3天的人类肺癌细胞h2228的培养上清液作为样品进行了使用。将培养上清液在2000
×
g、4℃下离心5分钟,用0.22μm过滤器(millipore公司制)过滤后,使用amicon ultra
‑
15(millipore公司制)进行了100倍浓缩。
[0168]
将浓缩物用等量的pbs、edta/egta
‑
pbs(将浓缩物稀释后的各终浓度为50mm)(ed/eg)、cmc
‑
pbs(将浓缩物稀释的后的终浓度为0.5重量%)(cmc)或edta/egta/cmc
‑
pbs(将浓缩物稀释的后各自的终浓度为37.5mm/37.5mm/0.5重量%)(ed/eg/c)稀释,添加固定了抗cd9抗体(本公司制)、抗cd63抗体(本公司制)的各抗体的dynabeads m
‑
280tosylactivated(life technologies公司)以分别达到0.26mg/ml。在4℃下旋转反应一晚后,用pbs
‑
t清洗3次,使用mirneasy microkit(qiagen公司制)提取了总rna。从提取的总rna,使用
superscript(商标)iv first
‑
strand synthesis system(thermo fisher scientific公司制)制备了cdna,使用droplet digital pcr(biorad公司制)对eml4
‑
alkmrna进行了定量(图10)。
[0169]
eml4
‑
alkmrna的检测中使用了以下的表5所示的序列的引物和荧光探针。作为荧光探针,使用了5’末端具有荧光物质hex,探针的内部具有zen淬灭剂,3’末端具有iowa black(注册商标)淬灭剂(iabkfq)的双淬灭剂探针。通过使用表5所示的序列的引物和荧光探针,能够检测eml4
‑
alk融合基因的变体3a和3b。
[0170]
[表5]
[0171]
表5.eml4
‑
alk mrna检测用探针及引物
[0172][0173]
对通过免疫沉降法回收的ev中所含有的eml4
‑
alk进行了检测。通过使用cmc,确认了eml4
‑
alkmrna检测量增大,ev回收效率的提高的效果。进一步而言,通过添加螯合剂,确认了eml4
‑
alkmrna检测量进一步增大,ev回收效率的进一步提高的效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1