基于杂交链式反应和核酶的传感器及癌胚抗原检测方法与流程
本发明涉及化学与生物传感技术领域,特别是涉及一种基于杂交链式反应和核酶的传感器及癌胚抗原检测方法。
背景技术:
癌胚抗原是一种广谱肿瘤标志物,对于恶性肿瘤的鉴别诊断、病情监测、疗效评价等方面有着重要的临床价值,然而在实际样品中,癌胚抗原的浓度过低,难以实现高灵敏度、高选择性的检测。
目前,常用的癌胚抗原检测方法主要有:电化学免疫分析、化学发光免疫分析,比色免疫分析等,但是这些方法具有成本高、耗时、选择性差、灵敏度低、实验条件苛刻等问题,使得这些方法在实际应用中受到制约。
技术实现要素:
基于此,为了克服上述问题,提供一种基于杂交链式反应和核酶的传感器及癌胚抗原检测方法,本发明所述荧光适配体传感器能够特异性识别癌胚抗原,通过杂交链式反应进行信号放大,提高检测的选择性与灵敏度,并利用荧光强度变化实现癌胚抗原的定量检测。
本发明为实现上述目的而采取的技术方案为:
一种基于杂交链式反应和核酶的荧光适配体传感器,包括核酸适配体探针与发夹探针,所述核酸适配体探针包括核酸适配体序列、引发链序列及互补序列,所述发夹探针包括第一发夹探针与第二发夹探针,所述第一发夹探针和所述第二发夹探针都是含有g-四链体核酶碱基的序列,所述核酸适配体探针特异性识别癌胚抗原,所述核酸适配体探针构象转换,使所述第一发夹探针与所述第二发夹探针形成双链dna,同时,在hemin存在的情况下,所述第一发夹探针与所述第二发夹探针自组装形成hemin/g-四链体核酶,所述hemin/g-四链体核酶催化氧化过氧化氢介导的硫胺素并发出荧光,可定量检测所述癌胚抗原。
进一步地,所述核酸适配体探针为发夹结构。
进一步地,所述核酸适配体序列为特异性识别癌胚抗原的核酸适配体序列,所述核酸适配体序列为5’-ataccagcttattcaatt-3’,所述引发链序列为5’-agaagaaggtgtttaagta-3’。
本发明基于杂交链式反应和核酶的荧光适配体传感用于检测癌胚抗原。
一种癌胚抗原检测方法,包括以下步骤:
(1)核酸适配体探针、第一发夹探针、第二发夹探针与癌胚抗原首次开盖使用前先离心,分别将其溶于二次水中配成100μm的母液,再用第一缓冲液分别稀释成核酸适配体探针溶液、第一发夹探针溶液和第二发夹探针溶液,在4℃保存待用;
(2)将核酸适配体探针溶液、第一发夹探针溶液与第二发夹探针溶液分别加热反应并冷却至室温备用;
(3)将步骤(2)加热反应后的核酸适配体探针溶液、第一发夹探针溶液、第二发夹探针溶液与不同浓度的癌胚抗原溶液、免疫球蛋白g、甲胎蛋白或者前列腺特异性抗原在第一缓冲液中反应,得到混合液;
(4)在步骤(3)混合液中加入hemin反应,得到反应液;
(5)将步骤(4)反应液与硫胺素、过氧化氢在第二缓冲液中反应,检测荧光信号强度。
进一步地,所述步骤(1)核酸适配体探针溶液、第一发夹探针溶液和第二发夹探针溶液的浓度分别为5μm、5μm、5μm。
进一步地,所述第一缓冲液为tris-hcl缓冲液,所述tris-hcl缓冲液的ph为7.4,所述第二缓冲液为k2hpo4-naoh缓冲液,所述k2hpo4-naoh缓冲液的ph为12,步骤(2)中,加热反应温度为85℃~95℃,反应时间为5分钟~15分钟。
进一步地,所述步骤(3)中所述核酸适配体探针溶液浓度为10nm~100nm,所述第一发夹探针溶液浓度为1nm~500nm,所述第二发夹探针溶液浓度为1nm~500nm,反应温度为25℃~45℃,反应时间为4小时~8小时。
进一步地,所述步骤(4)中hemin的浓度为0.1μm~1μm,室温下反应,反应时间1小时~4小时。
进一步地,所述步骤(5)中,硫胺素溶液浓度为6mm,过氧化氢溶液浓度为20mm,反应温度为室温,反应时间为10分钟~30分钟。
本发明基于杂交链式反应和核酶的荧光适配体传感器中,核酸适配体探针通过核酸适配体序列特异性识别癌胚抗原,使得核酸适配体探针发生构象变化,释放引发链序列,从而第一发夹探针与第二发夹探针形成双链dna,引起杂交链式反应,实现信号放大,提高了癌胚抗原检测的选择性和灵敏度。
同时,第一发夹探针与第二发夹探针中都含有g-四链体核酶碱基的序列,在hemin存在的情况下,处于第一发夹探针链端与第二发夹探针链端的富g碱基序列能够自组装形成hemin/g-四链体核酶,催化氧化过氧化氢介导的硫胺素,其中,硫胺素的氧化产物稳定,具有较明显的荧光信号强度变化,从而实现癌胚抗原的定量检测。
而且,本发明所提供的基于杂交链式反应和核酶的荧光适配体传感器的癌胚抗原检测方法中,dna链无需修饰,具有操作简便、显著降低检测成本、缩短检测时间的优势。
附图说明
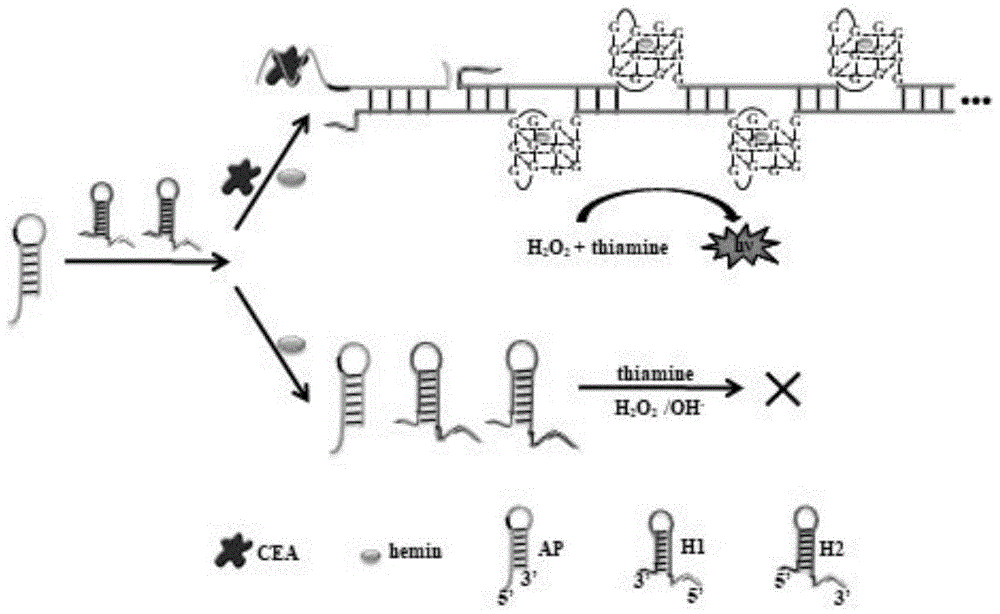
图1为本发明基于杂交链式反应和核酶的荧光适配体传感器的癌胚抗原检测方法的原理示意图;
图2为本发明实施例1中不同条件下基于杂交链式反应和核酶的荧光适配体传感器对癌胚抗原检测的荧光光谱图;
图3为本发明实施例2中基于杂交链式反应和核酶的荧光适配体传感器对不同浓度癌胚抗原检测的荧光光谱图;
图4为本发明实施例2中癌胚抗原浓度与相对荧光强度的关系图;
图5为本发明实施例3中基于杂交链式反应和核酶的荧光适配体传感器对癌胚抗原的选择性分析。
具体实施方式
以下将对本发明提供的基于杂交链式反应和核酶的荧光适配体传感器及癌胚抗原检测方法作进一步说明。
本发明所提供的基于杂交链式反应(hcr)和核酶(dnazyme)的荧光适配体传感器,包括核酸适配体探针(ap)与发夹探针,所述核酸适配体探针包括核酸适配体序列、引发链序列及互补序列,所述发夹探针包括第一发夹探针(h1)与第二发夹探针(h2),所述第一发夹探针及所述第二发夹探针都是含有g-四链体核酶碱基的序列,所述核酸适配体探针特异性识别癌胚抗原(cea),所述核酸适配体探针构象转换,使所述第一发夹探针与所述第二发夹探针形成双链dna,同时,在hemin存在的情况下,所述第一发夹探针与所述第二发夹探针自组装形成hemin/g-四链体核酶(hemin/g-四链体dnazyme),所述hemin/g-四链体核酶催化过氧化氢(h2o2)介导的硫胺素(thiamine)并发出荧光,定量检测所述癌胚抗原。
具体的,所述荧光适配体传感器利用所述核酸适配体探针高亲和力、高特异性的识别靶标。与抗体相比,核酸适配体探针具有易于合成、性质稳定和低免疫原性的显著优势,使得所述荧光适配体传感器具有高选择性,从而提高实际样品检测的准确性。
进一步地,考虑到核酸适配体探针的反应稳定性,所述核酸适配体探针设计为发夹结构。其中,所述核酸适配体序列用于特异性识别靶标,所述核酸适配体序列为特异性识别癌胚抗原的核酸适配体序列,能够高度特异性识别癌胚抗原,碱基序列为5’-ataccagcttattcaatt-3’。所述引发链序列能够激活杂交链式反应,碱基序列为5’-agaagaaggtgtttaagta-3’。所述互补序列是为了提高发夹结构的稳定性,碱基序列为5’-aattga-3’。可以理解的,本发明所述荧光适配体传感器并不限制所述互补序列的碱基序列,具有稳定发夹结构的作用即可。
可以理解,为了提高靶标的特异性识别,所述核酸适配体序列为癌胚抗原的核酸适配体序列,从而,所述核酸适配体探针能够高亲和力地特异性结合癌胚抗原。
考虑到靶标检测的灵敏度,本发明所述的荧光适配体传感器通过核酸扩增技术实现生物传感器信号放大。其中,杂交链式反应相对于常用的聚合酶链式反应、滚环扩增等技术,具有无需变温、无需辅助酶、操作简单、成本低等优势。
具体的,在所述癌胚抗原存在的情况下,所述癌胚抗原与所述核酸适配体序列结合,使得所述核酸适配体探针发生构象变化,打开所述核酸适配体探针的发夹结构,释放所述引发链序列,进而所述第一发夹探针与所述第二发夹探针形成双链dna,激活杂交链式反应,从而实现核酸信号放大,提高癌胚抗原检测的灵敏度,有利于实际样品中的痕量癌胚抗原的检测。
进一步地,在所述hemin参与的情况下,处于所述第一发夹探针的链端富g碱基序列与所述第二发夹探针的链端富g碱基序列能够自组装形成所述hemin/g-四链体核酶。考虑到硫胺素能够在hemin/g-四链体核酶的催化下产生荧光变化,因此,通过检测硫胺素氧化产物的荧光信号强度变化,所述基于杂交链式反应和核酶的荧光适配体传感器能够实现所述癌胚抗原的定量检测。
本发明还提供了所述的基于杂交链式反应和核酶的荧光适配体传感器的癌胚抗原的检测方法,包括:
(1)核酸适配体探针、第一发夹探针、第二发夹探针与癌胚抗原首次开盖使用前先离心,分别将其溶于二次水中配成100μm的母液,再用第一缓冲液分别稀释成核酸适配体探针溶液、第一发夹探针溶液和第二发夹探针溶液,在4℃保存待用;
(2)将核酸适配体探针溶液、第一发夹探针溶液与第二发夹探针溶液分别加热反应并冷却至室温备用;
(3)将步骤(2)加热反应后的核酸适配体探针溶液、第一发夹探针溶液、第二发夹探针溶液与不同浓度的癌胚抗原溶液、免疫球蛋白g、甲胎蛋白或者前列腺特异性抗原在第一缓冲液中反应,得到混合液;
(4)在步骤(3)混合液中加入hemin反应,得到反应液;
(5)将步骤(4)反应液与硫胺素、过氧化氢在第二缓冲液中反应,检测荧光信号强度。
具体的,考虑到核酸易受到核酸酶作用而降解,以及杂交链式反应扩增效率,所述第一缓冲液为tris-hcl缓冲液,所述tris-hcl缓冲液的ph为7.4,使所述核酸适配体探针、所述第一发夹探针与所述第二发夹探针能够保持较稳定的发夹结构,从而实现杂交链式反应。
在步骤(2)中,为了使核酸充分形成发夹结构,核酸探针需要经过高温过程,即反应温度为85℃~95℃,反应时间为5分钟~15分钟,使得dna变性,从而使二聚体的dna解链形成单链,在缓慢退火降温的复性过程中,核酸探针能够充分形成稳定的发夹结构,有利于后续的杂交链式反应。优选的,反应温度为90℃,反应时间为10分钟。
在步骤(3)中,为了提高杂交链式反应的扩增效率,所述核酸适配体探针溶液浓度为10nm~100nm,所述第一发夹探针溶液浓度为1nm~500nm,所述第二发夹探针溶液浓度为1nm~500nm。优选的,所述核酸适配体探针为50nm所述第一发夹探针溶液浓度为50nm,所述第二发夹探针溶液浓度为50nm。当反应温度过高时,dna双链之间的氢键不稳定,导致dna解链,降低扩增效率。当反应时间过短,则核酸探针之间的反应不完全。因此,考虑到反应温度以及反应时间对杂交链式反应的影响,所述反应温度为25℃~45℃之间,优选为37℃,所述反应时间为4小时~8小时,优选为6小时。
在步骤(4)中,所述hemin浓度为0.1μm~1μm,优选为0.5μm。室温下反应,反应时间为1小时~4小时,优选为2小时,以使所述第一发夹探针与所述第二发夹探针自组装形成所述hemin/g-四链体核酶,用于催化氧化所述硫胺素。
在步骤(5)中,所述第二缓冲液为k2hpo4-naoh缓冲液,所述k2hpo4-naoh缓冲液的ph为12,以使所述hemin/g-四链体核酶催化所述过氧化氢介导的所述硫胺素,从而形成较稳定的硫胺素氧化物,以产生显著的荧光信号强度变化,从而实现痕量癌胚抗原的定量检测。其中,反应温度为室温,反应时间为10分钟~30分钟,优选的,反应时间为20分钟。
本发明所提供的基于杂交链式反应和核酶的荧光适配体传感器的癌胚抗原检测方法中,dna链无需修饰,具有操作简便、显著降低检测成本、缩短检测时间的优势,而且无需辅助酶,就能够实现核酸信号放大,从而提高痕量癌胚抗原检测的选择性与灵敏度。
以下,将通过具体实施例对所述基于杂交链式反应和核酶的荧光适配体传感器及癌胚抗原检测方法做进一步的说明。
如图1所示,基于杂交链式反应和核酶的荧光适配体传感器的癌胚抗原检测方法的原理示意图。
实施例中,各dna序列如下:
表1本实验所用的dna序列
实施例1
核酸适配体探针、第一发夹探针、第二发夹探针与癌胚抗原首次开盖使用前先10000rpm离心,4℃离心30s,分别将其溶于二次水中配成浓度都为100μm的母液,再用tris-hcl缓冲液稀释成核酸适配体探针溶液、第一发夹探针溶液和第二发夹探针溶液,4℃保存待用;将核酸适配体探针溶液5μm、第一发夹探针溶液5μm与第二发夹探针溶液5μm分别加热到90℃,反应10分钟,并冷却至室温备用。
其中,在图2(a)中,离心管中加入ph为7.4的tris-hcl缓冲液,37℃反应6小时;然后室温下反应2小时;接着取出100μl反应液加入6mm硫胺素溶液及ph为12的k2hpo4-naoh缓冲液,室温下反应20分钟。
在图2(b)中,离心管中加入ph为7.4的tris-hcl缓冲液,37℃反应6小时;然后室温下反应2小时;接着取出100μl反应液加入6mm硫胺素溶液、20mm过氧化氢溶液及ph为12的k2hpo4-naoh缓冲液,室温下反应20分钟。
在图2(c)中,离心管中加入ph为7.4的tris-hcl缓冲液,37℃反应6小时;然后加入0.5μmhemin,室温下反应2小时;接着取出100μl反应液加入6mm硫胺素溶液、20mm过氧化氢溶液及ph为12的k2hpo4-naoh缓冲液,室温下反应20分钟。
在图2(d)中,离心管中加入50nm核酸适配体探针溶液、50nm第一发夹探针溶液与50nm第二发夹探针溶液在ph为7.4的tris-hcl缓冲液中,37℃反应6小时,得到混合液;然后加入0.5μmhemin,室温下反应2小时,得到反应液;接着取出100μl反应液加入6mm硫胺素溶液及20mm过氧化氢溶液于ph为12的k2hpo4-naoh缓冲液中,室温反应20分钟,检测荧光信号强度。
在图2(e)中,离心管中加入50nm核酸适配体探针溶液、50nm第一发夹探针溶液、50nm第二发夹探针溶液与0.25nm癌胚抗原溶液在ph为7.4的tris-hcl缓冲液中,37℃反应6小时,得到混合液;然后加入0.5μmhemin,室温下反应2小时,得到反应液;接着取出100μl反应液加入6mm硫胺素溶液及20mm过氧化氢溶液于ph为12的k2hpo4-naoh缓冲液中,室温反应20分钟,检测荧光信号强度。
通过图2的荧光光谱图,可以得出,所述癌胚抗原存在时,荧光信号强度最大,因此,所述基于杂交链式反应和核酶的荧光适配体传感器能够根据所述硫胺素的荧光信号强度变化来定量检测所述癌胚抗原。
实施例2
核酸适配体探针、第一发夹探针、第二发夹探针与癌胚抗原首次开盖使用前先10000rpm离心,4℃离心30秒,分别将其溶于二次水中配成100μm的母液,再用tris-hcl缓冲液稀释,4℃保存待用;将核酸适配体探针溶液5μm、第一发夹探针溶液5μm与第二发夹探针溶液5μm分别加热到90℃,反应10分钟,并冷却至室温备用。
其中,在图3(a)中,离心管中加入50nm核酸适配体探针溶液、50nm第一发夹探针溶液与50nm第二发夹探针溶液在ph为7.4的tris-hcl缓冲液中,37℃反应6小时,得到混合液;然后加入0.5μmhemin,室温下反应2小时,得到反应液;接着取出100μl反应液加入6mm硫胺素溶液及20mm过氧化氢溶液于ph为12的k2hpo4-naoh缓冲液中,室温反应20分钟,检测荧光信号强度。
在图3(b)中,离心管中加入50nm核酸适配体探针溶液、50nm第一发夹探针溶液、50nm第二发夹探针溶液与0.25nm癌胚抗原溶液在ph为7.4的tris-hcl缓冲液中,37℃反应6小时,得到混合液;然后加入0.5μmhemin,室温下反应2小时,得到反应液;接着取出100μl反应液加入6mm硫胺素溶液及20mm过氧化氢溶液于ph为12的k2hpo4-naoh缓冲液中,室温反应20分钟,检测荧光信号强度。
在图3(c)中,离心管中加入50nm核酸适配体探针溶液、50nm第一发夹探针溶液、50nm第二发夹探针溶液与0.50nm癌胚抗原溶液在ph为7.4的tris-hcl缓冲液中,37℃反应6小时,得到混合液;然后加入0.5μmhemin,室温下反应2小时,得到反应液;接着取出100μl反应液加入6mm硫胺素溶液及20mm过氧化氢溶液于ph为12的k2hpo4-naoh缓冲液中,室温反应20分钟,检测荧光信号强度。
在图3(d)中,离心管中加入50nm核酸适配体探针溶液、50nm第一发夹探针溶液、50nm第二发夹探针溶液与0.75nm癌胚抗原溶液在ph为7.4的tris-hcl缓冲液中,37℃反应6小时,得到混合液;然后加入0.5μmhemin,室温下反应2小时,得到反应液;接着取出100μl反应液加入6mm硫胺素溶液及20mm过氧化氢溶液于ph为12的k2hpo4-naoh缓冲液中,室温反应20分钟,检测荧光信号强度。
在图3(e)中,离心管中加入50nm核酸适配体探针溶液、50nm第一发夹探针溶液、50nm第二发夹探针溶液与1.0nm癌胚抗原溶液在ph为7.4的tris-hcl缓冲液中,37℃反应6小时,得到混合液;然后加入0.5μmhemin,室温下反应2小时,得到反应液;接着取出100μl反应液加入6mm硫胺素溶液及20mm过氧化氢溶液于ph为12的k2hpo4-naoh缓冲液中,室温反应20分钟,检测荧光信号强度。
在图3(f)中,离心管中加入50nm核酸适配体探针溶液、50nm第一发夹探针溶液、50nm第二发夹探针溶液与1.5nm癌胚抗原溶液在ph为7.4的tris-hcl缓冲液中,37℃反应6小时,得到混合液;然后加入0.5μmhemin,室温下反应2小时,得到反应液;接着取出100μl反应液加入6mm硫胺素溶液及20mm过氧化氢溶液于ph为12的k2hpo4-naoh缓冲液中,室温反应20分钟,检测荧光信号强度。
在图3(g)中,离心管中加入50nm核酸适配体探针溶液、50nm第一发夹探针溶液、50nm第二发夹探针溶液与2.0nm癌胚抗原溶液在ph为7.4的tris-hcl缓冲液中,37℃反应6小时,得到混合液;然后加入0.5μmhemin,室温下反应2小时,得到反应液;接着取出100μl反应液加入6mm硫胺素溶液及20mm过氧化氢溶液于ph为12的k2hpo4-naoh缓冲液中,室温反应20分钟,检测荧光信号强度。
在图3(h)中,离心管中加入50nm核酸适配体探针溶液、50nm第一发夹探针溶液、50nm第二发夹探针溶液与2.5nm癌胚抗原溶液在ph为7.4的tris-hcl缓冲液中,37℃反应6小时,得到混合液;然后加入0.5μmhemin,室温下反应2小时,得到反应液;接着取出100μl反应液加入6mm硫胺素溶液及20mm过氧化氢溶液于ph为12的k2hpo4-naoh缓冲液中,室温反应20分钟,检测荧光信号强度。
通过图3的荧光光谱图,可以得出,随着所述癌胚抗原浓度的增加,荧光信号强度逐渐增强,所述癌胚抗原能够与所述核酸适配体探针结合,激活杂交链式反应,使得所述第一发夹探针与所述第二发夹探针自组装形成hemin/g-四链体核酶,从而催化氧化硫胺素发出荧光,达到定量检测癌胚抗原的目的。
在本实施例中,从图4可以得出,在0.25nm~1.5nm范围内,相对荧光强度变化与癌胚抗原浓度呈现良好的线性关系,线性相关系数为r2=0.99849,检出限为0.2nm,其中f和f0分别为癌胚抗原存在与不存在时的荧光强度,因此,所述基于杂交链式反应和核酶的荧光适配体传感器具有较高的灵敏度。
实施例3
核酸适配体探针、第一发夹探针、第二发夹探针与癌胚抗原首次开盖使用前先10000rpm离心,4℃离心30s,分别将其溶于二次水中配成100μm的母液,再用tris-hcl缓冲液稀释,4℃保存待用;将核酸适配体探针溶液5μm、第一发夹探针溶液5μm与第二发夹探针溶液5μm分别加热到90℃,反应10分钟,并冷却至室温备用。
在图5(a)中,离心管中加入50nm核酸适配体探针溶液、50nm第一发夹探针溶液、50nm第二发夹探针溶液与0.25nm免疫球蛋白g(igg)在ph为7.4的tris-hcl缓冲液中,37℃反应6小时,得到混合液;然后加入0.5μmhemin,室温下反应2小时,得到反应液;接着取出100μl反应液加入6mm硫胺素溶液及20mm过氧化氢溶液于ph为12的k2hpo4-naoh缓冲液中,室温反应20分钟,检测荧光信号强度。
在图5(b)中,离心管中加入50nm核酸适配体探针溶液、50nm第一发夹探针溶液、50nm第二发夹探针溶液与0.25nm甲胎蛋白(afp)在ph为7.4的tris-hcl缓冲液中,37℃反应6小时,得到混合液;然后加入0.5μmhemin,室温下反应2小时,得到反应液;接着取出100μl反应液加入6mm硫胺素溶液及20mm过氧化氢溶液于ph为12的k2hpo4-naoh缓冲液中,室温反应20分钟,检测荧光信号强度。
在图5(c)中,离心管中加入50nm核酸适配体探针溶液、50nm第一发夹探针溶液、50nm第二发夹探针溶液与0.25nm前列腺特异性抗原(psa)在ph为7.4的tris-hcl缓冲液中,37℃反应6小时,得到混合液;然后加入0.5μmhemin,室温下反应2小时,得到反应液;接着取出100μl反应液加入6mm硫胺素溶液及20mm过氧化氢溶液于ph为12的k2hpo4-naoh缓冲液中,室温反应20分钟,检测荧光信号强度。
在图5(d)中,离心管中加入50nm核酸适配体探针溶液、50nm第一发夹探针溶液、50nm第二发夹探针溶液与0.25nm癌胚抗原在ph为7.4的tris-hcl缓冲液中,37℃反应6小时,得到混合液;然后加入0.5μmhemin,室温下反应2小时,得到反应液;接着取出100μl反应液加入6mm硫胺素溶液及20mm过氧化氢溶液于ph为12的k2hpo4-naoh缓冲液中,室温反应20分钟,检测荧光信号强度。
在图5(e)中,离心管中加入50nm核酸适配体探针溶液、50nm第一发夹探针溶液、50nm第二发夹探针溶液与0.25nm免疫球蛋白g、0.25nm甲胎蛋白、0.25nm前列腺特异性抗原、0.25nm癌胚抗原的混合溶液在ph为7.4的tris-hcl缓冲液中,37℃反应6小时,得到混合液;然后加入0.5μmhemin,室温下反应2小时,得到反应液;接着取出100μl反应液加入6mm硫胺素溶液及20mm过氧化氢溶液于ph为12的k2hpo4-naoh缓冲液中,室温反应20分钟,检测荧光信号强度。
从图5可知,当所述癌胚抗原或癌胚抗原混合液存在时,所述基于杂交链式反应和核酶的荧光适配体传感器具有较强的荧光信号强度,而其他蛋白质存在时,则仅有较弱的荧光信号强度,其中f和f0分别为蛋白质存在与不存在时的荧光强度,因此,所述荧光适配体传感器对癌胚抗原具有良好的选择性。
实施例4
为了评估该荧光适配体传感器在实样检测中的分析应用能力,测定了不同浓度的癌胚抗原在稀释的人血清中的回收率。实验结果如表2所示,所述基于杂交链式反应和核酶的荧光适配体传感器对癌胚抗原的加标回收率在102.47%到115.33%之间,满足实验要求,因而该传感器可以在复杂生物样品中定量检测癌胚抗原,具有临床应用前景。
表2血清中癌胚抗原的检测
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!