用于超早期帕金森病检测的试剂盒的制作方法
本发明属于生物检测技术领域,具体涉及一种用于超早期帕金森病检测的试剂盒。
背景技术:
帕金森病(parkinson’sdisease,pd)是最常见的中枢神经系统退行性运动障碍性疾病,是目前世界上仅次于阿尔兹海默病的第二大神经退行性疾病。帕金森病的临床表现主要包括静止性震颤、肌强直、运动迟缓和姿势步态异常等运动症状,此外还伴有情绪低落、睡眠障碍、便秘、认知障碍等非运动症状。据流行病学统计报道,我国现有pd患者250万左右,其中65岁以上人群的患病率为1700/10万,并随年龄增长而升高。据世界卫生组织专家预测,到2030年中国pd患者将占世界pd患者总数的一半,达到500万,给家庭和社会带来了沉重的负担。
pd的病理发展最早从胃肠神经丛、嗅球开始,逐渐向上发展到延髓、桥脑,所以pd早期表现主要为便秘、嗅觉减退、抑郁和睡眠障碍等非运动症状,而这些非典型症状容易被忽视。pd患者往往到出现运动迟缓、静止性震颤、肌强直等典型的运动症状才到医院就诊,而此时脑的病理损伤已发展到中脑,患者的病程进展已达数年至十余年,严重影响了疾病的早期诊断、治疗和预后。所以临床若能发现帕金森病的早期预警及疾病进展标记物,对控制疾病的发展及减轻神经损伤将具有非常重要的意义。
pd的病因迄今仍未十分清楚,遗传因素、环境因素、年龄老化、氧化应激等均可能参与pd的发生、发展过程。目前pd临床诊断主要是依据患者的运动症状,此时患者黑质致密部的多巴胺能神经元大量变性丢失、残存的神经元胞质内出现的嗜酸性包涵体即路易小体。
目前,关于pd生物标志物的研究主要集中于发现脑脊液内的蛋白生物标志物,α-突触核蛋白及其变体受到了最多的关注。然而,脑脊液中pd蛋白生物标志物检测的缺点主要为:1)脑脊液采集困难,对患者的损伤较大,临床上患者普遍难以接受;2)缺乏早期预警和诊断的蛋白标志物,目前已有的蛋白标志物仅仅能诊断中晚期pd,而不能够早期检测出潜在的pd患者;3)灵敏度低,目前检测脑脊液中蛋白标志物多采用酶联免疫吸附(elisa)的方法,该方法对于脑脊液中低丰度的蛋白标志物不够灵敏,而采用高灵敏度的电化学发光方法(如msd技术)成本较高。因此,开发基于临床上容易获取的组织来源,如血液、唾液、尿液等的pd检测方法迫在眉睫。
越来越多的证据指出氧化应激参与多种神经变性疾病,如阿尔茨海默病,帕金森病,路易体痴呆,亨廷顿舞蹈症等。氧化应激是一个普遍存在的病理生理过程,由活性氧(ros)产生与代谢失衡所致。氧化应激在pd发生发展的作用得到越来越多的重视与关注。
微量元素也被证实在帕金森病的病理过程中起了重要作用,如硒、铁、锌等。硒、铁、锌可与路易小体中的α-syn相结合,从而促进α-syn的聚集,加剧路易小体的形成。
对于pd的临床诊断,不管是英国脑库帕金森病诊断标准还是2015年国际运动障碍协会(internationalparkinsonandmovementdisordersociety,mds)新的帕金森病诊断标准,主要还是通过临床症状、病情进展变化、传统治疗效果来帮助临床医生进行鉴别和诊断。因此发现帕金森病早期预警及疾病进展标记物的需要也越来越迫切。
技术实现要素:
解决的技术问题:针对上述技术问题,本发明提供了一种用于超早期帕金森病检测的试剂盒,本试剂盒为一种联合检测pd相关指标的技术,用于辅助诊断超早期帕金森病,该试剂盒包括血清α-突触核蛋白α-syn、金属离子fe、zn及gsh、gsh-px、sod的检测,提高辅助诊断的敏感度和特异度。
技术方案:用于超早期帕金森病检测的试剂盒,所述试剂盒包括盒体、可开启的盒盖和试剂瓶,所述试剂瓶通过泡沫固定于盒体内,试剂瓶中含有α-突触核蛋白检测单元、血清铁检测单元、血清锌检测单元、gsh检测单元、gsh-px检测单元和sod检测单元。
优选的,所述试剂瓶为密封无菌的平底试剂瓶。
优选的,所述盒体与可开启的盒盖之间活动链接,所述试剂瓶通过泡沫固定于盒体内。
优选的,所述α-突触核蛋白检测单元包括标准品(α-突触核蛋白样品)、标准品稀释液(0.01mpbs)、生物素标记的α-突触核蛋白抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。
优选的,所述血清铁检测单元包括标准品(铁离子样品)、标准品稀释液(0.01mpbs)、生物素标记的铁离子抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。
优选的,所述血清锌检测单元包括标准品(锌离子样品)、标准品稀释液(0.01mpbs)、生物素标记的锌离子抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。
优选的,所述gsh检测单元包括标准品(gsh样品)、标准品稀释液(0.01mpbs)、生物素标记的gsh抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。
优选的,所述gsh-px检测单元包括标准品(gsh-px样品)、标准品稀释液(0.01mpbs)、生物素标记的gsh-px抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。
优选的,所述sod检测单元包括标准品(sod样品)、标准品稀释液(0.01mpbs)、生物素标记的sod抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。
有益效果:
本发明的试剂盒通过对血清α-突触核蛋白(α-syn)、金属离子fe、zn及gsh、gsh-px、sod的检测,全面联合检测pd的相关指标,可以有效用于辅助诊断超早期帕金森病,提高辅助诊断的敏感度和特异度。
本发明所需样本为血清液,相比与脑脊液抽取和检测更加方便简单,更利于临床推广。
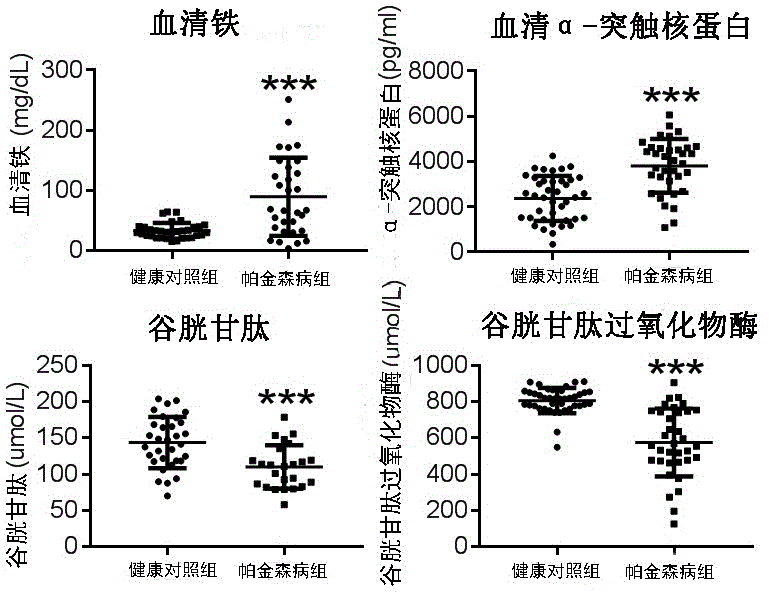
本发明前期结果显示在pd患者血清中血清铁含量和α-syn含量与健康对照组相比显著升高。而pd患者血清gsh和gshpx的量与对照组相比显著降低p<0.05,通过相关性分析发现,α-syn的聚集和gsh含量以及gpx活性有显著的负相关p<0.05,血清铁和gsh含量间也存在显著的负相关p<0.05
附图说明
图1为健康对照组和帕金森病组的血清铁、α-突触核蛋白、gsh及gsh-px的含量对比图;
图2为早期帕金森病的诊断技术路线图。
具体实施方式
下面结合本发明的具体内容,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明的保护范围。
实施例1
按照图2所示的技术路线图进行试验。
1.试验准备
对35例临床疑诊早期pd患者,抽取血液样本,离心采集血清后采用试剂盒进行检测;最后根据mds帕金森病诊断标准和影像学mri检测结果来综合比对试剂盒检测的正确率。
2.试剂盒检测
本发明的试剂盒包括盒体、可开启的盒盖和试剂瓶,所述试剂瓶通过泡沫固定于盒体内。所述试剂瓶为密封无菌的平底试剂瓶,试剂瓶中分别装有α-突触核蛋白检测单元、血清铁检测单元、血清锌检测单元、gsh检测单元、gsh-px检测单元和sod检测单元。
α-突触核蛋白检测单元包括标准品(α-突触核蛋白样品)、标准品稀释液(0.01mpbs)、生物素标记的α-突触核蛋白抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。
血清铁检测单元包括标准品(铁离子样品)、标准品稀释液(0.01mpbs)、生物素标记的铁离子抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。
血清锌检测单元包括标准品(锌离子样品)、标准品稀释液(0.01mpbs)、生物素标记的锌离子抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。
gsh检测单元包括标准品(gsh样品)、标准品稀释液(0.01mpbs)、生物素标记的gsh抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。
gsh-px检测单元包括标准品(gsh-px样品)、标准品稀释液(0.01mpbs)、生物素标记的gsh-px抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。
sod检测单元包括标准品(sod样品)、标准品稀释液(0.01mpbs)、生物素标记的sod抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。
2.1α-突触核蛋白检测
α-突触核蛋白检测通过α-突触核蛋白检测单元进行,该检测单元包括标准品(α-突触核蛋白样品)、标准品稀释液(0.01mpbs)、生物素标记的α-突触核蛋白抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。。
检测步骤如下:
第一步:使用前,将所有试剂各自充分摇匀,不要使液体产生大量的泡沫,以免加样时加入大量的气泡,产生加样上的误差;
第二步:根据待测样品数量加上标准品的数量决定所需的酶标条数,每个样品根据自己的数量来定,能使用复孔的尽量做复孔,标本加入50ul于反应孔内;
第三步:加入稀释好后的标准品50ul于反应孔、加入待测样品50ul于反应孔内,立即加入50ul的生物素标记的抗体,盖上塑料模板,轻轻振荡混匀,37℃温育1小时;
第四步:甩去孔内液体,每孔加满洗涤液,振荡30秒,甩去洗涤液,用吸水纸拍干,重复此操作3次,如果用洗板机洗涤,洗涤次数增加一次;
第五步:每孔加入80ul的亲和链酶素-hrp,轻轻振荡混匀,37℃温育30分钟;
第六步:甩去孔内液体,每孔加满洗涤液,振荡30秒,甩去洗涤液,用吸水纸拍干,重复此操作3次,如果用洗板机洗涤,洗涤次数增加一次;
第七步:每孔加入底物a、b各50ul,轻轻振荡混匀,37℃温育10分钟,避免光照;
第八步:取出酶标条,迅速加入50ul终止液,加入终止液后应立即在450nm波长处测定各孔的od值,其中酶标条及塑料膜板盖需自备。
2.2血清铁检测
血清铁检测通过血清铁检测单元进行,该检测单元包括标准品(铁离子样品)、标准品稀释液(0.01mpbs)、生物素标记的铁离子抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。
检测步骤如下:
第一步:使用前,将所有试剂各自充分摇匀,不要使液体产生大量的泡沫,以免加样时加入大量的气泡,产生加样上的误差;
第二步:根据待测样品数量加上标准品的数量决定所需的酶标条数,每个样品根据自己的数量来定,能使用复孔的尽量做复孔,标本加入50ul于反应孔内;
第三步:加入稀释好后的标准品50ul于反应孔、加入待测样品50ul于反应孔内,立即加入50ul的生物素标记的抗体,盖上塑料膜板,轻轻振荡混匀,37℃温育1小时;
第四步:甩去孔内液体,每孔加满洗涤液,振荡30秒,甩去洗涤液,用吸水纸拍干,重复此操作3次,如果用洗板机洗涤,洗涤次数增加一次;
第五步:每孔加入80ul的亲和链酶素-hrp,轻轻振荡混匀,37℃温育30分钟;
第六步:甩去孔内液体,每孔加满洗涤液,振荡30秒,甩去洗涤液,用吸水纸拍干,重复此操作3次,如果用洗板机洗涤,洗涤次数增加一次;
第七步:每孔加入底物a、b各50ul,轻轻振荡混匀,37℃温育10分钟,避免光照;
第八步:取出酶标条,迅速加入50ul终止液,加入终止液后应立即在450nm波长处测定各孔的od值。(其中酶标条及塑料膜板盖需自备)
2.3血清锌检测
血清锌检测通过血清锌检测单元进行,该检测单元包括标准品(锌离子样品)、标准品稀释液(0.01mpbs)、生物素标记的锌离子抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。
检测步骤如下:
第一步:使用前,将所有试剂各自充分摇匀,不要使液体产生大量的泡沫,以免加样时加入大量的气泡,产生加样上的误差;
第二步:根据待测样品数量加上标准品的数量决定所需的酶标条数,每个样品根据自己的数量来定,能使用复孔的尽量做复孔,标本加入50ul于反应孔内;
第三步:加入稀释好后的标准品50ul于反应孔、加入待测样品50ul于反应孔内,立即加入50ul的生物素标记的抗体,盖上塑料膜板,轻轻振荡混匀,37℃温育1小时;
第四步:甩去孔内液体,每孔加满洗涤液,振荡30秒,甩去洗涤液,用吸水纸拍干,重复此操作3次,如果用洗板机洗涤,洗涤次数增加一次;
第五步:每孔加入80ul的亲和链酶素-hrp,轻轻振荡混匀,37℃温育30分钟;
第六步:甩去孔内液体,每孔加满洗涤液,振荡30秒,甩去洗涤液,用吸水纸拍干,重复此操作3次,如果用洗板机洗涤,洗涤次数增加一次;
第七步:每孔加入底物a、b各50ul,轻轻振荡混匀,37℃温育10分钟,避免光照;
第八步:取出酶标条,迅速加入50ul终止液,加入终止液后应立即在450nm波长处测定各孔的od值,其中酶标条及塑料膜板盖需自备。
2.4gsh检测
gsh检测通过gsh检测单元进行,该检测单元包括标准品(gsh样品)、标准品稀释液(0.01mpbs)、生物素标记的gsh抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。
检测步骤如下:
第一步:使用前,将所有试剂各自充分摇匀,不要使液体产生大量的泡沫,以免加样时加入大量的气泡,产生加样上的误差;
第二步:根据待测样品数量加上标准品的数量决定所需的酶标条数,每个样品根据自己的数量来定,能使用复孔的尽量做复孔,标本加入50ul于反应孔内;
第三步:加入稀释好后的标准品50ul于反应孔、加入待测样品50ul于反应孔内,立即加入50ul的生物素标记的抗体,盖上塑料膜板,轻轻振荡混匀,37℃温育1小时;
第四步:甩去孔内液体,每孔加满洗涤液,振荡30秒,甩去洗涤液,用吸水纸拍干,重复此操作3次,如果用洗板机洗涤,洗涤次数增加一次;
第五步:每孔加入80ul的亲和链酶素-hrp,轻轻振荡混匀,37℃温育30分钟;
第六步:甩去孔内液体,每孔加满洗涤液,振荡30秒,甩去洗涤液,用吸水纸拍干,重复此操作3次,如果用洗板机洗涤,洗涤次数增加一次;
第七步:每孔加入底物a、b各50ul,轻轻振荡混匀,37℃温育10分钟,避免光照;
第八步:取出酶标条,迅速加入50ul终止液,加入终止液后应立即在450nm波长处测定各孔的od值,其中酶标条及塑料膜板盖需自备。
2.5gsh-px检测单元
gsh-px检测通过gsh-px检测单元进行,该检测单元包括标准品(gsh-px样品)、标准品稀释液(0.01mpbs)、生物素标记的gsh-px抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。
检测步骤如下:
第一步:使用前,将所有试剂各自充分摇匀,不要使液体产生大量的泡沫,以免加样时加入大量的气泡,产生加样上的误差;
第二步:根据待测样品数量加上标准品的数量决定所需的酶标条数,每个样品根据自己的数量来定,能使用复孔的尽量做复孔,标本加入50ul于反应孔内;
第三步:加入稀释好后的标准品50ul于反应孔、加入待测样品50ul于反应孔内,立即加入50ul的生物素标记的抗体,盖上塑料膜板,轻轻振荡混匀,37℃温育1小时;
第四步:甩去孔内液体,每孔加满洗涤液,振荡30秒,甩去洗涤液,用吸水纸拍干,重复此操作3次,如果用洗板机洗涤,洗涤次数增加一次;
第五步:每孔加入80ul的亲和链酶素-hrp,轻轻振荡混匀,37℃温育30分钟;
第六步:甩去孔内液体,每孔加满洗涤液,振荡30秒,甩去洗涤液,用吸水纸拍干,重复此操作3次,如果用洗板机洗涤,洗涤次数增加一次;
第七步:每孔加入底物a、b各50ul,轻轻振荡混匀,37℃温育10分钟,避免光照;
第八步:取出酶标条,迅速加入50ul终止液,加入终止液后应立即在450nm波长处测定各孔的od值,其中酶标条及塑料膜板盖需自备。
2.6sod检测
sod检测通过sod检测单元进行,该检测单元包括标准品(sod样品)、标准品稀释液(0.01mpbs)、生物素标记的sod抗体、亲和链霉素-hrp、洗涤缓冲液(pbs)、底物a(辣根过氧化物酶)、底物b(碱性磷酸酶)、终止液(磷酸溶液)。
检测步骤如下:
第一步:使用前,将所有试剂各自充分摇匀,不要使液体产生大量的泡沫,以免加样时加入大量的气泡,产生加样上的误差;
第二步:根据待测样品数量加上标准品的数量决定所需的酶标条数,每个样品根据自己的数量来定,能使用复孔的尽量做复孔,标本加入50ul于反应孔内;
第三步:加入稀释好后的标准品50ul于反应孔、加入待测样品50ul于反应孔内,立即加入50ul的生物素标记的抗体,盖上塑料膜板,轻轻振荡混匀,37℃温育1小时;
第四步:甩去孔内液体,每孔加满洗涤液,振荡30秒,甩去洗涤液,用吸水纸拍干,重复此操作3次,如果用洗板机洗涤,洗涤次数增加一次;
第五步:每孔加入80ul的亲和链酶素-hrp,轻轻振荡混匀,37℃温育30分钟;
第六步:甩去孔内液体,每孔加满洗涤液,振荡30秒,甩去洗涤液,用吸水纸拍干,重复此操作3次,如果用洗板机洗涤,洗涤次数增加一次;
第七步:每孔加入底物a、b各50ul,轻轻振荡混匀,37℃温育10分钟,避免光照;
第八步:取出酶标条,迅速加入50ul终止液,加入终止液后应立即在450nm波长处测定各孔的od值,其中酶标条及塑料膜板盖需自备。
3.试验结果
3.1试验数据/图像
1)对35例临床疑诊早期pd患者抽取血液样本,离心采集血清,通过试剂盒对血清α-突触核蛋白α-syn、金属离子fe、zn及gsh、gsh-px、sod的检测;并对照表1,计算综合帕金森风险系数。
表1试剂盒检测模块及分级标准
此表中综合帕金森风险系数满分为10分,当评估项目为早期诊断时,其对应的风险分析规则为:
等级i,总分大于7分,为高度疑似帕金森患者;
等级ii,总分7至5分,为中度疑似帕金森患者;
等级iii,总分4至3分,为轻度疑似帕金森患者;
等级iv,总分小于3分,基本可以排除帕金森患者。
其中等级i和ii,可综合判断结果为阳性,建议立即入院治疗;等级iii和iv,可综合判断结果为阴性,建议门诊随访治疗。
2)上述患者,随访观察3个月后,根据mds帕金森病诊断标准和影像学mri检测结果来作为综合确诊是否为帕金森患者。
临床诊断标准:根据2015年国际运动障碍协会制订的帕金森病诊断标准(主要包括缓慢进展性病程,出现运动迟缓,并且至少存在静止性震颤或强直这两项主征的一项,偏侧起病,对左旋多巴治疗敏感,同时还可以伴有便秘和嗅觉减退等非运动症状)和排除标准(排除其他pd综合症,症状出现时正在使用抗精神病药物和/或多巴胺耗竭剂、接触已知的神经毒物、无铁相关疾病史)。
影像学mri检测:进行脑部水相位图扫描,正常人显示双侧黑质尾部存在条状、泪滴状或不规则形高信号区域,红色箭头所指显示双侧黑质尾部有条状高信号区域,即“燕尾征”存在;pd患者,则上述区域未见高信号区,显示双侧黑质“燕尾征”消失,双侧黑质致密带变窄、模糊,甚至显示不清。
3.2试验结果
根据mds帕金森病诊断标准和影像学mri检测结果(能确诊)来综合比对试剂盒检测的灵敏度和特异度。
表2受试者不同检测等级的阳性预测者和阴性预测值
表3试剂盒的灵敏度和特异度
检测灵敏度=16/(16+5)=76.2%,特异度=12/(2+12)=85.7%。
如图1所示,本发明前期结果显示在pd患者血清中血清铁含量和α-syn含量与健康对照组相比显著升高。而pd患者血清gsh和gshpx的量与对照组相比显著降低p<0.05,通过相关性分析发现,α-syn的聚集和gsh含量以及gpx活性有显著的负相关p<0.05,血清铁和gsh含量间也存在显著的负相关p<0.05。
α-突触核蛋白是一种在中枢神经系统突触前及核周表达的可溶性蛋白质,在路易体中存在高度磷酸化的α-syn对多巴胺能神经元有毒性作用,磷酸化的s129α-syn可以促进α-syn的聚集并加剧神经元的死亡,它与帕金森病的发病和功能障碍密切相关。研究证实,寡聚体和原纤维是α-syn主要的毒性形式,外周血外泌体的α-syn水平和pd病情严重程度直接的相关性是显著的,α-syn水平改变与pd患者病情进展趋势非常一致。新型的elisa方法可以检测寡聚α-syn。多个研究表明pd患者脑脊液和血清中总α-syn水平有不同程度下降,但pd患者磷酸化α-syn的平均水平显著高于正常对照组,血清中寡聚α-syn水平显著升高,其特异性达0.852。因此血清α-syn是一个很好的帕金森病生物标记物,能够帮助我们诊断早期pd和观察病情进展,今后我们在临床上可尝试在疾病早期及进展期减少或逆转α-syn的聚合以延缓疾病进展。
病理情况下,细胞线粒体功能障碍导致ros增多,而参与清除ros的酶如sod、gsh、gsh-px功能和相对水平均下降。前期研究也表明pd患者gsh-px较正常对照组明显下降。
许多研究结果显示帕金森病患者脑黑质部位铁含量增高并积聚,导致氧化应激和多巴胺能神经元的损伤。而锌是许多酶的重要组成成分,如锌超氧化物歧化酶、多巴胺-β-羟化酶等,可参与多种神经退行性疾病的病理生理过程。
上述实例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所做的等效变换或修饰,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!