一种基于乳脂肪球膜特性的乳凝集素或粘蛋白1的ELISA定量检测方法与流程
本发明涉及生物学检测技术领域,具体地说,是一种基于乳脂肪球膜特性的乳凝集素或粘蛋白1的elisa定量检测方法。
背景技术:
母乳是婴儿最佳食品,是婴儿生长发育所需的唯一、最安全和最完整的天然食物。母乳喂养不仅能满足婴儿的体格生长发育,还能促进智力发育,有利于心理成长;母乳喂养的婴儿免疫发育好、抗病能力强、成年后的“三高症”(高血压、高血脂、高血糖)发生率低;另外母乳喂养可使母亲乳腺癌的发生率降低。新生儿及小婴儿的纯母乳喂养是世界卫生组织及联合国儿童基金会全力提倡的科学育儿法,是保障儿童健康成长的最基本措施。who提倡婴儿出生后母乳哺育至少4-6个月,以保证婴儿的正常生长发育,提高机体免疫力,预防传染性疾病的发生。然而,由于工作状况、职业、疾病等方面的原因,母乳喂养的现状并不乐观,母乳缺乏现象非常普遍。近年来我国母乳喂养率却持续下降,全国0-6个月婴儿纯母乳喂养率只有40%-50%,较上世纪90年代明显降低。因而婴幼儿配方奶粉成为首选的代乳品。然而,婴幼儿配方奶粉虽然营养丰富,但它和母乳在功能性方面仍然存在很大的差别。20世纪后期,随着母乳成分研究不断深入,出现了添加牛磺酸、核苷酸、聚糖、亚油酸、亚麻酸等一系列活性成分的婴幼儿配方奶粉,使其母乳化程度得到进一步提高。尽管目前市售婴幼儿配方乳粉在宏观营养成分的含量上接近母乳,然而母乳中功能性成分在婴幼儿配方奶粉中还没有得到准确的复制和体现。此外,既往基于母乳的研究大都是国外的数据,国内基于中国人群母乳研究的数据较少。事实上,由于地域、人种、饮食习惯等的不同,西方人母乳的特征性数据并不完全适用于中国人群。因此,对中国人群母乳成分的测定,以及母乳对母婴健康保护作用的研究工作显得至关重要。
母乳中的脂肪成分以脂肪球形式存在,形成三重膜系统包围甘油三酯核心的特殊结构,将包裹脂肪滴的三重膜的复杂结构体称为乳脂肪球膜(milkfatglobulemembrane,mfgm)。mfgm主要由胆固醇,甘油磷脂,鞘脂和蛋白质等组成,其中蛋白质占总乳蛋白质含量的1-4%和总小球质量的1%(1)。存在于mfgm中种类繁多的蛋白质成分在婴儿生长发育、抗感染以及免疫发育等方面具有重要作用,引起人们的广泛关注。其中,乳凝集素(lactadherin)和粘蛋白1(mucins简称muc1)是mfgm蛋白质中主要的两种蛋白质成分。乳凝集素,又称为乳脂肪球表皮生长因子8(milkfatglobuleegffactor8,mfge8),是一种分子量为46kda的糖基化膜蛋白(2)。乳凝集素氨基酸序列的n端结构域含有两个egf结构域,其中第二个egf结构域含有一个rgd(arg-gly-asp)基序,其结合整合素αvβ3/5促进细胞粘附以及诱导整合素介导的信号转导;而c端有两个盘基蛋白结构域,可以与凋亡细胞表面磷脂酰丝氨酸残基结合,介导吞噬细胞发挥作用(3,4),由于c端结构域与凝血因子v和viii具有同源性,乳凝集素同时也参与凝血过程,可抑制凝血酶原酶,x因子和viia等(5,6)。研究表明乳凝集素可能参与新生血管生成,并调节细胞粘附蛋白在平滑肌与动脉纤维相关的功能(7)。乳凝集素参与促进膳食甘油三酯的吸收和脂肪酸的细胞摄取,在与整合素αvβ3和αvβ5相互作用后,通过促进肠上皮甘油三酸酯水解酶活性进而调节肠上皮细胞中细胞质脂质小滴的水解(8,9)。乳凝集素与rgd结合整联蛋白α8β1结合,可控制肠道肌肉收缩的频率,降低肠道蠕动以促进营养吸收(10,11)。以乳凝集素为主的mfgm蛋白通过pi3k/akt/mtor/p70s6k信号途径促进c2c12细胞增殖(12)。这些研究提示我们通过母乳摄取乳凝集素可能对于婴幼儿胃肠道发育和营养吸收具有重要意义。此外,体外和体内研究表明,乳凝集素抑制轮状病毒结合并保护母乳喂养的儿童免于症状性轮状病毒感染(13)。乳凝集素也有助于在新生儿中建立肠屏障,预防新生儿坏死性小肠结肠炎(necrotizingenterocolitis,nec)(14)。乳凝集素也被证明与自身免疫性疾病系统性红斑狼疮有关(15),并可能帮助减轻新生儿败血症和肺损伤(16)。muc1是一种高分量的糖蛋白,结构复杂,由和心态和糖链组成,糖链占80%,二者以o型糖苷键项链。在muc1羧基末端,包括由72个氨基酸组成的胞内区、28个氨基酸组成的跨膜区和58个氨基酸组成的胞外区三部分。其中胞内段和跨膜段在不同种属间的结构具有高保守型,提示其重要的生物学功能。胞外段含有由20个氨基酸组成的串联重复序列,决定了muc1的空间结构特异性及免疫原性。muc1的主要生物学功能包括润滑、保护细胞、黏性维持、识别细胞、免疫调节等;此外,muc1肿瘤的发生与转移等方面都起到重要作用。
然而,由于乳凝集素和muc1均存在于mfgm中,不易分离,其所含有的脂肪成分对其定量测定造成极大干扰,因此使得对其含量的测量成为一个难题。此前,对mfgm蛋白质的定量多基于sds-page技术,如基于sds-page技术以及随后的考马斯亮蓝(cbb)染色进行分析,但此类方法受到蛋白质与染料的结合度的影响,例如糖蛋白会阻碍和cbb的结合,造成染色不良,此类方法难以对蛋白质进行绝对定量(17)。此后出现了对于研究技术的改良,如基于与电泳分离的蛋白带及其色氨酸含量进行相关的荧光测量(18)。除此之外,基于蛋白质组学技术的绝对定量技术也被使用进行mfgm的检测与定量。然而以上技术对于mfgm的检测具有难以普及和昂贵的缺陷。总体来说,以上技术通常用来评估mfgm蛋白质组的相对构成,而不适用于单个蛋白质的大规模样本检测。
此外,尽管现有技术中酶联免疫吸附测定已广泛用于定量多种母乳蛋白,但尚未有研究将其利用于mfgm蛋白质的定量分析。主要原因如下:
(1)mfgm蛋白质可能部分或者全部包埋在膜中,可能对于蛋白质的免疫识别造成困难。
(2)对样品进行处理的过程,可能造成mfgm蛋白质的丢失,而这种误差是不稳定的。
(3)mfgm对固相载体的结合能力难以评估,且同一mfgm上的蛋白质可能存在相互竞争关系。
(4)mfgm是包裹脂肪球的特殊结构,脂质的存在对于免疫检测也会产生一定影响。
综上所述,目前关于mfgm中蛋白质的定量分析仍是研究的空白,对mfgm蛋白质的定量分析有助于人们更加深入地了解母乳各组分的功能,以及母乳与婴儿生长发育之间的关系;同时也为配方奶粉及各类功能食品的配置提供科学依据。
因此,本发明目的是开发了一种酶联免疫吸附测定(elisa)的方法,用以测定母乳中乳凝集素或muc1的浓度。这对于母乳的深入研究具有重要意义。
关于本发明一种基于乳脂肪球膜特性的乳凝集素或粘蛋白1的elisa定量检测方法目前还未见报道。
技术实现要素:
本发明的第一个目的是针对现有技术的不足,提供一种基于乳脂肪球膜特性的乳凝集素或muc1蛋白的elisa定量检测方法。
本发明的第二个目的是针对现有技术的不足,提供如上所述方法的用途。
本发明的第三个目的是针对现有技术的不足,提供一种定量检测母乳中乳凝集素或muc1蛋白的试剂盒。
为实现上述第一个目的,本发明采取的技术方案是:
一种基于乳脂肪球膜特性的乳凝集素的elisa定量检测方法,所述检测方法是酶联免疫吸附测定法,包括步骤:
(1)采集母乳样本;
(2)对采集到的母乳样本预处理:使用
(3)对得到的全乳裂解液均质化后稀释,然后使用elisa试剂盒定量检测母乳样本中乳凝集素;
(4)取梯度浓度的标准品溶液,获得标准品溶液浓度的标准曲线;
(5)根据按照直线回归的方法拟合标准曲线,其拟合函数方程式为y=a+bx,根据标准曲线计算母乳样本中乳凝集素浓度;
所述检测方法不包括对母乳样本做离心处理。
优选地,所述的方法还包括对母乳样本做westernblot检测样本中乳凝集素表达水平。
优选地,步骤(1)中的母乳样本包括成熟乳和初乳。
优选地,步骤(2)中冰上裂解时间为20-40min;体积比为
优选地,母乳样本在westernblot检测前用5*sds上样缓冲液进行煮样,使用金属浴在90-110℃下处理5-10分钟。
优选地,步骤(4)中所述梯度浓度是:4000pg/ml,2000pg/ml,1000pg/ml,500pg/ml,250pg/ml,125pg/ml,62.5pg/ml,0pg/ml。
一种基于乳脂肪球膜特性的muc1蛋白的elisa定量检测方法,所述的方法同上。
优选地,所述的基于乳脂肪球膜特性的muc1蛋白的elisa定量检测方法步骤(4)中所述梯度浓度是:1000mu/ml,400mu/ml,160mu/ml,64mu/ml,25.6mu/ml,10.24mu/ml,4.10mu/ml,0mu/ml。
需要说明的是,测定乳凝集素和muc1所使用的的elisa试剂不同,pg/ml是质量浓度,pg代表质量;mu/ml是指活力浓度。两个蛋白浓度测定使用的试剂盒不一样,一个是用的质量浓度,一个是活力浓度。
为实现上述第二个目的,本发明采取的技术方案是:
如上所述的方法在奶粉配方研究中的应用。
如上所述的方法在制备定量检测母乳中乳凝集素或muc1蛋白的试剂盒中的应用。
为实现上述第三个目的,本发明采取的技术方案是:
一种定量检测母乳中乳凝集素或muc1蛋白的试剂盒,所述的试剂盒包括
需要说明的是,定量检测母乳中乳凝集素或muc1蛋白的试剂盒中仅存在的区别为:所使用的elisa检测试剂不同,即使用的酶标板上的抗体不一样,本发明使用的是商品化的试剂盒,其中,乳凝集素使用的是boster公司的试剂盒,货号:ek1201;muc1使用的是thermofisher公司,mucin1试剂盒,货号:ca15-3。
优选地,所述elisa试剂包括:(1)1xassaydiluentb:2ml原液+8ml去离子水;
(2)1xwashbuffer:20ml20xwashbuffer+380ml去离子水;
(3)1xbiotinylatedantibodyconcentrate:将biotinylatedantibodyreagent小瓶离心后加入100μl1xassaydiluentb,用移液器上下轻轻地混合(浓缩液可在4℃下保存5天),后根据用量再用1xassaydiluentb稀释80倍获得1x抗体;
(4)1xstreptavidin-hrpreagent:短暂离心streptavidin-hrpreagent,并在使用前上下吸管轻轻混合,根据用量使用1xassaydiluentb稀释200倍。(50ul+10ml即用即配)。
通过以上所述方法可实现对母乳中乳凝集素或muc1蛋白的定量检测。
优选地,所述mfge8的elisa试剂包括:(1)mfge8抗体工作液:根据每孔需要110ul(多)配制,应按1ul抗体原液加99ul抗体稀释液(使用前2h);
(2)abc工作液:根据每孔需要110ul(多)配制,应按1ul抗体原液加99ul抗体稀释液(使用前1h);
(3)1xwashbuffer:20ml20xwashbuffer+380ml去离子水。
本发明优点在于:
1、该方法用于定量检测产妇不同时期母乳中乳凝集素和muc1蛋白,高通量、准确率高率、尤其简化了检测步骤,低成本,且克服了由于mfgm蛋白质可能部分或者全部包埋在膜中,可能对于蛋白质的免疫识别造成困难的缺陷、会对mfgm蛋白质造成丢失的缺陷,减少了误差,对样本提前预处理进行裂解,消除了mfgm脂质等物质的存在对于免疫检测产生的影响。
2、该方法简化了实验步骤,实验结果表明在简化了实验步骤的前提下仍不会对结果产生不良影响,且该方法成本低、较基于与电泳分离的蛋白带及其色氨酸含量进行相关的荧光测量等方法不需要昂贵的设备、精确率相当,且能很好的应用于临床上,为奶粉的配方研究提供了科学依据。
附图说明
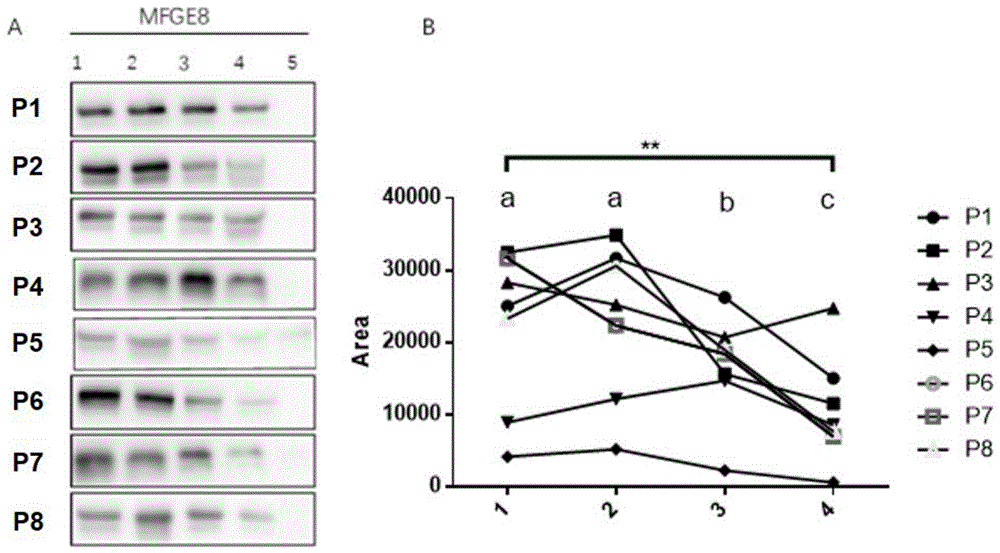
附图1是westernblot表征不同处理组乳凝集素的表达情况。图a和b中1代表全乳裂解液(
附图2是母乳中各组乳凝集素的浓度对比情况。a、全乳和乳清的乳凝集素含量对比;b使用
附图3是使用
附图4是westernblot表征不同处理组muc1的表达情况。图a和b中1代表wb;2代表why;3代表nlwb;4代表snlwb;5代表pnlwb。p代表不同产妇的母乳样本。如图b可见通过imagej对1-4组的灰度值进行比较。
附图5是母乳中各组muc1的浓度对比情况,a、全乳和乳清中的muc1差异;b、使用
附图6是使用
具体实施方式
下面结合具体实施方式,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明记载的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1乳凝集素的定量检测
1材料和方法
1.1母乳的采集与分装
随机选择在上海市浦南医院进行足月顺产或剖宫产的孕妇的母乳40例,所有入选产妇均为健康产妇,无传染性疾病或慢性疾病史如高血压,心脏病等且无孕期疾病史。所有入选产妇均签订知情同意书,并自愿参加研究。于上海浦南医院获得产妇母乳后,于2h内冰盒转运至实验室,并立即选取部分母乳经离心(4℃,3000g,10min)获得乳清成分。将全乳以及乳清分别分装并保存于-80℃直至使用,过程中保证样品均质化并避免反复冻融。
1.2主要试剂
1.3样品的处理
取相应例数的母乳,每例母乳包括3份100μl的全乳以及1份100μl的乳清。按照下述五个组别进行处理每例母乳:
1.3.1全乳裂解液(nlwb)组:将一份全乳样本中加入900μl
1.3.2全乳裂解液上清(snlwb)组:一份全乳样本加入900μlnaivelysisbuffer于冰上放置30min使充分裂解后,使用冷冻离心机在4℃条件下以12000r转速离心30min,使用针筒分离裂解后全乳的上清成分;
1.3.3全乳对照组(wb):一份全乳中加入900μl的pbs溶液;
1.3.4乳清对照组(why):于乳清样本中加入900μl的pbs溶液;
1.3.5沉淀组(pnlwb):将上述snlwb组中去除澄清成分后剩余的组分使用1ml的pbs溶液洗涤2次。尽量去除洗液以保留上层与沉淀的不溶物质。
1.4westernblot检测母乳中乳凝集素的表达水平
使用westernblot分析来自8例母乳样品中的5个组别中乳凝集素的表达水平。将第1至第4组(nlwb,snlwb,wb,why)的40μl样品与10μl的5*sds上样缓冲液进行混合,使用金属浴在100℃下处理5分钟。第5组取等量pnlwb,加入sds上样缓冲液混匀后100℃处理5分钟。使用来自invitrogennupage的预制聚丙烯酰胺凝胶制备胶板,上样后利用电泳仪,恒压120v电泳60min。电泳结束后以“三明治结构”在100v,60min进行转膜,封闭结束后使用1:1000浓度稀释的mfge8抗体(mab2767-sp,r&dsystem)进行孵育,4℃过夜,pbs洗涤三次,每次5分钟;后加入二抗后室温孵育两小时,pbs洗涤三次后进行ecl化学发光和曝光显影。
1.5elisa检测
使nlwb,snlwb,wb,why均质化后进行稀释;稀释1000倍,即总稀释倍数为10000倍。使用lactadherinelisa试剂盒(bosterbioek1201)。使用前,abc工作液和tmb应置于37℃平衡至少30min。于每孔添加100μl的标准液或者稀释样品,覆膜覆盖后在37℃下孵育1.5h;弃去溶液后不用洗涤;然后,向每个孔中加入100μl制备的mfge8抗体工作液,在覆膜覆盖后37℃孵育1小时;此时用洗液洗涤3次,每次应当浸泡1min;向每个孔中加入100μlabc工作液;在覆膜覆盖后37℃孵育30min;重复洗涤5次;每个孔中添加90μltmb底物,避光于37℃孵育20-25分钟;按每孔100μl添加终止液后应当于30分钟内进行检测。在450nm和550nm处使用酶标仪上测量吸光度,从450nm值中减去550nm值,以校正微孔板中的光学缺陷。
1.6统计分析
应用graphpadprism6软件分析作图,应用ibmspss软件19.0(ibmcorp.,armonk,ny)分析数据的统计显着性。配对t检验用于评估两组之间均值之间的差异;方差分析评估三组及以上组别之间的差异。当p<0.05时,数据被认为有显着差异。
2结果
2.1westernblot表征样品的乳凝集素成分
通过westernblot进行表征(图1)。乳凝集素在母乳中以mfgm蛋白质的方式存在。使用
如图1a所示可见pnlwb条带几乎不可见,说明不溶物质中所含的乳凝集素几经于无,提示
如图1b对westernblot的结果进行灰度值分析,并用方差分析检验各组差异性;并用事后两两比较(lsd)检验每两组之间的差异。方差分析提示四组灰度值不全相同(p<0.05)。其中nlwb和snlwb组条带无显著差异(p=0.959);nlwb和snlwb组与wb组灰度值有差异(p=0.032;p=0.036);why组与wb组有显著差异(p<0.024)。结果表明相对于乳清,使用裂解液和全乳都能获得更好的结果。因此如果直接去除mfgm成分,将对母乳中的乳凝集素造成损失。而使用裂解液的nlwb和snlwb组可以获得更佳的检测结果,提示mfgm的复杂结构可能干扰其蛋白质组分的定量分析。但nlwb和snlwb条带无显著差异(p>0.99),但由于母乳中没有内参作为对照,westernblot存在误差,本研究将进一步通过elisa进行验证。
2.2母乳中乳凝集素的浓度
接着,我们进一步利用elisa的方法对wb和why中的乳凝集素进行了验证。结果表明,与westernblot的结果相同,全乳中乳凝集素的水平要显著高于乳清(t=4.589,p<0.05),提示我们,利用乳清检测乳凝集素不能代表乳凝集素的实际浓度。
然后,我们又对nlwb和snlwb的乳凝集素进行了对比检测,发现二者之间乳凝集素的检测没有显著差异(t=0.2196,p=0.8324)。在加入
2.3naivelysisbuffer对乳凝集素检测的影响
经过2.2结果证明,elisa检测必须使用全乳样品,而加入
但
3讨论
elisa是一种操作简单、快速、敏感性高、特异性强的蛋白质检测方法。虽然超高效液相色谱(uhplc)与串联质谱联用(ms/ms)是一种非常准确的技术,可以替代诸如elisa进行定量,但elisa的应用仍然是具有优势的:elisa是一种高通量方法,样品不需要任何特殊制备。此外,用于uhplc-ms/ms的设备以及内标和试剂使该技术比elisa昂贵得多。相反,由于仅需要酶标仪和基本的实验室材料,可以在大多数实验室中进行elisa检测。然而,mfgm的特殊结构导致mfgm中的蛋白质很难利用elisa的方法进行检测。
为了使elisa检测具备可能性,必须解决mfgm结构和脂质组分带来的影响。使用裂解液可以获得溶于乳清的乳凝集素,但不同的裂解液使用会带来蛋白质溶解度和去污剂的问题。我们选择了一种
其次要考虑的是,裂解后的母乳导致脂质从膜中溢出,脂质以及裂膜后产生的不溶物质的存在都可能影响elisa检测的准确度。据此,我们将裂解后的母乳通过离心形成nlwb和snlwb对比组,结果证明其中不溶物质和脂质的存在对于elisa的检测没有影响。这可能是由于裂解液和elisa试剂盒共同对原样本进行了大比例的稀释以符合elisa可测浓度范围,使得实际脂质和不溶物质的影响微乎其微。
最后,为了验证
结合westernblot和elisa的双重验证,证明了基于
通过本研究开发的elisa方案,我们可以广泛计算不同产妇在不同时期的乳凝集素的浓度。研究所需样品量也比较少,因此具有广泛运用的意义。
作为母乳中重要的免疫成分,乳凝集素直接联系母乳状态与新生儿发育两方面。我们的研究对于乳凝集素的临床转化和mfgm其他蛋白质的研究都具有推动意义。
实施例2muc1蛋白的定量检测
1主要试剂
muc1elisa试剂盒(thermoehmuc1);nativelysisbuffer(abcamab156035);tbst;5*sds上样缓冲液;抗体稀释液;runningbuffer;脱脂奶粉;一抗(ab1):抗muc1抗体(d908k,cellsignaling)。
2主要耗材
一次性tip头;吸水纸;1.5/2mlep管;摇床、孵育盒、移液管、移液枪,滤纸,硝酸纤维素(nc)膜。
3实验方法
3.1母乳样本的采集和储存
3.1.1母乳样本的采集
(1)由专业医务人员进行宣教工作并签属知情同意书;1名经过培训的医务人员进行母乳采集工作;
(2)于产妇生产后于产妇分娩后产后42天随访时使用泵采集母乳一次。先用灭菌水冲洗乳头,采集一侧乳房全部乳汁。
(3)将采集母乳置于无菌离心管内,立刻放入冰盒转运至实验室。
3.1.2母乳样本的分离和储存
(1)将部分母乳分装于1.5mlep管中,将分装后母乳标记编号、姓名和时间,放置于-80℃冰箱进行保存;
(2)将另一部分母乳进行离心,4℃,3000g,10min;
(3)吸取上层脂肪与乳清层于1.5mlep管中,并分离下层沉淀;
(4)将下层沉淀加入1mlpbs进行离心,14000r,5min;并用pbs洗涤2次;
(5)根据来源母乳的体积计数细胞,并以cell/ml的单位进行记录;
(6)在沉淀中加入1ml的trizol,使沉淀全部溶解后静置5min,保存于-80℃冰箱中;
(7)将装有脂肪与乳清的成分管再次进行离心,4℃,3000g,10min;
(8)使用针筒小心吸取乳清层,并将乳清进行分装保存,-80℃,以备后用;
(9)使用针筒将脂肪层下残余液体尽量吸取干净后进行保存,-80℃,以备后用。
3.1.3母乳样本的储存与使用
所有母乳放置于-80℃保存,合理分装,保证样品均质化。每次测试取一份样品以避免反复冻融。
3.2mfgm蛋白质elisa检测的方法学研究
3.2.1样品的处理
(1)材料:每份母乳包括分装出3份100ul的全乳以及1份100ul的乳清样本;并建立5个不同对比组:
全乳裂解液(nlwb)组:将一份全乳样本中加入900ul
全乳裂解液上清(snlwb)组:一份全乳样本加入900ulnaivelysisbuffer于冰上放置30min使充分裂解后,使用冷冻离心机在4℃条件下以12000r转速离心30min,使用针筒分离裂解后全乳的乳清成分;
全乳对照组(wb):一份全乳中加入900ul的pbs溶液;
乳清对照组(why):于乳清样本中加入900ul的pbs溶液:
沉淀组(pnlwb):将上述snlwb组中去除澄清成分后剩余的组分使用1ml的pbs溶液洗涤2次。尽量去除洗液以保留上层与沉淀的不溶物质。
3.2.2westernblot检测母乳中muc1的蛋白质表达水平
(1)上样前准备
选择8份随机样本,按照上述要求分为5组。
将第1至第4组(nlwb,snlwb,wb,why)的40μl样品与10μl的5*sds上样缓冲液进行混合,使用金属浴在100℃下处理5分钟。第5组取等量pnlwb,加入sds上样缓冲液混匀后100℃处理5分钟。
(2)westernblot检测muc1的蛋白质水平
用电泳仪120v恒压电泳60min。电泳结束后以“三明治结构”在200a,3h进行转膜,封闭结束后使用1:1000浓度稀释的muc1抗体进行孵育,4℃过夜,将洗好的nc膜加入二抗,室温孵育两小时,洗涤后进行ecl化学发光和曝光显影。
(3)imagej进行灰度值分析
3.2.3elisa检测母乳中muc1的浓度
使nlwb,snlwb,wb,why均质化后进行稀释;进行muc1的elisa检测。稀释倍数及elisa检测方法如下。
3.3muc1的elisa检测
3.3.1试剂配制
(1)1xassaydiluentb:2ml原液+8ml去离子水。
(2)1xwashbuffer:20ml20xwashbuffer+380ml去离子水。
(3)1xbiotinylatedantibodyconcentrate:将biotinylatedantibodyreagent小瓶离心后加入100μl1xassaydiluentb,用移液器上下轻轻地混合(浓缩液可在4℃下保存5天),后根据用量再用1xassaydiluentb稀释80倍获得1x抗体。
(4)1xstreptavidin-hrpreagent:短暂离心streptavidin-hrpreagent,并在使用前上下吸管轻轻混合,根据用量使用1xassaydiluentb稀释200倍。(50ul+10ml即用即配)
3.3.2样品处理
(1)以体积比为
(2)标准曲线:短暂离心一瓶冻干的标准品。加入400μlassaydiluenta(用于血清/血浆样品)到冻干的标准小瓶中以制备100u/ml标准。轻轻混合将粉末彻底溶解。从样品瓶中加入5μlca15-3标准品(100u/ml)。将冻干的标准品放入装有495μlassaydiluenta的试管中,以制备1,000mu/ml的标准溶液。吸管每个管中加入300μlassaydiluenta。使用1,000mu/ml标准溶液进行对倍稀释。形成1000mu/ml,400mu/ml,160mu/ml,64mu/ml,25.6mu/ml,10.24mu/ml,4.10mu/ml,0mu/ml的标准曲线。
3.3.3实验步骤
(1)使用前,将所有试剂和样品置于室温(18-25℃)。
(2)每孔添加100μl的标准液或者稀释样品;覆膜覆盖后在室温下孵育2.5小时。
(3)丢弃溶液,并用1xwashbuffer(300μl)洗涤4次。并用干净的吸水纸控干水份。
(4)向每个孔中加入100μl制备的1xbiotinylatedantibodyconcentrate;在室温下孵育1小时并轻轻摇动。
(5)按照步骤3重复洗涤。
(6)向每个孔中加入100μl1xstreptavidin-hrpreagent;孵育45分钟并在室温下轻轻摇动。
(7)按照步骤3重复洗涤。
(8)向每个孔中添加100μltmb底物。避光,于室温轻轻摇动孵育30分钟。
(9)向每个孔加入100ul终止液。
(10)必须在停止反应后30分钟内进行测试。在450nm和550nm处使用酶标仪上测量吸光度,从450nm值中减去550nm值,以校正微孔板中的光学缺陷。如果没有550nm,则仅在450nm处测量吸光度。
3.3.4计算样品浓度
根据按照直线回归的方法拟合标准曲线,其拟合函数方程式为y=a+bx,根据标准曲线计算母乳样本浓度。
3.3.5统计学分析
使用spss19.0进行分析,以α=0.05作为检验标准。使用student’t检验进行两组之间显著性差异的分析,使用方差分析检验多组样本均数之间的差异。使用graphpadprism6进行作图。
4结果
4.1通过westernblot表征母乳中muc1
如图4a所示pnlwb(条带5)组条带几乎不可见,说明不溶物质中所含的muc1几经于无,提示
对westernblot的结果进行灰度值分析,并用方差分析检验各组差异性;并用事后两两比较(lsd)检验每两组之间的差异。方差分析提示四组灰度值不全相同(p<0.05)。其中nlwb和snlwb组条带无显著差异(p=0.775);nlwb和snlwb组与wb组灰度值有差异(p<0.001;p<0.001);why组与wb组有显著差异(p<0.001)。结果表明相对于乳清,使用裂解液和全乳都能获得更好的结果,而使用裂解液得nlwb和snlwb组可以获得更佳的检测结果,提示mfgm的复杂结构可能干扰其蛋白质组分的定量分析。但nlwb和snlwb条带无显著差异(p>0.99),但由于母乳中没有内参作为对照,westernblot存在误差,本研究将进一步通过elisa进行验证。
4.2elisa检测不同母乳组分中muc1的浓度
4.2.1elisa检测muc1
通过elisa检测发现wb组muc1的水平要显著高于why组(t=2.763,p<0.05);全乳中muc1的浓度要高于利用乳清检测的muc1的浓度。
nlwb和snlwb的muc1的浓度没有显著差异(t=1.637,p=0.1457);在加入
4.2.2大样本验证naivelysisbuffer对elisa检测muc1的影响
根据上述结果,我们取消了裂解后离心的步骤。对40份母乳使用
5讨论
由于muc1存在于母乳mfgm中,使得定量测定成为难题。因此我们开发了一种新的检测方式,对全乳中muc1进行定量分析。
为了使elisa检测具备可能性,必须解决mfgm结构和脂质组分带来的影响。使用裂解液可以使mfgm蛋白质具备可检测性,但裂解液也带来蛋白质溶解度和去污剂的问题。我们选择的
为进一步证明
最后,为了验证
通过本研究开发的elisa方案,我们可以广泛计算不同产妇在不同时期的乳凝集素的浓度。这样可以通过较小的样品量获得数据。具有广泛运用的意义。迄今为止,很少有研究估计母乳中mfgm蛋白的浓度,我们的研究方法去除了乳脂肪球膜的影响。而由于乳凝集素使用elisa检测所需的稀释程度,使得乳脂对该方案的研究微乎其微。
本研究是首次对人母乳中mfgm蛋白质进行检测,得到的结果极具参考性。
参考文献:
1.liaoy,alvarador,phinneyb,
2.matherih.areviewandproposednomenclatureformajorproteinsofthemilk-fatglobulemembrane.journalofdairyscience.2000;83(2):203-47.
3.adam,r.,m.a.ensslin,andb.d.shur,sed1/mfg-e8:abi-motifproteinthatorchestratesdiversecellularinteractions.journalofcellularbiochemistry,2010.106(6):p.957-966.
4.hanayama,r.,etal.,identificationofafactorthatlinksapoptoticcellstophagocytes.nature,2002.417(6885):p.182-187.
5.kaminska,a.,f.j.enguita,ande.l.stepien,lactadherin:anunappreciatedhaemostasisregulatorandpotentialtherapeuticagent.vasculpharmacol,2018.101:p.21-28.
6.zhou,y.,etal.,lactadherinpromotesmicrovesicleclearancetopreventcoagulopathy.
7.silvestre,j.s.,etal.,lactadherinpromotesvegf-dependentneovascularization.natmed,2005.11(5):p.499-506.
8.khalifeh-soltani,a.,etal.,mfge8promotesobesitybymediatingtheuptakeofdietaryfatsandserumfattyacids.natmed,2014.20(2):p.175-83.
9.khalifeh-soltani,a.,etal.,mfge8regulatesenterocytelipidstoragebypromotingenterocytetriglyceridehydrolaseactivity.jciinsight,2016.1(18):p.e87418.
10.khalifeh-soltani,a.,etal.,α8β1integrinregulatesnutrientabsorptionthroughanmfge8-ptendependentmechanism.elife,2016.5:p.e13063.
11.khalifeh-soltani,a.,etal.,alpha8beta1integrinregulatesnutrientabsorptionthroughanmfge8-ptendependentmechanism.elife,2016.5.
12.li,h.,etal.,milkfatglobulemembraneproteinpromotesc2c12cellproliferationthroughthepi3k/aktsignalingpathway.intjbiolmacromol,2018.114:p.1305-1314.
13.ng,t.b.,etal.,antiviralactivitiesofwheyproteins.applmicrobiolbiotechnol,2015.99(17):p.6997-7008.
14.shen,h.,etal.,roleoflactadherininintestinalbarrierintegrityinexperimentalneonatalnecrotizingenterocolitis.jcellbiochem,2019.120(12):p.19509-19517.
15.kishi,c.,s.i.motegi,ando.ishikawa,elevatedserummfg-e8levelispossiblyassociatedwiththepresenceofhigh-intensitycerebrallesionsonmagneticresonanceimaginginpatientswithsystemiclupuserythematosus.jdermatol,2017.44(7):p.783-788.
16.hansen,l.w.,etal.,deficiencyinmilkfatglobule-epidermalgrowthfactor-factor8exacerbatesorganinjuryandmortalityinneonatalsepsis.journalofpediatricsurgery,2017.52(9):p.1520.
17.rombaut,r.,v.dejonckheere,andk.dewettinck,microfiltrationofbutterserumuponcaseinmicelledestabilization.journalofdairyscience,2006.89(6):p.1915-1925.
18.holzmüller,w.andu.kulozik,quantificationofmfgmproteinsinbuttermilkandbutterserumbymeansofastainfreesds-pagemethod.journaloffoodcompositionandanalysis,2016.49:p.102-109.
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明原理的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!