一种荧光量子点纳米探针、其制备方法及其检测循环肿瘤细胞的应用
1.本发明属于生物检测技术领域,具体涉及一种荧光量子点纳米探针、其制备方法及其检测循环肿瘤细胞的应用。
背景技术:
2.循环肿瘤细胞是指由原发肿瘤或者转移瘤脱离基底后进入外周血中的各类肿瘤细胞的统称。循环肿瘤细胞自1869年被澳大利亚科学家thomas ashworth首次在癌症患者外周血中发现以来,受到了科学家们的广泛关注。越来越多的研究表明:循环肿瘤细胞与癌症的转移具有密切联系,可作为肿瘤转移和复发的标志物。因此,监测循环肿瘤细胞的数量和变化趋势,对于监测肿瘤变化趋势、评估治疗效果、早期诊断和个性化治疗等方面具有重大意义。但是,循环肿瘤细胞在血液中的浓度很低,而且血液环境复杂,其他细胞和生物分子的背景荧光对检测有较大干扰,导致对循环肿瘤细胞进行直接检测具有极大挑战。因此,建立高灵敏度、高信噪比和高稳定性的循环肿瘤细胞检测方法是开展相关研究的关键。
3.通过近几十年的研究,科学家们开发了许多基于不同信号模式的循环肿瘤细胞的检测方法,如电化学法、电感耦合等离子体质谱法、拉曼光谱法、比色法和荧光法等。其中大多数方法无法避免血液中复杂成分的干扰,而且检测需要经过离心分离、洗涤、富集和信号放大等步骤,不仅操作繁琐耗时,还会造成实际检测结果误差偏大等问题。荧光检测由于具有快速反应、无破坏性、实时监测和成本低廉等优点,是循环肿瘤细胞检测方法中一个备受关注的领域。
4.与可见-近红外一区荧光相比,近红外二区荧光(950-1700nm)由于其组织穿透更深、光散射和组织吸收更少,从而极大地提高了检测的信噪比和空间分辨率,而且近红外光对生物组织伤害更小,因此,近红外二区荧光在检测和成像等生物应用方面具有明显的优势。近些年来,科学家们对近红外二区荧光材料进行了大量研究,目前,主要的近红外二区荧光材料包括稀土掺杂纳米晶、碳纳米管、贵金属单质、有机染料和量子点等。稀土掺杂纳米晶具有丰富的4f跃迁能级,但是存在激发波长特定、吸收截面小的问题;碳纳米管和贵金属单质具有良好的生物相容性,但由于量子产率低、成本较高限制了其发展;有机染料发光强度较好,但存在光稳定性差、生物毒性高的缺点。与之对比,量子点具有发射波长可调、激发范围宽、吸收截面大和量子产率高等优势,是目前被广泛研究和普遍看好的一类荧光纳米探针。因此,近红外二区荧光量子点是直接检测循环肿瘤细胞的一类理想材料。
5.然而,目前主要研究的近红外二区量子点为ii-vi族和iv-vi族半导体,如cdse、cdte和pbse等,虽然具有较好的光学性质,但是其组分中的重金属元素(cd
2+
和pb
2+
等)不适合进行生物检测等应用。因此,开发一类无毒高效的近红外二区荧光量子点对直接检测循环肿瘤细胞至关重要。
技术实现要素:
6.本发明提供一种荧光量子点纳米检测探针,其包括抗体修饰的水溶性量子点;
7.其中,所述抗体可以与循环肿瘤细胞表面标记物进行特异性结合,例如可以为抗epcam抗体、抗egfr抗体、抗细胞角蛋白ck-8、ck-18和ck-19抗体、抗肿瘤细胞糖蛋白(tag)抗体或抗乳球蛋白抗体等;示例性为抗epcam抗体;
8.所述水溶性量子点选自近红外二区荧光水溶性无毒量子点,例如可以选自水溶性的cuinse2、cuinte2、aginse2、aginte2、ag2s、ag2se和ag2te等量子点中的至少一种,示例性为水溶性cuinse2量子点。
9.根据本发明的实施方案,所述荧光水溶性量子点的表面无有机配体,例如所述有机配体可以为油酸、油胺、十二硫醇和三辛胺等中的至少一种;示例性的,所述有机配体为油酸。
10.根据本发明的实施方案,所述荧光量子点纳米检测探针的平均粒径为1-30nm,例如10-20nm,示例性为12nm、15nm、18nm。
11.根据本发明的实施方案,所述荧光为808nm激发下的近红外二区(950-1700nm)发射荧光。
12.本发明还提供所述荧光量子点纳米检测探针的制备方法,包括如下步骤:利用两亲性分子合成水溶性量子点,加入活化剂活化,然后使用抗体修饰活化后的水溶性量子点,得到所述荧光量子点纳米检测探针。
13.优选地,所述两亲性分子为二硬脂酰基磷脂酰乙醇胺-聚乙二醇-羧基(dspe-peg-cooh)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇-氨基(dspe-peg-nh2)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(dspe-peg)、巯基丙酸(mpa)、谷胱甘肽(gsh)或叶酸(fa)等,根据本发明示例性的实施方案,所述两亲性分子为dspe-peg-cooh。
14.优选地,所述活化剂可以为碳二亚胺(edc)、n-羟基琥珀酰亚胺(nhs)和二甲基乙酰胺(dmac)中的至少一种;示例性地,所述活化剂为edc和nhs。
15.根据本发明的实施方案,所述水溶性量子点的合成方法,可以采用本领域已知的各种改性量子点材料的方法,例如酸洗法、配体交换法或配体连接法;根据本发明示例性的实施方案,所述合成方法为配体连接法。例如,将油溶性量子点加入无水乙醇中进行沉淀,然后加入氯仿和两亲性分子,搅拌使其充分交联,去除有机溶剂,再加入去离子水超声溶解,得到所述水溶性量子点。
16.根据本发明的实施方案,所述活性剂活化的过程在ph=4.5-7.2的第一缓冲溶液中进行;例如,所述第一缓冲溶液可以为mes缓冲液、pbs缓冲液、磷酸氢二钠
–
柠檬酸缓冲液、柠檬酸
–
氢氧化钠-盐酸缓冲液和磷酸二氢钾
–
氢氧化钠缓冲液中的至少一种;示例性地,所述缓冲溶液为ph 5.0-6.0的mes缓冲液,例如ph 5.6的mes缓冲液。
17.优选地,所述活化过程包括:将所述水溶性量子点和活化剂加入ph=4.5-7.2的第一缓冲液中,室温搅拌,离心。
18.优选地,所述水溶性量子点和第一缓冲液的重量体积比(mg/ml)为(1-6):1,例如(3-5):1,示例性为4:1。
19.优选地,所述水溶性量子点和活化剂的重量比为1:(0.5-3),例如1:(1-2),示例性为1:1.25。
20.优选地,所述搅拌的时间为10-30min,例如20min。
21.优选地,所述离心为高速离心。例如,转速可以为15000-30000rpm,例如20000-25000rpm,示例性为21000rpm。
22.根据本发明的实施方案,所述抗体修饰的方法可以采用本领域已知的各种抗体修饰方法,例如静电吸附法和化学配位法;根据本发明示例性的实施方案,所述方法为化学配位法。例如,将活化后的产物加入ph=7.0-8.0的第二缓冲液中,然后加入所述抗体,混合均匀,低温环境下反应,去离子水洗涤,将洗涤后的产物分散于超纯水中,得到所述荧光量子点纳米检测探针。
23.优选地,所述第二缓冲液为pbs缓冲液、巴比妥钠-盐酸缓冲液或tris
–
盐酸缓冲液等。示例性为,ph7.4的pbs缓冲液。
24.优选地,所述抗体与所述第二缓冲液的体积比为1:(300-800),例如1:(400-600),示例性为1:500。
25.优选地,所述水溶性量子点与所述第二缓冲液的重量体积比(mg/ml)为(0.5-6):1,例如(1-5):1,示例性为4:1。
26.优选地,所述低温环境为2-6℃,例如3-5℃,示例性为4℃。
27.优选地,所述低温环境下反应的时间为1-4h,例如1.5-3h,示例性为2h。
28.根据本发明的实施方案,所述荧光量子点纳米检测探针的制备方法包括如下步骤:
29.a)利用两亲性分子合成水溶性量子点,将所述水溶性量子点和活化剂加入ph=4.5-7.2的第一缓冲液中,室温搅拌活化,离心,得到活化后的水溶性量子点;
30.所述两亲性分子为二硬脂酰基磷脂酰乙醇胺-聚乙二醇-羧基(dspe-peg-cooh)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇-氨基(dspe-peg-nh2)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇(dspe-peg)、巯基丙酸(mpa)、谷胱甘肽(gsh)或叶酸(fa);
31.优选地,所述活化剂为碳二亚胺(edc)、n-羟基琥珀酰亚胺(nhs)和二甲基乙酰胺(dmac)中的至少一种;
32.b)将活化后的水溶性量子点加入ph=7.0-8.0的第二缓冲液中,然后加入抗体,混合均匀,低温环境下反应,去离子水洗涤,将洗涤后的产物分散于超纯水中,得到所述荧光量子点纳米检测探针;
33.所述第一缓冲液和第二缓冲液具有如上文所述的含义。
34.根据本发明示例性的方案,所述荧光量子点纳米检测探针为cuinse2量子点荧光纳米检测探针,其制备方法包括如下步骤:
35.a)将油溶性cuinse2量子点加入无水乙醇中进行沉淀,加入氯仿和dspe-peg-cooh,搅拌充分交联,旋蒸去除有机溶剂,再加入去离子水超声溶解,得水溶性cuinse2量子点;
36.b)取上述水溶性cuinse2量子点,溶于ph为4.5-7.2的第一缓冲液中,加入碳二亚胺(edc)和n-羟基琥珀酰亚胺(nhs),混合均匀,用去离子水离心洗涤,溶于ph为7.0-8.0的第二缓冲液中,然后加入epcam抗体,混合均匀,低温环境下反应,再用去离子水离心洗涤,溶解于超纯水中,得到所述cuinse2量子点纳米检测探针。
37.本发明还提供由上述方法制备得到的荧光量子点纳米检测探针。
38.本发明还提供所述荧光量子点纳米检测探针在制备检测循环肿瘤细胞的试剂盒中的应用。
39.本发明还提供包含所述荧光量子点纳米检测探针的试剂盒。
40.根据本发明的实施方案,所述试剂盒可用于检测循环肿瘤细胞。
41.根据本发明的实施方案,所述循环肿瘤细胞是对所述荧光量子点纳米检测探针中的抗体(例如抗epcam抗体、抗egfr抗体、抗细胞角蛋白ck-8、ck-18和ck-19抗体、抗肿瘤细胞糖蛋白(tag)抗体或抗乳球蛋白抗体等)具有特异性亲和力的癌细胞,例如乳腺癌(mcf-7)细胞、鼻咽癌细胞、结肠直肠癌细胞、卵巢癌细胞或者口腔癌细胞;示例性地,所述循环肿瘤细胞为mcf-7细胞。
42.根据本发明的实施方案,所述纳米检测探针或包含其的试剂盒用于检测来自生物体的血液、细胞悬浮液、胸水、腹水、脑脊液中的一种的循环肿瘤细胞的数目。
43.本发明还提供循环肿瘤细胞的检测方法,包括如下步骤:将含有循环肿瘤细胞的待测样品与所述荧光量子点纳米检测探针混合后,测定发光强度,计算待测样品循环肿瘤细胞的数目。优选地,所述待测样品循环肿瘤细胞的数目通过代入循环肿瘤细胞数目依赖型标准曲线计算得到。
44.根据本发明的实施方案,所述含有循环肿瘤细胞的待测样品为来自生物体的血液、细胞悬浮液、胸水、腹水和脑脊液中的一种;根据本发明示例性的实施方案,所述待测样品为血液。
45.根据本发明的实施方案,所述待测样品与所述荧光量子点纳米检测探针的重量体积比(mg/ml)为(0.1-1.0):1,例如(0.2-0.5):1,示例性为0.3:1。
46.根据本发明的实施方案,所述循环肿瘤细胞数目依赖型标准曲线通过以下步骤获得:
47.1)首先用包被液将捕获探针稀释,然后加入固相载体中进行固定,再用封闭液将所述捕获探针封闭;
48.2)配制含有不同数目循环肿瘤细胞的标准样品;
49.3)绘制所述循环肿瘤细胞数目依赖型标准曲线。
50.优选地,将所述含有不同数目循环肿瘤细胞的标准样品加入所述固相载体,孵育,洗涤,再加入所述荧光量子点纳米检测探针,孵育,洗涤,然后检测发光强度。以循环肿瘤细胞数目为横坐标,以荧光强度为纵坐标,绘制标准曲线。
51.根据本发明的实施方案,所述荧光量子点纳米检测探针具有如上文所述的含义,其为循环肿瘤细胞表面标记物对应的抗体修饰的近红外二区荧光水溶性无毒量子点,使用该纳米检测探针能提高检测探针与循环肿瘤细胞结合的特异性和稳定性,降低检测的假阳性和假阴性。
52.优选地,所述捕获探针为循环肿瘤细胞高表达抗原所对应的抗体,捕获探针与修饰近红外二区荧光水溶性无毒量子点所用抗体相同或不同,独立地选自本领域已知的可与循环肿瘤细胞表面标记物进行特异性结合,可以为单克隆抗体或多克隆抗体的任一种,例如抗epcam抗体、抗egfr抗体,抗细胞角蛋白ck-8、ck-18和ck-19抗体、抗肿瘤细胞糖蛋白(tag)抗体或抗乳球蛋白抗体等;根据本发明示例性的实施方案,所述抗体为抗epcam抗体。
53.根据本发明的实施方案,步骤1)中,所述固相载体可以是检测领域中已知的各种
固相载体,例如磁性微球、微孔板、高分子微球、金箔或硝酸纤维素膜等;根据本发明示例性的实施方案,所述固相载体为96微孔板。
54.优选地,所述固定可以通过共价偶联、静电吸附或物理吸附等方式固定,根据本发明示例性的实施方案,所述捕获探针通过共价偶联的方式固定于固相载体上。
55.优选地,所述捕获探针上含有各种化学反应性基团,例如氨基、羧基、酰胺基等,可以将捕获探针共价偶联到固相载体上。根据本发明示例性的实施方案,所述化学反应性基团为捕获探针上5’端的氨基。
56.根据本发明的实施方案,所述包被液为碳酸盐缓冲溶液,例如ph为9-10的碳酸盐缓冲溶液,示例性为ph为9.6的碳酸盐缓冲溶液。
57.根据本发明的实施方案,由包被液稀释后的捕获探针的浓度为5-30μg/ml,例如10-20μg/ml,示例性为10μg/ml。
58.根据本发明的实施方案,步骤1)中,所述封闭液用于封闭掉捕获探针上未反应的化学基团,降低后续检测中可能出现的假阳性。优选地,所述封闭液为用碳酸盐缓冲液(例如其浓度为0.05-0.3mol/l,示例性为0.1mol/l)配制的牛血清白蛋白(bsa)溶液(浓度为1-3%w/v,示例性为2%w/v)。
59.根据本发明的实施方案,步骤2)中,所述含有不同数目循环肿瘤细胞的标准样品可以为含有1-100000个循环肿瘤细胞的细胞悬液,示例性为含有10-50000个mcf-7的细胞悬液。
60.根据本发明的实施方案,步骤3)中所述孵育的温度可以选自30~50℃,优选地,所述孵育的温度选自35~40℃,示例性的,所述孵育的温度为37℃。优选地,所述孵育的时间可以选自60~240min,优选地,所述孵育的时间选自90~150min;示例性的,所述孵育的时间为120min。
61.根据本发明示例性的实施方案,所述检测方法包括如下步骤:向所述待测样品中加入所述固相载体,孵育,洗涤,再加入所述荧光量子点纳米检测探针,孵育,洗涤,然后检测发光强度;代入步骤3)所绘制的肿瘤细胞数目依赖型标准曲线,算出待测样品循环肿瘤细胞数目。
62.优选地,所述孵育的温度和时间如上文所述。
63.本发明的有益效果在于:
64.本发明提供了一种基于近红外二区荧光无毒量子点纳米探针、其制备方法以及用于检测循环肿瘤细胞的应用。本发明的纳米探针具有如下优点:1)与可见-近红外一区发射的荧光探针相比,所述检测探针的近红外二区荧光具有更深的组织穿透,更少的光散射和组织吸收,从而具有很高的灵敏度和抗干扰能力,可用于复杂血液体系中循环肿瘤细胞的直接检测;2)采用抗体作为捕获探针,利用抗原-抗体特异性结合,对循环肿瘤细胞具有良好的识别能力和稳定性,反应迅速、灵敏度高、抗干扰力强;3)循环肿瘤细胞不需要经过各种工具酶以及复杂的离心富集过程,也不需要对探针信号进行繁琐的放大过程,只需要简单混合和直接检测即可,操作十分简便;4)所述量子点材料性质稳定、发光效率高、比表面积大、可修饰性强、成本低廉且不含重金属元素,符合绿色化学理念,具有宽激发和宽发射的特点,具有广泛的实用性。
附图说明
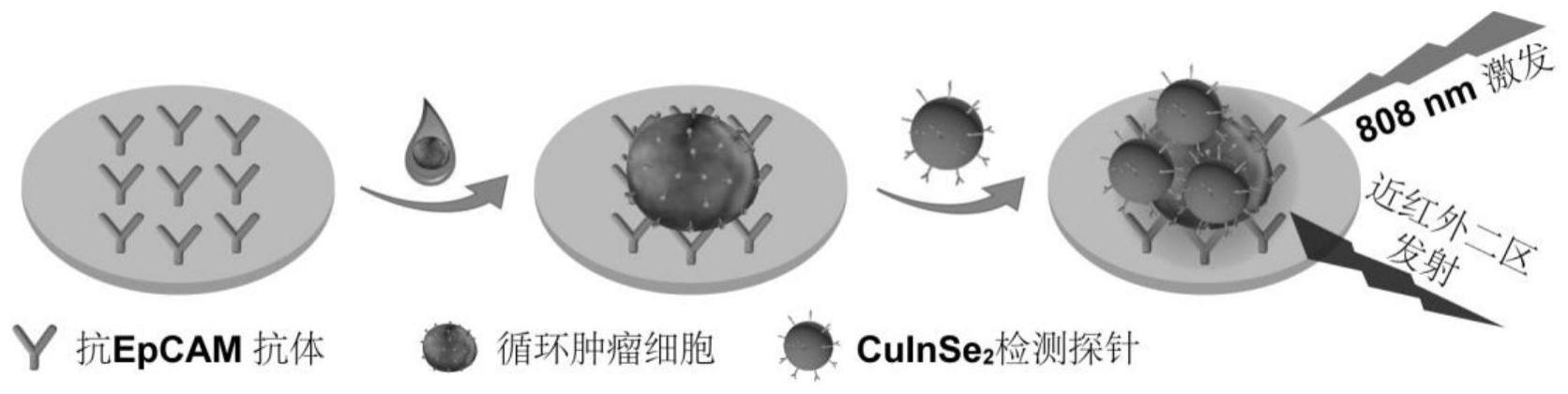
65.图1示出了本发明实施例1所述的循环肿瘤细胞的检测原理示意图。
66.图2示出了本发明制备例1所述cuinse2近红外二区荧光量子点纳米探针的合成示意图。
67.图3示出了本发明制备例1所述水溶性cuinse2量子点纳米探针的透射电镜图。
68.图4示出了本发明制备例1所述cuinse2量子点检测探针的水合粒径统计图。
69.图5示出了实施例1所述cuinse2量子点检测探针对不同数目的mcf-7循环肿瘤细胞在pbs标准液中的荧光响应曲线。
70.图6示出了实施例1所述cuinse2检测探针在pbs体系样品中,荧光强度与mcf-7循环肿瘤细胞数目依赖型标准曲线。
71.图7示出了实施例2所述的cuinse2量子点检测探针在在pbs标准液中,对不同类型循环肿瘤细胞荧光响应柱状图。
72.图8示出了实施例3所述cuinse2量子点检测探针在复杂血液体系样品中,对不同数目mcf-7循环肿瘤细胞的荧光响应曲线。
73.图9示出了实施例3所述cuinse2检测探针在复杂血液体系样品中,荧光强度与mcf-7循环肿瘤细胞数目依赖型标准曲线。
具体实施方式
74.下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
75.除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
76.部分仪器信息如下:
77.荧光酶标仪:爱丁堡公司,fls980荧光光谱仪;
78.透射电子显微镜:日本电子株式会社,jeol-2010透射电子显微镜;
79.mcf-7细胞/hela细胞:中国科学院上海生命科学研究院;
80.epcam抗体:上海领潮生物科技有限公司。
81.制备例1
82.基于cuinse2量子点的循环肿瘤细胞荧光检测探针的制备方法如下:
83.1)称量10mg的油溶性cuinse2量子点,并将其溶解在10ml氯仿中,再加入40mg的dspe-peg-cooh,搅拌10min,将混合液体用旋转蒸发仪蒸干,然后加入10ml超纯水,超声溶解15min,得到水溶性cuinse2量子点,室温保存备用。
84.2)称取20mg步骤1)中制备的水溶性cuinse2量子点,15mg nhs和10mg edc,加入5ml mes缓冲液(50mmol/l,ph 5.6),在室温下搅拌20min,在21000rpm下转速离心10min,去掉上层清液,加入5ml pbs缓冲液(50mmol/l,ph=7.4),再加入10μl抗epcam抗体,置于旋转混合仪上,在4℃下反应2小时。在21000rpm下转速离心10min,去掉上层液体,分散于超纯水中,得到抗epcam抗体修饰的循环肿瘤细胞荧光检测探针,保存在4℃环境下备用。
85.图3给出了所获得的水溶性cuinse2量子点荧光检测探针的透射电镜图。可以看
到,纳米颗粒分散性良好,尺寸均一,具有良好的结晶性。
86.图4给出了本实施例制备得到的荧光检测探针的水合粒径统计图,由图可知,所制得的纳米探针尺寸较小,平均水合粒径为15.2
±
0.9nm。
87.实施例1
88.对制备例1得到的检测探针测定循环肿瘤细胞数目的可行性进行考察,包括如下步骤:
89.1)包被:用0.05mol/l的碳酸盐缓冲液将捕获探针抗epcam抗体稀释至10μg/ml,在96微孔板中,每孔加入100μl稀释液,在37℃下孵育1小时,吸弃孔内液体,再用pbs洗涤缓冲液洗3次。
90.2)封闭:向每孔加入300μl用pbs缓冲液配制bsa溶液(2%w/v),在37℃下孵育1小时,吸弃孔内液体,用pbs洗涤缓冲液洗3次。
91.3)加样:用dmem细胞培养基(含10wt%胎牛血清、100μg/ml青霉素和100μg/ml链霉素)培养乳腺癌(mcf-7)细胞,待其生长到一定数目后,用胰蛋白酶进行消化并收集细胞,用pbs缓冲液配制成细胞悬浮液。分别将200μl含有10-50000个mcf-7细胞的细胞悬浮液加入上述96微孔板中,在细胞培养箱中孵育2小时,再用pbs缓冲液洗涤三次。
92.4)加入200μl pbs液配制的制备例1得到的cuinse2量子点循环肿瘤细胞荧光检测探针(300μg/ml),孵育2小时,用pbs液洗涤三次,然后用酶标仪在808nm激发下检测cuinse2量子点探针的近红外二区荧光。
93.5)绘制在pbs标准液中,检测探针与不同数目的mcf-7细胞与孵育后的荧光发射谱:以循环肿瘤细胞数目作为x轴,以发光波长为y轴,以发光强度为z轴。
94.图5给出了本实施例的检测探针与含不同数目的mcf-7循环肿瘤细胞的pbs标准液孵育后的荧光发射谱。图6给出了本实施例检测探针在pbs体系样品中,荧光强度与mcf-7循环肿瘤细胞数目依赖型标准曲线。由图可知,在10-50000个细胞范围,探针发光强度随细胞数目的增加而增加,且变化趋势明显,说明利用荧光强度来检测待测样品中mcf-7循环肿瘤细胞数目具有可行性。
95.实施例2
96.检测探针对循环肿瘤细胞种类的选择性考察。
97.1.本实验所用的试剂和仪器与实施例1相同,所用的cuinse2量子点循环肿瘤细胞荧光检测探针与实施例1一致。
98.2.考察cuinse2量子点检测探针对循环肿瘤细胞种类的选择性,包括如下步骤:
99.1)包被:用0.05mol/l的碳酸盐缓冲液将捕获探针抗epcam抗体稀释至10μg/ml,在96微孔板中,每孔加入100μl稀释液,在37℃下孵育1小时,吸弃孔内液体,再用pbs洗涤缓冲液洗3次。
100.2)封闭:向每孔加入300μl用pbs缓冲液配制bsa溶液(2%w/v),在37℃下孵育1小时,吸弃孔内液体,用pbs洗涤缓冲液洗3次。
101.3)加样:用dmem细胞培养基培养的乳腺癌(mcf-7)细胞(其为epcam阳性)及宫颈癌(hela)细胞(其为epcam阴性),待其生长到一定数目,用胰蛋白酶进行消化并收集细胞,用pbs配制成细胞悬浮液。分别将200μl含有100、1000和10000个mcf-7或hela细胞的细胞悬浮液加入上述96微孔板中,在细胞培养箱中孵育2小时,再用pbs缓冲液洗涤三次。
102.4)加入200μl pbs液配制的cuinse2量子点循环肿瘤细胞荧光检测探针(300μg/ml),孵育2小时,用pbs液洗涤三次,然后用酶标仪在808nm激发下检测cuinse2量子点探针的近红外二区荧光。
103.5)绘制不同类型循环肿瘤细胞加入探针后检测到的荧光信号对比图。
104.图7给出了本实施例检测探针与不同类型循环肿瘤细胞孵育后所检测到的荧光强度对比柱状图。可以看到:检测探针与mcf-7细胞孵育后所检测到的荧光强度,远远高于与hela细胞孵育后所检测到的荧光强度;检测到的荧光强度随mcf-7细胞数目的增加而增加,呈现良好的正向关系(与实施例1一致),而随着hela细胞数目的增加,检测到的荧光强度基本没有发生变化,发光强度与细胞数目没有相关性,并且荧光强度很弱。证明本实施例的检测探针与mcf-7细胞具有良好的特异性识别结合,而与hela细胞没有发生特异性识别,证明本发明构建的循环肿瘤细胞检测方案具有高特异性和良好的选择性。
105.实施例3
106.对检测探针在复杂血液体系样品中对循环肿瘤细胞检测灵敏度的考察。
107.1.本实验所用的试剂和仪器与实施例1相同,所用的cuinse2量子点循环肿瘤细胞荧光检测探针与实施例1一致。
108.2.复杂血液体系使用的模型基质为健康人体血液样本。
109.3.考察基于cuinse2量子点检测探针对复杂血液体系样品中循环肿瘤细胞检测灵敏度,包括如下步骤:
110.1)包被:用0.05mol/l的碳酸盐缓冲液将捕获探针抗epcam抗体稀释至10μg/ml,在96微孔板中,每孔加入100μl稀释液,在37℃下孵育1小时,吸弃孔内液体,再用pbs洗涤缓冲液洗3次。
111.2)封闭:向每孔加入300μl用pbs缓冲液配制bsa溶液(2%w/v),在37℃下孵育1小时,吸弃孔内液体,用pbs洗涤缓冲液洗3次。
112.3)加样:用dmem细胞培养基(含10wt%胎牛血清、100μg/ml青霉素和100μg/ml链霉素)培养mcf-7细胞,待其生长到一定数目后,用胰蛋白酶进行消化并收集细胞,用健康人体血液配制成细胞悬浮液来模拟血液循环肿瘤细胞。分别将200μl含有10-50000个mcf-7的细胞悬浮液加入上述96微孔板中,在细胞培养箱中孵育2小时,再用pbs缓冲液洗涤三次。
113.4)加入200μl pbs液配制的cuinse2量子点循环肿瘤细胞荧光检测探针(300μg/ml),孵育2小时,用pbs液洗涤三次,然后用酶标仪在808nm激发下检测cuinse2量子点探针的近红外二区荧光。
114.5)绘制标准曲线:以循环肿瘤细胞数目作为横坐标,以每一循环肿瘤数目对应的荧光强度作为纵坐标,得到循环肿瘤细胞数目依赖型标准曲线。
115.图8给出了本实施例检测探针与含不同数目的mcf-7循环肿瘤细胞的在复杂血液体系样品中的荧光响应曲线。
116.图9给出了在复杂血液体系样品中,本实施例检测探针荧光强度与mcf-7循环肿瘤细胞数目依赖型标准曲线。
117.实施例4
118.对检测探针临床应用潜力的考察
119.1.实验所需试剂和仪器与实施例1相同,实验所用的cuinse2量子点循环肿瘤细胞
荧光检测探针与实施例1一致。
120.2.实验所使用的检测样本为10例中期乳腺癌患者血液样本。
121.3.实验所使用的标准工作曲线和实施例3实验方法一致。
122.4.考察基于cuinse2量子点的临床应用潜力,包括如下步骤:
123.1)包被:用0.05mol/l的碳酸盐缓冲液将捕获探针抗epcam抗体稀释至10μg/ml,在96微孔板中,每孔加入100μl稀释液,在37℃下孵育1小时,吸弃孔内液体,再用pbs洗涤缓冲液洗3次。
124.2)封闭:向每孔加入300μl用pbs缓冲液配制bsa溶液(2%w/v),在37℃下孵育1小时,吸弃孔内液体,用pbs洗涤缓冲液洗3次。
125.3)加样:将200μl患者血样加入上述96微孔板中,在细胞培养箱中孵育2小时,再用pbs缓冲液洗涤三次。
126.4)加入200μl pbs液配制的cuinse2量子点循环肿瘤细胞荧光检测探针(300μg/ml),孵育2小时,用pbs液洗涤三次,然后用酶标仪在808nm激发下检测cuinse2量子点探针的近红外二区荧光。
127.5)将步骤4)中所测得的荧光信号代入实施例3所得的标准曲线,计算得到待测患者血液样本所对应的循环肿瘤细胞数目。
128.10例中期乳腺癌患者血液样本,通过本施例的检测方法,有9例检测到了循环肿瘤细胞,其中有8例检测到的循环肿瘤细胞在20-200个癌细胞/ml范围内。
129.对于检测血液中的循环肿瘤细胞而言,存在的挑战一方面是数目太少,许多检测方法都需要繁琐的富集和信号放大过程;另一方面是血液复杂的生理环境,严重影响了检测的灵敏度和准确性。本发明的实施例3将不同数目(10-50000)的乳腺癌(mcf-7)细胞加入健康血液中来模拟血液环境中的循环肿瘤细胞。接着,不需要经过任何预处理及富集操作,直接利用本发明的血液中循环肿瘤细胞检测方案对其进行检测。检测结果如图8和图9所示,对于血液中的mcf-7细胞,细胞数目与荧光强度仍然呈现出正相关性,在10-5000个细胞之间具有良好的检测线性关系,检测限以空白平均值加3倍标准偏差计算获得,算出其检测限低至12个细胞/孔。进一步地,如实施例4所述,可以用该检测探针对临床乳腺癌患者进行检测,将检测的荧光值代入标准曲线中,即可获得患者血液样本中乳腺癌细胞的数目。以上结果证明:在无任何富集和信号放大处理的条件下,本发明建立的循环肿瘤细胞检测方案可直接在血液中高灵敏度地检测循环肿瘤细胞数目。
130.以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1