一种脂质纳米球中脂质组分的检测方法与流程
scattering detector for the analysis of a synthetic polymer by supercritical fluid chromatography. journal of chromatography a, 1193 (2008) 151
–
155;zhen long,et al., a non-derivative method for the quantitative analysis of isosteroidal alkaloids from fritillaria by high performance liquid chromatography combined with charged aerosol detection. talanta 151 (2016) 239
–
244),主要表现在:1、灵敏度高,对同一化合物的检出限,电喷雾检测器平均比蒸发光散射检测器低一个数量级;2、线性和精密度优于elsd;3、不同化合物的响应一致,由于蒸发光散射检测器最终通过颗粒对光的散射进行测定,而不同物质的散射程度不同,而且由于在高温下溶液中析出的颗粒呈不规则性,其不同的面对光的散射程度也不相同,因此化合物之间的响应很不一致;4、耐用性更好,因为每台机器在出厂前已固定好一个最佳条件无法改动,且受环境影响很小。
技术实现要素:
7.鉴于现有脂质纳米球各脂质组分分析方法的缺失,本发明提供了一种通过高效液相色谱电喷雾式检测器法对脂质纳米球中各脂质组分进行定性、定量检测的方法。
8.本发明提供了一种脂质纳米球中脂质组分的检测方法,该方法采用高效液相色谱-电喷雾检测器法进行检测,包括:(1)检测脂质组分的标准品溶液,根据所述标准品溶液的浓度对色谱图中的峰面积做线性回归计算,构建标准曲线;(2)检测脂质纳米球溶液,根据色谱图中的保留时间鉴别所述脂质纳米球中的脂质组分,根据色谱图中脂质组分的峰面积以及上述标准曲线计算所述脂质组分的浓度。
9.优选地,电喷雾检测器的干燥器温度为50℃,采集频率为1~20hz,过滤常数为1~3 s;色谱柱填料为十八烷基硅胶,柱温为25~60℃,流速为0.6~1.5ml/min,所述进样量为5~50μl,流动相a为0.01m~0.5m 三乙胺醋酸的水溶液,流动相b为0.01m~0.5m 三乙胺醋酸的甲醇溶液,梯度洗脱,洗脱梯度如下:。
10.优选地,所述色谱柱为xbridge peptide beh c18色谱柱。
11.优选地,所述电喷雾检测器的干燥器温度为50℃,采集频率为10hz,过滤常数为1s。
12.优选地,所述柱温为55℃。
13.优选地,所述流速为1.0 ml/min。
14.优选地,所述进样量为10μl。
15.优选地,所述流动相a为0.01m 三乙胺醋酸的水溶液,所述流动相b为0.01m 三乙胺醋酸的甲醇溶液。
16.优选地,所述脂质标准品溶液至少包含六组浓度递减的线性溶液。
17.优选地,所述脂质组分的标准品溶液和所述脂质纳米球溶液的溶剂为甲醇、乙醇、异丙醇、二甲亚砜中的一种或多种。
18.本发明首次提供了一种对脂质纳米球中各脂质组分进行定性、定量检测的方法。本发明的方法采用常规的高效液相色谱,操作简便,且专属性、灵敏度、线性、精密度和准确度好,单次分析时间短。本发明的方法能够用于脂质纳米球的快速中控分析和质量控制。
附图说明
19.图1:脂质1的标准曲线;图2:脂质2的标准曲线;图3:脂质3的标准曲线;图4:脂质4的标准曲线;图5:脂质纳米球测试溶液的色谱图。
具体实施方式
20.下面结合具体实施例详细阐述本发明,但本发明的保护范围并不局限于此,任何熟悉本领域技术的技术人员在本发明公开的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
21.本发明中,“脂质”指的是一类有机化合物,其包括但不限于脂肪酸的酯。脂质在水中不溶,但是在许多有机溶剂中是可溶的。通常将它们分成至少三类:(1)“简单的脂质”其包括脂肪和油以及蜡;(2)“化合物脂质”其包括磷脂和糖脂;(3)“衍生的脂质”诸如类固醇。还可以基于脂质在选定ph下携带电荷的情况将脂质分为“阳离子脂质”、“阴离子脂质”和“中性脂质”。
[0022]“阳离子脂质”指的是在选定的ph,诸如生理ph下携带净正电荷的脂质。常见的阳离子脂质包括但不限于,例如1,2-二亚油基氧基-n,n-二甲基氨基丙烷(dlindma),1,2-二亚麻基氧基-n,n-二甲基氨基丙烷(dlendma),n,n-二油基-n,n-氯化二甲铵(dodac);n-(2,3-二油基氧基)丙基)-n,n,n-氯化三甲铵(dotma);n,n-二硬脂酰-n,n-溴化二甲铵(ddab);n-(2,3-二油酰氧基)丙基)-n,n,n-氯化三甲铵(dotap); 1,2-二肉豆蔻酰-rac-甘油-3-甲氧基聚乙二醇2000(dmg-peg2k);3-(n-(n’,n
’-
二甲基氨基乙烷)-氨基甲酰基)胆固醇(dc-chol)和n-(1,2二肉豆蔻基氧基丙-3-基)-n,n-二甲基-n-羟乙基溴化铵(dmrie)等。
[0023]“中性脂质”指在选定的ph以未带电荷或中性两性离子形式存在的许多脂质种类中的任何一种。在生理ph下,这样的脂质包括,例如,胆固醇、磷脂等,磷脂例如二酰基磷脂酰胆碱、二酰基磷脂酰乙醇胺、神经酰胺、鞘磷脂、脑磷脂、二硬脂酰基卵磷脂、脑苷脂和二酰基甘油等。
[0024]“阴离子脂质”指在选定的ph携带负电荷的脂质,常见的阴离子脂质包括但不限于,例如二油酰磷脂酰甘油(dopg)、二硬脂酰基磷脂酰-乙醇胺(dpse)、二酰基磷脂酰丝氨
酸、二酰基磷酸酯、二酰基磷脂酰肌醇、二酰基丙三醇半琥珀酸酯、二酰基丙三醇半戊二酸酯、胆留醇半琥珀酸酯、胆留醇半戊二酸酯和类似物等。
[0025]
此外,本发明中的脂质还包括“聚合物缀合的脂质”,即聚合物通过共价键与脂质连接得到的化合物。聚合物缀合的脂质可以为磷脂聚乙二醇(如dppe-peg,二棕榈酰磷酯酰乙醇胺-聚乙二醇、dmpe-peg,十四酰磷脂酰乙醇胺-聚乙二醇)、神经酰胺聚乙二醇(如c16-ceramide-peg,棕榈酰神经酰胺-聚乙二醇)、甘油酯聚乙二醇(如dmg-peg,十四酰甘油酯聚乙二醇)等。
[0026]“核酸”指包含至少两个脱氧核糖核苷酸(dna)或核糖核苷酸(rna)的以单或双链形式存在的聚合物。其中寡核苷酸,是一类只有20个以下碱基的短链核苷酸的总称(包括脱氧核糖核酸dna或核糖核酸rna内的核苷酸),rna包含信使rna(mrna)、转运rna(trna)、核糖体rna(rrna)等。除非具体限制,该术语涵盖包含天然核苷酸以及合成的核苷酸。除非另外指出,具体的核酸序列还暗含涵盖其保守性修饰的变体(例如,简并密码子取代)、等位基因、直向同源物,snps和互补序列以及明确指出的序列。
[0027]
自然生成的mrna是由dna的一条链作为模板转录而来的、携带遗传信息的、能指导蛋白质合成的一类单链核糖核酸。以细胞中基因为模板,依据碱基互补配对原则转录生成mrna后,mrna就含有与dna分子中某些功能片段相对应的碱基序列,作为蛋白质生物合成的直接模板,并决定基因表达蛋白产物肽链的氨基酸序列。在细胞中,mrna虽然只占细胞总rna的2%~5%,但种类最多,并且代谢十分活跃,是半衰期最短的一种rna,合成后数分钟至数小时即被分解。人工合成的mrna可以用于制造疫苗,用于制造疫苗的有两种mrna,非复制型(non-replicating) mrna和自我扩增型(self-amplifying)mrna。非复制型mrna长度为2~3 kb,包括m7gp3n帽、5’utr、编码抗原的开放阅读框、3’utr和多聚a尾,结构较为简单。自我扩增型mrna结构较为复杂,大小为9~10 kb,除包含非扩增型的结构外,还包含非结构蛋白基因序列和次基因组启动子。自我扩增型mrna不仅能编码抗原,还含有病毒复制所需序列,具有复制能力,从而大幅提高蛋白表达量。
[0028]
本发明中,“脂质纳米球”指的是核酸被充分包封或部分包封于由脂质形成的脂质体中所形成的纳米颗粒,所述纳米颗粒至少在一个维度上小于100纳米。通过脂质纳米球,可以将充分包封或部分包封于其中的核酸递送至细胞。本领域技术人员可以根据各种脂质的性质,基于需要包封的核酸或脂质纳米球的用途等选择合适的脂质。
[0029]
以下以包含脂质1(1,2-二肉豆蔻酰-rac-甘油-3-甲氧基聚乙二醇2000,dmg-peg2k,生产厂家:nof america corporation)、脂质2(胆固醇,生产厂家:nippon fine chemical)、脂质3(二硬脂酰基卵磷脂,dspc,生产厂家:nippon fine chemical)和脂质4四种脂质组分,且四种脂质组分在制备得到的纳米球溶液中的目标浓度分别为248μg/ml、982μg/ml、521μg/ml、2757μg/ml 的脂质纳米球为例描述本发明方法,其中脂质4的结构如式(i)所示,具体请见202010275644.4号发明专利申请。
[0030]
ꢀꢀꢀ
式(i)。
[0031]
脂质纳米球包含的mrna序列总长度为1000 nt,除抗原编码序列外,还包括5'端帽
结构,5'及3'-utrs,以及由质粒编码的长链多聚腺苷酸尾(polya tail),可以在细胞内稳定高效地表达目的蛋白。通过已知的方法,例如wo2017180917a2中公开的方法使用上述脂质1-4以及mrna制备脂质纳米球,所得到的脂质纳米球溶液中mrna的目标浓度为200μg/ml。上述脂质纳米球能够作为新型冠状病毒疫苗使用。本领域技术人员应知,本发明的方法并不限于该脂质纳米球,包含其他脂质组分、其他mrna及其他浓度的脂质纳米球同样可使用本发明的方法进行检测。
[0032]
配制脂质组分的标准品溶液精密称取上述四种脂质组分标准品,加甲醇溶解,得到含有四种脂质组分的标准品母液,使标准品母液中各脂质组分的浓度为脂质纳米球中四种脂质组分目标浓度的约1/3~1/2。在以下实施例中,标准品母液中脂质1的浓度为0.1mg/ml,脂质2的浓度为0.4mg/ml,脂质3的浓度为0.2mg/ml,脂质4的浓度为1.2mg/ml。
[0033]
对含有各脂质组分的标准品母液以甲醇进行稀释,得到一系列包含不同浓度的各脂质组分的标准品线性溶液。从减小误差的角度考虑,稀释后标准品溶液的数量至少为六组。
[0034]
按照表1稀释标准品母液,得到线性溶液1-6:表1:线性溶液配制方法。
[0035]
配制脂质纳米球测试溶液将脂质纳米球溶液稀释,使各脂质组分的溶度在上述线性溶液的浓度范围内。在以下实施例中,取脂质纳米球溶液50μl,加入950μl甲醇,混匀得脂质纳米球测试溶液。
[0036]
高效液相色谱-电喷雾检测器的参数设置电喷雾检测器(生产厂家:thermo fisher scientific inc.;型号:corona veo)的干燥器温度为高(50℃),采集频率为1~20hz,过滤常数为1~3 s;高效液相色谱(生产厂家:thermo fisher scientific inc.;型号:u3000)的色谱柱填料为十八烷基硅胶,柱温为25~60℃,流速为0.6~1.5ml/min,所述进样量为5~50μl,流动相a为0.01m~0.5m 三乙胺醋酸的水溶液,流动相b为0.01m~0.5m 三乙胺醋酸的甲醇溶液,梯度洗脱,洗脱梯度如表2所示:表2:洗脱梯度
。
[0037]
构建标准曲线使用上述高效液相色谱-电喷雾检测器分别对上述各脂质组分的标准品线性溶液进行检测,使用数据处理软件chromeleon(生产厂家:thermo fisher scientific inc.)以脂质组分浓度对色谱图中的峰面积作线性回归计算,构建各组分的标准曲线。
[0038]
脂质纳米球中各脂质组分的定性及定量分析使用上述高效液相色谱-电喷雾检测器对上述脂质纳米球溶液进行检测,根据色谱图中的保留时间鉴别各脂质成分,根据各脂质成分的峰面积,通过上述各组分的标准曲线计算各脂质成分的浓度。
[0039]
实施例1高效液相色谱-电喷雾检测器的参数为:电喷雾检测器的干燥器温度为高(50℃),采集频率为10hz,过滤常数为1s;色谱柱为xbridge peptide beh c18色谱柱(生产厂家:waters corporation),柱温为55℃,流速为1.0 ml/min,所述进样量为10μl,流动相a为0.01m 三乙胺醋酸的水溶液,流动相b为0.01m 三乙胺醋酸的甲醇溶液,梯度洗脱,洗脱梯度如表3下:表3:洗脱梯度
[0040]
分别对“配制脂质组分的标准品溶液”部分获得的各脂质组分的标准品线性溶液进行检测。获得的脂质1-4的保留时间如表4所示:表4:各脂质组分的保留时间以及分离度
。
[0041]
表4中分离度指的是色谱图中两个相邻峰的保留时间差与两峰峰底宽平均值之商。表4中,脂质2右侧的分离度数据表示脂质1和脂质2的分离度,脂质3右侧的分离度数据表示脂质2和脂质3的分离度,脂质4右侧的分离度数据表示脂质3和脂质4的分离度。由表4可以看出,各脂质组分的分离度均大于1.5,表明方法专属性良好,适用于脂质定量分析。
[0042]
根据“构建标准曲线”部分记载的方法,获得的脂质1-4的标准曲线如图1-4所示。脂质1的线性回归方程为y =
ꢀ-
0.0012 x
2 + 0.1444 x + 0.0125(r
²ꢀ
= 0.9991),脂质2的线性回归方程为y =
ꢀ-
0.0003 x
2 + 0.1159 x
ꢀ-ꢀ
0.3046(r
²ꢀ
= 0.9995),脂质3的线性回归方程为y =
ꢀ-
0.0004 x
2 + 0.1339 x
ꢀ-ꢀ
0.0617(r
²ꢀ
= 0.9990),脂质4的线性回归方程为y =
ꢀ-
7e-05 x
2 + 0.0896 x + 0.6655(r
²ꢀ
= 0.9996)。在各脂质组分的检测浓度范围内,各组分的线性回归方程的决定系数r
²
均在0.999以上,说明该方法获得的线性曲线的线性良好。
[0043]
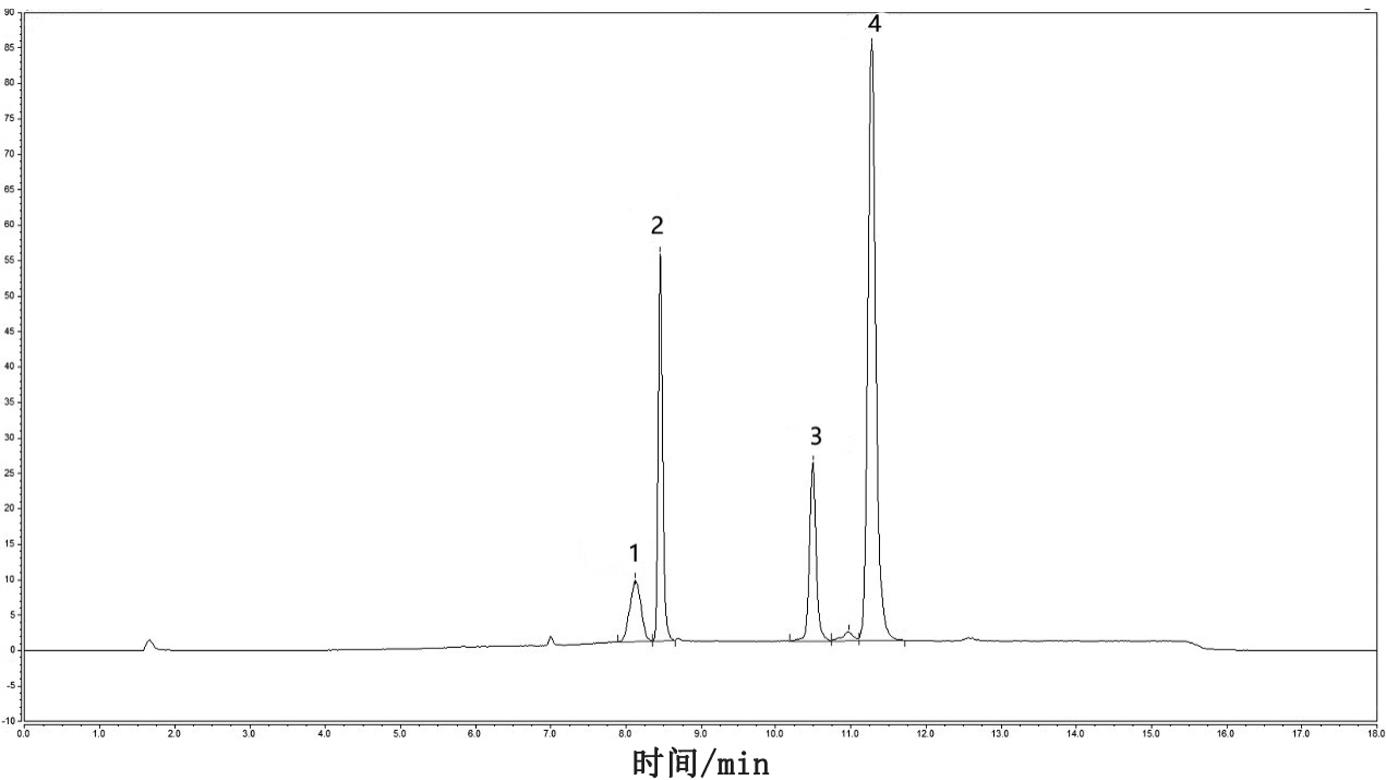
对“配制脂质纳米球测试溶液”部分获得的脂质纳米球测试溶液进行检测,得到的色谱图如图5所示。根据图5中各峰的保留时间可以看出,附图标记1代表的为脂质1,附图标记2代表的为脂质2,附图标记3代表的为脂质3,附图标记4代表的为脂质4。将图5中各脂质组分的峰面积代入上述各脂质组分的标准曲线中计算得到脂质纳米球测试溶液中各脂质组分的实测浓度为:脂质1:12.8303μg/ml,脂质2:47.9453μg/ml,脂质3:25.2547μg/ml,脂质4:143.5796μg/ml。脂质纳米球测试溶液与脂质纳米球溶液的稀释倍数为20倍,因此将脂质纳米球测试溶液中计算得到的各脂质组分的浓度乘以稀释倍数20,得到脂质纳米球溶液中各脂质组分的实测浓度为:脂质1:256.606μg/ml,脂质2:958.906μg/ml,脂质3:505.094μg/ml,脂质4:2871.592μg/ml。将脂质纳米球溶液中各脂质组分的实测溶度除以各脂质组分的理论浓度,得到各脂质组分的含量为:脂质1:103%,脂质2:98%,脂质3:97%,脂质4:104%。
[0044]
实施例2在本实施例中,对本发明方法的重复性以及精密度进行了测试。
[0045]
试验人员a使用实施例1的方法重复进行六次检测,结果如表5所示:
试验人员b使用实施例1的方法重复进行六次检测,如果如表6所示:试验人员a和试验人员b的结果汇总如表7所示:表5-7中脂质含量表示为各脂质组分的实测浓度与理论浓度的比值。由上述测试结果可知,同一测试人员对同一样品的检测结果的相对标准偏差(rsd)均小于5%,对于某些脂质组分,其检测结果的相对标准偏差低于1%,可见本发明方法的重复性好。即便是不同测试人员,对于同一样品的检测结果的相对标准偏差均小于10%,对于某些脂质组分,其检测结果的相对标准偏差只有1%,可见本发明方法的精密度优良。
[0046]
实施例3本实施例对脂质组分的标准品溶液以及脂质纳米球测试溶液随时间变化的稳定性进行了检测。
[0047]
以上述线性溶液4为例,使用实施例1的方法对脂质组分的标准品溶液随时间变化
的稳定性进行了检测,结果如表8所示:使用实施例1的方法对脂质纳米球测试溶液随时间变化的稳定性进行了检测,结果如表9所示:通过上述结果可知,各脂质组分的标准品溶液以及脂质纳米球测试溶液在室温条件下放置24小时之后,各脂质组分浓度的相对标准偏差均小于5%,可见本发明中使用的标准品溶液及脂质纳米球测试溶液的稳定性优良。
[0048]
实施例4本实施例对本发明方法的准确度进行了测试。
[0049]
取50μl浓度为0.2mg/ml的mrna溶液,加入950μl线性溶液1稀释,得到的准确度测试样品1中各脂质组分的浓度相当于上述脂质纳米球测试溶液中各脂质组分浓度的约50%,且mrna终浓度与脂质纳米脂球测试溶液中mrna的浓度一致,配制三份平行测试样品1、2、3。
[0050]
使用同样的方法,分别使用线性溶液3和线性溶液5替换线性溶液1得到准确度测试样品4、5、6、7、8、9。准确度测试样品4-6中,各脂质组分的浓度大约等于上述脂质纳米球
测试溶液中各脂质组分浓度,且mrna终浓度与脂质纳米脂球测试溶液中mrna的浓度一致。准确度测试样品7-9中,各脂质组分的浓度相当于上述脂质纳米球测试溶液中各脂质组分浓度的约150%,且mrna终浓度与脂质纳米脂球测试溶液中mrna的浓度一致。
[0051]
使用实施例1中的高效液相色谱-电喷雾检测器对上述准确度测试样品进行检测,并根据实施例1获得的标准曲线计算各准确度测试样品中各脂质组分的实测浓度。
[0052]
将各脂质组分的实测浓度除以理论浓度即得回收率,各准确度测试样品溶液的回收率如表10所示:由结果可以看出,通过本发明方法检测的各脂质组分的回收率在94.2%~110.2%范围内,且相对标准偏差均小于4%,可见本发明方法的准确度优良。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1