新型冠状病毒SARS-CoV-2的检测方法及检测装置与流程
本发明涉及生物医药技术领域,具体涉及新型冠状病毒sars-cov-2的检测方法及检测装置。
背景技术:
新型冠状病毒是一种传染性比较强的病毒,主要造成病毒性肺炎的形成,常见体征有发热、乏力、干咳,进而逐渐出现呼吸困难。该病毒在人体内具有较强的潜伏期,潜伏期也具有传染性,甚至存在大量无临床症状的无症状人群,无症状人群也可能具有传染性。因此如何快速、准确的对疑似人群和无症状人群进行新型冠状病毒检测是应对该病毒的重要问题。现有的检测技术主要分为核酸检测和抗体检测,其一核酸检测存在假阳性、检测时间较长以及检测环境局限的问题,同时对检测设备、平台和操作人员的要求较高,其二抗体检测大多是在试纸条上利用胶体免疫金层析技术对患者样本进行检测从而定性地判断样本中是否含有新型冠状病毒抗体,无法定量精准判断。因此,如何在复杂环境下精准且快速批量筛查疑似病例和无症状人群是亟需解决的问题。
因此为了解决上述存在的问题,本发明提供了一种新型冠状病毒sars-cov-2的检测方法及检测装置。
技术实现要素:
第一方面,本发明提供一种非疾病诊断目的的新型冠状病毒sars-cov-2的检测方法,该方法包括如下步骤:
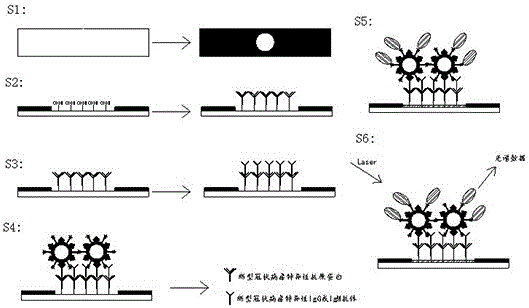
s1.制备基底,所述基底主要由纳米原纤化纤维素纸通过2,2,6,6-四甲基哌啶氧化物氧化制得,在基底的表面蜡印基底图案;
s2.对基底表面进行活化,滴加与igg抗体或igm抗体具有特异性的新型冠状病毒抗原蛋白作为捕获抗原蛋白;
s3.滴加经过处理后的待测样本,当待测样本中含有新型冠状病毒特异性igg或igm抗体,则igg抗体或igm抗体会与相应的捕获抗原蛋白发生免疫结合;
s4.滴加标记过的免疫金纳米粒子,金纳米粒子上的抗-igg抗体或抗-igm抗体会与基底上已经固定的新型冠状病毒特异性igg抗体或igm抗体发生特异性免疫结合;
s5.对整个基底进行银染增强,提高基底的拉曼信号强度;
s6.对基底进行检测,依据标定好的不同浓度新型冠状病毒特异性igg抗体或igm抗体对应的光谱数据,定性判断待测样本中是否含有新型冠状病毒特异性igg抗体或igm抗体以及定量得到其浓度值。
采用以上技术方案,在步骤s5中,对基底进行银染增强的具体操作如下:在基底上滴加对苯二酚和硝酸银溶液进行银染反应。
采用以上技术方案,在步骤s6中,还包括标定不同浓度新型冠状病毒特异性igg抗体或igm抗体光谱数据的过程。
采用以上技术方案,步骤s6中标定不同浓度新型冠状病毒特异性igg抗体或igm抗体光谱数据的具体过程如下:首先成梯度取确定浓度的新型冠状病毒特异性igg抗体或igm抗体,在步骤s3中替代经过处理后的待测样本,之后重复步骤s1-s5,最后进行检测即可得到完整的全梯度浓度的新型冠状病毒igg抗体或igm抗体对应的光谱数据。
第二方面,本发明提供一种新型冠状病毒sars-cov-2的检测装置,包括:
基底,所述基底主要由纳米原纤化纤维素纸通过2,2,6,6-四甲基哌啶氧化物氧化制得,在所述基底表面蜡印基底图案;
新型冠状病毒抗原蛋白,在对基底表面进行活化后,滴加与igg抗体或igm抗体具有特异性的新型冠状病毒抗原蛋白作为捕获抗原蛋白;
标记过的免疫金纳米粒子,免疫金纳米粒子上的抗-igg抗体或抗-igm抗体会与基底上已经固定的新型冠状病毒特异性igg抗体或igm抗体发生特异性免疫结合;
银染液,用于对整个基底进行银染增强;以及
拉曼光谱仪,定性判断待测样本中是否含有新型冠状病毒特异性igg抗体或igm抗体以及定量得到其浓度值。
本发明的有益效果:本发明通过2,2,6,6-四甲基哌啶氧化物氧化制得基底,在基底上利用免疫金标记技术来实现对样本中的新型冠状病毒特异性igg抗体或igm抗体的定性检测,检测速度快,并且标定后可以对样本中的抗体浓度进行定量检测,准确率高,而且表面增强拉曼散射基底用于添加试剂的区域不局限于固定的基底图案,可以根据使用要求和检测环境改变基底图案的尺寸及样式,既可以同时完成两种新型冠状病毒特异性抗体的检测,也可以同时对多个待测样本进行检测,从而最高效地实现样本检测。
附图说明
图1是本发明一种新型冠状病毒sars-cov-2的检测方法的一流程示意图。
图2是本发明一种新型冠状病毒sars-cov-2的检测方法的另一流程示意图。
图3是本发明实施例1中基底的结构示意图。
图4是本发明实施例1中基底的制备方法的流程示意图。
图5是本发明实施例1中一种新型冠状病毒sars-cov-2的检测方法的流程示意图。
图6是本发明实施例1中标记过的免疫金纳米粒子的结构示意图。
图7是本发明实施例1中制备标记过的免疫金纳米粒子的流程示意图。
图8是本发明实施例4中基底的结构示意图。
附图标记如下:1、基底;11、基底图案;2、标记过的免疫金纳米粒子。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
实施例1
参照图5所示,本实施例以在实验室环境下用台式拉曼光谱仪检测96个待测样本中的新型冠状病毒sars-cov-2(全称是:severeacuterespiratorysyndromecoronavirus2,中文释义为严重急性呼吸综合征冠状病毒2)单一特异性igg抗体为例:
s1.表面增强拉曼散射基底1由纳米原纤化纤维素纸通过2,2,6,6-四甲基哌啶氧化物氧化处理制备,参照图4所示,具体的制备方法如下:
s1-1.将2,2,6,6-四甲基哌啶氧化物氧化过的纳米原纤化纤维素的原始浆料加入蒸馏水中,制备出纤维素含量为0.1%的悬浮液;
s1-2.将制备出的悬浮液放置在搅拌机里,以1000rpm的转速搅拌2小时;
s1-3.取出50g悬浮液用滤膜在滤架上真空过滤6小时,滤膜材质选用聚偏氟乙烯,孔径为0.1μm;
s1-4.过滤后,在滤膜顶部残留氧化过的纳米原纤化纤维素的固液混合物,将残留物从过滤膜上取下来,用塑料膜和纤维素滤纸夹住,再在纤维素滤纸和塑料膜的外面再各自用一块特氟龙板夹住,制得堆叠物,并将制得的堆叠物放入热压机中,在90℃,2.6mpa的压力下压干10分钟制得基底1;
s1-5.制得的基底1冷却一段时间后用蜡印打印机在基底1表面蜡印基底1图案,用来限定后续液体滴加的区域位置,具体的基底1图案如图3所示,一共有96个孔位区域用于滴加相应的试剂;
s2.对制备完成的基底1进行活化,先在每一个孔位各自滴加10μledc/nhs混合溶液(含量0.1mol/l),滴加适量试剂活化30分钟,之后用去离子水冲洗,用吸水纸从基底1上部将每一个孔位的洗涤液吸出,干燥一段时间,向每一个孔位滴加与igg抗体具有特异性的新冠病毒抗原蛋白作为捕获抗原蛋白,滴加完成后孵育30分钟;
s3.依次在每一个孔位滴加经过处理过的96个待测样本,如果待测样本中含有新型冠状病毒特异性igg抗体,则igg抗体会与基底1上已经固定的捕获抗原蛋白发生特异性免疫结合从而实现固定,孵育30分钟后,用去离子水冲洗,用吸水纸从基底1上部将每一个孔位的洗涤液吸出;
s4.向每一个孔位分别滴加10μl预先制备的标记过的免疫金纳米粒子2,关于标记过的免疫金纳米粒子2的具体结构参照图6所示,金纳米粒子上连接的抗-igg抗体与新型冠状病毒特异性igg抗体发生特异性免疫结合从而固定在基底1上,孵育30分钟后用去离子水进行冲洗,用吸水纸从基底1上部将每一个孔位的洗涤液吸出,关于标记过的免疫金纳米粒子2需要提前制备,参照图7所示,具体流程如下:
s4-1.在用王水清洗过的玻璃器皿中加入100ml浓度为1×10-3mol/l的haucl4,将其煮沸后立刻加入9.34ml质量分数为1%的柠檬酸三钠水溶液,继续煮沸20分钟后停止加热,形成金纳米粒子;
s4-2.向每1ml金纳米粒子中加入2.5μl浓度为1×10-3mol/l的4-巯基苯甲酸作为拉曼活性探针,搅拌反应12小时,使其吸附在带有硫醇基团的金纳米粒子表面,然后再将修饰过的金纳米粒子离心洗涤,并用硼酸盐溶液重悬两次;
s4-3.向每1ml标记过的金纳米粒子中加入10μl浓度为1mg/ml的抗-igg抗体,混合均匀,通过静电作用和疏水作用使其吸附在金纳米粒子上,反应1小时后,以10000rpm的转速离心10分钟,然后再将其重悬于硼酸盐溶液中;
s4-4.加入质量分数为2%的bsa溶液,室温下放置40分钟,再将混合物重悬于硼酸盐溶液中。
s5.对整个基底1孔位进行银染增强,提高整体的拉曼信号强度,具体操作如下:
在黑暗环境下向孔位滴加对苯二酚和硝酸银溶液(1:1);反应20分钟后用去离子水冲洗,从基底1上方用吸水纸吸出洗涤液,并通氮气干燥;
s6.将反应完成的基底1放置在拉曼光谱仪的扫描区域,改变检测头位置,依次分析每一个检测孔位的拉曼光谱数据,并依次与标定的新型冠状病毒特异性igg抗体光谱数据对比,如果某孔位的拉曼光谱数据与标定的新型冠状病毒特异性igg抗体的光谱数据相拟合,则滴加在该孔位的待测样本中含有新型冠状病毒特异性igg抗体,当然如果还需定量检测,只需将该孔位的拉曼光谱数据波峰数值与标定数值对比,如果与某一标定浓度对应的光谱数据拟合,则滴加在该孔位的待测样本中新型冠状病毒特异性igg抗体浓度就是该标定浓度。
实施例2
本实施例以在实验室环境下用台式拉曼光谱仪检测48个待测样本中的新型冠状病毒sars-cov-2的特异性igg抗体和igm抗体为例:
s1.表面增强拉曼散射基底1由纳米原纤化纤维素纸通过2,2,6,6-四甲基哌啶氧化物氧化处理制备,具体的制备方法和基底1图案与实施例1相同,本发明在这里不做赘述;
s2.对制备完成的基底1进行活化,具体的活化流程与实施例1相同,活化完成后,向96个孔位滴加与人igg或igm抗体具有特异性的新冠病毒抗原蛋白,滴加完成后孵育30分钟;
s3.将经过处理过的48个待测样本中的每个待测样本分成两份,得到96个滴加样本,依次滴加在96个孔位中,如果待测样本中含有新型冠状病毒特异性igg抗体或igm抗体,则igg抗体或igm抗体会与基底1上已经固定的相对应的捕获抗原蛋白发生特异性免疫结合从而实现固定,孵育30分钟后,用去离子水冲洗,用吸水纸从基底1上部将每一个孔位的洗涤液吸出;
s4.向48个待测样本中其中一份对应的48个滴加孔位中分别滴加10μl预先制备连接抗-igg抗体并且标记过的免疫金纳米粒子2,这些免疫金粒子2上金纳米粒子上连接的抗-igg抗体会与新型冠状病毒特异性igg抗体发生特异性免疫结合从而固定在基底1上;向48个待测样本中另外一份对应的的48个滴加孔位中分别滴加10μl预先制备连接抗-igm抗体并且标记过的免疫金纳米粒子2,其中,这些免疫金粒子2上金纳米粒子上连接的抗-igm抗体会与新型冠状病毒特异性igm抗体发生特异性免疫结合从而固定在基底1上,孵育30分钟后用去离子水进行冲洗,用吸水纸从基底1上部将每一个孔位的洗涤液吸出;这两种标记过的免疫金纳米粒子2需要提前制备,第一种免疫金纳米颗粒2具体制备流程与实施例1相同,第二种免疫金纳米颗粒2将s4-3中添加的抗-igg抗体更改为抗-igm抗体,其余流程相同;
s5.对整个基底1孔位进行银染增强,提高整体的拉曼信号强度,具体操作与实施例1相同;
s6.将反应完成的基底1放置在拉曼光谱仪的扫描区域,改变检测头位置,依次分析每一个孔位的拉曼光谱数据,如果该孔位在步骤4中滴加的是第一种连接抗-igg抗体并且标记过的免疫金纳米粒子2,则与标定的新型冠状病毒特异性igg抗体的光谱数据进行对比,如果某孔位的拉曼光谱数据与标定的新型冠状病毒特异性igg抗体的光谱数据相拟合,则滴加在该孔位的待测样本中含有新型冠状病毒特异性igg抗体,如果还需定量检测,只需将该孔位的拉曼光谱数据波峰数值与标定数值对比,如果与某一标定浓度对应的光谱数据拟合,则滴加在该孔位的待测样本中新型冠状病毒特异性igg抗体浓度就是该标定浓度;如果该孔位在步骤4中滴加的是连接抗-igm抗体并且标记过的免疫金纳米粒子2,则与标定的新型冠状病毒特异性igm抗体的光谱数据进行对比,具体定性判断与定量判断方法与上述对比方法相同,这样,就可以实现48个待测样本的新型冠状病毒特异性igg抗体和igm抗体同时检测。
实施例3
本实施例以在非实验室复杂环境下用手持式便携拉曼光谱仪检测待测样本中的新型冠状病毒sars-cov-2的特异性igg抗体为例:
s1.表面增强拉曼散射基底1由纳米原纤化纤维素纸通过2,2,6,6-四甲基哌啶氧化物氧化处理制备,具体的制备方法与实施例1相同,基底1图案限定为一个孔位;
s2.对制备完成的基底1进行活化,具体活化流程与实施例1相同,活化完成后,向该孔位滴加与igg抗体具有特异性的新冠病毒抗原蛋白,滴加完成后孵育30分钟;
s3.步骤s1与步骤s2需要提前在实验室环境下准备好,并将准备好的基底1冷冻保存,到实际检测时在此步骤将基底1取出,然后抽取待测样本并简单处理后将适量待测样本滴加到孔位中,如果待测样本中含有新型冠状病毒特异性igg抗体,则抗体会与基底1上已经固定的捕获抗原蛋白发生特异性免疫结合从而实现固定,孵育30分钟后,用去离子水冲洗,用吸水纸从基底1上部将每一个孔位的洗涤液吸出;
s4.向基底1的孔位滴加10μl预先制备的标记过的免疫金纳米粒子2,金纳米粒子上连接的抗-igg抗体与新型冠状病毒特异性igg抗体发生特异性免疫结合从而固定在基底1上,孵育30分钟后用超纯水进行冲洗,用吸水纸从基底1上部将每一个孔位的洗涤液吸出;标记过的免疫金纳米粒子2也是在实验室环境下准备好并冻存,具体流程与实施例1相同,到此步骤前取出滴加即可;
s5.对整个基底1孔位进行银染增强,提高整体的拉曼信号强度,具体操作与实施例1相同;
s6.用手持式便携拉曼光谱仪检测头对准基底1的孔位,分析该孔位的拉曼光谱数据,并与标定的新型冠状病毒特异性igg抗体的光谱数据对比,具体比较方法与实施例1相同,这样就可以实现在非实验室环境下利用手持式便携拉曼光谱仪检测待测样本中的新型冠状病毒特异性igg抗体,当然如若检测新型冠状病毒特异性igm抗体,只需要改变步骤s4中连接抗-igg抗体的金纳米粒子为连接抗-igm抗体的金纳米粒子即可,对比数据也改变为对比标定的新型冠状病毒特异性igm抗体的光谱数据即可。
实施例4
本实施例以在实验室环境下用台式拉曼光谱仪标定不同浓度新型冠状病毒sars-cov-2的特异性igg抗体或igm抗体光谱数据为例,使用新型冠状病毒样本在图1和图2所示的步骤s3中替代经过处理后的待测样本,之后重复图1和图2所示的步骤s1-s5,最后通过拉曼光谱分析仪进行检测即可得到完整的全梯度浓度的新型冠状病毒igg抗体或igm抗体对应的光谱数据:
s1.表面增强拉曼散射基底1由纳米原纤化纤维素纸通过2,2,6,6-四甲基哌啶氧化物氧化处理制备,具体的制备方法与实施例1相同,具体的基底1的基底图案如图8所示,一共有14个孔位区域用于滴加相应的试剂;
s2.对制备完成的基底1进行活化,具体的活化流程与实施例1相同,活化完成后,向每个孔位滴加与人igg或igm抗体具有特异性的新冠病毒抗原蛋白,滴加完成后孵育30分钟;
s3.成梯度取确定浓度的新型冠状病毒特异性igg抗体和igm抗体样本,例如样本浓度分别取1ng/ml,10ng/ml,100ng/ml,1μg/ml,10μg/ml,100μg/ml以及1mg/ml,将经过处理过的7个浓度的新型冠状病毒特异性igg抗体样本依次滴加在7个孔位中,将经过处理过的7个浓度的新型冠状病毒特异性igm抗体样本依次滴加在另外7个孔位中,样本中的新型冠状病毒特异性igg抗体或igm抗体会与基底1上已经固定的捕获抗原蛋白发生特异性免疫结合从而实现固定,孵育30分钟后,用去离子水冲洗,用吸水纸从基底1上部将每一个孔位的洗涤液吸出;
s4.向滴加过新型冠状病毒特异性igg抗体样本的7个孔位中分别滴加10μl第一种预先制备的连接抗-igg抗体并且标记过的免疫金纳米粒子2,金纳米粒子上连接的抗-igg抗体与新型冠状病毒特异性igg抗体发生特异性免疫结合从而固定在基底1上;向滴加过新型冠状病毒特异性igm抗体样本的7个孔位中分别滴加10μl第二种预先制备的连接抗-igm抗体并且标记过的免疫金纳米粒子2,孵育30分钟后用去离子水进行冲洗,用吸水纸从基底1上部将每一个孔位的洗涤液吸出;两种标记过的免疫金纳米粒子2需要提前制备,具体制备流程与实施例2相同;
s5.对整个基底1孔位进行银染增强,提高整体的拉曼信号强度,具体操作与实施例1相同;
s6.将反应完成的基底1放置在拉曼光谱仪的扫描区域,改变检测头位置,依次分析步骤4中滴加过连接抗-igg抗体并且标记过的免疫金纳米粒子的每一个孔位的拉曼光谱数据,即可得到完整的全梯度浓度的新型冠状病毒igg抗体对应的光谱数据;分析步骤4中滴加过连接抗-igm抗体并且标记过的免疫金纳米粒子的每一个孔位的拉曼光谱数据,即可得到完整的全梯度浓度的新型冠状病毒igg抗体对应的光谱数据。当然该标定不同浓度新型冠状病毒特异性igg抗体或igm抗体光谱数据的过程只需做一次,后续对待测样本进行检测后,将待测样本的光谱数据与标定的光谱数据进行对比,即可得出待测样本中新型冠状病毒igg抗体或igm抗体的浓度。
以上实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。本发明的保护范围以权利要求书为准。
- 还没有人留言评论。精彩留言会获得点赞!