基于PBNPs原位生长调控多模信号输出的黄曲霉毒素B1检测试剂盒及方法与流程
本发明属于新型功能材料与生物传感检测技术领域,具体涉及一种基于pbnps原位生长调控多模信号输出的黄曲霉毒素b1检测试剂盒及检测方法。
背景技术:
黄曲霉毒素b1(aflatoxinb1,简写为afb1)是二氢呋喃氧杂萘邻酮的衍生物,含有一个双呋喃环和一个氧杂萘邻酮(香豆素),主要存在于土壤、动植物和坚果中,其中,最容易被afb1污染的食品有花生、玉米、核桃和水稻。afb1是已知的化学物质中致癌性最强的一种,它对人和动物均具有强烈的毒性,其毒性作用主要是对肝脏有严重的损害,因此它是引起食品安全事故的重要因素。由于极低的afb1就能引发较为显著的生理毒性,因此对其检测需要高灵敏度、高选择性和高准确性的方法。
目前,检测afb1的方法主要有高效液相色谱法、液相色谱/质谱联用法、免疫层析法和传统的酶联免疫分析法。高效液相色谱法和液相色谱/质谱联用法虽然有较高的检测准确度,但其仪器成本高,需要专业的操作人员,不适用于现场快速分析检测;免疫层析法虽有简单、快速和成本低的优点,但是其灵敏度和精密度较差;传统的酶联免疫分析法具有操作过程繁琐、成本高、检测周期长、易出现假阳性等缺点。因此,通过改良的酶联免疫方法实现对污染食品中afb1含量简单、灵敏和准确的测定变得越来越重要。
技术实现要素:
本发明的目的之一在于,克服现有技术的缺陷,提供一种基于pbnps(普鲁士蓝纳米颗粒(prussianbluenanoparticles),简写为pbnps)原位生长调控多模信号输出的黄曲霉毒素b1检测试剂盒,实现afb1便携可视的现场即时半定量及荧光准确定量检测。
为实现上述目的,本发明采用以下技术方案:一种基于pbnps原位生长调控多模信号输出的黄曲霉毒素b1检测试剂盒,该试剂盒包括afb1单克隆抗体(ab1)、生物素标记的afb1核酸适配体(bio-aptamer)、cy5标记的cdna和链霉亲和素化的mnps(sa-mnps);该链霉亲和素化的mnps偶联生物素标记的afb1核酸适配体与cy5标记的cdna杂交形成的双链dna后得到检测探针。
上述试剂盒还包括96孔聚苯乙烯微孔板、pbs缓冲液及显色底物。
具体地,上述试剂盒包括如下试剂:
(1)96孔聚苯乙烯微孔板;
(2)afb1单克隆抗体(ab1),市购产品;
(3)生物素标记的afb1核酸适配体(bio-aptamer):浓度为1μm,其核苷酸序列为:5’-gttgggcacgtgttgtctctctgtgtctcgtgcccttcgctaggccc-3’,如seqidno:1所示;
(4)cy5标记的cdna:浓度为1μm,序列为:5’-ggcctagcg-3’,如seqidno:2所示;
(5)链霉亲和素化的mnps(sa-mnps,mnps为四氧化三铁磁纳米颗粒):浓度为0.1-1mg/ml,市购产品;
(6)pbs缓冲液:浓度为0.01m,市购产品;并按常规技术配制浓度为1mg/ml牛血清白蛋白(bsa)的pbs缓冲溶液;
(7)显色底物:a液,浓度为5.88mm的h2o2溶液;b液,浓度为1.25mm的tmb溶液。
本发明的另一目的是提供一种基于pbnps原位生长调控多模信号输出的黄曲霉毒素b1检测方法,该方法步骤如下:
(1)将生物素标记的afb1核酸适配体与cy5标记的cdna按体积比1:1杂交,形成双链dna后加入到链霉亲和素化的mnps溶液中,以通过生物素与链霉亲和素特异性结合,aptamer/cdna修饰到mnps表面,得到检测探针aptamer@cdna@mnps;
(2)将afb1单克隆抗体用pbs缓冲溶液稀释后加入到96聚苯乙烯微孔板中,完成抗体包被;并用含牛血清白蛋白的pbs缓冲溶液封闭微孔板上的非特异性活性位点;
(3)向微孔板中分别加入样品溶液以及浓度梯度的afb1标准溶液,再加入步骤(1)制得的检测探针、体积比为1:3的盐酸溶液和k4fe(cn)6溶液进行超声反应;
(4)依据不同检测要求根据afb1标准溶液检测结果绘制标准曲线,将样品溶液检测结果对应绘制的标准曲线,即可对样品溶液中的afb1进行检测分析。
具体地,上述检测方法的步骤如下:
(1)取bio-aptamer和cy5标记的cdna按体积比1:1杂交,形成双链dna后加入到0.1-1mg/ml的sa-mnp溶液中,室温下孵育0.5-2h,以通过生物素与链霉亲和素特异性结合,将aptamer/cdna修饰到mnps表面,8000-12000r/mim下离心8-15min,洗涤3次,得到检测探针aptamer@cdna@mnps;
(2)用0.01m的pbs缓冲溶液稀释afb1单克隆抗体(ab1)至0.01mg/ml,之后取200μl加入96聚苯乙烯微孔板中,4℃下反应过夜,用0.01m的pbs缓冲溶液洗涤3次,完成抗体包被;再于微孔板中加入200μl浓度为1mg/ml牛血清白蛋白(bsa)的pbs缓冲溶液,避光室温孵育1h,以封闭微孔板上的非特异性活性位点,用0.01m的pbs溶液洗洗涤3次;
(3)向微孔板中分别加入200μl样品溶液、200μl浓度为10-14-10-7g/ml和0g/ml的afb1标准溶液,室温下避光孵育0.5-2h,用0.01mpbs溶液冲洗掉多余的afb1;于微孔板中加入步骤(1)制得的检测探针,室温下避光孵育0.5-2h,用pbs溶液冲洗掉未反应的探针,再向微孔板中加入体积比为1:3的盐酸溶液和k4fe(cn)6溶液,超声反应20-60min;
(4)依据不同检测要求根据afb1标准溶液检测结果绘制标准曲线,将样品溶液检测结果对应绘制的标准曲线,即可对样品溶液中的afb1进行检测分析。
上述样品溶液是将样品粉粹,取2-8g样品浸泡在20-40ml体积浓度为40%的甲醇中,搅拌均匀,离心,取上清液,稀释5倍得到。其中,离心是以3000-6000r/min离心5-10min。
上述步骤(4)中提及的检测要求为:光热检测、比色半定量检测及荧光检测,具体地:
光热检测:用808nm的红外激光照射步骤(3)中超声反应后的微孔板,以温度计为信号读出器,通过温度与afb1标准溶液浓度之间的关系,绘制标准曲线,实现对afb1快速便携检测。
比色检测;向用808nm的红外激光照射步骤(3)中超声反应后的微孔板中加入双氧水溶液和tmb溶液,反应后,观察颜色变化,并且用酶标仪记录其溶液在652nm处的紫外吸收值。通过紫外吸收值与afb1标准溶液浓度之间的关系,绘制标准曲线,实现对afb1快速半定量检测。
荧光检测:将步骤(3)超声反应后的微孔板的溶液快速离心,取上清液;用荧光成像仪对上清液进行拍照。通过imagelab软件分析其荧光强度与afb1标准溶液浓度之间的关系建立标准曲线,实现对afb1高灵敏的精确定量检测。
本发明先采用链霉亲和素化的mnps为载体及前体物,偶联目标物afb1核酸适配体与cy5标记的dna杂交形成的双链dna,因mnps较强的荧光猝灭能力及分离效率,得到荧光淬灭的检测探针,再在96聚苯乙烯微孔板上进行免疫反应后,通过抗体与核酸适配体共同识别并捕获目标物,即以mnps为前体物,在盐酸消解下释放出fe3+,k4fe(cn)6与fe3+完全反应后得到原位生长的普鲁士蓝纳米颗粒(prussianbluenanoparticles,简写为pbnps),以调控多模信号输出(温度-比色-荧光信号),完成afb1的便携-可视的半定量及实验室内精准定量检测,具体为:原位生长的pbnps具有优异的近红外光(nir)驱动的光-热转换特性(光热效应),光-热信号转导过程中产生的热量可以用温度计作为量化目标的信号读出器,通过光子-电子-声子耦合的等离子体光热转换,使基底溶液温度升高,实现对afb1快速便携的热信号检测;同时pbnps具有类似天然过氧化物酶的催化性能,能够催化无色的3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,简写为tmb)在h2o2的存在下氧化形成蓝色产物(ox-tmb,氧化态tmb),实现对afb1快速可视的比色信号检测;此外mnps作为探针基底,原位生长pbnps的过程中被盐酸刻蚀脱落含有荧光基团的dna双链,导致荧光恢复,实现对afb1的荧光精准定量检测。本发明设计的三模免疫分析方法灵敏度高,操作简单,快速便携,准确性高,将其应用afb1的检测,取得了良好的检测结果;对于被污染食品中黄曲霉毒素b1的检测具有较为重要的应用价值。
与现有技术相比,本发明的有益效果是:
(1)本多模态免疫检测方法融合了不同单模技术的优点,兼具温度信号的便携、比色信号的可视及荧光信号的高灵敏,有望同步实现目标物便携-可视的现场即时半定量及实验室内高灵敏的精准定量检测。
(2)使用核酸适配体作为目标物识别元件构建检测探针,可显著提高检测特异性,同时赋予该方法较宽的适用范围及较强的扩展性,找到相对应的核酸适体,即可应用与其他食品危害物的检测。
(3)以mnps作为探针基底,极大地增加了普鲁士蓝的负载量,进一步提高了比色、荧光和光热信号。
附图说明
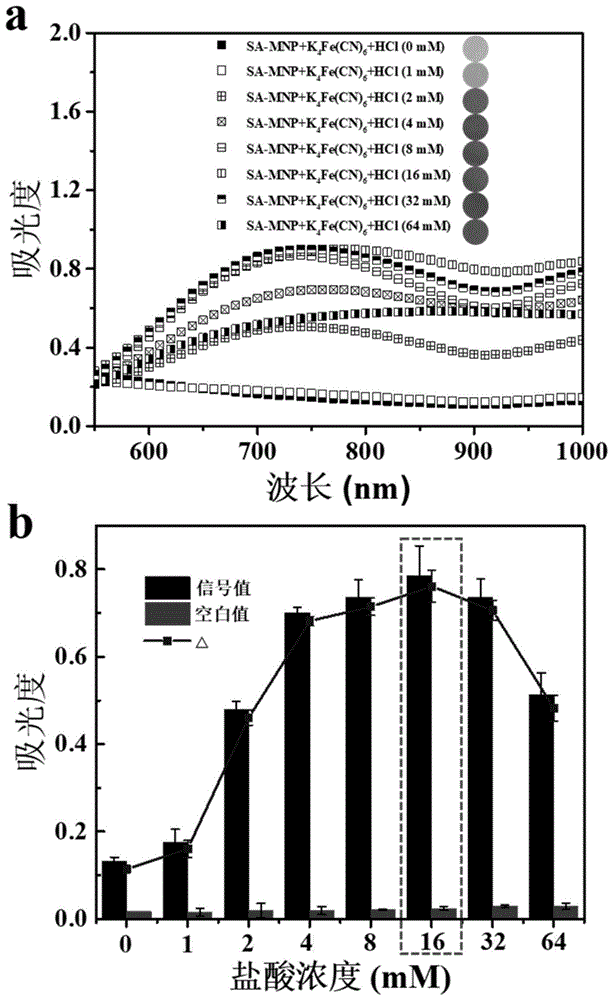
图1为本发明不同浓度的盐酸溶液下制备的mnps@pbnps的实验特性图。
其中:a为紫外光谱图,b为吸光度值变化图。
图2为本发明不同浓度的k4fe(cn)6溶液下制备的mnps@pbnps的实验特性图。
其中:a为紫外光谱图,b为吸光度值变化图。
图3为本发明不同反应时间条件下生成的mnps@pbnps的实验特性图。
其中:a为紫外光谱图,b为吸光度值变化图。
图4为本发明试剂盒用于afb1的光热检测图。
其中,a为随afb1浓度改变的溶液温度随时间的变化趋势图;b为afb1的热信号检测标准曲线。
图5为本发明试剂盒用于afb1的比色检测图。
其中:a为随afb1浓度改变的溶液紫外吸收光谱的变化趋势图;b为afb1的比色检测标准曲线。
图6为本发明试剂盒用于afb1的荧光检测图,显示了随afb1浓度改变的溶液荧光强度的变化趋势图及afb1的荧光检测标准曲线。
图7为本发明试剂盒用于afb1的回收率实验图,显示了三种检测方式对花生样品中添加的不同浓度的afb1的检测值与理论添加量的对比。
其中:1-7为同浓度的花生样品。
具体实施方式
下面结合具体实施例和附图对本发明作进一步详细的描述。
实施例1
取8支离心管,分别向其加入100μlsa-mnps和100μlk4fe(cn)6作为前体物,之后分别加入不同浓度的盐酸溶液(浓度为0、1、2、4、8、16、32、64mmol/l),置于室温下反应,40min后,观察溶液颜色的变化。此时所制得的颗粒为mnps@pbnps,在780nm左右有明显的吸收峰。用紫外分光光度计记录200-1000nm波长范围内紫外光谱图的变化。并记录在不同浓度盐酸溶液的条件下780nm波长处的吸光值以及空白样品(未加sa-mnps)在780nm波长处的吸光度值。
从图1中可以看出,当盐酸的浓度小于16mmol/l,随着盐酸浓度的增大,780nm处的吸光度也逐渐增大,溶液渐渐变为蓝色,pbnps已经生成。当盐酸浓度大于16mmol/l,780nm处的吸光度缓慢下降,溶液颜色逐渐变浅。
实施例2
取8支离心管,分别向其中加入100μlsa-mnp,然后分别加入浓度为0、0.1、0.2、0.75、1、2、5mmol/l的k4fe(cn)6溶液,之后再加入浓度为16mmol/l的盐酸溶液,置于室温下反应,40min后,观察溶液颜色的变化。随着k4fe(cn)6溶液浓度的变化,所制备的mnps@pbnps复合颗粒的颜色不同。参见图2,当k4fe(cn)6溶液浓度为1mmol/l时,780nm波长处的吸光度值最高,且溶液颜色为蓝色。因此可以说k4fe(cn)6溶液浓度为1mmol/l时,为最佳浓度。
实施例3
取1支离心管,向其中加入100μlsa-mnp,然后分别加入浓度为1mmol/l的k4fe(cn)6溶液,之后再加入浓度为16mmol/l的盐酸溶液,置于室温下反应,分别在反应0、10、20、30、40、50和60min后,记录200-1000nm波长范围内紫外光谱图的变化。随着反应时间的变化,所制备的mnps@pbnps复合颗粒在780nm处的吸光度值发生变化。参见图3,当反应40min时,780nm波长处的吸光度值最高。因此可以40min为最佳反应时间浓度。
实施例4本发明试剂盒的制备与检测
(1)取50μl的1μmbio-aptamer和50μl的1μmcdna杂交,形成双链dna后加入到1ml的0.1mg/ml的sa-mnp溶液中,室温下孵育1h时间,10000r/mim下离心8min,洗涤3次,得到检测探针aptamer@cdna@mnps;
(2)用0.01m的pbs缓冲溶液稀释afb1单克隆抗体(ab1)至0.01mg/ml,之后取200μl加入96聚苯乙烯微孔板中,4℃下反应过夜,用0.01m的pbs缓冲溶液洗涤3次,完成抗体包被;
(3)向步骤(2)中加入200μl浓度为1mg/ml牛血清白蛋白(bsa)的pbs缓冲溶液,避光室温孵育1h,封闭微孔板上的非特异性活性位点,用0.01m的pbs溶液洗洗涤3次;
(4)向步骤(3)中分别加入200μl的样品溶液、以及200μl浓度为10-7g/ml、10-8g/ml、10-9g/ml、10-10g/ml、10-11g/ml、10-12g/ml、10-13g/ml、10-14g/ml和0g/ml的afb1标准溶液,室温下避光孵育1h,用0.01mpbs溶液冲洗掉多余的afb1;
(5)取步骤(1)制得的检测探针加入到步骤(4)中,室温下避光孵育1h,用pbs溶液冲洗掉未反应的探针。向微孔板中加入16μl浓度0.1m的盐酸溶液和40μl浓度为5mm的k4fe(cn)6溶液,超声反应40min。mnps被盐酸刻蚀后,释放出fe3+,k4fe(cn)6与fe3+完全反应后得到原位生长的pbnps。
光热检测:用808nm的红外激光照射步骤(5)中超声反应后的微孔板,以温度计为信号读出器,通过图4a可以看到温度随着afb1的浓度增大而增加。根据温度与afb1标准溶液浓度之间的关系,绘制标准曲线,如图4b所示,y=40.6+5.26lgx。
比色检测:向温度检测中808nm激光照射过的溶液中加入50μl含有双氧水的a液和50μl含有tmb的b液,反应后,观察颜色变化,并且用酶标仪记录其溶液在652nm处的紫外吸收值。通过图5a可知溶液颜色随着afb1的浓度增大而加深,并且在652nm处的吸光度值逐渐增大。根据紫外吸收值与afb1标准溶液浓度之间的关系,绘制标准曲线,如图5b所示,y=0.398+0.069lgc。
荧光检测:将步骤(5)中超声反应后的微孔板的溶液快速离心,取上清液;用荧光成像仪对上清液进行拍照。通过imagelab软件分析其荧光强度与afb1标准溶液浓度之间的关系建立标准曲线,如图6所示,y=2625.01+330.68lgx。由图6可知荧光强度随着afb1的浓度增大而增强。
实施例5回收率试验
花生样品溶液的制备:将花生样品粉粹,取5g浸泡在25ml40%的甲醇中,搅拌10min后,以4000r/min离心5min,取上清液1ml稀释5倍。
首先在96孔聚苯乙烯微孔板中加入afb1抗体,4℃反应过夜后,用pbs缓冲液洗涤3次,加入bsa封闭剂反应1h后,用pbs溶液洗涤3次再加入同浓度的花生样品(1-7)溶液50μl和不同浓度的afb1(0.05-1ng/ml)反应1h,同样用pbs溶液洗涤3次,加入0.01mg/ml的sa-mnps反应1h,用pbs溶液洗涤3次,紧接着加入1mm的k4fe(cn)6和16mm的hcl溶液,超声反应40min,观察它的温度/比色/荧光信号。如图7所示,理论添加值与三种检测方法的实际检测值是比较一致的,说明基于pbnps原位生长调控多模信号输出的黄曲霉毒素b1检测试剂盒有着良好的准确性。
以上内容仅为本发明的较佳实施例,对于本领域的普通技术人员,依据本发明的思想,在具体实施方式及应用范围上均会有改变之处,本说明书内容不应理解为对本发明的限制。
序列表
<110>湖南农业大学
<120>基于pbnps原位生长调控多模信号输出的黄曲霉毒素b1检测试剂盒及方法
<130>004
<160>2
<170>siposequencelisting1.0
<210>1
<211>47
<212>dna
<213>人工序列()
<400>1
gttgggcacgtgttgtctctctgtgtctcgtgcccttcgctaggccc47
<210>2
<211>9
<212>dna
<213>人工序列()
<400>2
ggcctagcg9
- 还没有人留言评论。精彩留言会获得点赞!