生物粒子定位感测方法及系统与流程
1.本发明与生物粒子定位感测方法及系统有关;特别是指一种可提高生物粒子检测效率的生物粒子定位感测方法及系统。
背景技术:
2.随着科技发展,生物医学的检测技术也越发进步,对于特定的生物粒子也能利用免疫方式提升检测的准确性。在过去,生物粒子主要是利用免疫荧光显色的方式进行高精密度的检测;详言之,免疫荧光显色是针对生物粒子的特定表面抗原,利用具有抗体的荧光材料进行专一性辨识,使目标生物粒子在特定波长的光线照射下,放射出荧光,并且利用感测器进行侦测。
3.然而,对于样品数量庞大或荧光微弱的样品,传统生物粒子的检测方法无法有效地完成检测;举例来说,传统生物粒子的检测装置系以电荷耦合装置或光敏装置作为感测器,并通过感测器撷取每个视野下的影像,经过软件运算拼凑成完整的影像后再通过智能软件辨识特定荧光讯号,这类感测器的侦测极限值较高,因此对于荧光微弱的样品无法准确地侦测,而有较高比例的失准;另外,上述感测器的感测所需时间较长,因此对于数量庞大的样品,无法快速地完成检测,而使得检测效率低落。
4.据此,目前亟需一种新颖的生物粒子定位感测方法及系统,以改善传统检测方法及系统长期存在的技术问题。
技术实现要素:
5.有鉴于此,本发明之目的在于提供一种生物粒子定位感测方法及系统,其利用第一感测器先快速且敏锐地筛选出具有特定生物粒子的检测区域,并且记录所述检测区域的位置信息,接着,第二感测器根据位置信息,移动至具有特定生物粒子的检测区域,对于检测区域中特定生物粒子进行高精度的检测步骤,并且记录特定生物粒子在活性检测区域中的准确位置及相关信息。
6.缘以达成上述目的,本发明提供的一种生物粒子定位感测方法,包括至少以下步骤:
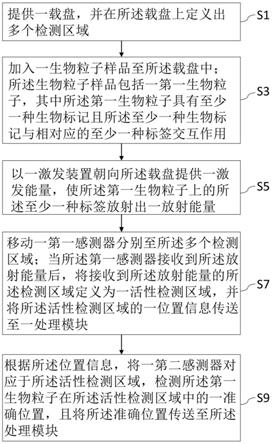
7.提供一载盘,并在所述载盘上定义出多个检测区域;
8.加入一生物粒子样品至所述载盘中;所述生物粒子样品包括一第一生物粒子,其中所述第一生物粒子具有至少一种生物标记且所述至少一种生物标记与相对应的至少一种标签交互作用;
9.以一激发装置朝向所述载盘提供一激发能量,使所述第一生物粒子上的所述至少一种标签放射出一放射能量;
10.相对地移动一第一感测器分别至所述多个检测区域;当所述第一感测器接收到所述放射能量后,将接收到所述放射能量的所述检测区域定义为一活性检测区域,并将所述活性检测区域的一位置信息传送至一处理模块;以及
11.根据所述位置信息,将一第二感测器对应于所述活性检测区域,检测所述第一生物粒子在所述活性检测区域中的一准确位置,且将所述准确位置传送至所述处理模块。
12.本发明之另一目的在于提供一种生物粒子定位感测系统,所述生物粒子定位感测系统包括一载盘、一激发装置、一第一感测器及一第二感测器;其中,所述载盘定义有多个检测区域,且一生物粒子样品设置于所述载盘中;所述生物粒子包括一第一生物粒子,其中所述第一生物粒子具有至少一种生物标记;所述至少一种生物标记与相对应的至少一种标签交互作用;所述激发装置可受操控地移动至靠近所述载盘,且朝向所述载盘提供一激发能量,使所述第一生物粒子上的所述至少一种标签放射出一放射能量;所述第一感测器可受操控地相对于所述载盘移动,且分别移动至所述多个检测区域;当所述第一感测器接收到所述放射能量后,将接收到所述放射能量的所述检测区域定义为一活性检测区域,并将所述活性检测区域的一位置信息传送至一处理模块;所述第二感测器根据所述位置信息相对于所述载盘移动至所述活性检测区域,检测所述第一生物粒子在所述活性检测区域中的一准确位置,且将所述准确位置传送至所述处理模块。
13.本发明之效果在于,利用第一感测器先快速且敏锐地筛选出具有特定生物粒子的检测区域,并且记录所述检测区域的位置信息,接着,第二感测器根据位置信息,移动至具有特定生物粒子的检测区域,对于检测区域中特定生物粒子进行高精度的检测步骤,并且记录特定生物粒子在活性检测区域中的准确位置及相关信息。借此,本发明提供的生物粒子定位感测方法及系统可提高生物粒子检测效率,同时兼具高精确度,以改善传统生物检测装置及方法对于样品数量庞大或荧光微弱的样品无法有效地完成检测的诸多问题。
附图说明
14.图1为本发明一优选实施例之生物粒子定位感测方法的流程图。
15.图2为图1的补充流程图。
16.图3为本发明一优选实施例之生物粒子定位感测系统的上视图。
17.图4为图3中剖面线4-4的剖视图。
18.图5为本发明一优选实施例之生物粒子定位感测系统的另一剖视图。
19.图6为本发明另一优选实施例之生物粒子定位感测系统的剖视图。
20.图7为本发明又一优选实施例之生物粒子定位感测系统的剖视图。
具体实施方式
21.为能更清楚地说明本发明,兹举优选实施例并配合附图详细说明如后。请参图1至图6所示,图1为本发明一优选实施例之生物粒子定位感测方法的流程图;图2为图1的补充流程图;图3为本发明一优选实施例之生物粒子定位感测系统的上视图;图4为图3中剖面线4-4的剖视图;图5为本发明一优选实施例之生物粒子定位感测系统的另一剖视图;图6为本发明另一优选实施例之生物粒子定位感测系统的剖视图。
22.请先参考图4及图5,一种生物粒子定位感测系统包括一载盘10、一激发装置20、一第一感测器30及一第二感测器40。所述载盘10定义有多个检测区域12,且一生物粒子样品bp1、bp2、bp3设置于所述载盘10中;所述生物粒子bp1、bp2、bp3包括一第一生物粒子bp1,其中所述第一生物粒子bp1具有至少一种生物标记(未图示);所述至少一种生物标记与相对
应的至少一种标签(未图示)交互作用。
23.所述激发装置20可受操控地移动至靠近所述载盘10,且朝向所述载盘10提供一激发能量,使所述第一生物粒子bp1上的所述至少一种标签放射出一放射能量。附着于所述第一生物粒子bp1上的所述标签组成物吸收所述激发能量,放射出所述放射能量。在本发明实施例中,所述生物粒子bp1、bp2、bp3包括一第二生物粒子bp2、bp3,所述第二生物粒子bp2、bp3不与所述至少一种标签交互作用,因此所述第二生物粒子bp2、bp3不会产生所述放射能量。在本发明另一实施例中,所述第一生物粒子的所述至少一种生物标记与相对应的所述至少一种标签的免疫匹配关系及激发所述至少一种标签上的荧光分子放射荧光的作用机制可适用于荧光共振能量转移作用(fret)及生物发光共振能量转移作用(bret)。
24.所述第一感测器30可受操控地相对于所述载盘10移动,且分别移动至所述多个检测区域12;当所述第一感测器30移动至对应于所述多个检测区域12中的一个,且所述第一感测器30接收到所述放射能量后,第一感测器30将接收到所述放射能量的所述检测区域12定义为一活性检测区域121,并将所述活性检测区域121的一位置信息传送至一处理模块p。所述第二感测器40根据所述位置信息移动至所述活性检测区域121,检测所述第一生物粒子bp1于所述活性检测区域121中的一准确位置122,且将所述准确位置122传送至所述处理模块p。在本发明另一实施例中,所述载盘系可受操控地相对于所述第一感测器移动,且使所述多个检测区域分别移动至对应于所述第一感测器。
25.接着请参考图1,生物粒子定位感测方法,包括至少以下步骤:
26.步骤s1:提供一载盘10,并在所述载盘10上定义出多个检测区域12;
27.步骤s3:加入一生物粒子样品bp1、bp2、bp3至所述载盘10中;所述生物粒子样品bp1、bp2、bp3包括一第一生物粒子bp1,其中所述第一生物粒子bp1具有至少一种生物标记(未图示)且所述至少一种生物标记与相对应的至少一种标签(未图示)交互作用;
28.步骤s5:以一激发装置20朝向所述载盘10提供一激发能量,使所述第一生物粒子bp1上的所述至少一种标签放射出一放射能量;
29.步骤s7:相对地移动一第一感测器30分别至所述多个检测区域12;当所述第一感测器30移动至对应于所述多个检测区域12中的一个,且所述第一感测器30接收到所述放射能量后,所述第一感测器30将接收到所述放射能量的所述检测区域12定义为一活性检测区域121,并将所述活性检测区域121的一位置信息传送至一处理模块p;以及
30.步骤s9:根据所述位置信息,将一第二感测器40对应于所述活性检测区域121,检测所述第一生物粒子bp1在所述活性检测区域121中的一准确位置122,且将所述准确位置122传送至所述处理模块p。
31.根据本发明实施例,在步骤s3中,所述生物粒子bp1、bp2、bp3包括一第二生物粒子bp2、bp3,所述第二生物粒子bp2、bp3不与所述至少一种标签交互作用,因此在步骤s5中,所述第二生物粒子bp2、bp3不会产生所述放射能量,如图5所示。所述生物粒子bp1、bp2、bp3包括但不限于细胞、细菌、真菌、藻类、原虫、蠕虫、病毒、蛋白载体、核酸载体或其组合。
32.根据本发明实施例,所述至少一种生物标记包括位于生物粒子上或位于生物粒子内的至少一种核酸、蛋白质或多醣类分子,所述至少一种标签包括蛋白质、核酸、多醣类分子或特定化合物。在本发明另一实施例中,所述至少一种生物标记包括位于所述生物粒子上的至少一种表面抗原,所述至少一种标签包括至少一种抗体或化学分子染剂,以专一性
地辨识所述至少一种表面抗原或细胞质间、细胞核内蛋白质或核酸;另外,所述至少一种标签包括一冷光结构、一荧光结构、一磷光结构、一物理性可辨识结构、一化学性可辨识结构或其组合。根据本发明实施例,所述至少一种生物标记包括epcam、cd45、cd71、gpa、核酸或其组合,但不以此为限制,任何可能出现在细胞表面的表面抗原皆可适用于本发明实施例。根据本发明实施例,所述荧光结构包括荧光蛋白、量子点粒子(quantum dot)或其组合。根据本发明实施例,当所述至少一种生物标记为epcam时,其激发波长范围为450nm至500nm,放射波长范围为520nm至555nm;当所述至少一种生物标记为核酸时,其激发波长范围为380nm至420nm,放射波长范围为540nm至560nm;当所述至少一种生物标记为cd45时,其激发波长范围为600nm至650nm,放射波长范围为660nm至720nm。根据本发明另一实施例,相较于一般荧光分子,量子点粒子具有较宽的激发波长范围(10nm以上),并产生较窄的放射波长范围,且放射光谱较为对称,以与其他放射波长范围的量子点粒子产生明显差异;除此之外,量子点粒子可通过其粒径大小而调控其放射波长范围,因此具有不同粒径尺寸的量子点粒子可使用相同激发波长范围的激发光源激发且放射出不同放射波长范围的放射光,以使用相同量子点材料及激发波长达到标记辨识多种生物标记的目的。量子点粒子还具有高荧光强度、荧光寿命长、稳定性佳及生物兼容性佳等诸多优点,因此在本发明另一实施例中,可利用量子点粒子对于生物粒子上或生物粒子内的生物标记进行标记及辨识。
33.根据本发明实施例,所述激发装置20包括一冷光源、一雷射光源、一紫外光源、一可见光源、一红外光源、一超声波产生器、一电磁波产生器、一微波产生器或其组合。在步骤s5中,所述激发装置20朝向所述载盘10提供的所述激发能量包括激发光线、激发声波、激发电磁波或其组合,且所述第一生物粒子bp1上的所述至少一种标签所放射出的所述放射能量包括光讯号、电讯号、磁讯号、声波讯号或其组合。
34.在本发明实施例中,所述第一感测器30包括光电倍增管(pmt)、电荷耦合元件(ccd)、光敏电阻、超声波感测器、感应线圈或其组合;所述第一感测器30优选为可侦测微弱光源的光电倍增管(pmt),而在本发明一实施例中,光电倍增管(pmt)的侦测极限可以为小于或等于5v,例如可为1v、1.5v、2v、2.5v、3v、3.5v、4v、4.5v或5v;第二感测器40优选为可提供高影像分辨率的电荷耦合元件(ccd)、互补式金属氧化半导体元件(cmos;complementary metal-oxide semiconductor)或其组合,但不以此为限制。在本发明一实施例中,当所述放射能量为光讯号时,所述光讯号到达所述第一感测器具有一第一光路径,所述光讯号到达所述第二感测器具有一第二光路径,所述第一光路径与所述第二光路径相同或不同。若所述第一光路径与所述第二光路径不同,则所述第一光路径与所述第二光路径各自为独立光路径。
35.接着请参考图2及图3,在步骤s7中,相对地移动所述第一感测器30分别至所述多个检测区域12包括使所述第一感测器30依一移动路径r相对于所述载盘行进(即步骤s71),所述移动路径r系依一预定顺序通过对应于所述多个检测区域12的位置(即步骤s73)。在本发明实施例中,所述移动路径r可为线性逐行扫描(如图3所示)或以载盘10中心为圆心进行环状扫描或任何可通过所述多个检测区域的扫描方式。在步骤s7中,相对地移动所述第一感测器30分别至所述多个检测区域12系指所述第一感测器与所述载盘相对移动,即固定所述载盘而使所述第一感测器受操控地相对于所述载盘移动,或固定所述第一感测器而使所述载盘可受操控地相对于所述第一感测器移动,使所述多个检测区域分别移动至对应于所
述第一感测器。
36.在本发明另一实施例中,所述激发装置20、所述第一感测器30及所述第二感测器40系设置于同一机械手臂50上,当所述机械手臂50动作时,所述激发装置20、所述第一感测器30及所述第二感测器40同步移动,如图4及图5所示;换言之,生物粒子定位感测方法的步骤s5、s7、s9可同步进行,也可将步骤s5结合步骤s7及步骤s5结合步骤s9分为两阶段进行。在图4及图5中,所述机械手臂50可受控制地沿水平方向d1及垂直方向d2移动。在步骤s9中,所述载盘亦可受操控地相对于所述第二感测器移动,且使所述多个活性检测区域分别移动至对应于所述第二感测器。
37.在本发明另一实施例中,所述激发装置20及所述第一感测器30设置于机械手臂50a上,另一激发装置20及所述第二感测器40设置于机械手臂50b上,且所述多个激发装置20、所述第一感测器30及所述第二感测器40及所述多个机械手臂50a、50b系讯号连接于所述处理模块p,所述多个激发装置20、所述第一感测器30及所述第二感测器40及所述多个机械手臂50a、50b系通过所述处理模块p控制动作及位移,如图6所示;换言之,在本实施例中,生物粒子定位感测方法可将步骤s5结合步骤s7及步骤s5结合步骤s9分为两阶段进行。在图6中,所述机械手臂50a、50b可受控制地沿水平方向d1及垂直方向d2移动。
38.在图4中,所述载盘10具有一透明底部14,且所述激发装置20、所述第一感测器30及所述第二感测器40系在所述载盘10的所述透明底部14的下方移动。所述载盘10系设置于一承载台60的一容置槽602内,所述容置槽602具有一开口,所述载盘10的所述透明底部14系对应于所述开口。除此之外,在本发明另一实施例中,所述激发装置、所述第一感测器及所述第二感测器系在所述载盘的上方移动。
39.在本发明实施例中,所述承载台60与所述第一感测器30之间所形成的光路以及所述承载台60与所述第二感测器40之间所形成的光路上分别设置有一滤光镜组,以提高第一感测器30及所述第二感测器40的感测灵敏度及准确率。
40.举例来说,在图6中所述承载台60包括一滤光镜组62覆盖于所述开口,当所述激发装置20、所述第一感测器30及所述第二感测器40在所述载盘10下方动作时,所述激发能量及所述放射能量透射所述滤光镜组62,使所述第一感测器30及所述第二感测器40接收所述放射能量。值得一提的是,因为雷射发射的波长与所述至少一种标签上的荧光分子被雷射激发后释放的波长不同,因此设置于开口的滤光镜组62至少包括透镜、滤镜、及反射镜的组合,以使激发光(即雷射光)及放射光(即荧光)可经由滤光镜组62的不同光路径通过,进而通过滤光镜组62提高第一感测器30及所述第二感测器40的感测灵敏度及准确率。
41.在本发明另一实施例中,在图7中所述第一感测器30包括一滤光镜组32覆盖于所述第一感测器30的光入射面,而所述第二感测器40包括一滤光镜组42覆盖于所述第二感测器40的光入射面。当所述激发装置20、所述第一感测器30及所述第二感测器40在所述载盘10下方动作时,所述激发能量及所述放射能量透射所述滤光镜组32、42,使所述第一感测器30及所述第二感测器40接收所述放射能量。值得一提的是,因为雷射发射的波长与所述至少一种标签上的荧光分子被雷射激发后释放的波长不同,因此设置于开口的滤光镜组32、42至少包括透镜、滤镜、及反射镜的组合,以使激发光(即雷射光)及放射光(即荧光)可经由滤光镜组32、42的不同光路径通过,进而通过滤光镜组32、42提高第一感测器30及所述第二感测器40的感测灵敏度及准确率。
42.在本发明一实施例中,第二感测器40优选为可提供高影像分辨率的高速电荷耦合元件(high-speed ccd),第二感测器40可用于确认所述第一生物粒子bp1出现于所述载盘10上的所述活性检测区域121中的所述准确位置122,并将活性检测区域121的准确位置122的信息回馈所述处理模块p。所述第一生物粒子bp1可为一颗或多颗,第二感测器40可进一步的撷取所述第一生物粒子bp1的清晰影像。
43.在本发明一实施例中,所述第一生物粒子bp1上的一个或多个表面抗原被一个或多个抗体所结合,所述一个或多个抗体上具有一个或多个荧光分子可被特定辐射源激发并释放特定荧光讯号,光电倍增管(pmt)侦测所述荧光讯号初步确认所述第一生物粒子bp1存在的活性检测区域121,接着以电荷耦合元件(ccd)拍摄不同荧光讯号后确认所述第一生物粒子bp1的准确位置122,利用所述准确位置122来分选第一生物粒子bp1及其他生物粒子bp2、bp3。
44.在本发明一实施例中,所述第一生物粒子bp1可以为循环肿瘤细胞(ctc),所述循环肿瘤细胞上的表面抗原可以被至少一种带有荧光分子的抗体所辨识。举例来说,循环肿瘤细胞(ctc)上的epcam表面抗原可以与epcam抗体结合,产生第一荧光讯号,hoechst抗体可以与循环肿瘤细胞(ctc)内的核酸结合产生第二荧光讯号;但因循环肿瘤细胞(ctc)上无cd45抗原,无法与cd45抗体结合,因此不会产生一第三荧光讯号,所以光电倍增管(pmt)在一检测区域内若能侦测到第一荧光讯号与第二荧光讯号,但不能侦测到第三荧光讯号则认定所述第一生物粒子bp1即循环肿瘤细胞(ctc)出现在所述检测区域内,且光电倍增管(pmt)回传所述循环肿瘤细胞(ctc)所存在的检测区域12的位置至所述处理模块p。
45.在本发明之另一实施例中,若所述第二生物粒子bp2所在的检测区域无法让光电倍增管(pmt)侦测到第一荧光讯号或第二荧光讯号,或可让光电倍增管(pmt)侦测到第三荧光讯号,则认定所述第二生物粒子bp2并非循环肿瘤细胞(ctc),即所述第一生物粒子bp1并未出现在所述检测区域,此时,光电倍增管(pmt)将略过所述第二生物粒子bp2所在的检测区域。抑或者是,若所述第三生物粒子bp3所在的检测区域让光电倍增管(pmt)只能侦测到第一荧光讯号及第二荧光讯号中的一个,但不能侦测到第一荧光讯号及第二荧光讯号中的另一个,则认定所述第三生物粒子bp3并非循环肿瘤细胞(ctc),此时,光电倍增管(pmt)将略过所述第三生物粒子bp3所在的检测区域。由此可知,在本发明实施例中,可通过光电倍增管(pmt)快速扫描及侦测生物粒子bp1、bp2、bp3所在的检测区域所表现的荧光讯号,并且实时判断生物粒子bp1、bp2、bp3是否出现在所述检测区域,以立即针对所述第一生物粒子bp1所存在的活性检测区域121进行记录定位。
46.接着,当光电倍增管(pmt)回传循环肿瘤细胞(ctc)所存在的活性检测区域121的位置到所述处理模块p并排除未有循环肿瘤细胞(ctc)所存在的检测区域后,电荷耦合元件(ccd)移动到所述活性检测区域121。若电荷耦合元件(ccd)在所述活性检测区域121的视野下能侦测到具有第一荧光讯号与第二荧光讯号,但不具有第三荧光讯号的生物粒子,则确认所检测的第一生物粒子bp1为循环肿瘤细胞(ctc),并且回传所述循环肿瘤细胞(ctc)在活性检测区域121中的准确位置122至所述处理模块p,以及由所述电荷耦合元件(ccd)所回馈的准确位置122中分辨出所述第一生物粒子bp1。
47.根据本发明实施例,利用第一感测器先快速且敏锐地筛选出具有特定生物粒子的检测区域,并且记录所述检测区域的位置信息,接着,第二感测器根据位置信息,移动至具
有特定生物粒子的检测区域,对于检测区域中特定生物粒子进行高精度的检测步骤,并且记录特定生物粒子在活性检测区域中的准确位置及相关信息。借此,本发明提供的生物粒子定位感测方法及系统可提高生物粒子检测效率,同时兼具高精确度,以改善传统生物检测装置及方法对于样品数量庞大或荧光微弱的样品无法有效地完成检测的诸多问题。
48.以上所述仅为本发明优选可行实施例而已,举凡应用本发明说明书及申请专利范围所为之等效变化,理应包含在本发明之专利范围内。
49.附图标记说明
50.[本发明]
[0051]
10:载盘
[0052]
12:检测区域
[0053]
121:活性检测区域
[0054]
122:准确位置
[0055]
14:透明底部
[0056]
20:激发装置
[0057]
30:第一感测器
[0058]
40:第二感测器
[0059]
50、50a、50b、50c:机械手臂
[0060]
60:承载台
[0061]
602:容置槽
[0062]
62、32、42:滤光镜组
[0063]
4-4:剖面线
[0064]
bp1、bp2、bp3:生物粒子
[0065]
d1:水平方向
[0066]
d2:垂直方向
[0067]
p:处理模块
[0068]
r:移动路径
[0069]
s1、s3、s5、s7、s9、s71、s73:步骤
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1