一种乳粉或乳清粉中唾液酸含量的检测方法与流程
1.本发明属于食品检测技术领域,具体涉及一种乳粉或乳清粉中唾液酸残留量的检测方法。
背景技术:
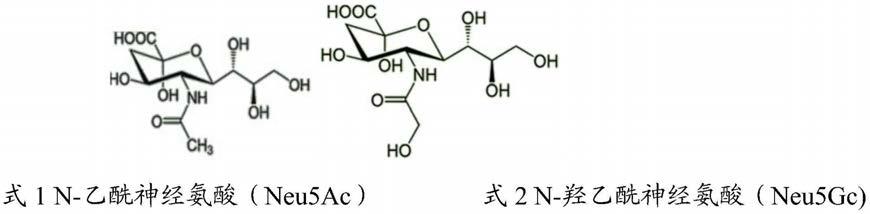
2.唾液酸(sialic acid,sa)是一族神经氨酸(neuraminic acid)氮或氧基取代的衍生物,广泛存在于多种生物组织,是构成细胞膜上糖蛋白和糖脂的重要成分。在大部分哺乳动物组织中发现的唾液酸主要是n-乙酰神经氨酸(neu5ac),见式1,在狭义上讲通常把n-乙酰神经氨酸称为唾液酸。唾液酸参与细胞表面多种生理功能,也是一种天然的大脑营养素,对婴幼儿的免疫系统和认知发育起到重要的作用。研究发现,牛乳中总唾液酸含量不到人乳唾液酸总量的25%,并且,人乳中存在大量的n-乙酰神经氨酸,不含有n-羟乙酰神经氨酸(neu5gc),见式2,而牛乳中含有占总唾液酸含量5%的n-羟乙酰神经氨酸。因此,普通婴幼儿配方粉与人乳相比,其所含的唾液酸种类与含量与人乳存在显著差异。为贴近人乳这个金标准,厂商常把富含酪蛋白糖巨肽(casein glycomacropeptide,cgmp)的乳清粉作为配方粉的原料(其中酪蛋白糖巨肽是一种含有唾液酸的糖肽),以此来强化奶粉中唾液酸含量,使婴幼儿配方粉更加贴近母乳。
3.目前检测乳制品中唾液酸的方法有很多,包括紫外分光光度法、液相色谱法、液相色谱-串联质谱法和离子色谱法等。紫外分光光度法是最早用于唾液酸检测的方法,其原理是利用酸水解释放牛奶中的唾液酸,利用cu
2+
和cr
3+
协同催化唾液酸与间苯二酚显色,用乙酸乙酯—正丁醇萃取有色物质,在615nm波长处进行测定。由于该方法存在步骤繁琐、灵敏度低、检测结果不稳定等缺陷,因此很少应用于乳制品这种的复杂基质。高效液相色谱法检测乳中唾液酸有许多不同方式,最典型的是采用高效液相色谱-荧光检测器搭配4,5-亚甲二氧基-1,2-邻苯二胺盐(4,5-methylenedioxy-1,2-phenylenediamin edihydroc hloride,dmb)衍生法。dmb衍生法可同时得到n-乙酰化神经氨酸和o-乙酰化的神经氨酸,虽然灵敏度较高,但操作比较繁琐。液相色谱-串联质谱法虽然不需要唾液酸衍生过程,但该法仪器造价高,难以推广。离子色谱法相比以上检测手段具有灵敏度高、前处理无需衍生、仪器普及度高等优点,且该法所用到的试剂对环境污染小,符合绿色化学的倡导。
4.法规方面,2017年5月国家计生委将n-乙酰神经氨酸批准为新食品原料。随着中国配方制度的实施,产品中一个新原料的加入不但要符合添加剂的要求,还要做到保质期内的稳定性验证,并且要有能够经过验证的检验方法来证实添加量符合标示值的要求。然而,
目前我国尚未颁布乳清粉和配方奶粉中唾液酸含量的检测标准方法。如何准确、高效、安全地测定乳清粉和乳粉中唾液酸的含量成了近年来的一大难点。
技术实现要素:
5.本发明的目的在于提供一种快速、精准检测乳清粉和乳粉中的唾液酸含量的方法,通过对乳粉和乳清粉进行不同的提取过程,能够更好地进行除杂净化,节约处理步骤,从而使得提取的唾液酸纯度更高,检测效率更高。
6.根据本发明的一个方面,提供一种乳粉或乳清粉中唾液酸含量的检测方法,包括以下步骤:
7.将乳粉或乳清粉溶解于水中,得到乳粉水溶液或乳清粉水溶液;
8.向所述乳粉水溶液或所述乳清粉水溶液添加酸溶液,得到乳粉酸溶液或乳清粉酸溶液;
9.对所述乳粉酸溶液或乳清粉酸溶液加热进行水解,得到乳粉水解液或乳清粉水解液;
10.将所述乳粉水解液或乳清粉水解液进行离心分离后,得到乳粉上清液或乳清粉上清液;
11.将所述乳清粉上清液经稀释后进行第一过滤,得到乳清粉滤液;或者对所述乳粉上清液进行固相萃取,用水淋洗,并用氯化钠溶液洗脱收集得到乳粉洗脱液,将所述乳粉洗脱液稀释进行第二过滤后获得乳粉滤液;
12.将所述乳清粉滤液或乳粉滤液用高效阴离子交换色谱-电化学检测器测定。
13.优选地,所述酸溶液为硫酸水溶液、三氟乙酸水溶液和盐酸水溶液中的一种或多种。
14.优选地,固相萃取步骤采用固相萃取柱dionex on guard ii a进行。
15.优选地,所述固相萃取柱预先用水活化。
16.优选地,所述水解的温度为80
±
1℃,时间为1小时。
17.优选地,所述第一过滤和第二过滤独立地采用0.22微米的水相滤膜进行。
18.优选地,所述检测方法使用包含au电极和ag/agcl参比电极的高效阴离子交换色谱-电化学检测器,并使用糖标准四电位波形。
19.优选地,离心分离步骤在4-10℃的温度下进行。
20.优选地,固相萃取步骤采用3mm
×
150mm的dionex carbopac pa 20色谱柱,所述梯度洗脱条件为淋洗液a:100mmol/l氢氧化钠;淋洗液b:100mmol/l naoh与400mmol/l乙酸钠;洗脱梯度为:0-15min,97.5%-50%a;15-20min,50%a;20.1-25min,97.5%a。流速:0.5ml/min,进样量:10μl。
21.优选地,所述乳粉水溶液与酸溶液的体积比为1:10,所述乳清粉水溶液与酸溶液的体积比为1:5。
22.根据本发明的测定方法操作简单,针对不同的基质进行前处理,有效提高检测效率,降低检测成本,实现了高准确度,能够对乳清粉和乳粉中三种状态的n-乙酰神经氨酸总量进行准确的定性和定量分析。
附图说明
23.参考随附的附图,本发明更多的目的、功能和优点将通过本发明实施方式的如下描述得以阐明,其中:
24.图1示出了富含酪蛋白糖巨肽的乳清粉中neu5ac的色谱分离图谱;
25.图2示出了婴幼儿配方粉中neu5ac的色谱分离图谱。
具体实施方式
26.为了更加清楚地理解本发明的技术特征、目的和有益效果,现对本发明的技术方案进行进一步的详细说明。应理解,以下具体实施方式仅是示例性的,本发明的技术方案不限于以下所列举的具体实施方式。
27.本发明提供的乳粉或乳清粉中唾液酸含量的检测方法,包括溶解步骤、水解步骤、离心分离步骤、净化步骤和测定步骤,其中净化步骤包括固相萃取步骤。
28.本发明检测的乳清粉是指以羊乳或牛乳为基体的乳清蛋白粉、α-乳清蛋白粉、浓缩乳清蛋白粉、脱盐乳清粉(d90、d70)、富含酪蛋白糖巨肽的乳清粉、富含乳脂肪球膜的乳清粉。乳粉包括以牛、羊、驼或其他哺乳动物乳为基体的各类婴幼儿配方粉和成人粉。
29.其中,溶解步骤包括将乳粉或乳清粉溶解于水中,得到乳粉水溶液或乳清粉水溶液,优选地,包括涡旋振荡摇匀。
30.根据一个具体实施方式,上述溶解步骤包括:准确称取乳清粉0.1g(精确至0.0001g),用水溶解并定容于10ml容量瓶中,涡旋震荡摇匀;或者准确称取奶粉样品1g(精确至0.0001g),用水溶解并定容于10ml容量瓶中,涡旋震荡混匀。
31.所述水解步骤包括向所述乳粉水溶液或所述乳清粉水溶液添加酸溶液,得到乳粉酸溶液或乳清粉酸溶液。本发明可用的酸溶液可为硫酸水溶液、三氟乙酸水溶液和盐酸水溶液中的一种或多种,优选硫酸水溶液,更优选0.05mol/l的稀硫酸。
32.根据一个具体实施方式,所述乳粉水溶液与酸溶液的体积比为1:10,所述乳清粉水溶液与酸溶液的体积比为1:5。该水解过程的加热优选可通过恒温水浴加热的方式进行。
33.具体地,取乳清粉水溶液1ml于15ml离心管中,使用硫酸溶液(0.05mol/l)定容到10ml;取乳粉水溶液2ml样液于15ml离心管中,使用硫酸溶液(0.05mol/l)定容到10ml,进行水解处理。
34.根据一个具体实施方式,将制备好的乳清粉酸溶液或乳粉酸溶液放置在恒温水浴锅中,调整水浴锅温度,该过程中使用水银温度计插入水解液中实际测量,直到水解液温度达到80℃,保持水浴锅温度在该状态下恒定,水解1小时后取出放置至室温。
35.水解完成后的离心分离步骤包括将乳粉水解液或乳清粉水解液转移至离心管,进行离心分离后,得到乳粉上清液或乳清粉上清液。离心分离步骤在4-10℃、6000rpm下,进行离心5分钟。
36.将上述乳清粉上清液经稀释后进行第一过滤,得到乳清粉滤液。具体地,乳清粉上清液用水稀释20倍(例如,取乳清粉上清液0.5ml,用水稀释至10ml),过0.22μm的水相滤膜过滤,用于高效阴离子交换色谱-电化学检测器测定。
37.另一方面,对以上获得的乳粉上清液进行固相萃取步骤,包括将离心分离步骤后得到的样液去除上层脂肪,取上清液,转移至hco
3-型的聚二乙烯苯强碱型阴离子交换树脂
的固相萃取柱(dionex on guard ii a柱,规格2.5cc)中,保持样液流出速度约1d/2-3s。待液体流出后,用10ml水淋洗固相萃取柱,保持淋洗液流出速度1d/s。再用0.05mol/l的氯化钠溶液洗脱,收集洗脱液,定容于25ml比色管中。使用水淋洗固相萃取柱可除去杂质。
38.其中,固相萃取柱预先进行活化:取15ml水过固相萃取小柱,保持2d/s,放置15min后待用。
39.将以上乳粉洗脱液用水稀释3倍(例如,取乳粉上清液1ml,用水稀释至3ml),过0.22μm的水相滤膜过滤,得到乳粉滤液,用于高效阴离子交换色谱-电化学检测器测定。
40.优选地,使用包含au电极和ag/agcl参比电极的高效阴离子交换色谱-电化学检测器,并使用糖标准四电位波形。
41.离子色谱法采用3mm
×
150mm的dionex carbopac pa 20色谱柱,或具有同等柱效的色谱柱。
42.其中,梯度洗脱条件为淋洗液a:100mmol/l氢氧化钠;淋洗液b:100mmol/l naoh与400mmol/l乙酸钠;洗脱梯度为:0-15min,97.5%-50%a;15-20min,50%a;20.1-25min,97.5%a;流速:0.5ml/min,进样量:10μl。采用外标法定量。
43.本发明的有益效果:
44.1.本发明能在指定的水解条件下使与蛋白、糖类和脂类结合的唾液酸全部游离,但不破坏唾液酸的结构,并且水解时间短,水解效果良好。
45.2.对乳清粉和乳粉区别对待,乳清粉通过水解后稀释直接可以检测,乳粉水解后需要再经过固相萃取柱净化,区别对待的好处是对于乳清粉检测可节约成本,缩短分析时间;对于乳粉检测的好处是可通过固相萃取柱进行净化,去除干扰杂质,使分析结果更准确,方法的灵敏度更高。
46.3.对比液相色谱法,不需要衍生步骤,缩短了检测时间,节省了购买衍生试剂的费用。
47.4.能准确测定n-乙酰神经氨酸含量。
48.为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,对本发明作进一步的详细说明。
49.下述实施例中所用方法如无特别说明均为常规方法,所用的试剂如无特别说明均为可商购的试剂。
50.实施例
51.实施例1
52.本实施例选用市售某品牌富含酪蛋白糖巨肽的乳清粉(以下简称cgmp)、α-乳清蛋白粉、富含乳脂肪球膜的乳清粉(以下简称mfgm),进行唾液酸含量检测。具体方法如下:
53.(1)试剂:
54.水:符合gb/t 6682规定的一级水;
55.硫酸:优级纯;
56.无水乙酸钠:优级纯;
57.50%氢氧化钠:色谱纯。
58.(2)样品前处理:
59.准确称取富含酪蛋白糖巨肽的乳清粉0.1g(精确至0.0001g),用水溶解并定容于
10ml容量瓶中,涡旋震荡摇匀;取溶解后的液体1ml于15ml离心管中,使用硫酸溶液(0.05mol/l)定容到10ml;将制备好的水解液放置在恒温水浴锅中,调整水浴锅温度,该过程中使用水银温度计插入水解液中实际测量,直到水解液温度达到80℃,保持水浴锅温度在该状态下恒定,水解1小时后取出放置至室温。转移液体至离心管中,4℃,6000rpm,离心5分钟。离心液用水稀释20倍,过0.22um的水相滤膜过滤,滤液待上机测定。
60.图1为某原料厂商所提供富含酪蛋白糖巨肽的乳清粉上机测定的图谱。该图谱中所示neu5ac浓度为2.97ug/ml,未进行标识的峰均为杂质峰。可以看出,目标峰型效果良好,与杂质峰的最小分离度大于1.5倍。
61.(3)仪器条件:
62.采用高效阴离子交换色谱-电化学检测器检测,au电极,ag/agcl参比电极,糖标准四电位波形。色谱柱:dionex carbopac pa 20,3*150mm,流速:0.5ml/min,进样量:10μl;淋洗液a:100mm氢氧化钠;淋洗液b:100mmol/l naoh与400mmol/l乙酸钠;洗脱梯度为:0-15min,97.5%-50%a;15-20min,50%a;20.1-25min,97.5%a。
63.(4)标准储备溶液的制备
64.neu5ac储备液标准储备液(3000μg/ml):准确称取150mg(精确至0.1mg)neu5ac于50ml容量瓶中,用超纯水溶解并定容至刻度。
65.(5)标准混合中间液的制备
66.neu5ac中间液溶液1(含30μg/ml neu5ac):准确吸取neu5ac储备液标准储备液(3000μg/ml)500μl于50ml容量瓶中,加超纯水至刻度,摇匀。
67.neu5ac中间液溶液2(含3μg/ml neu5ac):取1ml neu5ac中间液溶液1(含30μg/ml neu5ac)用水定容于10ml容量瓶中。摇匀。
68.(6)标准上机工作液的制备
69.neu5ac上机工作液:分别准确吸取neu5ac中间液溶液2(含3μg/ml neu5ac)0.01ml、0.025ml、0.050ml、0.1ml、0.25ml、0.5ml、0.75ml、1ml使用移液器加水配至1ml,加水定容至刻度,neu5ac标准系列工作溶液浓度分别为0.03μg/ml、0.075μg/ml、0.15μg/ml、0.3μg/ml、0.75μg/ml、1.5μg/ml、2.25μg/ml、3.000μg/ml。
70.(7)计算
71.计算公式:试样中neu5ac的含量按式(a)计算:
72.式中:
73.x—试样中neu5ac的含量,μg/g;
74.ρ—由标准曲线得到的试样溶液中neu5a的浓度,μg/ml;
75.v—定容体积,ml;
76.n—稀释倍数;
77.m—试样的称样量,g;
78.(8)标准曲线线性、回收率和精密度验证
79.依据该实施例,测定结果显示,neu5ac在0.0774μg/ml-3.096μg/ml浓度区间内线性关系良好。该样品在进行六次独立平行测定后的重复性结果和实验室间比对结果见表1。
80.重复性:根据gb/t 27417-2017《合格评定化学分析方法确认和验证指南》的要求,neu5ac实验结果在6%附近时rsd为2.37%≤2.7%,neu5ac实验结果在1.6%附近时rsd为2.44%≤2.7%,neu5ac实验结果在0.6%附近时rsd为2.78%≤3.8%,重复性实验符合要求。正确性:neu5ac测得结果与原料厂商提供数据实验室间比对结果为4.68%,均小于15%,正确度满足要求。表1 cgmp重复性结果和实验室间比对n=6
81.实施例2
82.本实施例选用市售某品牌婴幼儿配方粉1段、婴幼儿配方粉3段和全脂奶粉进行唾液酸含量检测。具体方法如下:
83.(1)试剂:
84.水:符合gb/t 6682规定的一级水;
85.硫酸:优级纯;
86.氯化钠、乙酸钠、50%氢氧化钠:均为色谱级。
87.样品前处理:
88.准确称取奶粉样品1g(精确至0.0001g),用水溶解并定容于10ml比色管中,涡旋震荡混匀。取溶解后的液体2ml样液于15ml离心管中,使用硫酸溶液(0.05mol/l)定容到10ml。将制备好的乳粉水解液放置在恒温水浴锅中,调整水浴锅温度,该过程中使用水银温度计插入水解液中实际测量,直到水解液温度达到80℃,保持水浴锅温度在该状态下恒定,水解1小时后取出放置至室温。然后将液体转移至离心管中,4℃,6000rpm,离心5分钟,挑去上层脂肪,取5ml上清液,转移至dionex on guard ii a(2.5cc)固相萃取柱中,保持样液流出速度约1d/2-3s,待液体流出后,用10ml水淋洗固相萃取柱,保持淋洗液流出速度1d/s,用0.05mol/l的氯化钠溶液洗脱,定容于25ml比色管中。(固相萃取柱活化:取15ml水过固相萃取小柱,保持2d/s,放置15min后待用。),洗脱液用水稀释3倍。过0.22μm的水相滤膜过滤,滤液待上机测定。图2为市售某品牌乳粉(婴幼儿配方粉)上机测定图谱。该图中所示neu5ac浓度为1.91ug/ml,未进行标识峰均为杂质峰,杂质对目标峰没有影响。且分离度大于1.5倍。
89.(3)仪器条件:
90.采用高效阴离子交换色谱-电化学检测器检测,au电极,ag/agcl参比电极,糖标准四电位波形。色谱柱:dionex carbopac pa20,3*150mm,流速:0.5ml/min,进样量:10ul;淋洗液a:100mm氢氧化钠;淋洗液b:100mmol/l naoh与400mmol/l乙酸钠;洗脱梯度为:0-15min,97.5%-50%a;15-20min,50%a;20.1-25min,97.5%a。
91.(4)标准储备溶液的制备
92.neu5ac储备液标准储备液(3000μg/ml):准确称取150mg(精确至0.1mg)neu5ac于50ml容量瓶中,用超纯水溶解并定容至刻度。
93.(5)标准混合中间液的制备
94.neu5ac中间液溶液1(含30μg/ml neu5ac):准确吸取neu5ac储备液标准储备液(3000μg/ml)500μl于50ml容量瓶中,加超纯水至刻度,摇匀。neu5ac中间液溶液2(含3μg/ml neu5ac):取1ml neu5ac中间液溶液1(含30μg/ml neu5ac)用水定容于10ml容量瓶中,摇匀。
95.(6)标准上机工作液的制备
96.neu5ac上机工作液:分别准确吸取neu5ac中间液溶液2(含3μg/ml neu5ac)0.01ml、0.025ml、0.050ml、0.1ml、0.25ml、0.5ml、0.75ml、1ml使用移液器加水配至1ml,加水定容至刻度,neu5ac标准系列工作溶液浓度分别为0.03μg/ml、0.075μg/ml、0.15μg/ml、0.3μg/ml、0.75μg/ml、1.5μg/ml、2.25μg/ml、3.00μg/ml。
97.(7)计算
98.计算公式:试样中neu5ac的含量按式(b)计算:
99.式中:
100.x—试样中neu5ac的含量,μg/g;
101.ρ—由标准曲线得到的试样溶液中neu5a的浓度,μg/ml;
102.v—定容体积,ml;
103.n—稀释倍数;
104.m—试样的称样量,g;
105.(8)标准曲线线性、回收率和精密度验证
106.依据该实施例,测定结果显示,neu5ac在0.1548μg/ml-3.096μg/ml线性关系良好;该样品在进行六次独立平行加标测定后的回收率和重复性结果见表2。重复性:根据gb/t 27417-2017《合格评定化学分析方法确认和验证指南》的要求,neu5ac实验结果最大rsd为2.09%,重复性实验符合要求。正确度:根据gb/t 27417-2017《合格评定化学分析方法确认和验证指南》的要求,标准物质添加量大于100mg/kg时,方法回收率范围为95-105%,而实验中neu5ac回收率在95.23-104.81%,正确性符合要求。表2平均回收率和相对标准偏差n=6
107.以上所述仅仅是本发明的优选实施方式。应当指出的是,在不脱离本发明的精神和实质的情况下,本领域技术人员可对本发明的细节和特征进行各种修改、组合、变更或替换。这些修改、组合、变更或替换也应理解为包括在本发明要求保护的范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1