应用于癌症检测、诊断与治疗的外泌体探针的制作方法
本发明属于分子检测技术领域,具体涉及一种应用于癌症检测、诊断与治疗的外泌体探针。
背景技术:
现有的肿瘤早期筛查和诊断、疾病监测、用药指导中,液体活检技术是主流趋势,该技术主要针对细胞表明的肿瘤标志物来进行(Siravegna,G.et al.(2017)Integrating liquid biopsies into the management of cancer.Nat Rev Clin Oncol 14(9),531-548)。
目前液体活检的主要检测标志物包括血液中游离的循环肿瘤细胞(Circulating Tumor Cells,CTCs)(Sundling,K.E.and Lowe,A.C.(2018)Circulating Tumor Cells:Overview and Opportunities in Cytology.Adv Anat Pathol)、循环肿瘤DNA/RNA(Circulating Tumor DNA,ctDNA/ctRNA)碎片(Cabel,L.et al.(2018)Clinical potential of circulating tumour DNA in patients receiving anticancer immunotherapy.Nat Rev Clin Oncol 15(10),639-650)和细胞外囊泡(Extracellular Vesicles,EV)(Melo,S.A.et al.(2015)Glypican-1identifies cancer exosomes and detects early pancreatic cancer.Nature 523(7559),177-82)。其中,由于CTCs在血液中含量较低,因此检测有难度。ctDNA是肿瘤细胞自身分泌或死亡时释放的物质,利用液体活检技术,可以在影像学技术还未能发现病灶时就在外周血中检测到肿瘤细胞或肿瘤相关遗传物质。EV是一种细胞分泌的脂质双层膜结构的小泡,直径在30-1000nm之间。EV根据其大小和来源不同可分为外泌体(exosome)和微泡(MV),其中外泌体尺寸为30-100nm,来源于内体和细胞膜;而微泡则尺寸为100-1000nm,主要由细胞膜内的成分组成。EV可以作为一种载体,携带分泌细胞的蛋白、核酸以及脂类物质。
现有的液体活检技术主要针对体液中存在的肿瘤标志物蛋白或者核酸,其存在的主要问题有:(1)体液中存在的蛋白或者核酸容易降解,稳定性不足,导致检测结果的准确率与可重复性不高;(2)体液中直接检测的肿瘤标志物特异性不足,容易得到假阳性/阴性结果。EV作为检测目标为具有多种优点,包括含量高、稳定性好等,因而成为新一代的液体活检中的黑马。
目前已经发现的可以用于EV识别的多肽包括C2B环肽和L型MARCKS-ED。这些多肽存在的缺点在于:1)C2B环肽只适用于检测细胞外囊泡的曲率;2)C2B环肽与L型MARCKS-ED在体内多肽的水解酶环境下较不稳定,在检测中不适用;3)C2B环肽在生产过程中成本较高。所以需要研究新的识别EV的多肽。
技术实现要素:
为此,本发明的目的之一是提供一种应用于癌症检测、诊断与治疗的外泌体探针,所述外泌体探针的氨基酸序列如下1)-6)任一项所述:
1)KKKKKRFSFKKSFKLSGFSFKKNKK(SEQ ID NO:1);
2)KKSFKLSGFSFKKNKK(SEQ ID NO:2);
3)KRFSFKK(SEQ ID NO:3);
4)KKRFSFKK(SEQ ID NO:4);
5)KKRFSFKKF(SEQ ID NO:5);
6)KKFSFKKF(SEQ ID NO:6);
所述氨基酸序列中的氨基酸为D-型氨基酸。
本发明的另一目的还在于提供上述外泌体探针的以下任一项所述的应用:
(1)在检测外泌体囊泡中的应用;
(2)在富集外泌体囊泡中的应用;
(3)在制备检测外泌体囊泡试剂中的应用;
(4)在制备富集外泌体囊泡试剂中的应用;
(5)在制备癌症检测试剂中的应用。
上述应用中,所述外泌体囊泡为直径为30-400nm的外泌体囊泡。
本发明的另一目的还在于提供一种用于检测外泌体囊泡的试剂盒,包括上述外泌体探针。
上述试剂盒中,所述外泌体囊泡为直径为30-400nm的外泌体囊泡。
上述外泌体探针可以通过化学合成的方法制备。
本发明的优点:
本发明的外泌体探针可以发现并识别EV,能够应用到预测癌症转移的发生。本发明的外泌体探针与大鼠突触蛋白-1(Synaptotagmin-1,Syn-1)的C2A-C2B细胞质结构域(C2AB)(第96至421个氨基酸残基),简称C2B环肽相比,可以有效检测细胞外囊泡表面带负电的脂质组分,应用范围更广;使用D-型的氨基酸作为结构骨架,具有抵抗作用于L-多肽水解酶的能力,可以稳定在体内环境下存在。
附图说明
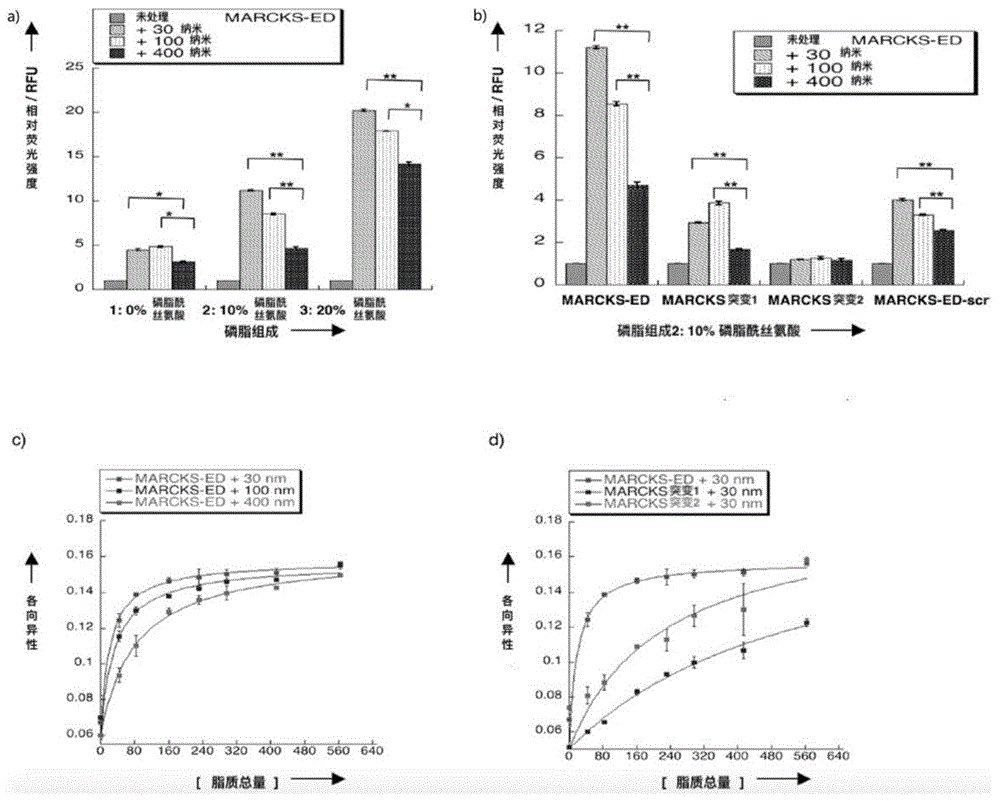
图1为不同外泌体探针对于囊泡膜曲率和PS的识别效果:
(A)为外泌体探针MARCKS-ED与不同直径的和不同PS含量的相互作用;(B)为不同外泌体探针的结合和检测能力,其中脂质囊泡含有60%卵磷脂,15%胆固醇,15%磷酸肌醇,10%磷脂酰乙醇胺;其中**为:400nm孔隙大小下P值<0.01;*为:400nm孔隙大小下的P值<0.05;(C)为MARCKS-ED对于不同直径的囊泡的识别情况;(D)为不同外泌体探针对直径为30nm囊泡的识别情况。
图2为MARCKS-ED检测大鼠血液样本中的EV的结果;其中,(A)为MARCKS-ED与囊泡结合的荧光增强结果;(B)为NTA表征MARCKS-ED及其突变体结合的囊泡数量。
图3为外泌体探针在秀丽线虫体中检测外部化的PS的结果;(A)NBD标记的MARCKS-ED在秀丽线虫体中的检测结果;(B)NBD标记的MARCKSmut1在秀丽线虫体中的检测结果;其中,中间列:荧光显微镜图像;左侧列:Hoechst 3332(生殖细胞细胞核染色);右侧列:Nomarksi(DIC);上:野生型;中:tat-1突变体;下:ced-7突变体;N2(WT)性腺细胞不存在外部化的PS;tat-1或ced-7突变体在细胞表面表达磷脂酰丝氨酸。
图4为NBD标记的多肽对于不同直径脂质囊泡的荧光增强检测结果,其中*P<0.01。
具体实施方式
下面将结合具体实施例对本发明的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。本发明中所使用的材料和装置,如无特殊说明,均为市售。下述实施例中的方法,如无特别说明,均为本领域的常规方法。
实施例1探针多肽和的脂类囊泡的合成
探针多肽的合成
化学合成以下多肽序列:
KKKKKRFSFKKSFKLSGFSFKKNKK(SEQ ID NO:1),命名为MARCKS-ED;
KKKKKRASAKKSAKLSGASAKKNKK,命名为MARCKSmut1(MARCKS突变1);
AAAAAAFSFAASFALSGFSFAANAA,命名为MARCKSmut2(MARCKS突变2)。
为了验证某些氨基酸残基的作用,以两个突变的MARCKS-ED多肽段作为对照:MARCKSmut1的将五个疏水的苯丙氨酸突变为了五个丙氨酸;MARCKSmut2的带正电荷的赖氨酸和精氨酸突变为丙氨酸。
上述氨基酸序列中的氨基酸为D-型氨基酸。
合成脂质囊泡
合成的不同直径和组成脂类囊泡(EV)可以去检测MARCKS衍生的多肽识别膜曲率并结合的能力,膜曲率与直径成反比,更小的囊泡意味着脂质双层膜曲率更大,一系列的不同组成成分的脂类模型可以代表不同脂类组成的生物膜。EV比细胞的胆固醇和磷脂酰丝氨酸(PS)含量高。动态光散射和负染电子透射显微镜结果表明,使用脂类合成仪合成囊泡时通过控制压力,可以合成不同直径(100纳米、400纳米)的囊泡,并能够稳定存在至少16小时,合成的脂类囊泡可以较好地模拟不同EV的大小和膜曲率。
合成脂类囊泡的一般方法为,将溶解在氯仿中的不同脂质混合,通过氮气流将氯仿吹干,直至样品明显干燥,然后将其置于干燥器中的真空下1小时(72)来除去氯仿。然后将干燥的脂质用磷酸盐缓冲盐水(PBS,pH 7.4)再水化以获得所需浓度,并在间歇摇动下加热至40℃ 1小时。然后将脂质溶液冷冻并融化三遍。将储备溶液储存在70℃下。要获得均质的囊泡,应使用具有孔径分别为30、100和400nm的聚碳酸酯滤膜的Avestin FL-50加压挤出机(Avanti Polar Lipids)将脂质溶液分别挤出10次。)。
例如,将磷脂POPS、POPC、1-棕榈酰基-2-油酰-sn-甘油-3-磷酸乙醇胺(POPE)和胆固醇购自Avanti Polar Lipids(Alabaster,AL)的氯仿溶液制备脂质囊泡,形成包含60%POPC/15%POPE/15%胆固醇/10%POPS的囊泡,用于PS和曲率感测分析(Morton,L.A.,R.Tamura,.,H.Yin.2014.Biochim.Biophys.Acta.8:3137–3144,Morton,L.A.;J.P.Saludes,and H.Yin.2012.J.Vis.Exp.2012:4151.)。并使用包含70%POPC/15%POPE/15%胆固醇的脂质作为阴性对照。
制备的脂类囊泡包括不含磷脂酰丝氨酸(PS)和含有磷脂酰丝氨酸(PS)的囊泡,其中含有磷脂酰丝氨酸(PS)的囊泡中PS含量为10%、20%。
实施例2 MARCKS-ED和C2AB与合成脂质囊泡相互作用
在本实施例中,通过共沉淀方法表征MARCKS-ED对不同大小囊泡的识别。在该实验中使用囊泡的直径分别为100和400纳米,而直径小于100nm的囊泡因在高速离心时难以沉淀,本实验中未作为对照组。
将10μM MARCKS-ED与600μM、直径分别为100纳米和400纳米的合成的囊泡孵育。实验的阳性对照是大鼠突触蛋白-1(Synaptotagmin-1,Syn-1)的C2A-C2B细胞质结构域(C2AB)(第96至421个氨基酸残基)。用1mM CaCl2和1.5μM C2AB并与300μM大小为100纳米和400纳米的囊泡一起孵育。囊泡与C2AB的混合物在室温下孵育30分钟,然后在20℃下以65,000转每分钟(rpm)离心45分钟。囊泡与MARCKS-ED的混合物在室温下孵育2小时,然后在20℃下以75,000rpm离心45分钟。
收集每个样品的上清液以及来自MARCKS-ED或C2AB处理的样品的沉淀物,并在预制的12-15%Tris-Bis凝胶(Invitrogen,Eugene,Oregon)上进行电泳测定。
离心后收集的上清液和沉淀样品的凝胶电泳结果显示,100nm含PS(磷脂酰丝氨酸)的囊泡比400nm囊泡结合更多的MARCKS-ED或C2AB。此外,MARCKS-ED与没有磷脂酰丝氨酸(PS)的脂质囊泡相对亲和力降低,表明多肽-脂质结合及其对膜曲率的识别取决于PS是否在囊泡上。与C2AB蛋白类似,MARCKS-ED与含有PS的高曲率的囊泡更紧密地结合。
实施例3 MARCKS-ED和突变体与合成脂质囊泡相互作用
通过荧光增强方法进一步测定并量化MARCKS-ED对膜曲率和PS感知能力。
用具有荧光基团NBD标记外泌体探针(实施例1所述),将脂质囊泡(30nm、100nm和400nm)分别滴定NBD标记的MARCKS-ED,MARCKSmut1,MARCKSmut2多肽。然后用荧光增强测定和荧光各向异性滴定进行结果检测。
具体的实验原理与方法如下:
在与脂质囊泡结合后,NBD标记的MARCKS-ED的荧光强度由于与囊泡结合和荧光团周围的疏水环境而增加,同时最大发射波长的轻微蓝移。使用激发光波长为480纳米的Fluorolog-3荧光分光光度计记录所有NBD标记的多肽的发射光谱。在500微摩尔不同大小囊泡的磷酸盐缓冲液(PBS,pH=7.40)中,多肽或蛋白浓度为500纳摩尔,荧光的发射波长为500-650纳米。阳性对照组C2AB(200纳摩尔)用CaCl2(2.5毫摩尔)处理,激发波长为275纳米,发射波长为300-450纳米。未处理的多肽经PBS(pH=7.40)空白溶液校正,Ca2+-C2AB样品通过PBS-Ca2+溶液校正。所有样品均在4℃下孵育过夜。
荧光增强测定不能区分不同程度的膜穿透和结合亲和力之间的贡献,因此进行荧光各向异性测定以衡量MARCKS衍生肽的结合力。通过各种大小(30,100和400纳米)的合成脂质体滴定NBD标记的多肽(1微摩尔)。使用Fluorolog-3荧光分光光度计记录荧光各向异性。在滴定之前平衡混合物2分钟。激发波长为480纳米,接收的发射光波长为545纳米,电压250V。空白PBS(pH=7.40)滴定NBD标记的肽作为阴性对照,其各向异性变化可忽略。
使用以下等式确定如先前报道的解离常数:Fb=Kp[L]/(1+Kp[L]),其中Fb表示与脂质结合的肽的比率,Kp表示摩尔分配系数,[L]表示脂质浓度。
摩尔分配系数(Kp)表明肽在疏水性脂质双层和水性溶剂之间分配的比例。表观解离常数(Kd)的值为50%肽结合的脂质浓度,是摩尔分配系数(Kr)的倒数。
结果如下如图1所示,a)柱状图表明MARCKS-ED与30nm且包含PS的囊泡作用荧光信号最强;b)柱形图表明MARCKSmut1与MARCKSmut2结合和检测能力下降,其中脂质囊泡含有60%卵磷脂,15%胆固醇,15%磷酸肌醇,10%磷脂酰乙醇胺;c)为MARCKS-ED对于不同直径的囊泡的识别情况;d)为不同外泌体探针对直径为30nm囊泡的识别情况;其中,**:与400nm孔隙相比P值<0.01;*:与400nm孔隙相比P值<0.05。
MARCKS-ED结合含有10%PS的30,100和400纳米孔径的脂质囊泡,Kd值分别为24±3、42±13、86±20微摩尔。MARCKS mut1结合亲和力大大降低(图1d)),证实苯丙氨酸残基起到了关键作用。此外,MARCKS mut2的静电相互作用也受到损害。荧光各向异性测定结果表明MARCKS-ED曲率识别的能力。
实施例4 MARCKS-ED性结合大鼠血浆中的EV
在本实施例中,测试外泌体探针(实施例1所述)在复杂生物系统中检测高曲率的富含PS的生物结构的效果。
EV是高度弯曲的脂质囊泡,在动物体液(例如,血液,尿液,腹水)中存在。其中由癌细胞释放的囊泡的脂质不对称性失调,PS在其外膜上也有富集。使用大鼠模型的血浆样品研究MARCKS-ED的微囊泡泡检测能力。
使用重约250-275克的成年雄性Fisher344大鼠(Harlan,8-9周龄),动物预先适应一周环境条件且每天喂养观察。
通过透射电子显微镜成像表征这些样品中的EV,使用酶联免疫吸附测定(ELISA)方法检测表面上暴露的特征蛋白CD63和膜转运蛋白Rab5b。通过抗体捕获两种蛋白质,并在比色终点测定中定量测定。
通过纳米颗粒跟踪分析(NTA)分离的EV,确认它们的平均尺寸为56纳米。使用配备有532纳米波长激光的NanoSight LM 10-HS仪器(Amesbury)进行NTA跟踪分析,并在散射和荧光模式(滤光器波长550纳米)下观察,使用市售的50纳米聚苯乙烯珠子校准仪器。
对大鼠分离的囊泡和血浆进行平行实验,所述囊泡或血浆与未用荧光染料Alexa Fluor 546TM处理的MARCKS-ED结合形成的悬浮颗粒不发荧光。荧光染料Alexa Fluor 546TM标记的小鼠抗大鼠CD63抗体和未结合的荧光染料Alexa Fluor 546TM分别用作阳性和阴性对照。还研究了在没有微囊泡的情况下MARCKS-ED-Alexa Fluor 546TM和Alexa Fluor 546TM的图谱,以证实这些在相同条件下散射和荧光背景信号可忽略。
然后,用已建立的PS识别蛋白膜联蛋白-V(Annexin-V)证实EV存在PS。先前的报道显示,在与富含PS的脂质囊泡结合后,膜联蛋白-V的荧光强度增加。在TES缓冲液中用CaCl2(3毫摩尔)和500微摩尔不同PS含量的脂质囊泡处理膜联蛋白-V(0.32微摩尔)的发射波长为295纳米。观察到膜联蛋白-V与微囊泡结合在300-450纳米的发射的荧光强度增强,表明存在蛋白质-脂质相互作用。
未用囊泡处理的MARCKS-ED(500毫摩尔)用作阴性对照。将膜联蛋白-V(阳性对照)和MARCKS-ED与分离的大鼠微囊泡孵育,使用MARCKS-ED与囊泡结合的荧光增强测定方法进行检测。
结果证实了MARCKS-ED能够与生物颗粒结合。通过MARCKS-ED结合并分离出微囊泡的直径大小和数目则进一步进行定量实验。纳米粒子跟踪分析(NTA)可以使用激光进行散射和荧光模式测定,通过布朗运动跟踪小颗粒,可检测纳米级微泡。在为荧光染料Alexa Fluor 546TM设置发射滤光片的荧光模式下,分别测定与MARCKS-ED,MARCKSmut1和MARCKSmut2肽结合的生物微膜泡。荧光标记的MARCKS-ED、MARCKSmut1和MARCKSmut2以55纳摩尔的浓度富集来自大鼠的血浆中的微囊泡。使用散射模式检测未处理的血浆样品,并通过跟踪荧光染料Alexa Fluor 546TM预染的MARCKSED、MARCKSmut1和MARCKSmut2多肽的荧光来监测处理后的样品,实验结果如图2所示。
发现MARCKS-ED选择性地结合血浆中的直径较小EV。MARCKSmut1也显示出一些优先结合较小的囊泡的倾向,但荧光信号相对较弱。MARCKSmut2的结合可忽略不计。此外,进行空白样品以排除来自肽,囊泡和染料的荧光背景。这些数据表明MARCKS-ED可以选择性地检测大鼠血浆中具有高曲率的富含PS的生物相关微粒。
实施例5 MARCKS-ED能标记表面暴露PS的线虫模型
利用线虫为动物模型进行体内实验,通过荧光显微镜观察并定量荧光标记的外泌体探针来检测细胞表面的PS来分析探针的功能。已有研究表明tat-1和ced-7敲低的突变体线虫模型中性腺细胞的PS可外翻。因此,可以通过与野生型做比较,来研究MARCKS-ED是否可以在体内结合突变体细胞表面的PS。
在此实验中,将首先通过解剖并获取野生型和突变体线虫的性腺进行离体研究(ex vivo),通过荧光显微镜观察分析探针对性腺器官中细胞的标记情况来判断并比较MARCKS-ED探针与PS的结合情况。然后,将通过注射MARCKS-ED探针到活的线虫中(in vivo),并分析来进一步研究MARCKS-ED探针在体内与细胞表面PS的结合情况。突变和乱序重排肽将作为对照组来测试MARCKS-ED类似物的序列特异性。
结果如图3所示,MARCKS-ED在秀丽线虫体中能够检测PS的外翻;荧光显微镜图像中间列:秀丽线虫性腺经了20μM NBD标记的MARCKS-ED(A)或MARCKSmut1(B),左侧列:Hoechst 3332(生殖细胞细胞核染色);右侧列:Nomarksi(DIC)。N2(WT)性腺细胞不存在外部化的PS。tat-1或ced-7突变体在细胞表面表达磷脂酰丝氨酸。
实施例6不同外泌体探针的识别作用
外泌体探针的合成
化学合成以下多肽序列:
1)KKKKKRFSFKKSFKLSGFSFKKNKK(SEQ ID NO:1),命名为MARCKS-ED;
2)KKKKKRFSFKK,命名为MAX1;
3)KKSFKLSGFSFKKNKK(SEQ ID NO:2),命名为MAX2;
3)KRFSFKK(SEQ ID NO:3),命名为MAX3;
4)KKRFSFKK(SEQ ID NO:4),命名为MAX4;
5)KKFSFKK,命名为MAX5;
6)KKRFSFKKF(SEQ ID NO:5),命名为MAX6;
7)KKFSFKKF(SEQ ID NO:6),命名为MAX7;
上述氨基酸序列中的氨基酸为D-型氨基酸。
用具有荧光基团NBD标记上述外泌体探针,分别用直径为30nm、100nm、400nm脂质囊泡滴定用NBD标记的上述外泌体探针,其中外泌体探针为500nM,脂质囊泡为500μM。然后用荧光增强测定进行检测,结果如图4所示(制备方法和检测方法如实施例1和2所示)。结果显示:除了MARCKS-ED,片段MRX2,MRX3,MRX4,MRX6和MRX7显示出曲率感知能力,与较小的脂质体结合后荧光增强。相反,MRX1和MRX5没有任何曲率感知能力。
序列表
<110> 清华大学
<120> 应用于癌症检测、诊断与治疗的外泌体探针
<160> 6
<170> SIPOSequenceListing 1.0
<210> 1
<211> 25
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 1
Lys Lys Lys Lys Lys Arg Phe Ser Phe Lys Lys Ser Phe Lys Leu Ser
1 5 10 15
Gly Phe Ser Phe Lys Lys Asn Lys Lys
20 25
<210> 2
<211> 16
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 2
Lys Lys Ser Phe Lys Leu Ser Gly Phe Ser Phe Lys Lys Asn Lys Lys
1 5 10 15
<210> 3
<211> 7
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 3
Lys Arg Phe Ser Phe Lys Lys
1 5
<210> 4
<211> 8
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 4
Lys Lys Arg Phe Ser Phe Lys Lys
1 5
<210> 5
<211> 9
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 5
Lys Lys Arg Phe Ser Phe Lys Lys Phe
1 5
<210> 6
<211> 8
<212> PRT
<213> 人工序列(Artificial Sequence)
<400> 6
Lys Lys Phe Ser Phe Lys Lys Phe
1 5
- 还没有人留言评论。精彩留言会获得点赞!