一种基于量子点微球免疫层析试纸条的新冠病毒检测方法与流程
[0001]
本发明属于生物诊断制品的生产和技术领域,特别涉及一种基于量子点微球免疫层析试纸条的新冠病毒检测方法。
背景技术:
[0002]
新型冠状病毒感染后仍无症状的的患者,存在感染他人的风险,最有效方式就是对疑似病患进行专业的免疫检测,确认其显性还是隐性。其中,免疫检测包括对新型冠状病毒的核酸链段、新型冠状病毒的特异性蛋白、抗体等待检测目标物进行检测。
[0003]
免疫检测中最常用的就是免疫试纸条,荧光免疫层析试纸条技术是以抗原抗体间接特异性识别为基础,以荧光作为信号标签,通过荧光信号实现对待测样本中目标分析物精确和快速定量,广泛应用与临床医学领域。
[0004]
为实现免疫层析试纸低浓度的目标物的检测,越来越多的新型纳米材料被应用于免疫层析方法的示踪标记物,如上转磷光颗粒、量子点、磁性纳米颗粒、荧光微球及量子点微球等。
[0005]
量子点荧光免疫层析试纸是继示踪标记胶体金以后发展起来的一种免疫学检测方法,它通过将荧光微球与生物大分子结合,当在特定激发光下的波长范围内,该免疫复合探针会在特定的捕获区域内发出可见光,从而被仪器或人眼识别,具有灵敏度高、准确度高的优点。
[0006]
基于以上考虑,本案由此产生。
技术实现要素:
[0007]
本发明的目的,在于提供一种基于量子点微球免疫层析试纸条的新冠病毒检测方法,可用于非洲猪瘟病毒抗体的快速、高特异性、高灵敏度的定量检测;该方法操作简单,无需经过专业的培训,可以很好地胜任各种现场、基层实验室等环境下的检测;结合荧光检测仪,可以对结果进行定量,通过读取检测线和质控线的荧光强度,定量测定抗体浓度。
[0008]
为了达成上述目的,本发明的解决方案是:
[0009]
一种基于量子点微球免疫层析试纸条的新冠病毒检测方法,包括如下具体步骤:
[0010]
s1.全血、血浆和血清的处理:采集全血分离血浆或血清作为检测样本;
[0011]
s2.取出量子点微球免疫层析试纸条,将其放于洁净操作台上;
[0012]
s3.吸取样本,滴加至加样孔中;
[0013]
s4.滴加完成后,等待10-15min,判定结果;
[0014]
s5.判定结果:使用目视判定或使用荧光检测仪判定结果。
[0015]
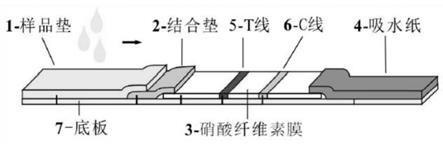
上述免疫层析试纸条包括底板,所述底板上依次排列设置样品垫、结合垫、硝酸纤维素膜和吸水垫;所述结合垫上包被有量子点微球标记的新冠病毒抗原蛋白或新冠病毒抗体;所述新冠病毒抗原蛋白或新冠病毒抗体能与待检测样中含有的新冠病毒待检测目标物特异性结合,所述的硝酸纤维素膜上设有检测线和质控线,所述质控线处设有能与待检测
目标物特异性结合的生物标记物,所述检测线包被有羊抗鸡igy多抗,所述质控线靠近所述吸水垫一侧设置。
[0016]
上述生物标记物为新冠病毒抗原蛋白抗人总抗体。
[0017]
上述的样品垫、结合垫、硝酸纤维素膜和吸水垫依次重叠放置,黏贴于底板上。
[0018]
上述基于量子点微球免疫层析试纸的制备具体包括以下步骤:
[0019]
s1.结合垫的制备:将制备好的包被有量子点微球标记的新冠病毒抗原蛋白或新冠病毒抗体,喷涂在所述的结合垫上,干燥备用;
[0020]
s2.样品垫的制备:预先用pbs缓冲液浸泡15-30分钟处理,干燥备用;
[0021]
s3.硝酸纤维素膜的制备:在硝酸纤维素膜上喷涂羊抗鸡igy多抗得到检测线,然后喷涂生物标记物得到质控线;
[0022]
s4.试纸的组装:在底板上依次相互交错地设置样品垫、结合垫、硝酸纤维素膜和吸水垫,得到量子点微球免疫层析试纸条。
[0023]
上述步骤s1中,新冠病毒抗原蛋白或新冠病毒抗体的制备方法包括以下步骤:
[0024]
s11.量子点微球的活化:将量子点微球加入缓冲液中;加入edc和nhs;在37℃摇床中恒温孵育;再至离心机中离心,弃上清,加入缓冲液重悬;
[0025]
s12.量子点微球的偶联:在上述得到的量子点微球缓冲液中加入新冠病毒抗原蛋白或新冠病毒抗体,在37℃摇床中恒温孵育;
[0026]
s13.量子点微球的封闭:将上述得到的完成偶联的量子点微球缓冲液中加入封闭液,在37℃摇床中恒温孵育,弃上清,加入缓冲液重悬。
[0027]
采用上述方案后,本发明提供的基于量子点微球免疫层析试纸的新冠病毒检测方法与现有技术相比,具有以下有益效果:
[0028]
(1)本发明的检测方法操作简单,无需经过专业的培训,可以很好地胜任各种现场、基层实验室等环境下的检测;结合荧光检测仪,可以对结果进行定量,通过读取检测线和质控线的荧光强度,定量测定抗体浓度;
[0029]
(2)本发明的检测方法特异性强,灵敏度高,稳定且具有重复性。
附图说明
[0030]
图1是本发明实施例所述的量子点微球免疫层析试纸条的结构示意图;
[0031]
其中:1-样品垫;2-结合垫;3-硝酸纤维素膜;4-吸水纸;5-检测线;6-质控线;7-底板。
具体实施方式
[0032]
下面将结合本发明的实施例,对本发明的优选实施方式进行详细说明。此外需要理解的是,以下的实施例仅是为了对本发明作进一步说明,帮助理解。而不是用于对本发明的范围进行限制,本发明的保护范围不受任何实施例形式上的限制。下述实施例中所使用的的实验方法如无特殊说明,皆为常规方法。下述实施例中的各种设备与试剂,若无特殊说明,皆可通过商业途径得到。
[0033]
实施例1一种检测新冠病毒的量子点微球免疫层析试纸条,包括底板,所述底板上依次排列设置样品垫、结合垫、硝酸纤维素膜和吸水垫;所述结合垫上包被有量子点微球标
记的新冠病毒抗原蛋白或新冠病毒抗体;所述新冠病毒抗原蛋白或新冠病毒抗体能与待检测样中含有的新冠病毒待检测目标物特异性结合,所述的硝酸纤维素膜上设有检测线和质控线,所述质控线处设有能与待检测目标物特异性结合的生物标记物,所述检测线包被有羊抗鸡igy多抗,所述质控线靠近所述吸水垫一侧设置。
[0034]
实施例2量子点微球标记的新冠病毒抗体的制备
[0035]
1.量子点微球的活化:取50ul的量子点微球加入至50ul 0.02m的pb缓冲液中;加入终浓度为50mg/ml的edc1 ul;在37℃恒温孵育30min;离心弃上清,加入缓冲液重悬;其中,量子点微球的粒径在50-200nm为宜。
[0036]
2.量子点微球的偶联:在步骤1得到的量子点微球缓冲液中加入10ug的新冠病毒抗体,于37℃恒温孵育2h。
[0037]
3.量子点微球的封闭:将步骤2得到的量子点微球缓冲液中加入1ul的1%bsa,37℃恒温孵育35分钟;离心弃上清,加入缓冲液重悬,得量子点微球标记的新冠病毒抗体溶液,置于4℃冰箱中保藏。
[0038]
实施例3结合垫的制备
[0039]
1.用0.5%-5%bsa,0.2%-2%tween-20,10%蔗糖的pbs缓冲液浸泡15-30分钟处理,干燥备用。
[0040]
2.从4℃冰箱中取出实施例2制备的量子点微球标记的新冠病毒抗体溶液放置至室温。
[0041]
3.取步骤2量子点微球标记的新冠病毒抗体溶液喷涂在结合垫上,过夜干燥,其中,结合垫的材质可以为玻璃纤维或聚酯纤维,也可以为其他可作为结合垫材料的其他纤维材料。
[0042]
实施例4样品垫的制备
[0043]
用0.5-5wt%bsa,0.2-2wt%tween-80的pbs缓冲液将样品垫浸泡15-30分钟处理,干燥备用,其中,样品垫材料为玻璃纤维。
[0044]
实施例5硝酸纤维素膜的制备
[0045]
1.将羊抗鸡igy多抗用含有3wt%蔗糖的pbs缓冲液(ph7.4)稀释成0.8mg/ml,得到检测线(t线)溶液。
[0046]
2.将新冠病毒抗原蛋白抗人总抗体用含有3wt%蔗糖的pbs缓冲液稀释成0.8mg/ml,得到质控线(c线)溶液。
[0047]
3.用划膜仪喷涂t线溶液和c线溶液在硝酸纤维素膜上,其中检测线上的羊抗鸡igy多抗用量以0.5-0.8ug/cm为宜,所述质控线上的新冠病毒抗原蛋白抗人总抗体用量以0.5-0.7ug/cm为宜。
[0048]
4.过夜干燥。
[0049]
实施例6试纸条的组装
[0050]
试纸条具体组装方式如图1所示,在正常湿度和温度下的洁净操作台上,将处理好的样品垫、结合垫、硝酸纤维素膜、吸水垫(材质为吸水滤纸)依次重叠黏贴在底板2上后送入切条机,得到试纸条。
[0051]
实施例7使用方法及结果判定
[0052]
1.全血、血浆和血清的处理:采集全血分离血浆或血清(4000g离15min或4℃过夜
自然析出)作为检测样本。
[0053]
2.撕开试纸条的铝箔袋,取出试纸条,将其放于洁净操作台上。
[0054]
3.用一次性塑料吸管吸取样本,滴加1滴检测样本(约30μl)至加样孔中,再滴加3滴(约120μl)样本稀释液,其中样本稀释液为含有1wt%脱脂乳和0.05wt%的tween20的pbs缓冲液(ph7.4)。
[0055]
4.滴加完成后,等待10-15min,判定结果,30min后结果无效。
[0056]
5.1判定结果(目视):在做好防护措施下,可配合紫外激光发射器,在紫外光的照射下,试纸条的c线显色,t线显色时,结果判定为阳性,t线的颜色越深,则阳性越强;当试纸条的的c线显色,t线不显色时,结果判定为阴性;若试纸条的c线不显色,则该纸条的检测结果无效。
[0057]
5.2判定结果(荧光检测仪):将试纸条插入手持或台式荧光检测仪的试纸条插入槽口中,得到荧光强度的数值,可定量判断样品的阳性有无及强弱水平。
[0058]
性能测试
[0059]
1.敏感性检测
[0060]
检测方法:检测方法参考实施例7,将健康人的抗凝血血清作为阴性质控;将新冠病毒单克隆抗体,经elisa测定后,稀释至1:500、1:1000、1:2000、1:4000、1:8000作为阳性质控品。分别用不同稀释度的阳性质控样品和一份阴性质控样品分别用本发明的试纸条进行检测。
[0061]
检测结果:本发明所提供的试纸条对1:6400阳性质控样品检测的结果为阳性,表明试纸条对新冠病毒单克隆抗体的检出限最低可达1:6400的稀释度。
[0062]
2.均一性检测
[0063]
取1:6400稀释倍数的阳性质控样品重复检测20次,结果均为阳性,荧光显色均一,荧光强度数值接近;取阴性质控样品重复检测20次,结果均为阴性,荧光显色均一,荧光强度数值接近。
[0064]
3.与胶体金试纸条的灵敏度对比
[0065]
对1:500、1:1000、1:2000、1:4000、1:8000不同稀释度的阳性质控样品和1份阴性质控样品分别用本发明的量子点微球免疫层析试纸条与胶体金试纸条进行检测,检测可以看出:本发明的的量子点微球免疫层析试纸条与同样原料制成的胶体金试纸条分别对不同浓度新冠病毒单克隆抗体进行检测,量子点微球试纸条检测1:8000稀释倍数的新冠病毒单克隆抗体时为阳性;胶体金试纸条检测1:1000稀释倍数的新冠病毒单克隆抗体时为阳性,检测1:2000稀释倍数的新冠病毒单克隆抗体时为阴性,明显低于量子点微球试纸条。
[0066]
以上实施例仅为说明本发明的技术思想,不能以此限定本发明的保护范围,凡是按照本发明提出的技术思想,在技术方案基础上所做的任何改动,均落入本发明保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1