细菌单克隆抗体交叉反应快速测定免疫试纸条及测定方法
1.本发明属于生物检测领域,具体涉及一种细菌单克隆抗体交叉反应快速测定免疫试纸条及测定方法。
背景技术:
2.单克隆抗体是由小鼠的b淋巴细胞与骨髓瘤细胞融合后产生的,既保持了效应b细胞分泌特异性抗体的能力,同时也具有骨髓瘤细胞的无限增殖的能力。单克隆由于它的高特异性及稳定性,结合一些新技术的使用,单克隆抗体市场规模每年在保持着高速的增长。而细菌单克隆抗体面临的问题主要有三点:一是细菌膜蛋白靶点多,特异性靶点难以获取;二是细菌血清系多,抗体对不同血清系病株吸附力不一致,三是细菌靶点通常为糖蛋白,空间结构及序列难以预测。目前,细菌单克隆抗体的筛选和交叉反应的测定均依赖间接elisa方法,且单克隆抗体在应用之前,如何快速的挑选出特异性较好、广谱性强、效价高的抗体或杂交瘤显得尤为关键。
3.细菌单克隆抗体的交叉反应的测定是通过将不同的细菌包被在孔板上,并做好记录,封闭,洗脱,与目标的抗体孵育,洗脱,与酶标抗体孵育,洗脱,形成抗原
‑
抗体
‑
酶标抗体的三元复合物,催化底物形成有色物质,产物的量与孔板上包被的细菌直接相关,每次测定时间需要5h
‑
1天,且需要准备多种细菌,劳动强度高,时间长。这种方法费时费力,难以将高质量可大范围应用的抗体和杂交瘤挑选出来,因此,有必要建立一种快速便捷的方法,使得能够快速的对杂交瘤或者抗体的交叉反应进行快速测定。
技术实现要素:
4.本发明是为了解决上述问题而进行的,目的在于提供一种细菌单克隆抗体交叉反应快速测定免疫试纸条及测定方法。
5.本发明提供了一种细菌单克隆抗体交叉反应快速测定免疫试纸条,具有这样的特征,包括:依次排列于pvc底板上的样品垫、结合垫、硝酸纤维素膜和吸水垫,其中,结合垫上喷涂有独立质控菌,硝酸纤维素膜上喷涂有羊抗鼠抗体形成检测线,硝酸纤维素膜上还喷涂有独立质控菌抗体形成质控线,该质控线位于检测线旁并靠近吸水线一侧,即硝酸纤维素膜上的c线处。
6.本发明还提供了采用细菌单克隆抗体交叉反应快速测定免疫试纸条进行交叉反应快速测定的方法,具有这样的特征,包括如下步骤:步骤1,构建检测线为羊抗鼠抗体的试纸条;步骤2,取50μl细胞上清与调试好浓度的目标菌混合,插上试纸条进行层析,反应10
‑
15min;步骤3,观察试纸条的检测线,根据检测线以及质控线判定结果为阴性或阳性,从而得到细胞上清中的抗体与目标菌是否产生交叉反应。
7.本发明提供的采用细菌单克隆抗体交叉反应快速测定免疫试纸条进行交叉反应快速测定的方法,还可以具有这样的特征:其中,步骤1包括如下子步骤:步骤1
‑
1,取pvc底板、样品垫、结合垫、硝酸纤维素膜以及吸水垫;步骤1
‑
2,将含有荧光标记的独立质控菌喷
涂于结合垫上,得到处理后的结合垫;步骤1
‑
3,将羊抗鼠抗体喷涂在硝酸纤维素膜上形成检测线,得到含有检测线的硝酸纤维素膜;步骤1
‑
4,将含有独立质控菌抗体喷涂在含有检测线的硝酸纤维素膜的c线处,形成质控线,得到含有检测线和质控线的硝酸纤维素膜;步骤1
‑
5,将样品垫、处理后的结合垫、含有检测线和质控线的硝酸纤维素膜以及吸水垫分别依次粘贴在pvc底板上,组装得到免疫荧光试纸条。
8.本发明提供的采用细菌单克隆抗体交叉反应快速测定免疫试纸条进行交叉反应快速测定的方法,还可以具有这样的特征:其中,步骤2中的目标菌的浓度为od600,且吸光值为0.6
‑
1.5。
9.发明的作用与效果
10.根据本发明所涉及的细菌单克隆抗体交叉反应快速测定免疫试纸条及测定方法,能够便捷、快速对杂交瘤或者抗体的交叉反应进行快速测定,且测定成本低,符合率高,检测时间短,还可以将高质量可大范围应用的抗体和杂交瘤挑选出来。
附图说明
11.图1是本发明的实施例中细菌单克隆抗体交叉反应快速测定免疫试纸条的结构示意图;
12.图2是本发明的实施例中革兰氏阳性菌和革兰氏阴性菌,动植物细菌荧光标记的显微镜下观察结果示意图;
13.图3是本发明的实施例中结合垫上不同浓度未封闭的标记的出血性大肠杆菌o157:h7测试结果示意图;
14.图4是本发明的实施例中结合垫上不同浓度未封闭的标记的果斑菌sd01测试结果示意图;
15.图5是本发明的实施例中结合垫上不同浓度未封闭的标记的副溶血性弧菌测试结果示意图;
16.图6是本发明的实施例中出血性大肠杆菌o157:h7杂交瘤e7细胞上清与不同细菌测试反应结果示意图;
17.图7是本发明的实施例中出血性大肠杆菌o157:h7杂交瘤e7细胞上清与不同细菌测试反应结果示意图;
18.图8是本发明的实施例中副溶血性弧菌杂交瘤h7细胞上清与不同细菌测试反应结果示意图;
19.图9是本发明的实施例中副溶血性弧菌杂交瘤h7细胞上清与不同细菌测试反应结果示意图;
20.图10是本发明的实施例中副溶血性弧菌杂交瘤c9细胞上清与不同细菌测试反应结果示意图;
21.图11是本发明的实施例中副溶血性弧菌杂交瘤c9细胞上清与不同细菌测试反应结果示意图。
具体实施方式
22.为了使本发明实现的技术手段与功效易于明白了解,以下结合实施例及附图对本
发明作具体阐述。
23.本发明提供了一种细菌单克隆抗体交叉反应快速测定免疫试纸条,具有依次排列于pvc底板上的样品垫、结合垫、硝酸纤维素膜和吸水垫,其中,结合垫上喷涂有独立质控菌,述硝酸纤维素膜上喷涂有羊抗鼠抗体形成检测线,硝酸纤维素膜上还喷涂有独立质控菌抗体形成质控线,该质控线位于检测线旁并靠近吸水线一侧,即硝酸纤维素膜上的c线处。
24.本发明还提供了采用细菌单克隆抗体交叉反应快速测定免疫试纸条进行交叉反应快速测定的方法,包括如下步骤:
25.步骤1,构建检测线为羊抗鼠抗体的试纸条,具体子步骤如下:
26.步骤1
‑
1,取pvc底板、样品垫、结合垫、硝酸纤维素膜以及吸水垫;
27.步骤1
‑
2,将含有荧光标记的独立质控菌喷涂于结合垫上,得到处理后的结合垫;
28.步骤1
‑
3,将羊抗鼠抗体喷涂在硝酸纤维素膜上形成检测线,得到含有检测线的硝酸纤维素膜;
29.步骤1
‑
4,将含有独立质控菌抗体喷涂在含有检测线的硝酸纤维素膜的c线处,形成质控线,得到含有检测线和质控线的硝酸纤维素膜;
30.步骤1
‑
5,将样品垫、处理后的结合垫、含有检测线和质控线的硝酸纤维素膜以及吸水垫分别依次粘贴在pvc底板上,组装得到免疫荧光试纸条。
31.步骤2,取50μl细胞上清与调试好浓度的目标菌混合,插上试纸条进行层析,反应10
‑
15min。
32.本发明中,目标菌的浓度为od600,且吸光值为0.6
‑
1.5。
33.步骤3,观察试纸条的检测线,根据检测线以及质控线判定结果为阴性或阳性,从而得到细胞上清中的抗体与目标菌是否产生交叉反应。
34.实施例:
35.本实施例中所使用的试剂与仪器:
36.主要试剂
37.pvp、tween
‑
20购自国药集团化学试剂有限公司;样品垫、吸水垫购自上海金标生物科技有限公司;bsa购自上海杰一生物技术有限公司;fitc购自上海索莱宝生物科技有限公司;硝酸纤维素膜(nc膜)95购自赛多利斯;羊抗鼠抗体购自洛阳佰奥通实验材料中心;小鼠抗体分型试剂购自sigma公司。
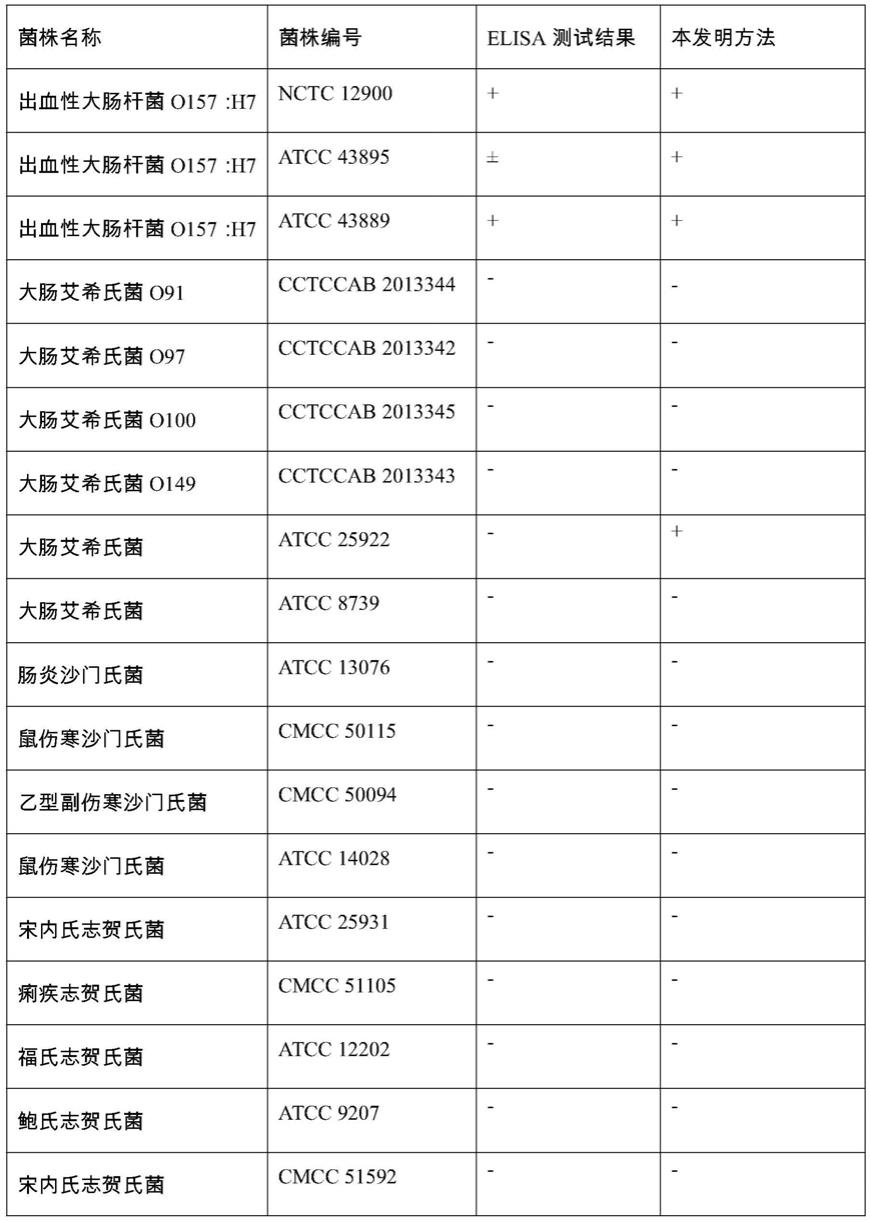
38.主要仪器
39.高压蒸汽灭菌锅购自日本tomy;酶标仪spectramax m2购自molecular devices;nanodrop 2000c购自thermo scientific;点样仪ad6010购自bio
‑
dot;恒温培养摇床sph
‑
100b购自上海世平;蛋白纯化仪biologic
tm
lp 358br5057购自bio
‑
rad;单人净化工作台sw
‑
sj
‑
2d购自苏州净化。
40.一、测效价荧光试纸条组建
41.1、试纸条组建
42.图1是本发明的实施例中细菌单克隆抗体交叉反应快速测定免疫试纸条的结构示意图。
43.如图1所示,测细菌单克隆抗体交叉反应快速测定免疫试纸条具有以下特征:样品
垫1、结合垫2、硝酸纤维素膜3、检测线4质控线5,吸水垫6和pvc底板7。pvc7在最下层,其次是硝酸纤维素膜2(nc膜),硝酸纤维素膜居于中间,两端分别连着结合垫2和吸水垫6,样品垫1连着结合垫2远离nc膜3的一端,nc膜3上具有检测线4、和质控线5,检测线3靠近结合垫2一侧,结合垫上含有荧光标记质控细菌。
44.2、靶标细菌与质控菌株的标记
45.分别将靶标菌株与质控菌株按以下方法进行标记:
46.步骤1,将液体扩大培养的大于1*108cfu/ml的细菌,离心,用交联缓冲液清洗三次,重悬。交联液配制方法为称取7.56g nahco3,1.06gnaco3,7.36g nacl,加水定容至1l。
47.步骤2,将fitc溶于dmso中,浓度为1mg/ml,每次交联使用的fitc均应新鲜配制。将配制好的fitc溶液加入已采用交联液清洗过的菌液中,fitc终浓度为200μg/ml,置于4℃暗处过液。
48.步骤3,加入5mol/l的nh4cl至终浓度50mmol/l,4℃终止反应2小时。
49.图2是本发明的实施例中革兰氏阳性菌和革兰氏阴性菌,动植物细菌荧光标记的显微镜下观察结果示意图。
50.步骤4,将交联物5000rpm离心5min,用pbs重悬,直至离心后上清清亮为止。标记好的细菌进行1%bsa封闭,并在显微镜观察。标记效果如图2所示,革兰氏阳性菌(金黄色葡萄球菌,atcc 6538)和革兰氏阴性菌(出血性大肠杆菌o157:h7,nctc 12900;副溶血性弧菌,atcc 17802;果斑菌,sd01;阪崎肠杆菌,atcc 29544)采用该方法均能被较好的标记,同样,动物病原菌革兰氏阳性菌(金黄色葡萄球菌,atcc 6538;出血性大肠杆菌o157:h7,nctc 12900;副溶血性弧菌,atcc 17802;阪崎肠杆菌,atcc 29544)和植物病原菌(果斑菌,sd01)采用该方法菌能被较好的标记。
51.3、独立c线系统筛选
52.在进行一种单克隆抗体交叉反应筛选时,需要用到很多不同的荧光标记靶标细菌,没有统一的c线,试纸条的质控就无法得到保证。鉴于不同靶标的细菌,因此有必要建立一种独立的c线质控系统。为了选用最优的独立c线系统,对靶标菌都不进行封闭,选用三种靶标菌及对应的单克隆抗体进行筛选,分别为出血性大肠杆菌o157:h7(nctc 12900)、副溶血性弧菌(atcc 17802)和果斑菌(sd01)。对以上三种细菌分别进行荧光标记,并进行浓缩调整成不同浓度,在波长600nm下测定吸光值,结果如表1。t线采用羊抗鼠二抗,c线采用靶标细菌的单抗,以便确定合适的结合垫浓度。测试时,取细胞上清100μl或稀释后的单克隆抗体进行测试,且每次测试均采用pbs作阴性对照。
53.图3是本发明的实施例中结合垫上不同浓度未封闭的标记的出血性大肠杆菌o157:h7测试结果示意图,其中,大肠o157:h7浓度用a
600
数值来表示,(
‑
)表示用sp2细胞上清测试结果,(+)表示用e7细胞上清测试结果,1为a
600
为1.206(
‑
),2为a600为1.206(+),3为a
600
为0.982(
‑
),4为a600为0.982(+),5为a600为0.684(
‑
),6为a600为0.684(+),7为a600为0.395(
‑
),8为a600为0.395(+),9为a600为0.228(
‑
),10为a600为0.228(+),11为a600为0.109(
‑
),12为a600为0.109(+)。
54.图4是本发明实施例中结合垫上不同浓度未封闭的标记的果斑菌sd01测试结果示意图,其中,果斑菌sd01浓度用a600数值来表示,(
‑
)表示用sp2细胞上清测试结果,(+)表示用6f细胞上清测试结果,1为a
600
为1.139(
‑
),2为a600为1.139(+),3为a
600
为0.917(
‑
),4为
a600为0.917(+),5为a600为0.642(
‑
),6为a600为0.642(+),7为a600为0.290(
‑
),8为a600为0.290(+),9为a600为0.186(
‑
),10为a600为0.186(+),11为a600为0.095(
‑
),12为a600为0.095(+)。
55.图5是本发明的实施例中结合垫上不同浓度未封闭的标记的副溶血性弧菌测试结果示意图,其中,副溶血性弧菌浓度用a
600
数值来表示,(
‑
)表示用sp2细胞上清测试结果,(+)表示用c9细胞上清测试结果,1为a
600
为1.234(
‑
),2为a600为1.234(+),3为a
600
为0.995(
‑
),4为a600为0.995(+),5为a600为0.701(
‑
),6为a600为0.701(+),7为a600为0.406(
‑
),8为a600为0.406(+),9为a600为0.233(
‑
),10为a600为0.233(+),11为a600为0.130(
‑
),12为a600为0.095(+)。
56.出血性大肠杆菌o157:h7 nctc 12900作为试纸条质控菌筛选结果如图3所示,7号试纸条后面的试纸条的c线荧光变浅,其中1
‑
6号试纸条c线荧光较亮,其中6号试纸t线荧光最亮,且5号试纸条背景荧光最低。果斑菌sd01作为试纸条质控菌筛选结果如图4所示,未封闭的果斑菌采用pbs均有荧光条带,有假阳性,因此不适合作为质控菌株。副溶血性弧菌atcc 17802作为试纸条质控菌筛选结果如图5所示,8号试纸条后面的试纸条的c线荧光变浅,其中1
‑
7号试纸条c线荧光较亮,其中4号试纸t线荧光最亮,且所有的阴性荧光背景最低,结合表1,结合垫上的荧光标记质控菌浓度采用波长600nm下吸光值为0.7~1.2之间较为合适,且副溶血性弧菌atcc 17802和出血性大肠杆菌o157:h7均可作为质控菌株。
57.表1结合垫上荧光标记靶标菌的浓度
58.试纸条编号出血性大肠杆菌o157:h7副溶血性弧菌果斑菌1/21.2061.2341.1393/40.9820.9950.9175/60.6840.7010.6427/80.3950.4060.2909/100.2280.2330.18611/120.1090.1300.095
59.三、交叉反应测试
60.在杂交瘤细胞建株时,对杂交瘤细胞上清的特异性进行快速测定,快速获得特异性和广谱性的杂交瘤细胞是一种理想的细胞开发策略,对相应的杂交瘤的抗体的快速应用起着决定性作用,同时,也节省了繁琐的工作量和成本。
61.本实施例中采用细菌单克隆抗体交叉反应快速测定免疫荧光试纸条进行快速测定的方法,该方法中采用两种荧光标记的细菌,测定大肠杆菌o157杂交瘤细胞上清的交叉反应时,采用副溶血性弧菌atcc 17802抗体作为质控线,测定副溶血性弧菌杂交瘤细胞上清交叉反应时,采用大肠杆菌nctc 12900抗体作为质控线。每次测定时,取50μl细胞上清与调试好浓度的目标菌混合,插上试纸条进行层析,另各取100μl细胞上清同时采用间接elisa测定。由于t线采用的是多抗,且细菌表面蛋白靶点多,因此交叉反应采用对比判读,每种细菌同时测定阴性及阳性测试样本,进行最后交叉反应的判读。
62.细菌细胞上清交叉反应间接elisa方法测定的步骤如下:
63.步骤1,加入100μl不同细菌的108菌液于所设定的孔中进行包被;并记录相关的信息。
64.步骤2,37℃避光孵育2小时或者4℃过夜;
65.步骤3,洗板2次,每次加入220ul 1
×
pbst,最后一次尽量甩干并在吸水纸上吸干;
66.步骤4,每孔加入220ul3%bsa封闭液封闭菌板;
67.步骤5,37℃避光孵育1.5小时或者4℃过夜;
68.步骤6,洗板2次,每次加入220ul 1
×
pbst,最后一次尽量甩干并在吸水纸上吸干;
69.步骤7,在每孔中加入100ul稀释过的靶标抗体,轻轻摇动微孔板混匀;
70.步骤8,室温37℃避光孵育1小时;
71.步骤9,洗板3次,每次加入220ul 1
×
pbst,最后一次尽量甩干并在吸水纸上吸干;
72.步骤10,每孔分别加入稀释好的羊抗鼠二抗(避免阳光直射和工作台温度过低,孵育时适当覆盖微孔板);
73.步骤11,室温37℃避光孵育1小时;
74.步骤12,洗板3次,每次加入220ul1
×
pbst,最后一次尽量甩干并在吸水纸上吸干;
75.步骤13,加入100ul的tmb显色液(配制好的显色液无色,出现颜色变化不能使用);
76.步骤14,室温37℃避光孵育10
‑
15分钟,加入50ul的终止液终止反应,在450nm下读od值(读数前使用无绒布擦拭微孔底部水分和指模)。
77.1、出血性大肠杆菌e7杂交瘤细胞上清交叉反应测试
78.图6是本发明的实施例中出血性大肠杆菌o157:h7杂交瘤e7细胞上清与不同细菌测试反应结果示意图,其中,(
‑
)表示用sp2细胞上清测试结果,(+)表示用e7细胞上清测试结果;1为nctc 12900(
‑
),2为nctc 12900(+),3为atcc 43895(
‑
),4为atcc 43895(+),5为atcc 43889(
‑
),6为atcc 43889(+),7为cctccab 2013344(
‑
),8为cctccab 2013344(+),9为cctccab 2013342(
‑
),10为cctccab 2013342(+),11为cctccab 2013345(
‑
),12为cctccab 2013345(+),13为cctccab 2013343(
‑
),14为cctccab2013343(+),15为atcc 25922(
‑
),16为atcc 25922(+),17为atcc 8739(
‑
),18为atcc 8739(+),19为atcc 13076(
‑
),20为atcc 13076(+),21为cmcc 50115(
‑
),22为cmcc 50115(+),23为cmcc 50094(
‑
),24为cmcc 50094(+)。
79.图7是本发明的实施例中出血性大肠杆菌o157:h7杂交瘤e7细胞上清与不同细菌测试反应结果示意图,其中,(
‑
)表示用sp2细胞上清测试结果,(+)表示用e7细胞上清测试结果,1为atcc 14028(
‑
),2为atcc 14028(+),3为atcc 25931(
‑
),4为atcc 25931(+),5为cmcc 51105(
‑
),6为cmcc 51105(+),7为atcc 12202(
‑
),8为atcc 12202(+),9为atcc 9207(
‑
),10为atcc 9207(+),11为cmcc 51592(
‑
),12为cmcc 51592(+),13为cmcc 51346(
‑
),14为cmcc 51346(+),15为cmcc 52207(
‑
),16为cmcc 52207(+),17为atcc 23715(
‑
),18为atcc 23715(+),19为atcc 29544(
‑
),20为atcc 29544(+),21为atcc 29004(
‑
),22为atcc 29004(+),23为atcc 17802(
‑
),24为atcc 17802(+)。
80.采用本实施例的方法,e7杂交瘤细胞上清交叉反应如图6和图7所示,与elisa实验结果统计进行对比,如表2所示,间接elisa测试结果表明,e7杂交瘤细胞的抗体与目标菌atcc 43895弱结合,在不同的测试中,存在无法测出的问题,与其他菌株均无交叉反应,特异性良好。本实施例方法测试结果表明,图6中的15号和16号试纸条均出现强阳性,通过对比判读,判读为阳性,图7均无阳性。因此,除了atcc 25922,本实施例方法的结果与间接elisa的结果高度一致,在24株菌测试中,符合率达到95.8%。
81.表2 e7杂交瘤细胞上清交叉反应
82.[0083][0084]
2、副溶血性弧菌杂交瘤细胞上清交叉反应测试
[0085]
图8是本发明的实施例中副溶血性弧菌杂交瘤h7细胞上清与不同细菌测试反应结果示意图,其中,(
‑
)表示用sp2细胞上清测试结果,(+)表示用h7细胞上清测试结果,其中,1为atcc 17802(
‑
),2为atcc 17802(+),3为nctc 12900(
‑
),4为nctc 12900(+),5为atcc 43895(
‑
),6为atcc 43895(+),7为atcc 43889(
‑
),8为atcc43889(+),9为cctccab 2013344(
‑
),10为cctccab 2013344(+),11为cctccab 2013342(
‑
),12为cctccab 2013342(+),13为cctccab 2013345(
‑
),14为cctccab 2013345(+),15为cctccab 2013343(
‑
),16为cctccab 2013343(+),17为atcc 25922(
‑
),18为atcc 25922(+),19为atcc 8739(
‑
);20:atcc 8739(+),21为atcc 13076(
‑
),22为atcc 13076(+),23为cmcc 50115(
‑
),24为cmcc 50115(+)。
[0086]
图9是本发明的实施例中副溶血性弧菌杂交瘤h7细胞上清与不同细菌测试反应结果示意图,其中,(
‑
)表示用sp2细胞上清测试结果,(+)表示用h7细胞上清测试结果,其中,1为cmcc 50094(
‑
),2为cmcc 50094(+),3为atcc 14028(
‑
),4为atcc 14028(+),5为atcc 25931(
‑
),6为atcc 25931(+),7为cmcc 51105(
‑
),8为cmcc 51105(+),9为atcc 12202(
‑
),10为atcc 12202(+),11为atcc 9207(
‑
),12为atcc 9207(+),13为cmcc 51592(
‑
),14为cmcc 51592(+),15为cmcc 51346(
‑
),16为cmcc 51346(+),17为cmcc 52207(
‑
),18为cmcc 52207(+),19为atcc 23715(
‑
),20为atcc 23715(+),21为atcc 29544(
‑
),22为atcc 29544(+),23为atcc 29004(
‑
),24为atcc 29004(+)。
[0087]
图10是本发明的实施例中副溶血性弧菌杂交瘤c9细胞上清与不同细菌测试反应结果示意图,其中,(
‑
)表示用sp2细胞上清测试结果,(+)表示用h7细胞上清测试结果,1为atcc 17802(
‑
),2为atcc 17802(+),3为nctc 12900(
‑
),4为nctc 12900(+),5为atcc 43895(
‑
),6为atcc 43895(+),7为atcc 43889(
‑
),8为atcc 43889(+),9为cctccab 2013344(
‑
),10为cctccab 2013344(+),11为cctccab 2013342(
‑
),12为cctccab 2013342(+),13为cctccab 2013345(
‑
),14为cctccab 2013345(+),15为cctccab 2013343(
‑
),16为cctccab 2013343(+),17为atcc 25922(
‑
),18为atcc 25922(+),19为atcc 8739(
‑
),20为atcc 8739(+),21为atcc 13076(
‑
),22为atcc 13076(+),23为cmcc 50115(
‑
),24为cmcc 50115(+)。
[0088]
图11是本发明的实施例中副溶血性弧菌杂交瘤c9细胞上清与不同细菌测试反应结果示意图,其中,(
‑
)表示用sp2细胞上清测试结果,(+)表示用h7细胞上清测试结果,1为
cmcc 50094(
‑
),2为cmcc 50094(+),3为atcc 14028(
‑
),4为atcc 14028(+),5为atcc 25931(
‑
),6为atcc 25931(+),7为cmcc 51105(
‑
),8为cmcc 51105(+),9为atcc 12202(
‑
),10为atcc 12202(+),11为atcc 9207(
‑
),12为atcc 9207(+),13为cmcc 51592(
‑
),14为cmcc 51592(+),15为cmcc 51346(
‑
),16为cmcc 51346(+),17为cmcc 52207(
‑
),18为cmcc 52207(+),19为atcc 23715(
‑
),20为atcc 23715(+),21为atcc 29544(
‑
),22为atcc 29544(+),23为atcc 29004(
‑
),24为atcc 29004(+)。
[0089]
采用实施例的方法,h7杂交瘤细胞上清交叉反应如图8和图9所示,采用本实施例的c9杂交瘤细胞上清交叉反应如图10和图11所示。与elisa实验结果统计进行对比,如表3所示,间接elisa测试结果表明,h7和c9杂交瘤细胞上清的抗体均只与17802结合,与其他菌株均无交叉反应,特异性良好。本实施例的方法测试结果表明,图8和图10中15号和16号试纸条均出现强阳性,无法判读。图9和图11均无阳性。因此,除了atcc 25922,本实施例方法结果与间接elisa结果高度一致,在24株菌测试中,符合率达到95.8%。
[0090]
采用本实施例构建的方法,能够对不同的细菌细胞上清的单克隆抗体的交叉反应进行快速测定,由于采用了对细菌进行荧光标记,需要很少的抗体,测定成本低,且测定结果与间接elisa方法高度一致,在24株菌测试中,符合率达到95.8%,检测时间仅需10
‑
15min。
[0091]
表3 h7、c9杂交瘤细胞上清交叉反应
[0092]
[0093][0094]
实施例的作用与效果
[0095]
以上实施例中的细菌单克隆抗体交叉反应快速测定免疫荧光试纸条,由于采用了新的试纸条及设计,实验结果显示,与间接elisa方法对比,该方法能够对不同细菌的细胞上清中单克隆抗体纯化后的单克隆抗体的交叉反应进行快速从测定,时间仅需10
‑
15min。
[0096]
因此,本实施例的细菌单克隆抗体交叉反应快速测定免疫荧光试纸条及测定方法,能够便捷、快速对杂交瘤或者抗体的交叉反应进行快速测定,且测定成本低,符合率高,检测时间短,还可以将高质量可大范围应用的抗体和杂交瘤挑选出来。
[0097]
上述实施方式为本发明的优选案例,并不用来限制本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1