一种基于明亮发光杆菌快速检测玉米赤霉烯酮生物毒性的方法
本发明涉及玉米赤霉烯酮生物毒性检测领域,具体涉及一种基于明亮发光杆菌快速检测玉米赤霉烯酮生物毒性的方法。
背景技术:
玉米赤霉烯酮(zearalenone,zen,zea),又称f-2毒素,是一种由镰刀属真菌产生的具有雌激素毒性作用的一种甾体霉菌毒素。zen能污染许多粮食作物如玉米、小麦和大豆等,造成人类的食品安全问题;zen污染饲料后,引发动物中毒;zen进入自然界则会造成环境污染。zen被国际癌症研究机构iarc分类为第3组致癌物质,其毒性仅次于黄曲霉毒素,给人和动物的健康带来很大的危害,其毒性主要表现为生殖毒性、免疫毒性、肝肾毒性、细胞毒性和致癌性等,可引发动物产生雌激素亢进症,妊娠期的动物食用zen可引起流产、死胎或畸胎,此外,人食用被zen污染的食物也可引起中枢神经系统中毒,产生头痛、恶心、神经抑郁等症状。
为了减少zen对人体、动物健康的危害以及农业、畜牧业带来的经济损失,建立一种快速、准确、简便、成本低的zen检测方法具有重要意义。目前,用于检测zen的方法主要有薄层色谱法、气相色谱法、高效液相色谱法和免疫分析法。1)薄层色谱法(tlc)是最早用于检测zen的方法,该方法操作步骤简单、检测稳定性好而且成本也较低。然而,在使用该方法时,存在诸如样品预处理比较复杂、展开剂需求大、检测周期长和所用材料环保性不好对操作人员健康存在影响的缺点。该方法已被现在的主流检验机构逐渐淘汰。2)气相色谱法(gc)可用于zen的定量检测,具有灵敏度高、选择性高、检测速度快等优点,但是gc法对样品中成分的纯净度要求很高,预处理操作过程复杂,常需要与质谱联用才能得到准确的结果。gc/ms对操作环境要求高和需要熟练的操作人员等,gc/ms不能作为常规方法进行饲料中zen的检测。3)高效液相色谱法(hplc)是zen定量检测中最常用的一种方法,具有灵敏度高、重复性好等优点,但是该方法检测成本较高,且操作复杂、检测周期较长,难以实现高通量快速检测的要求。4)免疫分析法是通过抗原与单克隆抗体或多克隆抗体之间的特异性反应实现的,可用于zen定性定量分析。酶联免疫吸附法避免不了反复多次的洗板步骤;化学发光分析法具有检测时间长的缺点;放射免疫法容易出现交叉反应和假阳性实验中使用放射性同位素,容易污染环境,对人体也有一定的伤害。
生物毒性检测法是利用微生物、植物及动物在受污染的环境中产生的各种生理方面信息来判断环境质量的方法,通常生物毒性检测采用的指示生物有鱼类、水圣、藻类、发光菌等。发光细菌是一类能在生长过程中发出450~490nm可见荧光的非致病性革兰氏阴性菌,发光菌法是通过发光菌与有毒物直接接触而引起发光值发生变化的直接生物毒性测试方法。发光菌的发光过程与其细胞的活性和生理代谢活动直接关联,当采用发光菌作为毒性受试生物时,细胞的生理活性会发生一些改变,这些变化会最终导致生物发光强度的减弱,通过测定其发光下降程度,评价被测物质毒性的强弱。
薄层色谱法、气相色谱法和高效液相色谱法等zen的检测技术,均仅对zen的含量进行了测定,不能反映zen的生物毒性。现在对zen的生物毒性评价,主要有三个方面,即细胞毒性(肝脏毒性)、雌激素效应和致突变性。针对细胞毒性(肝脏毒性)的评价,各类文献中常见的为hepg2细胞试验模型;针对雌激素效应的评价,各类文献中常见的为mcf-7细胞试验模型。使用细胞模型对zen的生物毒性来进行评价,具有准确的优点,但细胞实验对操作环境要求高、需要熟练的操作人员和测试周期长,并不适用于常规的生产及研究中。
因此,目前仍然需要反应快、检测灵敏、操作简便、成本低,能够达到分析zen生物毒性的检测方法。
技术实现要素:
为了克服现有技术的缺点与不足,本发明的目的在于提供一种基于明亮发光杆菌快速检测米赤霉烯酮降生物毒性的方法,以解决上述背景技术中提出的问题。该方法使用明亮发光杆菌作为检验玉米赤霉烯酮生物毒性的受试生物,包括明亮发光杆菌的培养、冻干粉的制备、冻干粉的复苏活化和样品生物毒性的检测4个步骤。
本发明的目的通过下述技术方案实现:
一种基于明亮发光杆菌快速检测米赤霉烯酮降生物毒性的方法,包括以下步骤:
s1、明亮发光杆菌冻干粉的复苏活化
(1)取明亮发光杆菌冻干粉,迅速加入预冷的无菌水,恒温复苏;
(2)取复苏后的菌液,以1:40~1:60的体积比,加入预冷的冻干菌活化液并漩涡均匀,恒温下活化;
(3)菌液的稀释,以预冷的氯化钠溶液为稀释液,将活化后的菌液稀释至适当发光强度;
s2、样品生物毒性的检测及计算
(a)检测:取稀释后的菌液置于酶标板上,然后加入等体积一系列浓度的玉米赤霉烯酮样品,混合均匀,室温下反应15±1min,使用多功能酶标仪测定发光强度;每一样品做一个对照;
(b)计算:相对发光强度(%)=样品管发光强度×100%/对照管发光强度;以明亮发光杆菌的相对发光度与玉米赤霉烯酮的浓度之间的关系做出关系曲线并得到相关方程;
(c)取待测样品,参照步骤(a)~(b),测得发光强度,并获得相对发光强度,根据相关方程计算得出待测样品中玉米赤霉烯酮的浓度。
优选的,步骤s1(1)中,明亮发光杆菌为明亮发光杆菌t3小种(photobacteriumphosphoreumt3spp.);
优选的,步骤s1(1)中,预冷的无菌水为预冷至4±1℃的无菌水;
优选的,步骤s1(1)中,恒温复苏的条件为在15±1℃下恒温复苏10~15min;
优选的,步骤s1(1)中,明亮发光杆菌冻干粉,是将每50ml发酵菌液离心后获得菌体,并加入1ml冰冷的冻干保护剂重悬,分装,每管100μl,冻干获得明亮发光杆菌冻干粉;预冷的无菌水的加入量为100~200μl/管。
进一步的,步骤s1(1)中,明亮发光杆菌冻干粉的制备步骤如下:
ⅰ)在无菌条件下,取冷冻保藏的明亮发光杆菌菌种,接种到液体培养基中,振荡培养,获得种子液;接入一定量培养好的种子液到液体培养基中,振荡培养,得到发酵菌液;
ⅱ)将培养好的发酵菌液转移到离心管中,离心,弃去上清液,将附着在离心管壁的菌泥用冰冷的氯化钠溶液重悬;再一次离心,弃去上清液,将附着在离心管壁的菌泥用冰冷的冻干保护剂重悬;
ⅲ)将用冻干保护剂重悬的菌体分装,置于-80℃下冷冻成冰;真空干燥,干燥完毕置于-20℃保存备用。
优选的,步骤ⅰ)中,菌种的接种量为0.1%~0.5%(v/v);进一步为0.4%(v/v);
优选的,步骤ⅰ)中,液体培养基的配方为:30g/lnacl、6.89g/lnah2po4·2h2o、2.75g/lk2hpo4·3h2o、0.204g/lmgso4·7h2o、0.5g/l(nh4)2hpo4、2.5g/lpeptone、2.5g/lsoyapeptone、0.5g/lyeastextract和3ml/lglycerol。
优选的,步骤ⅰ)中,振荡培养的条件均为在20±1℃,200~220rpm条件下振荡培养20±1h;
优选的,步骤ⅰ)中,种子液的接种浓度在od600范围为0.015~0.025。
优选的,步骤ⅱ)中,离心的条件为6000~10000g,4±0.1℃条件下离心10~15min;进一步为7000g,4±0.1℃条件下离心15min;
优选的,步骤ⅱ)中,再一次离心的条件为6000~10000g,4±0.1℃条件下离心10~15min;进一步为7000g,4±0.1℃条件下离心15min;
优选的,步骤ⅱ)中,所述冻干保护剂为:20%(m/v)的蔗糖溶液或20%(m/v)蔗糖+4%(m/v)海藻糖的溶液;进一步优选为20%的蔗糖溶液。
优选的,步骤ⅲ)中,真空干燥的条件为在-50±1℃下真空干燥18~22h;进一步为在-50℃下真空干燥20h;
优选的,步骤s1(2)中,以1:50的体积比,加入预冷的冻干菌活化液并漩涡均匀。
优选的,步骤s1(2)中,预冷的冻干菌活化液为预冷至4±1℃的冻干菌活化液;
所述的冻干菌活化液为:30g/lnacl、2.035g/lmgcl2·7h2o和0.3g/lkcl,调ph值至7.0±0.1。
优选的,步骤s1(2)中,恒温下活化的条件为15±1℃恒温下活化20~30min;
优选的,步骤s1(3)中,预冷的氯化钠溶液为预冷至4±1℃的氯化钠溶液;
所述的氯化钠溶液为ph值为7±0.1的3%(m/v)氯化钠无菌溶液;
优选的,步骤s1(3)中,适当发光强度为100μl稀释后菌液的发光强度为10000~12000;
优选的,步骤s2(a)中,所述一系列浓度的玉米赤霉烯酮为100、80、60、40、20、10、5mg/l,溶剂为甲醇。
优选的,步骤s2(a)中,室温的温度为20~25℃。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明的方法中,在室温(20~25℃)下,不同浓度玉米赤霉烯酮与明亮发光杆菌接触后,随着玉米赤霉烯酮浓度升高,明亮发光杆菌相对发光强度减弱。表明玉米赤霉烯酮浓度越高,对明亮发光杆菌发光抑制性越强,即玉米赤霉烯酮浓度越高对明亮发光杆菌的生物毒性作用越强。本发明的检测结果完全能够满足对玉米赤霉烯酮残留检测,该方法前处理简单、反应快、检测灵敏、操作简便、成本低,可对玉米赤霉烯酮生物毒性实现快速检测。
(2)与现有的薄层色谱法、气相色谱法、高效液相色谱法和免疫分析法等能定量检测zen的方法相比,本发明的方法,采用发光细菌检测的前处理简单,成本低廉,对玉米赤霉烯酮的检测速度快,同时也可对样品的综合生物毒性进行评价。而与hepg2细胞试验模型、mcf-7细胞试验模型等能对zen的生物毒性评价的方法相比,本发明的方法对操作环境要求低、不需要熟练的操作人员、费用低和测试周期短,同时也可反映出样品中的玉米赤霉烯酮含量的高低,适用于常规的生产及研究中。
(3)本发明中提供的发光细菌冻干制剂制备工艺简单、操作简便;使用该方法制备的发光细菌冻干制剂,对不同浓度玉米赤霉烯酮敏感度高;同时,本发明使用多功能酶标仪作为检测仪,可实现多个样品的批量检测。因此,本发明提供的方法适于规模化工业生产及应用。
附图说明
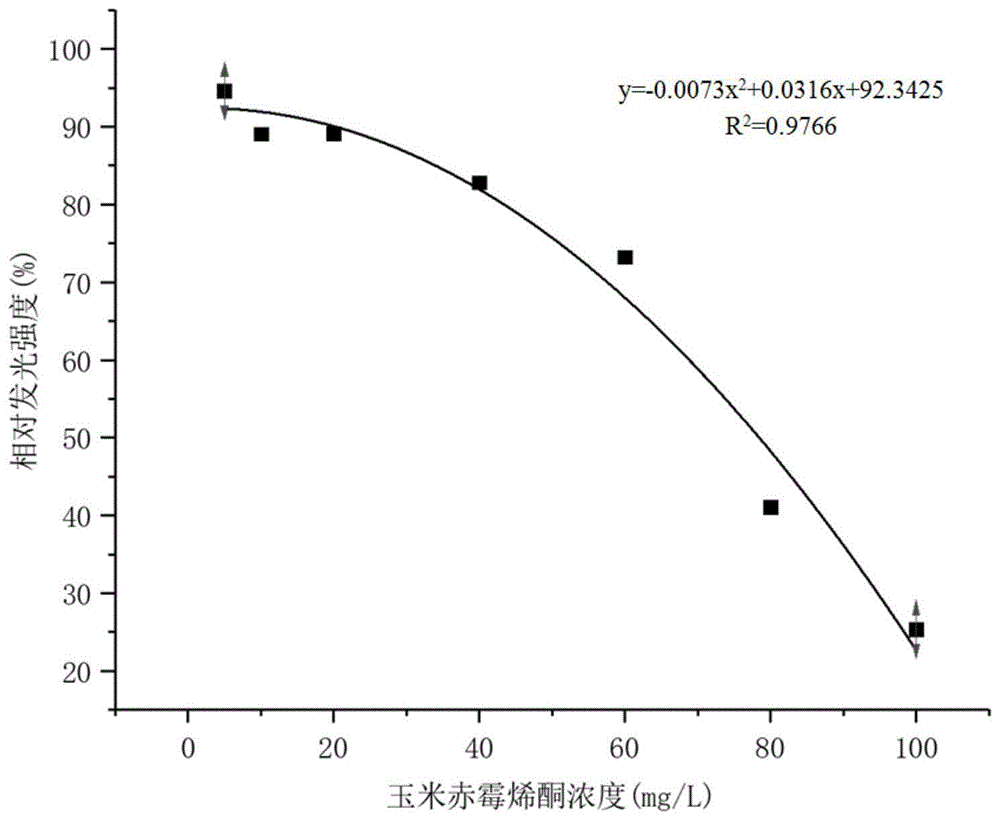
图1是实施例4中不同浓度玉米赤霉烯酮对明亮发光杆菌(经本发明方法处理后的冻干菌活化液)相对发光强度的影响。
图2是实施例4中不同浓度玉米赤霉烯酮对明亮发光杆菌(新鲜菌液)相对发光强度的影响。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。所使用的材料、试剂等,如无特殊说明,为从商业途径得到的试剂和材料。
实施例中所用的明亮发光杆菌为明亮发光杆菌t3小种(photobacteriumphosphoreumt3spp.),购自北京碧霄生物科技有限公司。
实施例1、明亮发光杆菌的培养
(1)种子培养:在无菌条件下,取甘油冷冻保藏的菌种200μl,接种到盛有50ml液体培养基(配方:称取30gnacl、6.89gnah2po4·2h2o、2.75gk2hpo4·3h2o、0.204gmgso4·7h2o、0.5g(nh4)2hpo4、2.5gpeptone、2.5gsoyapeptone、0.5gyeastextract和3mlglycerol,溶于1l水中,调ph值至7.0±0.1,121℃,20min灭菌)的250ml锥形瓶中,在20℃,200rpm条件下振荡培养20h,得到培养好的种子液。
(2)发酵培养:取培养好的种子液,在盛有50ml液体培养基的250ml锥形瓶中,接入一定量的种子液(接种浓度为od600值范围为0.015~0.025),20℃,200rpm培养,培养时间为20h,得到培养好的发酵菌液。
实施例2、明亮发光杆菌冻干粉的制备
(1)将实施例1培养好的发酵菌液50ml转移到无菌的离心管中,7000g,4℃条件下离心15min;
(2)弃去上清液,将附着在离心管壁的菌泥用5ml冰冷的浓度为3%(m/v)的氯化钠溶液重悬。再一次在7000g,4℃条件下离心15min;
(3)弃去上清液,将附着在离心管壁的菌泥用1ml冰冷的冻干保护剂(20%(m/v)的蔗糖溶液)重悬;
(4)将用冻干保护剂重悬的菌体分装到ep管中,每管100μl,置于-80℃下冷冻12h;
(5)在-50℃下真空干燥20h,干燥完毕置于-20℃保存备用。
实施例3、明亮发光杆菌冻干粉的复苏活化
(1)将存储在-20℃冰箱中的装有明亮发光杆菌冻干粉的ep小管取出,迅速加入100μl预冷至4℃的无菌水,在15℃下恒温复苏10min;
(2)取复苏后的菌液,以1:50的比例,加入预冷至4℃的冻干菌活化液并漩涡均匀,15℃恒温下活化30min。
所述的冻干菌活化液的制备如下:称取30gnacl、2.035gmgcl2·7h2o和0.3gkcl,溶于1l水中,调ph值至7.0±0.1,121℃,20min灭菌;
(3)菌液的稀释,以预冷至4℃的氯化钠溶液(ph值为7的3%氯化钠无菌溶液)为稀释液,将活化后的菌液稀释,稀释后的100μl菌液的发光强度在10000~12000为宜。
实施例4、不同浓度玉米赤霉烯酮生物毒性的检测
(1)样品的制备:将玉米赤霉烯酮标品溶于甲醇,浓度为1000mg/l,用ph值为7.0的3%氯化钠溶液作为稀释液,稀释所得玉米赤霉烯酮的甲醇溶液得到浓度为100mg/l、80mg/l、60mg/l、40mg/l、20mg/l,10mg/l,5mg/l的7种浓度的玉米赤霉烯酮溶液。对照为不含玉米赤霉烯酮的甲醇溶液,按的制备不同玉米赤霉烯酮浓度的方法进行稀释,每一稀释度做一个对照。
(2)使用冻干菌活化液进行检测:取稀释后的冻干菌活化菌液100μl置于酶标板上,然后加入等体积一系列浓度的玉米赤霉烯酮样品,混合均匀,每个样品设置3组重复,室温下(20~25℃左右)反应15min,使用多功能酶标仪测定发光强度。每一样品做一个对照。
(3)使用新鲜培养的菌液进行检测:取实施例1培养制备的新鲜发酵菌液,用ph值为7.0的3%氯化钠溶液作为稀释液,稀释至100μl菌液的发光强度在10000~12000。取稀释后的新鲜菌液100μl置于酶标板上,然后加入等体积一系列浓度的玉米赤霉烯酮样品,混合均匀,每个样品设置3组重复,室温下(20~25℃左右)反应15min,使用多功能酶标仪测定发光强度。每一样品做一个对照。
(4)计算与结果分析:相对发光强度(%)=样品管发光强度×100%/对照管发光强度。以明亮发光杆菌的相对发光度与玉米赤霉烯酮的浓度之间的关系做出关系曲线并得到相关方程。
使用冻干菌活化液进行检测的测试结果如图1所示。在室温(20~25℃)下,不同浓度玉米赤霉烯酮与经过本发明冻干处理后的明亮发光杆菌的接触后,随着玉米赤霉烯酮浓度升高,明亮发光杆菌相对发光强度降低。表明玉米赤霉烯酮浓度越高,对明亮发光杆菌发光抑制性越强,即玉米赤霉烯酮浓度越高对明亮发光杆菌的生物毒性作用越强。将明亮发光杆菌的相对发光度与玉米赤霉烯酮的浓度,进行拟合分析,得到拟合方程为:y=-0.0073x2+0.0316x+92.342,相关系数r2=0.9766,相关性较高。说明在本实验范围内,经过本发明提供的方案处理后的明亮发光杆菌的相对发光强度受不同浓度玉米赤霉烯酮的影响显著。因此本发明的方法可以用于玉米赤霉烯酮生物毒性的评价。
使用新鲜培养的菌液进行检测的测试结果如图2所示。在室温(20~25℃)下,不同浓度玉米赤霉烯酮与新鲜培养的明亮发光杆菌接触后,随着玉米赤霉烯酮浓度升高,明亮发光杆菌相对发光强度有降低的趋势。将明亮发光杆菌的相对发光度与玉米赤霉烯酮的浓度,进行拟合分析,得到拟合方程为:y=-0.0305x+98.4483,相关系数r2=0.0424,相关性非常低。说明在本实验范围内,新鲜培养的明亮发光杆菌对不同浓度的玉米赤霉烯酮敏感性非常低,不适用于表征样品中玉米赤霉烯酮浓度的变化。
实施例5、玉米赤霉烯酮经酶处理后产物的生物毒性的检测
(1)样品的制备:将400μl的过氧化物酶prx水溶液,50μl的0.25mol/ltris-hcl(ph8.5)缓冲液,和20μl的0.5mol/lh2o2水溶液混合均匀;接着添加50μlzen的甲醇储备液(1mg/ml),放置在40℃的恒温水浴锅中,反应12h,在12000×g下离心5min,上清液用于分析酶催化反应后的生物毒性。在对照组中,使用缓冲液代替过氧化物酶prx水溶液。
(2)使用冻干菌活化液进行检测:取稀释后的冻干菌活化菌液100μl置于酶标板上,然后加入100μl酶催化反应后的上清夜,混合均匀,每个样品设置3组重复,室温下(20~25℃左右)反应15min,使用多功能酶标仪测定发光强度。每一样品做一个对照。
(3)计算:相对发光强度(%)=样品管发光强度×100%/对照管发光强度。
余元善等(cloning,expressionofaperoxiredoxingenefromacinetobactersp.sm04andcharacterizationofitsrecombinantproteinforzearalenonedetoxification.microbiologicalresearch10.1016/j.micres.2011.07.004)基于mcf-7细胞增值试验,对玉米赤霉烯酮经过氧化物酶prx催化反应后的产物的生物毒性进行评价。实验结果表明,经过氧化物酶prx催化反应后的样品组,mcf-7细胞的增值率为9.2±1.4%;而未经过氧化物酶prx处理的对照组,mcf-7细胞的增值率高达84±0.6%,这说明过氧化物酶prx能有效的降解玉米赤霉烯酮,显著降低含玉米赤霉烯酮的体系的生物毒性。
实验结果表明,经酶催化反应后样品组的相对发光强度为97.0268%,而未经酶处理的对照组的明亮发光杆菌基本无发光强度。所以,经过氧化物酶prx酶催化反应后,体系的玉米赤霉烯酮能被有效降解,体系的生物毒性大大降低。这与余元善等人的酶催化反应产物生物毒性的评价结果一致,也进一步说明本发明的方法是切实可行的。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!