一种卡那霉素残留量的检测方法与流程
1.本发明属于分析检测技术领域,具体涉及一种卡那霉素残留量的检测方法。
背景技术:
2.卡那霉素是一种蛋白质生物合成抑制剂,它可以结合于细菌细胞内的核糖体30s亚基,导致mrna的错读,来抑制细菌蛋白质的合成抑制细菌生长。工程菌构建过程中,常将有卡那霉素抗性的重组质粒转入大肠埃希菌中。在发酵过程中,含有重组质粒的大肠埃希菌经过一级种子液和二级种子液发酵时,常加入浓度为200mg/ml的卡那霉素,以便菌种更好地发酵。随着抗生素广泛应用和细菌耐药性的产生,抗生素残留对产品的影响获得越来越多的关注和研究。对抗生素残留量进行测定,检测其含量在生产和质控中显得至关重要。传统的抗生素残留检测法有培养法、高效液相串联质谱法、酶联免疫吸附法(elisa法)。其中,elisa法以其简便、快速定量、价格低廉成为主要的检验手段。
3.酶联免疫吸附法的试剂盒的原理是采用间接竞争elisa方法。在酶标板微孔条上预包被偶联抗原,样本中残留的卡那霉素和微孔条上预包被的偶联抗原竞争抗卡那霉素的抗体,加入酶标二抗后,用3,3,5,5
‑
四甲基联苯胺(tmb)底物显色,样本吸光度值与其所含残留物卡那霉素的含量成负相关,与标准曲线比较,再乘以其对应的稀释倍数,即可得出样本中的卡那霉素残留量,其定量测定卡那霉素的范围是0.5~40.5ng/ml。含有经过基因重组质粒的大肠埃希菌,在生产的发酵阶段加入了卡那霉素,经过一系列的裂解、纯化步骤后,去除了大部分卡那霉素,因此,在使用elisa法检测的过程中,如果样本卡那霉素残留量过低,其检测结果会落于标准曲线的范围外,不适用于直接根据曲线换算残留量。
技术实现要素:
4.为了克服现有技术存在无法检测供试品中过低卡那霉素残留量的问题,本发明的第一方面的目的,在于提供一种卡那霉素残留量的检测方法。
5.为了实现上述目的,本发明所采取的技术方案是:
6.本发明的第一个方面,提供一种卡那霉素残留量的检测方法,包括如下步骤:
7.(1)采用卡那霉素检测酶联免疫试剂盒分别检测供试品和标准品的吸光值(od值);
8.(2)根据供试品和标准品的吸光值判断供试品中卡那霉素的残留量与标准品浓度的大小:
9.当od
供试品
>od
标准品
时,表明供试品的卡那霉素残留量低于标准品的浓度;当od
供试品
≤od
标准品
时,表明供试品的卡那霉素残留量大于等于标准品的浓度。
10.所述卡那霉素检测酶联免疫试剂盒包括酶标板、酶标记抗抗体、卡那霉素标准品、底物显色液、终止液、洗涤液、稀释液、卡那霉素抗体,所述酶标板包被有包被原。
11.步骤(1)中所述标准品的浓度可以根据需要通过卡那霉素检测酶联免疫试剂盒中的卡那霉素标准品和稀释液进行调整。
12.优选的,所述酶标记抗抗体的酶标记为辣根过氧化物酶标记的羊抗鼠抗抗体。
13.优选的,所述底物显色液包括底物显色a液和底物显色b液,所述底物显色a液为过氧化脲,所述底物显色b液为四甲基联苯胺。
14.优选的,所述终止液为硫酸溶液。
15.优选的,所述稀释液为磷酸盐缓冲液。
16.优选的,所述包被原为卡那霉素偶联抗原。
17.步骤(1)中所述采用卡那霉素检测酶联免疫试剂盒检测供试品和标准品的吸光值的方法为:
18.1)分别将供试品和标准品加入酶标板中,然后加入酶标抗抗体、卡那霉素抗体,孵育;
19.2)去除酶标板中的液体,加入洗涤液洗涤;
20.3)分别加入底物显色a液及底物显色b液,反应,分别加入终止液,检测吸光值。
21.优选的,步骤1)中所述孵育的条件为15~35℃下孵育25~55min;进一步为20~30℃下孵育30~50min。
22.优选的,步骤2)中所述洗涤的条件为洗涤3~5次,每次5~20s。
23.优选的,步骤3)中所述反应的条件为20~30℃下反应10~20min。
24.优选的,所述供试品为含卡那霉素的样品。
25.优选的,所述样品为药品和食品中的至少一种;进一步为质粒、牛奶、肉和疫苗中的至少一种。
26.本发明的有益效果是:
27.卡那霉素作为一种食品或药品中的杂质残留,关键在于限度的控制,本发明提供了一种卡那霉素残留量的检测方法,通过分别检测供试品和标准品的吸光值,判断供试品中的卡那霉素残留量是否超过残留量限度,该方法可以简便、快速、准确地判断供试品中卡那霉素残留量的多少,达到质量控制的目的。该方法无需昂贵的实验仪器和耗材,无需长时间培养菌悬液,且无需制备标准曲线;特别适用于研发初期实验条件尚不完备,且卡那霉素残留量特别低的产品。同时,该方法具有优异的准确性、精密度和耐用性。
附图说明
28.图1是培养法检测质粒浓度的结果图。
具体实施方式
29.以下通过具体的实施例对本发明的内容作进一步详细的说明。
30.本实施例中所使用的材料、试剂等,如无特别说明,为从商业途径得到的试剂和材料。
31.本实施例中使用的质粒通过如下方法得到:将将目的基因片段插入含有卡那霉素抗性基因的载体,然后导入大肠埃希菌,经发酵后收菌,通过碱裂解法裂解菌体,收获质粒。将复溶的质粒依次通过分子筛柱、亲和层析柱和阴离子交换柱,得到纯化后的原液,加入辅料配制后,过滤灌装成制剂。
32.本实施例中采用的卡那霉素(kanamycin)检测酶联免疫试剂盒(购自北京勤邦生
物技术有限公司,型号:ka03502h)。
33.实施例1一种卡那霉素残留量的检测方法
34.步骤a:使用elisa法对供试品和标准品进行处理:
35.1)配液:用供试品(质粒),用稀释液(磷酸盐缓冲液)配制卡那霉素残留量为20ng/ml、0.375ng/ml、0.25ng/ml和0.125ng/ml的标准品(卡那霉素残留量为20ng/ml时为阳性对照);所有试剂和酶标板(酶标板包被有卡那霉素偶联抗原)均放在20~25℃回温,溶液使用前摇匀,将供试品和标准品对应酶标板的微孔有序编号,每个供试品和标准品设置3个平行样;
36.2)孵育:分别取供试品/标准品各20μl到有包被原包被的酶标板的微孔中,然后每孔加入酶标记抗抗体(辣根过氧化物酶标记的羊抗鼠抗抗体)50μl,再每孔加入抗体工作液(卡那霉素抗体)80μl,轻轻震荡摇匀,用盖板膜覆盖板后置于25℃避光环境下反应40分钟;
37.3)洗涤:将酶标板的微孔内液体甩干,每孔加入洗涤工作液250μl,洗涤5次,每次10s;
38.4)显色:每孔加入底物显色a液(过氧化脲)50μl,再加入底物显色b液(四甲基联苯胺)50μl,震荡摇匀,用盖板膜覆盖板后置于25℃避光环境下反应15分钟;
39.5)测定:每孔加入终止液(硫酸溶液)50μl,摇匀,酶标仪双波长450/630nm检测od值。
40.步骤b:根据供试品和标准品的od值进行结果判断:当od
供试品
>od
标准品
时,表明供试品的卡那霉素残留量低于标准品的浓度;当od
供试品
≤od
标准品
时,表明供试品的卡那霉素残留量大于等于标准品的浓度。
41.效果实施例1准确性检测
42.(1)半定量法
43.取卡那霉素(kanamycin)检测酶联免疫试剂盒(北京勤邦生物技术有限公司,型号:ka03502h)中的标准曲线构建试剂包,制备标准曲线(具体方法参考试剂盒说明书),结果如表1所示:吸光度值(od)与卡那霉素浓度(c)呈反比:y为标准品吸光度值与最大吸光度值之比值,x为卡那霉素浓度,使用四参数logistic建立函数,y=2.088
‑
1.878/[1+(x/1.149)
0.396
],;r2=0.9966,其有效检测浓度0.5~40.5ng/ml,对应的吸光度值范围为0.210~1.841。
[0044]
表1定量法检测卡那霉素残留量的标准测试品吸光度值和变异系数
[0045]
标准测试品浓度(ng/ml)吸光度平均值(od)变异系数(cv)102.088
‑
20.51.8410.31%31.51.4671.59%44.50.9191.31%513.50.4733.29%640.50.2101.35%
[0046]
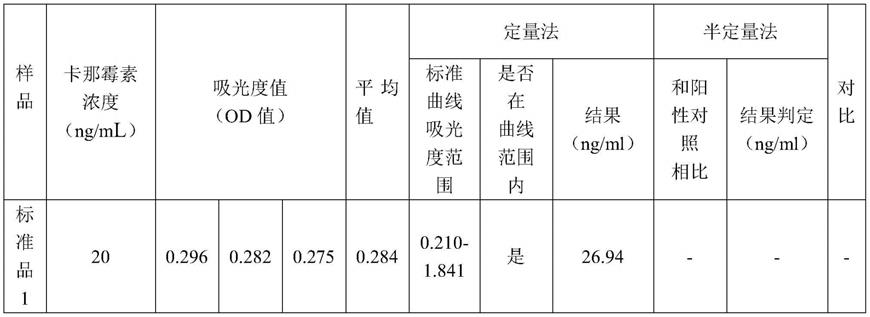
实施例1中的含有不同卡那霉素浓度的标准品1(20ng/ml)、标准品2(0.375ng/ml)、标准品3(0.25ng/ml)、标准品4(0.125ng/ml)、供试品1(质粒)经检测od值如表2所示:od
标准品1
为0.284,od
标准品2
为1.666,od
标准品3
为1.812,od
标准品4
为1.908,od
供试品1
为1.919。半定量法
结果为标准品2、3、4、供试品1的残留量均小于标准品1;标准品2和3的定量法结果为0.91ng/ml和0.53ng/ml,与半定量法结果一致;标准品4的理论浓度为0.125ng/ml,理论浓度和半定量法结果一致;标准品4和供试品1的od值经过双样本t检验分析,p值为0.731,两者无显著差异,表明两者理论浓度无显著差异,供试品1的结果和半定量法一致。
[0047]
表2定量法与半定量法检测卡那霉素残留的比较
[0048][0049][0050]
(2)培养法
[0051]
按照《中国药典》的抗生素残留培养法,取含有芽孢85%以上的枯草芽孢杆菌接种于有营养琼脂培养基(购自北京三药科技开发公司,产品号:11e1b)的培养皿中,35~37℃培养7天,将含菌液培养基倒入有抗生素ⅰ号培养基(购自北京三药科技开发公司,产品号:11e03,ph6.5
‑
6.6)底层的培养皿,放置4个牛津杯,依次加入阳性对照(卡那霉素残留量为20ng/ml)、阴性对照(ph8.0磷酸盐缓冲液)和质粒;同时,以实施例1的半定量法测定卡那霉素残留量为20ng/ml时及质粒的od值,结果如表2及图1所示:图1中,阳性对照(卡那霉素残留量为20ng/ml)有抑菌环,阴性对照无抑菌环,质粒无抑菌环,表明该批次质粒卡那霉素残留量<20ng/ml。与半定量法结果一致(质粒的od值大于卡那霉素浓度为20ng/ml时的od值)。
[0052]
效果实施例2精密度检测
[0053]
(1)重复性
[0054]
同一检验人员采用实施例1中检测方法对同一批质粒、阳性对照(卡那霉素残留量为20ng/ml)进行检测,每个供试品/标准品设置8个平行,结果如表3所示:三次的结果均显示阳性对照(卡那霉素残留量为20ng/ml)和质粒的od值的均值相比,p<0.001,有显著性差异,质粒的卡那霉素残留量小于20ng/ml。根据结果判定的规则,同一检验人员对同一批次的三次检验结果无差异。
[0055]
表3同一检验人员对同一批次质粒检测的结果
[0056][0057]
(2)中间精密度
[0058]
由不同的检验人员(人员a、人员b)采用实施例1中检测方法对同一批质粒、阳性对照(卡那霉素残留量为20ng/ml)进行检测,每个供试品/标准品设置5个平行,结果如表4所示:检验人员a和b的结果均显示阳性对照(卡那霉素残留量为20ng/ml)和质粒的od值均值相比,p<0.001,有显著性差异,质粒的卡那霉素残留量小于20ng/ml。根据结果判定的规则,不同检验人员对同一批次的检验结果无差异。
[0059]
表4不同检验人员对同一批次质粒检测的结果
[0060][0061]
效果实施例3耐用性检测
[0062]
(1)孵育温度对吸光度值的影响
[0063]
采用实施例1中检测方法对同一批质粒、阳性对照(卡那霉素残留量为20ng/ml)进
行检测(分别以20℃、25℃和30℃三个温度进行孵育),每个供试品/标准品设置8个平行,考察孵育温度对结果的影响,试验结果如表5所示:随着孵育温度的升高,吸光度值增大;但是与说明书标注的孵育温度(25℃)相比,20℃、30℃与25℃的rsd值均在elisa试剂盒的可接受范围内(<20%),且不同孵育温度的判定结果均为<20ng/ml,即孵育温度对吸光度值的无显著性影响。
[0064]
表5不同孵育温度下供试品的吸光度值
[0065][0066][0067]
(2)孵育时间对吸光度值的影响
[0068]
采用实施例1中检测方法对同一批质粒、阳性对照(卡那霉素残留量为20ng/ml)进行检测(孵育时间分别为30min、40min、50min),每个供试品/标准品设置8个平行,考察孵育时间对结果的影响,试验结果如表6所示:随着孵育时间的延长,吸光度值增大;但是与说明书标注的孵育时间(40min)相比,30min、50min与40min的rsd值均在elisa试剂盒的可接受
范围内(<20%),且不同孵育温度的判定结果均为<20ng/ml,即孵育时间对吸光度值的无显著性影响。
[0069]
表6不同孵育温度下供试品的吸光度值
[0070][0071][0072]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1