基于确定FGFR的分类样本的方法
基于确定fgfr的分类样本的方法
技术领域
1.本技术涉及分子诊断的领域。
背景技术:
2.尿路上皮癌(uc)是全球10种最常见的恶性肿瘤之一,其具有近386000例新发病例和近150200例死亡/年,其特征是高复发率和进展率。几十年来,转移性uc的唯一治疗方案是基于铂的化疗,其伴随着≤15%的低5年总生存率且标准化疗方案失败的患者预后极差。
3.免疫疗法代表了一种新兴的抗癌治疗概念。特别是,靶向ctla4、pd-1或pd-l1的抗体取得惊人的治疗成功,例如在被认为是高度免疫原性肿瘤的转移性黑色素瘤患者中。此外,抗体如纳武利尤单抗(nivolumab),已被成功用于治疗全身性晚期非小细胞肺癌和肾细胞癌。这些疗法的成功在突变负荷高的肿瘤类型中尤其令人信服,如非小细胞肺癌或黑色素瘤。
4.uc是一种体细胞突变率最高的癌症,并因此由于新抗原数量的增加,其被认为是高度免疫原性肿瘤。在过去两年,发表了几项对疗法应答具有良好结果的研究。而一些研究表明,获益与免疫组织化学染色确定的pd-l1表达无关。后来的研究证明了pd-l1表达状态依赖性的应答(阿替丽珠单抗(atezolizumab)、帕博利珠单抗(pembrolizumab))。
5.目前,肿瘤浸润免疫细胞(ic)的pd-l1染色似乎仅检测到潜在疗法应答者的一个子集,但到目前为止不是它们的全部。基因表达研究表明,阿替丽珠单抗对可以富集fgfr3突变的luminal i型肿瘤患者的获益较低。异常fgfr信号传导可以通过直接驱动癌细胞增殖和存活以及支持血管生成来促进肿瘤发展。
6.在晚期肌层浸润性膀胱癌(≥t2期)中,5%至20%的患者在fgfr3癌基因中存在点突变,而40%的患者存在fgfr3蛋白表达的上调。fgfr3在上尿路uc中也经常发生改变,而在高级别上尿路uc中的改变比在膀胱uc中的更常见(35.6%相较于21.6%,p=0.065)。fgfr突变状态、免疫浸润、免疫疗法靶点(如pdl1)的表达与免疫疗法方法的应答之间的相互作用在很大程度上是未知的,但在fgfr抑制剂(如厄达替尼(erdafitinib))方面有潜在的协同或互补治疗选择。
7.1.2研究范围
8.本研究旨在评价具有晚期尿路上皮癌的患者中fgfr3突变以及fgfr2和fgfr3基因融合物对抗pd-1和抗pd-l1治疗结局的预测值。在fgfr表达、分子亚型和pd1/pdl1状态的背景下,进一步评价了预后相关性。
9.因此,本发明的一个目的是鉴定化疗和/或免疫肿瘤疗法后预后不良的uc患者。
10.本发明的另一个目的是鉴定可以从fgfr抑制剂中获益的那些uc患者。
11.用根据本发明的独立权利要求的方法和手段,满足了这些和其他目的。从属权利要求与具体实施方案有关。
技术实现要素:
12.本发明提供了一种对患有尿路上皮癌或膀胱癌或具有发展尿路上皮癌或膀胱癌的风险的患者的样本进行分类的方法。所述方法包括以下步骤:a)确定来自所述患者的所述样本中存在或不存在fgfr基因中的改变和/或至少一个编码选自fgfr1、fgfr2、fgfr3或fgfr4受体的基因的表达水平,和b)将步骤a)的结果得到的所述患者的样本分为至少两种分类中的一种。
13.附图简述
14.图1:比较男性和女性患者(a)以及用pd1抑制剂(纳武利尤单抗/帕博利珠单抗)治疗的患者与用pdl1抑制剂(阿替丽珠单抗,b)治疗的患者的总生存期的kaplan meier分析。在用抗pd1和抗pdl1免疫肿瘤疗法的这些患者组中,没有观察到显著的生存期差异。
15.图2:io治疗后疾病特异性生存期(dss)的kaplan meier分析,其比较原发性肿瘤组织队列中fgfr2 mrna高表达和低表达的患者。
16.图3:io治疗后疾病特异性生存期(dss)的kaplan meier分析,其比较了总队列(包括转移)中fgfr2 mrna高表达和低表达的患者。
17.图4:io治疗后原发性肿瘤组织队列中疾病特异性生存期(dss)的kaplan meier分析,其比较了按fgfr改变状态分层的(1)fgfr2 mrna高表达患者与(2)fgfr2 mrna低表达患者(2a:fgfr2 mrna低表达且没有fgfr改变,2b:fgfr2 mrna低表达且有fgfr改变)。
18.图5:io治疗后总队列(包括转移)中疾病特异性生存期(dss)的kaplan meier分析,其比较了按fgfr改变状态分层的(1)fgfr2 mrna高表达患者与(2)fgfr2 mrna低表达患者(2a:fgfr2 mrna低表达且没有fgfr改变,2b:fgfr2 mrna低表达且有fgfr改变)。
19.图6:io治疗后原发性肿瘤组织队列中疾病特异性生存期(dss)的kaplan meier分析,其比较了按fgfr3 mrna水平分层的fgfr2 mrna高表达患者与fgfr2 mrna低表达患者。
20.图7:io治疗后总队列(包括转移)中疾病特异性生存期(dss)的kaplan meier分析,其比较按fgfr3 mrna水平分层的fgfr2 mrna高表达患者(29例患者)与fgfr2mrna低表达患者。fgfr2 mrna低表达和fgfr3 mrna低表达(10例患者)。fgfr2mrna低表达和fgfr3 mrna高表达(26例患者)。
21.图8:fgfr3-tacc3重排的结构。fgfr3和tacc3基因座的基因组组成(上图)。在报告的fgfr3-tacc3变体中,基因组重排导致fgfr3基因外显子17和一小部分内含子17与tacc3基因内含子10并列(juxtaposition),导致fgfr3外显子17和tacc3外显子11的框内融合,如联合mrna(joint mrna)的sanger序列所示。这一融合结构是鉴定出的最常见的mrna融合变体之一。方框表示fgfr3-tacc3的rt-pcr筛选试验中使用的诊断性引物的位置。fgfr3-tacc3的结构总是包括fgfr3的tk结构域和tacc3的卷曲螺旋结构域。fgfr3的激酶结构域位于外显子12-18。图8还显示了将在下文讨论的引物组合。用于检测的探针未在图8示出。
22.a行显示引物组合,其可以用于检测和定量fgfr3-tacc3融合构建体的存在。
23.b行显示引物组合,其通过检测fgfr3的n端的存在和fgfr3的c端的存在或不存在(虚线)可以用于检测和定量野生型fgfr3与fgfr3-tacc3融合构建体。fgfr3的c端仅存在于fgfr3野生型中,而在融合构建体中缺失。
24.c行显示引物组合,其通过检测tacc3的c端的存在和tacc3的n端的存在或不存在(虚线)可以用于检测和定量野生型tacc3与fgfr3-tacc3融合构建体。tacc3的n端仅存在于
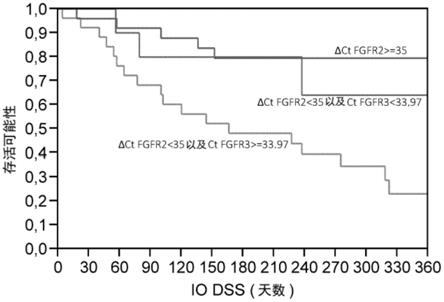
dct fgfr3外显子16)-(40-dct fgfr3外显子18)),这显示了显著较高的基因比(》ddct 2),尤其是在含fgfr3基因融合物的肿瘤中。相比之下,无fgfr3基因融合物的患者表现出较低的基因比(~ddct 0),这表明fgfr3外显子16和fgfr3外显子18的表达平衡。
35.图11:描述研究中患者队列和样本选择的流程图。
36.图12显示具有本技术所指外显子的tacc3的基因结构。
37.图13显示具有本技术所指外显子的fgfr3的基因结构。
38.图14显示fgfr3-tacc3融合蛋白的不同变体:(a)fgfr3-tacc3融合特异性rt-pcr扩增子的琼脂糖凝胶分离。(b)fgfr3-tacc3融合特异性rt-pcr产物的sanger测序色谱图。箭头表示2个基因的断开点。摘自kurobe et al(2016),其内容通过引用并入本文。
39.发明详述
40.在对本发明进行详细描述之前,应理解的是,本发明不限于所描述的器械的特定组件部分或所描述的方法的工艺步骤,因为此类器械和方法可以发生变化。还应理解的是,本文使用的术语仅用于描述特定实施方案,并不旨在限制。必须指出的是,正如本说明书和所附权利要求中所使用的,单数形式“一(a)”、“一(an)”和“一(the)”包括单数和/或复数指代,除非上下文另有明确指明。此外,可以理解的是,如果给出了由数值分隔的参数范围,则认为该范围包括这些限值。
41.应进一步理解的是,本文公开的实施方案不应理解为彼此不相关的单个实施方案。与一个实施方案讨论的特征也意味着与本文所示的其他实施方案一起得到公开。在一种情况下,如果特定的特征不与一个实施方案一起公开,但与另一实施方案一起公开,则本领域技术人员将理解这不一定意味着所述特征并不意味着与所述其他实施方案一起公开。本领域技术人员将理解,本技术的主旨也是为其他实施方案公开所述特征,但是仅仅为了清楚的目的并且将本说明书保持在可管理范围内而没有这样做。
42.此外,本文所提及的现有技术文件的内容已通过引用并入本文。这尤其适用于公开标准或常规方法的现有技术文件。在这种情况下,通过引用并入的主要目的是提供充分的授权公开,并避免冗长的重复。
43.根据本发明的第一方面,提供了一种对患有尿路上皮癌或膀胱癌或具有发展尿路上皮癌或膀胱癌的风险的患者的样本进行分类的方法,所述方法包括以下步骤:
44.a)在所述患者的所述样本中确定:
45.·
fgfr基因中是否存在改变,和/或
46.·
编码选自fgfr1、fgfr2、fgfr3或fgfr4的受体的至少一个基因的表达水平,和
47.b)将步骤a)的结果得到的所述患者的所述样本分类为至少两种分类中的一种。
48.正如其名称所示,成纤维细胞生长因子受体(fgfr)是与成纤维细胞生长因子蛋白家族成员结合的受体。成纤维细胞生长因子受体由胞外配体结构域组成,胞外配体结构域由三个免疫球蛋白样结构域、一个单跨膜螺旋结构域和一个具有酪氨酸激酶活性的胞内结构域组成。这些受体结合成纤维细胞生长因子,这是最大的生长因子配体家族的成员,包括22个成员。
49.fgfr是具有多个结构域的~800个氨基酸的受体酪氨酸激酶,其包括3个胞外免疫球蛋白样结构域(d1-d3)、跨膜结构域(tm)和2个胞内酪氨酸激酶结构域(tk1和tk2)。
50.4个成纤维细胞生长因子受体(fgfr)基因的天然交替剪接导致产生超过48种不同
的fgfr亚型。这些亚型在其配体结合特性和激酶结构域中各不相同。
51.三个免疫球蛋白(ig)样结构域在d1和d2之间呈现一段酸性氨基酸(“酸盒”)。这一“酸盒”可以参与调节fgf与fgfr的结合。免疫球蛋白样结构域d2和d3足以与fgf结合。每个受体可以被几种fgf激活。在许多情况下,fgf本身也可以激活超过一种的受体(即fgf1,结合所有7种主要fgfr)。然而,fgf7只能激活fgfr2,最近发现fgf18激活fgfr3。
52.迄今为止,已在脊椎动物中鉴定出表1所示的以下fgfr以及相应的mrna序列,以及所有这些fgfr均属于酪氨酸激酶超家族(fgfr1至fgfr4)。应该注意的是,本领域技术人员能够选择合适的引物组合(以及任选地探针),以根据本文提供的公开结合其常规知识来鉴定和定量这些基因中任何一个的表达。
53.表1:fgfr1
–
fgfr4的详细信息
[0054][0055]
通常,术语“尿路上皮癌”和“膀胱癌”的范围重叠,并有时可以互换使用。有时,术语“尿路上皮癌”可用作通用定义,而“膀胱癌”用于确定给定种类的尿路上皮癌。有时,术语“尿路上皮癌”用于指定输尿管中的癌症,而“膀胱癌”用于指定膀胱中的癌症。
[0056]
在一个实施方案中,确定其表达水平的两个基因是fgfr2和fgfr3。
[0057]
如本文使用的,术语“fgfr基因中的改变”尤其涉及其中fgfr3基因发生改变的样本,例如,通过突变或融合。在一个实施方案中,确定其改变的基因是fgfr3。
[0058]
fgfr3基因的典型改变是与tacc3的融合。
[0059]
根据本发明的一个或多个实施方案,将步骤a)结果得到的所述患者的样本分类为至少两种分类中的一种的步骤b)包括分类为以下一种:
[0060]
(i)对于用抗癌剂的治疗的预后良好,或
[0061]
(ii)对于用抗癌剂的治疗的预后不良。
[0062]
根据本发明的一个或多个实施方案,基于步骤b)中的分类,选择治疗模式,该治疗模式选自以下一种:
[0063]
(i)在对于用抗癌剂的治疗预后良好的情况下施用抗癌剂,或
[0064]
(ii)在对于用抗癌剂的治疗预后不良好的情况下施用fgfr抑制剂。
[0065]
根据本发明的一个或多个实施方案,所述表达水平由以下至少一项进行确定:
[0066]
(i)基于杂交的方法,其中使用标记的单链探针,
[0067]
(ii)基于pcr的方法,所述方法包括聚合酶链式反应(pcr),
[0068]
(iii)基于特定分子的电化学检测的方法,所述方法涵盖分子在产生可检测信号的情况下结合的电极系统,
[0069]
(iv)基于阵列的方法,其包括使用微阵列和/或生物芯片,和/或
[0070]
(v)免疫学方法,其中使用一种或多种靶特异性蛋白结合剂。
[0071]
如本文中使用的术语“基于pcr的方法”是指包括聚合酶链式反应(pcr)的方法。这是一种通过酶复制来指数扩增核酸(如dna或rna)无需使用活生物体的方法。由于pcr是体外技术,它可以在不限制dna形式的情况下进行,并且可以被广泛的修饰来进行大量的基因操作。在确定表达水平时,例如,通过(1)借助逆转录酶将完整的mrna库(所谓的转录组)逆转录为cdna,和(2)借助各自的引物检测给定的cdna的存在,基于pcr的方法可以用于检测给定mrna的存在。这一方法通常被称为逆转录酶pcr(rtpcr)。此外,例如,基于pcr的方法包括实时pcr,和特别适用于表达水平分析、动力学或定量pcr(qpcr)。
[0072]
术语“定量实时pcr”(qpcr)是指允许对样本中的模板进行定量的任何类型的pcr方法。定量实时pcr包括不同的性能或产品检测技术,例如taqman技术或lightcycler技术。例如,taqman技术使用双标记荧光探针。taqman实时pcr在pcr的指数阶段而不是像常规pcr那样在终点通过荧光团测量产物的积累。产物的指数增加用于确定阈值循环ct,即检测到荧光呈显著指数增加的pcr循环数,且其与反应中存在的dna模板拷贝数直接相关。该反应的设置与传统pcr非常相似,但在实时热循环仪中进行,其允许测量pcr管中的荧光分子。与常规pcr不同,在taqman实时pcr中,在反应中加入探针,即与dna模板内20-60个核苷酸片段互补并位于两个引物之间的单链寡核苷酸。荧光报告物或荧光团(例如,6-羧基荧光素,缩写词:fam或四氯荧光素,缩写词:tet)和猝灭剂(例如,四甲基罗丹明,缩写词:tamra,二氢环吡咯并吲哚三肽“小沟结合剂”,缩写词:mgb)分别共价连接到探针的5
′
端和3
′
端[2]。连接在探针上的荧光团与猝灭剂之间的紧密接近抑制来自荧光团的荧光。在pcr期间,随着dna合成的开始,taq聚合酶的5
′
至3
′
核酸外切酶活性降低与模板退火的探针比例(因此其名称:taq聚合酶+pacman)。探针的降解将荧光团从其中释放出来,并打破与猝灭剂的紧密接近,从而解除猝灭效应并使荧光团产生荧光。因此,在实时pcr热循环仪中检测到的荧光与释放的荧光团和pcr中存在的dna模板量成正比。
[0073]
本文的“微阵列”也是指“生物芯片”或“生物学芯片”。离散区域密度为至少约100/cm2,优选至少约1000/cm2的区域阵列。微阵列中的区域具有典型的尺寸,例如直径,其范围为约10-250μm,并与阵列中的其他区域分开约相同的距离。
[0074]
如本文使用的术语“基于杂交的方法”是指将互补的单链核酸或核苷酸类似物结合到单个双链分子中的过程的方法。核苷酸或核苷酸类似物在正常情况下会与其补体结合,因此两条完全互补的链会容易地相互结合。在生物分析中,经常标记的单链探针是为了找到互补的靶序列。如果样品中存在此类序列,探针将与所述序列杂交,然后由于标记可以被检测到。其他基于杂交的方法包括微阵列和/或生物芯片方法。因此,将探针固定在固相
上,然后将其暴露于样本。如果样本中存在互补核酸,这些核酸将与探针杂交,并从而可以被检测到。这些方法也被称为“基于阵列的方法”。然而,另一种基于杂交的方法是pcr,如上所述。当确定表达水平时,基于杂交的方法可以例如用于确定给定基因的mrna量。
[0075]
术语“基于分子的电化学检测的方法”涉及使用电极系统的方法,分子特别是生物分子,如蛋白、核酸、抗原、抗体等,在产生可检测信号的情况下与之结合。例如,在本发明申请人提交的wo0242759、wo0241992和wo02097413中公开此类方法,其内容通过引用并入本文。这些探测器包括具有平坦表面的基底(例如,由硅芯片的晶体学表面形成)和电探测器(可以采用,例如,指状组合型电极或二维电极阵列的形状)。这些电极携带探针分子,例如核酸探针,能够特异性结合靶分子,例如靶核酸分子。例如,通过巯基-金结合固定探针分子。出于这个目的,在其5
′‑
或3
′
端用巯基修饰探针,巯基与包含金表面的电极结合。例如,这些靶核酸分子可以携带酶标记,如辣根过氧化物酶(hrp)或碱性磷酸酶。靶分子与探针结合后,加入底物(例如,α-磷酸萘酯或3,3'5,5'-四甲基联苯胺,其通过所述酶转化,尤其是在氧化还原反应中)。所述反应的产物,或由于电子交换在所述反应中产生的电流,可以在电子检测器的帮助下以位点特异性方式被检测到。
[0076]
术语“免疫学方法”是指使用一种或多种靶特异性蛋白结合剂的方法。此类方法包括western blot(wb)、免疫组织化学(ihc)、免疫荧光(if)、免疫细胞化学(icc)和elisa等,均为常规方法。尤其是,适用于上述方法的此类蛋白结合剂是指与fgfr1、fgfr2、fgfr3或fgfr4中的任何一种或与其改变的变体结合的多克隆抗体或单克隆抗体。此类抗体可以由本领域技术人员用常规方法(免疫/杂交瘤)来产生,以及也可以购自常规供应商。下表仅显示示例的非限制性列表:
[0077]
类型目录号/克隆id供应商抗fgfr1抗体epr806yabcam抗fgfr2抗体pa5-14651thermofisher抗fgfr3抗体oti1b10origene抗fgfr4抗体sc-136988santacruz biotechnology
[0078]
根据本发明的一个或多个实施方案,所述fgfr基因的改变通过以下来确定:
[0079]
(i)确定改变的fgfr变体的表达水平,
[0080]
(ii)确定至少以下的表达水平
[0081]
·
并入改变的fgfr变体的fgfr外显子,和
[0082]
·
未并入改变的fgfr变体的fgfr外显子,
[0083]
和将两者进行比较,
[0084]
(iii)对各自的fgfr基因进行测序,以鉴定相应的改变,和/或
[0085]
(iv)snapshot突变分析。
[0086]
本领域技术人员熟知不同的方法,并在本文其他地方讨论。
[0087]
此类改变的fgfr变体优选是fgfr3-tacc3融合,尤其是如costa等人(2016)(其内容通过引用并入本文)或lasorella等人(2017)(其内容通过引用并入本文)或kurobe等人(2016)(其内容通过引用并入本文)所公开的。
[0088]
根据本发明的一个或多个实施方案,所述表达水平通过以下至少一个的实时聚合酶链式反应(rt-pcr或qpcr)来确定:
[0089]
·
fgfr野生型mrna和/或
[0090]
·
改变的fgfr变体的mrna。
[0091]
出于这一目的,合适的引物和任选地探针是必要的,并在本文其他地方进行公开。在此类方法中,将mrna转录本逆转录为cdna,并然后在qpcr反应中使用cdna作为模板,以检测和定量基因表达产物。
[0092]
在rt-pcr或qpcr中,在pcr期间监测靶向的dna分子的扩增,即实时地,而不是像常规pcr一样在其终点。实时pcr可以定量使用(定量实时pcr),以及半定量使用,即高于/低于一定量的dna分子(半定量实时pcr)。
[0093]
实时pcr中检测pcr产物的两种常用方法是:(1)嵌入任何双链dna的非特异性荧光染料,和(2)由标记荧光报告物的寡核苷酸组成的序列特异性dna探针,其允许仅在探针与其互补序列杂交后进行检测。
[0094]
给定基因表达水平的一个量度是ct(“循环阈值”)。ct定义为荧光信号超过阈值(即超过背景水平)所需的循环数。ct水平与样本中靶mrna的量成反比,即ct水平越低,样本中靶mrna的量越大,即各自基因的表达水平越高。
[0095]
根据本发明的一个或多个实施方案,方法的特征在于:步骤a)中确定的一个或多个表达水平在步骤b)之前用一个或多个参考基因的一个或多个表达水平进行归一化,以获得一个或多个归一化的表达水平。
[0096]
kozera和rapacz(2013)讨论了pcr中的参考基因,其内容通过引用并入本文。
[0097]
为了归一化给定基因的表达水平,优选与参考基因进行比较。在一个实施方案中,通过以下公式计算fgfr(在下文中称为靶基因),优选fgfr2和fgfr3的归一化的基因表达:
[0098]
40
–
((ct靶基因)
–
(ct管家))
[0099]
本文也称为“δct”。
[0100]
根据本发明的一个或多个实施方案,方法的特征在于所述一个或多个参考基因是至少一个管家基因。
[0101]
本文使用的术语“管家基因”是指参考基因的更专门的形式。它是指一组编码蛋白的基因,其活性对维持细胞功能至关重要。这些基因通常在所有细胞类型中都类似地进行表达。管家基因包括但不限于甘油醛-3-磷酸脱氢酶(gapdh)、cypl、白蛋白、肌动蛋白(例如β-肌动蛋白)、微管蛋白、亲环蛋白、次黄嘌呤磷酸核糖转移酶(hypoxantine phsophoribosyltransferase,hrpt)、l32、28s和18s。
[0102]
根据本发明的一个或多个实施方案,选自calm2、b2m和/或rpl37a的至少一个管家基因,如下表2所示。应该注意的是,本领域技术人员能够选择合适的引物组合(以及任选地探针),以根据本文提供的公开结合其常规知识来鉴定和定量这些基因中任何一个的表达。
[0103]
表2:管家基因的详细信息
[0104][0105]
根据本发明的一个或多个实施方案,确定选自krt5、erbb2、krt20、pd1、pd-l1和/或tacc3的至少一个以上基因的表达水平并任选地归一化。这些基因见下表3。
[0106]
应该注意的是,本领域技术人员能够选择合适的引物组合(以及任选地探针),以根据本文提供的公开结合其常规知识来鉴定和定量这些基因中任何一个的表达。
[0107]
表3:可确定的其他基因的详细信息
[0108][0109]
注意的是,表中给出的ncbi参考编号仅为示例。各自mrna的其他亚型或变体可以是存在的,并容易被本领域技术人员在各自数据库中找到。
[0110]
应该注意的是,本领域技术人员能够选择合适的引物组合(以及任选地探针),以根据本文提供的公开结合其常规知识来鉴定和定量这些基因中任何一个的表达。
[0111]
根据本发明的一个或多个实施方案,方法的特征在于尿路上皮癌或膀胱癌是t2、t3或t4期癌症。
[0112]
尿路上皮癌或膀胱癌分为以下四个阶段:
[0113]
t1:肿瘤已扩散到结缔组织(称为固有层),将膀胱内壁与下方肌肉分开,但不累及膀胱壁肌肉。
[0114]
t2:肿瘤已扩散至膀胱壁肌肉。
[0115]
t3:肿瘤已生长到膀胱周组织(包围膀胱的脂肪组织)。
[0116]
t4:肿瘤已扩散到以下任何部位:腹壁、盆壁、男性的前列腺或精囊(携带精液的管道)或女性的子宫或阴道。
[0117]
根据本发明的一个或多个实施方案,步骤b)中的分类依赖于fgfr2和/或fgfr3的表达水平。
[0118]
优选地,步骤b)中的分类分别依赖于fgfr2和fgfr3表达水平之间的比值或其归一化的表达水平。因此,此类方法致力于确定存在基因间失衡。
[0119]
14.根据前述任何一项权利要求所述的方法,其中步骤b)中的分类依赖于是否存在fgfr基因中的改变,优选fgfr3基因中的改变。
[0120]
例如,fgfr基因(优选fgfr3基因)中的此类改变是fgfr3与tacc3之间的融合,将在本文中进行讨论。此类改变导致基因内失衡。此类突变可以导致fgfr3激酶结构域的过度活性,并因此可以具有与fgfr3相对过表达相似的作用。
[0121]
如本文使用的,术语“上调”涉及给定样本中基因表达(即转录的mrna或翻译的蛋白的量)较高的情况。在一个实施方案中,其比健康患者或正常患者的比较样本中的表达高至少1.3倍。
[0122]
如本文使用的,术语“过表达”涉及给定样本中基因表达(即转录的mrna或翻译的蛋白的量)较高的情况。在一个实施方案中,其比健康患者或正常患者的比较样本中的表达高至少1.3倍。
[0123]
在一个实施方案中,如果其δct值≥35,则认为fgfr2是上调或过表达的。
[0124]
在一个实施方案中,如果其δct值≥33.97,则认为fgfr3是上调或过表达的。
[0125]
如本文使用的,术语“下调”涉及给定样本中基因表达(即转录的mrna或翻译的蛋白的量)较低的情况。在一个实施方案中,其比健康患者或正常患者的比较样本中的表达低至少1.3倍。
[0126]
如本文使用的,术语“低表达”涉及给定样本中基因表达(即转录的mrna或翻译的蛋白的量)较低的情况。在一个实施方案中,其比健康患者或正常患者的比较样本中的表达低至少1.3倍。
[0127]
在一个实施方案中,如果其δct值《35,则认为fgfr2是下调或低表达的。在一个实施方案中,如果其δct值《33.97,则认为fgfr3是下调或低表达的。
[0128]
如本文使用的,术语“fgfr基因中的改变”尤其涉及其中fgfr3基因发生改变(例如,通过突变或融合)的样本。例如,此类突变可以存在于fgfr3基因的外显子7、10和15中。最常观察到的突变之一是外显子7中的s249c(tomlinson et al.,2007)。另一种常见的fgfr3的改变是fgfr3-tacc3融合,如costa et al.(2016)所述,其内容通过引用并入本文,或lasorella et al.(2017)所述,其内容通过引用并入本文。
[0129]
如图所示,通常情况下,以下fgfr状态已确定为对(i)抗癌剂,如免疫肿瘤药物,或(ii)fgfr抑制剂治疗提供合适的预后价值。表4给出一些示例:
[0130]
表4:根据本发明的不同预后结果
[0131][0132][0133]
因此,如果fgfr2上调或过表达,则各自患者对于用抗癌剂的治疗预后良好。因此,应选择的治疗模式是抗癌剂,如免疫肿瘤药物。
[0134]
如果fgfr3上调或过表达,应选择的治疗模式是fgfr抑制剂。同样,如果fgfr2下调或低表达,并且fgfr3发生改变,则应选择的治疗模式为fgfr抑制剂。
[0135]
如果fgfr2和fgfr3下调或低表达,则各自患者对于用抗癌剂的治疗预后良好。因此,应选择的治疗模式是抗癌剂,如免疫肿瘤药物。
[0136]
特别是,如果fgfr3下调或低表达,这可以导致免疫浸润增加,这反过来表明用免疫肿瘤药物(如免疫检查点抑制剂(见下文))治疗可以成功。
[0137]
根据本发明的一个或多个实施方案,用二氧化硅包被的磁性颗粒和离液盐处理样本,以用于在步骤a)中确定之前纯化所述样本中所含的核酸。
[0138]
根据本发明的一个或多个实施方案,抗癌剂包括至少一种化疗剂。
[0139]
根据本发明的一个或多个实施方案,抗癌剂包括免疫检查点抑制剂。
[0140]
检查点抑制剂是一种靶向免疫检查点(即刺激或抑制其作用的免疫系统的关键调节因子)的癌症免疫疗法药物形式。肿瘤可以利用这些检查点来保护自己免受免疫系统的攻击。检查点疗法可以阻断抑制性检查点,恢复免疫系统功能。
[0141]
根据本发明的一个或多个实施方案,免疫检查点抑制剂是选自以下的至少一种:
[0142]
·
pd-1抑制剂
[0143]
·
pd-l1抑制剂
[0144]
·
ctla-4抑制剂
[0145]
·
lag 3抑制剂
[0146]
·
tim3抑制剂,和/或
[0147]
·
ox40抑制剂
[0148]
根据本发明的一个或多个实施方案,免疫检查点抑制剂是选自以下的至少一种:
[0149]
·
抗体,
[0150]
·
修饰的抗体形式,
[0151]
·
保留靶结合特性的抗体衍生物或片段
[0152]
·
基于抗体的结合蛋白,
[0153]
·
寡肽结合剂和/或
[0154]
·
抗体模拟物。
[0155]“抗体”,也称为“免疫球蛋白”(ig),通常包括4条多肽链,2条重链(h)和2条轻链(l),并因此是多聚蛋白,或其等效的ig同系物(例如,骆驼纳米抗体,其仅包括重链、可以来源于重链或轻链的单结构域抗体(dab));包括全长功能性突变、变体或其衍生物(包括但不限于鼠的、嵌合的、人源化的和全人的抗体,其保留ig分子的基本表位结合特征,且包括双重特异性、双特异性、多特异性和双可变结构域免疫球蛋白;免疫球蛋白分子可以是任何类别(例如igg、ige、igm、igd、iga和igy)或亚类(例如igg1、igg2、igg3、igg4、iga1和iga2)和同种异型。
[0156]
如本文使用的“基于抗体的结合蛋白”可以代表在其他非免疫球蛋白或非抗体衍生组分背景下含有至少一个抗体衍生的vh、v
l
或ch免疫球蛋白结构域的任何蛋白。此类基于抗体的蛋白包括但不限于(i)结合蛋白的fc融合蛋白,包括具有免疫球蛋白ch结构域全部或部分的受体或受体组分,(ii)结合蛋白,其中vh和/或v
l
结构域与替代分子支架偶联,或(iii)分子,其中免疫球蛋白vh和/或v
l
和/或ch结构域以通常不在天然存在的抗体或抗体片
段中发现的方式组合和/或组装。
[0157]
本文使用的“抗体衍生物或片段”涉及包括至少一条多肽链的分子,该多肽链衍生于非全长抗体,包括但不限于(i)fab片段,其为单价片段,由可变轻链(v
l
)、可变重链(vh)、恒定轻链(c
l
)和恒定重链1(ch1)结构域组成;(ii)f(ab')2片段,其为二价片段,包括铰链区二硫键连接的两个fab片段;(iii)f
ab
(fd)片段的重链部分,其由vh和ch1结构域组成;(iv)可变片段(fv)片段,其由抗体单臂的v
l
和vh结构域组成;(v)结构域抗体(dab)片段,其包括单个可变结构域;(vi)分离的互补决定区(cdr);(vii)单链fv片段(scfv);(viii)双体,其是二价、双特异性抗体,其中vh和v
l
结构域在单一多肽链上表达,但使用的连接子太短无法在同一链上的两个结构域之间配对,从而迫使结构域与另一条链的互补结构域配对,并产生两个抗原结合位点;和(ix)线性抗体,其包括一对串联fv片段(v
h-ch1-v
h-ch1),其与互补轻链多肽一起形成一对抗原结合区域;和(x)免疫球蛋白重链和/或轻链的其他非全长部分,或其突变体、变体或衍生物,单独或任何组合。在任何情况下,所述衍生物或片段均保留靶结合特性。
[0158]
如本文使用的,术语“修饰的抗体形式”涵盖抗体药物偶联物、聚亚烃氧化物修饰的scfv、单体、双体、骆驼抗体、结构域抗体、双特异性或三特异性抗体、iga或通过j链和分泌性组分连接的两种igg结构、鲨鱼抗体、新世界灵长类动物框架+非新世界灵长类动物cdr、去除铰链区的igg4抗体、在ch3结构域中工程化另外两个结合位点的igg、fc区改变以增强fcγ受体亲和力的抗体、包括ch3+vl+vh的二聚化构建体等。
[0159]
如本文使用的,术语“抗体模拟物”是指不属于免疫球蛋白家族的蛋白,甚至是非蛋白,如适配子或合成聚合物。一些类型具有抗体样β折叠结构。“抗体模拟物”或“替代支架”相对于抗体的潜在优点是溶解度更好、组织渗透性更高、对热和酶的稳定性更高以及生产成本相对较低。
[0160]
一些抗体模拟物可以在大文库中提供,其提供针对每个可设想靶的特异性结合候选物。就像抗体一样,通过使用高通量筛选(hts)技术以及成熟的展示技术,可以开发靶向特异性抗体模拟物,就像噬菌体展示、细菌展示、酵母或哺乳动物展示一样。目前开发的抗体模拟物涵盖,例如,锚蛋白重复蛋白(称为darpin)、c型凝集素、金黄色葡萄球菌的a结构域蛋白、转铁蛋白、脂钙蛋白、纤连蛋白的第10个iii型结构域、kunitz结构域蛋白酶抑制剂、泛素衍生的结合物(称为affilin)、γ晶体蛋白衍生的结合物、半胱氨酸结或打结素、基于硫氧还蛋白a支架的结合物、sh-3结构域、斯塔都体(stradobody)、通过二硫键和ca2+稳定的膜受体的“a结构域”、基于ctla4的化合物、fyn sh3和适配子(与特定靶分子结合的肽分子)。
[0161]
根据本发明的一个或多个实施方案,免疫检查点抑制剂是选自表5所示的至少一种。
[0162]
表5:免疫检查点抑制剂
[0163]
[0164][0165]
dart,双亲和重新靶向;mab,单克隆抗体;na,不适用。
[0166]
fgfr抑制剂干扰fgfr信号传导,并因此提供了影响肿瘤存活的不同模式。它们允许在人癌细胞中增加肿瘤对紫杉醇、依托泊苷等常规抗癌药物的敏感性,并从而增强抗凋亡潜力。此外,在乳腺癌常用vegfr-2治疗后,基于fgf2上调的自分泌fgf信号传导,fgf信号传导抑制显著减少血运重建(作用于癌症、血管生成的标志之一),并降低人类肿瘤中的肿瘤负荷。通过此类方法,fgfr抑制剂可以与疗法协同作用,通过消除未来复发的潜在途径来切断癌症克隆的复发。
[0167]
此外,由于靶向egfr或vegfr的疗法后fgfr激活的次要亚群的克隆演化,fgfr抑制剂可以对复发性肿瘤有效。由于fgfr抑制剂克服人类癌症中的耐药性有多种作用机制,fgfr靶向疗法是难治性癌症治疗的一种有前景的策略。
[0168]
根据本发明的一个或多个实施方案,fgfr抑制剂是fgfr酪氨酸激酶抑制剂。酪氨酸激酶抑制剂(tki)是一种抑制酪氨酸激酶的药物。酪氨酸激酶是负责通过信号转导级联激活许多蛋白的酶。通常,它们形成跨膜受体的细胞内部分,并在与细胞外配体结合时被激活。酪氨酸激酶通过向蛋白添加磷酸基团(磷酸化)激活蛋白,这是tki抑制的步骤。tki通常用作抗癌药物。例如,它们显著改善慢性粒细胞白血病的结局。
[0169]
根据本发明的一个或多个实施方案,fgfr抑制剂是选自如下表6所示的至少一种:
[0170]
表6:fgfr抑制剂
[0171][0172]
泛fgfr=fgfr1、fgfr2、fgfr3和fgfr4
[0173]
根据本发明的另一个方面,提供了一种寡核苷酸,其包括至少一个能够与以下杂交的核苷酸序列:
[0174]
a)编码fgfr1、fgfr2、fgfr3或fgfr4中任何一个的核酸分子或改变的fgfr基因,或
[0175]
b)编码fgfr1、fgfr2、fgfr3或fgfr4中任何一个或其同种型或改变的fgfr的mrna,
[0176]
其中寡核苷酸选自以下:
[0177]-扩增引物(正向和/或反向)
[0178]-标记的探针,和/或
[0179]-底物结合的探针。
[0180]
根据本发明的一个或多个实施方案,提供所述寡核苷酸,用于制备用于根据上述说明书所述的方法的试剂盒。
[0181]
优选地,提供一组(i)正向扩增引物,(ii)反向扩增引物和(iii)探针(标记的和/或底物结合的)。
[0182]
除此之外,任选地,提供包括至少一个核苷酸序列的寡核苷酸,其能够与以下杂交:
[0183]
a)编码参考基因或管家基因的核酸分子,或
[0184]
b)编码参考蛋白或管家蛋白的mrna,
[0185]
其中寡核苷酸选自以下:
[0186]-扩增引物(正向和/或反向)
[0187]-标记的探针,和/或
[0188]-底物结合探针。
[0189]
优选地,提供一组(i)正向扩增引物,(ii)反向扩增引物和(iii)探针(标记的和/或底物结合的)以用于该目的。优选地,参考基因或管家基因选自calm2、b2m和/或rpl37a。
[0190]
注意的是,一些合适的引物(正向和/或反向)和探针显示在本文的序列表中。
[0191]
根据本发明的一个或多个实施方案,包括上述说明书中所述的至少一种寡核苷酸的试剂盒。
[0192]
根据本发明的一个或多个实施方案,试剂盒包括至少一组反向引物、正向引物加上任选地探针,如上所述。
[0193]
根据本发明的一个或多个实施方案,试剂盒包括:
[0194]
a)能够与编码fgfr2的核酸分子杂交的正向/反向引物组,加上任选地合适探针,以及
[0195]
b)能够与编码fgfr3的核酸分子杂交的正向/反向引物组,加上任选地合适探针。
[0196]
此类引物和任选地探针的示例见序列表,seq id no 25-57(fgfr2)和seq id no58-75(fgfr3)。
[0197]
基于本发明的启示和本文公开的序列信息,以及在显示fgfr2和fgfr3基因组和mrna序列的公共数据库中,本领域技术人员可以找到同样合适的替代引物和探针,而无需任何创造性的活动。因此,此类替代物也应涵盖在本技术范围内。
[0198]
根据本发明的一个或多个实施方案,试剂盒还包括能够检测fgfr3-tacc3融合蛋白存在的引物组。
[0199]
根据本发明的一个或多个实施方案,试剂盒包括:
[0200]
a)能够与编码fgfr2的核酸分子杂交的正向/反向引物组,和
[0201]
b)能够检测fgfr3-tacc3融合蛋白存在的引物组。
[0202]
根据本发明的一个或多个实施方案,能够检测fgfr3-tacc3融合蛋白存在的引物组包括:
[0203]
a)能够与位于fgfr3和tacc3之间融合位点的n端的fgfr3外显子中的核酸分子杂交的正向引物,和能够与位于fgfr3和tacc3之间融合位点的c端的tacc3外显子中的核酸分子杂交的反向引物,
[0204]
b)能够与编码fgfr3 n端区域的核酸分子杂交的正向引物和能够与编码fgfr3n端区域的核酸分子杂交的反向引物,加上能够与编码fgfr3 c端区域的核酸分子杂交的正向引物和能够与编码fgfr3 c端区域的核酸分子杂交的反向引物,
[0205]
c)能够与编码tacc3的c端区域的核酸分子杂交的正向引物和能够与编码tacc3的n端区域的核酸分子杂交的反向引物,加上能够与编码tacc3的n端区域的核酸分子杂交的正向引物和能够与编码tacc3的n端区域的核酸分子杂交的反向引物,和/或
[0206]
d)能够与位于fgfr3和tacc3之间融合位点的n端的fgfr3外显子中的核酸分子杂交的正向引物,和能够与位于fgfr3和tacc3之间融合位点的c端的fgfr3外显子中的核酸分
子杂交的反向引物。
[0207]
选项a)用于测量所定义的fgfr3-tacc3融合蛋白的表达。
[0208]
选项b)用于测量fgfr3 n端和c端表达之间的δ。当fgfr3-tacc3融合物存在时,fgfr3 c端的表达应小于fgfr3 n端的表达。通过这一实施方案,可以测量不同的fgfr3-tacc3融合蛋白变体。
[0209]
选项c)用于测量tacc3 n端和c端表达之间的δ。当fgfr3-tacc3融合物存在时,tacc3 c端的表达高于tacc3 n端的表达。通过这一实施方案,可以测量不同的fgfr3-tacc3融合蛋白变体。
[0210]
选项d)用于测量位于fgfr3和tacc3之间融合位点的n端的fgfr3外显子和位于fgfr3和tacc3之间融合位点的c端的fgfr3外显子的表达之间的δ。当fgfr3-tacc3融合物存在时,位于n端的fgfr3外显子的表达应高于位于c端的fgfr3外显子的表达。
[0211]
选项a)至d)对应于图8a-d所示的实施方案。
[0212]
tacc3和fgfr3的外显子结构如图12和13所示。tacc3基因由跨越23.6kb的16个经过验证的外显子组成。fgfr3基因由跨越16.5kb的19个外显子组成,其中外显子1在人类中是未知的。基于这一信息,本领域技术人员能够在阅读本发明的启示时设计引物和任选地探针。
[0213]
在选项a)的一个实施方案中,正向引物能够与fgfr3外显子1-18中的核酸分子杂交,以及反向引物能够与tacc3外显子11-16中的核酸分子杂交。
[0214]
选项a)的此类引物和任选地探针示例示于序列表,seq id no 149和150。
[0215]
选项b)的此类引物和任选地探针示例示于序列表,seq id no 153、154、157和158。
[0216]
选项c)的此类引物和任选地探针示例示于序列表,seq id no 155、156、159和160。
[0217]
在选项d)的一个实施方案中,正向引物能够与fgfr3外显子1-17中的核酸分子杂交和反向引物能够与fgfr3外显子18或更高中的核酸分子杂交。
[0218]
选项d)的此类引物和任选地探针示例示于序列表,seq id no 161-166。
[0219]
如在其他地方所讨论的,文献中描述fgfr3-tacc3融合蛋白。在一种情况下,如图8所示,融合包括n-》c方向的fgfr3外显子1-17和tacc3外显子11-16。如上所示的引物试剂盒作为选项a)和d)的优选实施方案,已被设计为此类融合结构的基础之一。但是,在融合结构不同的情况下,可以或必须对引物和任选地探针进行修饰。
[0220]
基于本发明的启示,和本文公开的序列信息,和在显示fgfr3和tacc3的基因组和mrna序列的公共数据库中,以及替代fgfr3-tacc3融合蛋白结构的公共可用性(参见本文图8和14,以及kurobe et al(2016),其内容通过引用并入本文),本领域技术人员可以找到同样合适的替代引物和探针,而无需任何创造性的活动。因此,此类替代方法也应涵盖在本技术范围内。
[0221]
根据本发明的一个或多个实施方案,本发明的试剂盒包括引物/探针组,其包括:
[0222]
a)正向引物和反向引物,和任选地探针,正如表1所示,和正向引物和反向引物,和任选地探针,正如表2所示,
[0223]
b)a)的引物和任选地探针,和至少正向引物和反向引物,和任选地探针,正如表3
所示,
[0224]
c)正向引物和反向引物,和任选地探针,正如表1所示,和至少正向引物和反向引物,和任选地探针,正如表3所示。
[0225]
任选地,试剂盒还包括一组反向引物、正向引物加上任选地探针,用于检测参考基因或管家基因,如上所述。优选地,所述基因选自calm2、b2m和/或rpl37a。
[0226]
如本文使用的,术语“改变的fgfr基因”例如涉及发生改变(例如,通过突变或融合)的fgfr3基因。例如,此类突变可以存在于fgfr3基因的外显子7、10和15中。最常观察到的突变之一是外显子7中的s249c(tomlinson et al.,2007)。另一种常见的fgfr3的改变是fgfr3-tacc3融合,如costa et al.(2016)所述,其内容通过引用并入本文。
[0227]
如本文使用的,术语“改变的fgfr”涉及依赖于此类改变fgfr基因的基因产物,即蛋白或mrnna。
[0228]
根据本发明的一个或多个实施方案,试剂盒包括标记的探针,其用一个或多个荧光分子、发光分子、放射性分子、酶分子和/或猝灭分子标记。
[0229]
在本发明背景下使用的一种典型探针类型是所谓的taqman探针。taqman探针由共价连接在寡核苷酸探针5’端的荧光团和3’端的猝灭剂组成。有几种不同的荧光团(例如6-羧基荧光素,缩写词:fam,或四氯荧光素,缩写词:tet)和猝灭剂(例如四甲基罗丹明,缩写词:tamra)是可用的。当由循环仪的光源通过共振能量转移(fret)激发时,猝灭剂分子猝灭荧光团发出的荧光。只要荧光团和猝灭剂在附近,猝灭就会抑制任何荧光信号。taqman探针的设计使其在特定引物组扩增的dna区域内退火。(与示意图不同,探针与单链dna结合。)taqman探针可以与小沟结合剂(mgb)部分,二氢环吡咯并吲哚三肽(dpi3)缀合,以增加其与靶序列的结合亲和力;由于范德华力的稳定性增加,mgb缀合的探针具有更高的熔解温度(tm)。当taq聚合酶延伸引物并合成新生链时(再次,在单链模板上,但方向与示意图中所示相反,即从互补链的3'至5'),taq聚合酶的5'至3'核酸外切酶活性降解退火至模板的探针。探针的降解将荧光团从其中释放出来,并打破与猝灭剂的紧密接近,从而解除猝灭效应并使荧光团产生荧光。因此,在定量pcr热循环仪中检测到的荧光与释放的荧光团和pcr中存在的dna模板量成正比。
[0230]
根据本发明的一个或多个实施方案,提供根据上述说明书的寡核苷酸或试剂盒在将患有尿路上皮癌或膀胱癌或具有发展尿路上皮癌或膀胱癌的风险的患者的样本分类为至少两种分类之一的方法中的用途。
实施例
[0231]
虽然在附图和前面的说明书中对本发明进行详细的说明和描述,但是此类说明和描述应当被认为是说明性或示范性的,并且不具有限制性;本发明不限于所公开的实施方案。根据对附图、所公开内容和随附权利要求的研究,实施所要求发明的本领域技术人员可以理解和实现所公开实施方案的其他变体。在权利要求书中,词语“包括”并不排除其他要素或步骤,且非限定性冠词“一(a)”或“一(an)”并不排除复数。仅仅是某些量度在相互不同的从属权利要求中被引用的事实并不表明这些量度的组合不能被用来取得优点。本权利要求中的任何参考符号不应解释为限制范围。
[0232]
本文公开的所有氨基酸序列均显示为从n端至c端;本文公开的所有核酸序列均显
示为5'-》3'。
[0233]
材料和方法
[0234]
分析的患者的临床状态和生存数据
[0235]
在本研究中,72例福尔马林固定、石蜡包埋(ffpe)的晚期尿路上皮癌样本获自5家病理机构(采集日期为2016年至2018年)。所有标本根据2010年tnm分类按病理分期重新评价,并按常见分级系统(who 1974,ah,me)分级。72例患者(男性52例[72%];女性20例[28%])用免疫疗法治疗,49例(69%)患者接受pd1抑制剂(纳武利尤单抗、帕博利珠单抗),以及22例(31%)接受pdl1抑制剂(阿替丽珠单抗)。免疫疗法开始后的中位随访时间为7.1个月(范围:1-25个月)。50例患者(69%)的肿瘤起源于膀胱,以及22例患者(31%)的肿瘤位于上尿路(输尿管和/或肾盂)。组织病理学中的tnm分期(膀胱切除术、肾输尿管切除术、初诊)显示52例患者(73%)为t3或t4期肿瘤。关于全身化疗,4例患者(6%)接受新辅助化疗,以及67例患者(94%)未接受新辅助化疗。在辅助治疗中,20例(28%)接受辅助化疗,以及52例患者(72%)未接受辅助化疗。组织病理学数据和手术总结见下表6。
[0236]
表6:患者队列的组织学数据、肿瘤位置和手术
[0237]
[0238][0239]
kaplan meier分析中,男性和女性患者的总生存期相当(图2a)。用pd1抑制剂(纳武利尤单抗/帕博利珠单抗)治疗的患者与用pdl1抑制剂(阿替丽珠单抗)治疗的患者相比也是如此。同样,在用io疗法治疗的这些患者组中未观察到显著的生存差异。在kaplan meier分析中,io疗法下晚期膀胱肿瘤和晚期上尿路肿瘤患者的总生存期相当(数据未显示)。具有远处转移的患者(n=19)的总生存期(12个月后生存概率25.3%)显著短于无远处转移的患者(n=40;12个月后生存概率59.2%,p=0.0048,(数据未显示))。
[0240]
用于snapshot测序的dna分离
[0241]
使用自动化程序(promega maxwell,promega,wisconsin,usa),从福尔马林固定石蜡包埋组织(ffpe)中分离dna。一般而言,每例患者肿瘤使用5个10μm ffpe切片,其中肿瘤含量至少为50%。简言之,切片用二甲苯脱蜡,用无rnase乙醇(100%,96%,70%)再水化。将分馏的肿瘤组织混悬于300μl孵育缓冲液(promega)中,在80℃的恒温振荡器(350rpm)上预孵育10分钟,并用蛋白酶k(promega)在56℃下处理过夜(550rpm)。然后使用promega dna纯化试剂盒(promega,wisconsin,usa)从裂解物中分离dna。
meier回归进行生存分析,并使用对数秩检验显著性。如果检验显示显著性水平低于0.05,则认为结果具有显著性。通过非参数检验(wilcoxon秩和检验、kruskal-wallis检验)对数值连续变量进行统计分析。采用spearman等级相关进行连续变量的相关性分析。所有统计分析均通过graphpad prism 7.2(graphpad software inc.,la jolla,california,usa)以及jmp sas 13.2(sas,cary,north carolina,usa)进行。
[0252]
患者队列
[0253]
鉴定在多个中心(n=5)用临床常规抗pd-1/抗pd-l1免疫肿瘤药物作为一线、二线和三线治疗的一部分治疗患者,并产生各自的原发性和转移性肿瘤组织选择的样本选择。
[0254]
引物/探针组
[0255]
下文显示了具有用于执行本发明的可选探针的pcr引物组。应该注意的是,本领域技术人员能够在未指定的情况下选择合适的探针。
[0256]
表7:具有针对的fgfr2可选探针的引物组的seq id no
[0257]
正向探针反向252627282930313233343536373839404142434445464748495051525354555657
[0258]
表8:具有针对fgfr3的可选探针的引物组的seq id no
[0259][0260][0261]
表9:具有针对fgfr3-tacc3的可选探针的引物组的seq id no
[0262][0263]
参考文献
[0264]
kozera and rapacz,reference genes in real-time pcr,j appl genet.2013;54(4):391
–
406
[0265]
tomlinson dc et al,knockdown by shrna identifies s249c mutant fgfr3 as a potential therapeutic target in bladder cancer.oncogene.2007aug 30;26(40):5889
–
5899
[0266]
costa r et al,fgfr3-tacc3 fusion in solid tumors:mini review.oncotarget.2016 aug 23;7(34):55924-55938
[0267]
lasorella aet al.,fgfr-tacc gene fusions in human glioma.neuro oncol.2017 apr;19(4):475
–
483
[0268]
van oers jm,et al,fgfr3 mutations and a normal ck20 staining pattern define low-grade noninvasive urothelial bladder tumours.eur urol.2007 sep;52(3):760-8.
[0269]
van rhijn bw,et al:novel fibroblast growth factor receptor 3(fgfr3)mutations in bladder cancer previously identified in non-lethal skeletal disorders.eur j hum genet.2002 dec;10(12):819-24.
[0270]
kurobe m et al.(2016)development of rna-fish assay for detection of oncogenic fgfr3-tacc3 fusion genes in ffpe samples.plos one 11(12):e0165109.doi:10.1371/journal.pone.0165109
[0271]
序列
[0272]
以下序列构成本技术公开的一部分。该申请还提供了wipo st 25兼容的电子序列表。为避免疑义,如果下表中的序列与电子序列表中的序列之间存在差异,则认为本表中的序列正确。
[0273]
[0274]
[0275]
[0276]
[0277]
[0278]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1