一种单胺氧化酶酶活力检测试剂盒及其使用方法与流程
1.本发明属于生物技术领域,特别涉及一种单胺氧化酶酶活力检测试剂盒及其使用方法。
背景技术:
2.单胺氧化酶(mao,ec1.4.3.4)是存在于细胞线粒体外膜上的,含有硫氢基的一种黄素蛋白。其在体内的主要功能是催化内源性和外源性单胺类物质的代谢。在mao的作用下,单胺类物质被氧化而产生脱氨基作用。mao广泛分布于中枢神经和神经末梢组织中,主要位于大脑、肝脏和肠粘膜等组织细胞线粒体的外膜上。mao被认为是一种老化标志酶,随着年龄的增加,人体内的mao活力上升,而异常的mao的活性与神经病学上的紊乱有关,如mao
‑
b与帕金森综合征和阿尔茨海默症的发生密切相关,而mao
‑
a与精神疾病如抑郁症的发生密切相关。
3.目前市面上有售的单胺氧化酶酶活力检测试剂盒多采用犬脲胺法,但其存在以下缺点:样本提取过程中容易出现样本提取不完全、人为误差较大、检测时间很长,试剂存放条件严格、试剂用量大且试剂成本高等。另外,还有试剂盒采用醛苯腙比色法,其检测原理是:待测样品在mao作用下,氧化底物苄胺生成苄醛,后者经催化反应生成醛苯腙(呈棕红色),通过分光光度计检测470nm处吸光度,再根据标准曲线即可检测出mao活力。该检测方法操作较为复杂,且苄醛需要苯肼催化才能生成醛苯腙,而苯肼本身有毒。
技术实现要素:
4.针对现有技术中的问题,本发明提供了一种单胺氧化酶酶活力检测试剂盒及其使用方法,该检测试剂盒使用过程中,不需要将苄醛催化生成醛苯腙,可以直接进行检测,不仅简化检测流程、缩短检测时间,且灵敏度高、安全性更高。
5.为了实现上述目的,本发明采用以下技术方案:
6.一种单胺氧化酶酶活力检测试剂盒,所述试剂盒包括提取液、基质缓冲液和显色底物,所述显色底物为4
‑
对二甲氨基苄胺盐酸盐,所述基质缓冲液为pipes(哌嗪
‑
n,n
‑
二(2
‑
乙磺酸))缓冲液。
7.进一步地,在上述技术方案中,所述提取液包括样本提取液和酶提取液,所述样本提取液和酶提取液均为蔗糖水溶液;更进一步地,所述样本提取液中蔗糖含量为5~20mmol/l,所述酶提取液中蔗糖含量为300~500mmol/l。
8.进一步地,在上述技术方案中,所述pipes缓冲液中pipes含量为30~50mmol/l,且所述pipes缓冲液的ph为6.1~7.5。
9.进一步地,在上述技术方案中,所述显色底物溶于所述pipes缓冲液中形成显色溶液,所述显色溶液中显色底物的含量为4~10mmol/l。
10.本发明还提供了上述单胺氧化酶酶活力检测试剂盒的使用方法,具体包括以下步骤:
11.s1、用提取液提取血清、血浆、组织或细胞样品,得待测样本;
12.s2、将待测样本与基质缓冲液、显色底物混合均匀,用酶标仪于355nm测初始od值,记为a1;
13.s3、在固定温度下孵育时间tmin,用酶标仪于355nm测此时od值,记为a2;
14.若待测样本来自于血清或血浆样品时,采用式(1)计算:
[0015][0016]
若待测样本来自于细胞或组织样品时,采用式(2)计算:
[0017][0018]
其中,v1为反应体系的总体积,v2为待测样本的体积,ε:对二甲氨基苯甲醛的摩尔消光系数,d为光径(即酶标孔反应液高度),c
pr
为待测样本的蛋白浓度;式(1)中u的定义为:每升血清或血浆样本每分钟催化显色底物产生1nmol对二甲氨基苯甲醛所需要的酶量为一个活力单位;式(2)中u的定义为:每克蛋白每分钟催化显色底物产生1nmol对二甲氨基苯甲醛所需要的酶量为一个活力单位。
[0019]
进一步地,在上述技术方案中,步骤s1所述待测样本的制备过程具体为:
[0020]
当样本为动物组织样本时,过程具体为:取0.1
‑
0.5g样本,并按0.1g:0.5
‑
0.9ml的比例加入样本提取液进行匀浆,4℃下800
‑
1000
×
g离心8
‑
10min,弃沉淀;上清液再于4℃下9000
‑
10000
×
g离心20
‑
30min,弃上清;再加入0.9
‑
1ml酶提取液,混匀,4℃下15000
‑
18000
×
g离心35
‑
40min,弃上清;最后加入0.9
‑
1ml基质缓冲液工作液,混匀后即为待测样本;
[0021]
当样本为细胞样本时,过程具体为:在细胞中加入样本提取液,研磨或超声使细胞破碎细胞,将细胞破碎液于4℃下9000
‑
10000
×
g离心20
‑
30min,弃上清;再加入0.9
‑
1ml酶提取液,混匀,4℃下15000
‑
18000
×
g离心35
‑
40min,弃上清;最后加入0.9
‑
1ml基质缓冲液,混匀后即得待测样本。
[0022]
进一步地,在上述技术方案中,步骤s4所述温度为32
‑
40℃,所述孵育时间t为10
‑
60min;更进一步地,所述温度为37℃,所述孵育时间t为30min。
[0023]
需要注意的是,步骤s2中,在将各试剂加入酶标孔时,应触酶标板底缓慢加样。
[0024]
本发明的有益效果为:1)本发明提供的试剂盒适用范围广,适用于动物、细胞和微生物等所有样本;2)试剂盒中的显色底物经mao催化,生成对二甲氨基苯甲醛(相似355nm处有最大吸收),该显色体系在缓冲液中进行反应时,反应速率稳定,可选择检测时间范围广;3)本发明通过采用不同浓度的蔗糖溶液做提取液,配合特定的离心速差,实现了待测酶的有效分离,使得样本提取过程更为合理、准确;4)试剂盒中的基质缓冲液不仅能够很好的保护待测样本的酶活,更能与显色体系配合,使显色过程稳定,检测结果可靠;5)操作简单,检测时间短,且试剂成本低。
附图说明
[0025]
图1为本发明提供的检测试剂盒的显色原理示意图。
具体实施方式
[0026]
下面通过具体的实施例对本发明做进一步的详述,但不应理解为是对本发明保护范围的限制。
[0027]
实施例1
[0028]
一种单胺氧化酶检测试剂盒,包含以下试剂:
[0029]
样本提取液为20mmol/l的蔗糖溶液,溶剂为双蒸水;
[0030]
酶提取液为300mmol/l的蔗糖溶液,溶剂为双蒸水;
[0031]
基质缓冲液为pipes缓冲液,其中pipes浓度为50mmol/l,溶剂为水,缓冲液的ph为6.5;
[0032]
显色底物为4
‑
对二甲氨基苄胺盐酸盐,在具体的试剂盒中既可以以粉剂的形式存在,也可以与基质缓冲液直接配置成显色底物;在本实施例中,显色溶液中显色底物的浓度为8mmol/l
[0033]
该检测试剂盒需要在较低的温度下进行保存,例如4℃。
[0034]
实施例2
[0035]
一种单胺氧化酶检测试剂盒,包含以下试剂:
[0036]
样本提取液为10mmol/l的蔗糖溶液,溶剂为双蒸水;
[0037]
酶提取液为500mmol/l的蔗糖溶液,溶剂为双蒸水;
[0038]
基质缓冲液为pipes缓冲液,其中pipes浓度为30mmol/l,溶剂为水,缓冲液的ph为7.2;
[0039]
显色底物为4
‑
对二甲氨基苄胺盐酸盐,在具体的试剂盒中既可以以粉剂的形式存在,也可以与基质缓冲液直接配置成显色底物;在本实施例中,显色溶液中显色底物的浓度为5mmol/l
[0040]
该检测试剂盒需要在较低的温度下进行保存,比如4℃。
[0041]
实施例3
[0042]
使用单胺氧化酶检测试剂盒对样本中的酶活性进行检测,具体包括如下步骤:
[0043]
(1)待测样本的制备
[0044]
不同样本适用的处理方法不同,本实施例采用以下方法进行处理:
[0045]
①
动物组织样本处理
[0046]
取0.1
‑
0.5g样本,并按0.1g:0.5
‑
0.9ml的比例加入样本提取液进行匀浆,4℃下800
‑
1000
×
g离心8
‑
10min,弃沉淀;上清液再于4℃下9000
‑
10000
×
g离心20
‑
30min,弃上清;再加入0.9
‑
1ml酶提取液,混匀,4℃下15000
‑
18000
×
g离心35
‑
40min,弃上清;最后加入0.9
‑
1ml基质缓冲液工作液,混匀后即为待测样本,冰盒保存待用。
[0047]
②
细胞样本处理
[0048]
a.培养细胞的收集
[0049]
悬浮培养的细胞,可直接离心收集沉淀细胞(200
×
g,离心10min,弃上清留沉淀细胞);贴壁培养的细胞,吸去上清,可用细胞刮直接将细胞刮下;或者用0.25%的胰酶室温消化2
‑
3min,加培养液终止消化,用微量移液器轻轻吹打,将所有液体吸出转入ep管,200
×
g,离心10min弃上清,留沉淀细胞。
[0050]
b.培养细胞的破碎
[0051]
研磨破碎:在沉淀细胞中加入一定量的样本提取液(具体为:每106个细胞量加入0.3
‑
0.5ml的样本提取液),用手动玻璃匀浆器冰水浴研磨3
‑
5min;
[0052]
或超声破碎:在沉淀细胞中加入一定量的样本提取液(加入量同上),利用超声波细胞破碎仪进行破碎;本实施例中超声流程具体为:超声仪功率为300w,冰水浴、每3
‑
5s超声一次,共超声4次,每次间隔时间30s左右;
[0053]
可以理解的是,只要是将细胞破碎,破碎方法和破碎条件对检测结果无直接影响。
[0054]
c.细胞中酶的提取
[0055]
将细胞破碎液于4℃下9000
‑
10000
×
g离心20
‑
30min,弃上清;再加入0.9
‑
1ml酶提取液,混匀,4℃下15000
‑
18000
×
g离心35
‑
40min,弃上清;最后加入0.9
‑
1ml基质缓冲液,混匀后即得待测样本,冰盒保存待用。
[0056]
需要注意的是,对于动物组织、细胞样本处理后得到的待测样本,需测总蛋白浓度(c
pr
),具体可用bca法测蛋白浓度。
[0057]
③
对于血清或血浆样本,可直接检测。
[0058]
(2)测定
[0059]
酶标板设置
[0060] 123456789101112as1s9s17s25s33s41s49s57s65s73s81s89bs2s10s18s26s34s42s50s58s66s74s82s90cs3s11s19s27s35s43s51s59s67s75s83s91ds4s12s20s28s36s44s52s60s68s76s84s92es5s13s21s29s37s45s53s61s69s77s85s93fs6s14s22s30s38s46s54s62s70s78s86s94gs7s15s23s31s39s47s55s63s71s79s87s95hs8s16s24s32s40s48s56s64s72s80s88s96
[0061]
注:s1
‑
s96:测定孔
[0062]
操作步骤如下:
[0063]
①
向酶标板中相应的测定孔加入v2体积待测样本;
[0064]
②
向步骤
①
中的测定孔加入v3体积基质缓冲液;
[0065]
③
向步骤
②
中测定孔加入v4体积显色溶液,酶标仪上振板混匀;
[0066]
④
酶标仪于355nm处,检测测定孔的吸光度,记为a1;固定温度下孵育t min后,再次检测测定孔的吸光度,记为a2。
[0067]
需要注意的是,用移液枪移取液体时,要小心吸打,避免产生气泡。检测时,环境室内温度25
‑
30℃。
[0068]
(3)单胺氧化酶酶活力的计算
[0069]
当待测样本来自于血清血浆样本时,采用式(1)进行计算:
[0070][0071]
式(1)中,v1为反应体系的总体积(即v1+v2+v3),ε为4
‑
对二甲氨基苯甲醛的摩尔消光系数(具体为2.77
×
10
‑4l/nmol
·
cm),d为光径;u定义为:反应体系中,每升血清或血浆在
特定温度下每分钟催化显色底物产生1nmol 4
‑
对二甲氨基苯甲醛所需要的酶量为一个活力单位。
[0072]
当待测样本来自于细胞、细菌或组织样本时,采用式(2)进行计算:
[0073][0074]
式(2)中,v1为反应体系的总体积(即v1+v2+v3),ε为4
‑
对二甲氨基苯甲醛的摩尔消光系数(具体为2.77
×
10
‑4l/nmol
·
cm),d为光径,c
pr
为步骤
①
所述待测样本的蛋白浓度,且其浓度单位为gprot/l;u定义为:反应体系中,每克蛋白在特定温度下每分钟催化显色底物产生1nmol 4
‑
对二甲氨基苯甲醛所需要的酶量为一个活力单位。
[0075]
实施例4
[0076]
按照实施例1中的试剂盒和实施例3中的检测方法,取如下四个样品:大鼠肺组织匀浆、大鼠肝组织匀浆、大鼠脑组织匀浆和猪血清进行检测。其中:
[0077]
大鼠组织样本处理过程具体为:
[0078]
取0.5g样本,并按0.1g:0.9ml的比例加入样本提取液进行匀浆,60hz匀浆90s;4℃下1000
×
g离心10min,弃沉淀;上清液再于4℃下10000
×
g离心30min,弃上清;再加入1ml酶提取液,混匀,4℃下16000
×
g离心40min,弃上清;最后加入1ml基质缓冲液工作液,混匀后即为待测样本;
[0079]
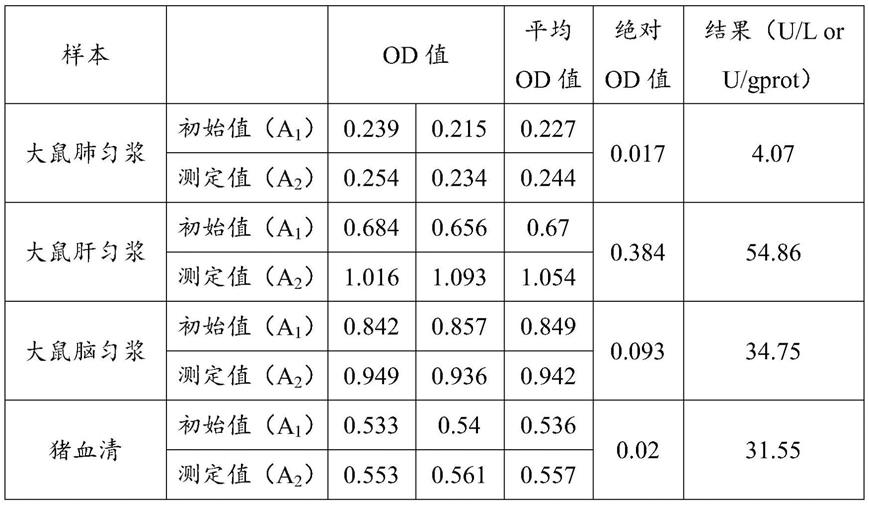
检测条件具体为:v2为25μl,v3为150μl,v4为25μl,孵育温度为37℃,孵育时间为30min。结果如下表:
[0080][0081]
对实施例1和2中的检测试剂盒,进行质量验证,发现其效果优于现有的犬脲胺法,具体体现在:批间差≤7.0%,回收率为95~105%,反应时间由原来的60min缩短至30min,甚至是10min;而且试剂本身性质稳定,空白对照组的吸光度无变化。
[0082]
本领域相关的技术人员可以借助实施例更好地理解和掌握本发明。但是,本发明的保护和权利要求范围不限于所提供的案例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动条件下所获得的所有其它实施例,都属于本发明保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1