一种确定具有GBM预后价值的血液炎症标志物的方法及GBM生存率计算系统
一种确定具有gbm预后价值的血液炎症标志物的方法及gbm生存率计算系统
技术领域
1.本发明涉及gbm(胶质母细胞瘤)预后评估领域,特别涉及一种确定具有gbm预后价值的血液炎症标志物的方法及gbm生存率计算系统。
背景技术:
2.gbm是成人中最常见的恶性脑肿瘤。尽管手术切除和放化疗对于病人的生存率有所改善,但gbm患者的中位总生存期仍小于15个月。一些影响gbm预后的因素已经被识别出来,其中idh1(异柠檬酸脱氢酶1)突变和mgmt(o6-甲基鸟嘌呤-dna甲基转移酶)启动子甲基化已广泛应用于临床实践。然而,这些分子生物标志物是术后才能获得的。因此,有必要确定gbm患者的术前生物标志物,以评估其临床结局,指导个体化治疗方案。
技术实现要素:
3.本发明目的是提供一种确定具有gbm预后价值的血液炎症标志物的方法,解决现有技术中存在的上述问题。
4.本发明解决上述技术问题的技术方案如下:
5.一种确定具有gbm预后价值的血液炎症标志物的方法,包括如下步骤:
6.步骤1,构建弥漫性胶质瘤患者组,所述弥漫性胶质瘤患者组包括lgg(低级别胶质瘤)患者组和gbm患者组;
7.步骤2,提取所述弥漫性胶质瘤患者组中每位患者的血常规及肝功能数据中的血液炎症指标,并计算所述血液炎症指标的比例;其中,所述血液炎症指标包括中性粒细胞、淋巴细胞、血小板、单核细胞、白蛋白及球蛋白;所述血液炎症指标的比例包括nlr(中性粒细胞/淋巴细胞)、plr(血小板/淋巴细胞)、lmr(淋巴细胞/单核细胞)、agr(白蛋白/球蛋白);
8.步骤3,比较所述血液炎症指标及所述血液炎症指标的比例在所述lgg患者组和所述gbm患者组中的统计学差异;获得所述gbm患者组较所述lgg患者组具有更高的中性粒细胞、nlr和plr,更低的淋巴细胞、lmr和agr,无显著差异的血小板、单核细胞和白蛋白;提示中性粒细胞、nlr、plr、淋巴细胞、lmr和agr为具有gbm区分意义的血液炎症标志物,确定nlr、lmr和agr具有gbm独立的预后价值。
9.本发明的有益效果是:采用统计学分析方法从血液炎症指标和血液炎症指标的比例中确定具有gbm预后价值的血液炎症标志物,以评估gbm患者的临床结局,为术前指导gbm患者的个体化治疗方案提供理论支撑。
10.在上述技术方案的基础上,本发明还可以做如下改进。
11.进一步,还包括如下步骤:
12.步骤4,识别出所述gbm患者组的中性粒细胞、淋巴细胞、血小板、白蛋白、nlr、plr、lmr和agr的最佳截断值,基于每个所述最佳截断值将所述gbm患者组各划分为两个组,分别
比较每两个组所述gbm患者的os(总生存期),进一步确定nlr、lmr和agr具有gbm独立的预后价值。
13.进一步,所述步骤3包括如下步骤:
14.步骤31,对所述血液炎症指标和所述血液炎症指标的比例进行正态性检验及方差齐性分析,获得白蛋白符合正态分布以及方差齐性,中性粒细胞、淋巴细胞、血小板、单核细胞、nlr、plr、lmr和agr均是非正态分布;
15.步骤32,使用mann-whitney(曼-惠特尼)u检验比较中性粒细胞、淋巴细胞、血小板、单核细胞、nlr、plr、lmr和agr在所述lgg患者组和所述gbm患者组中的统计学差异;
16.步骤33,使用非配对t-检验比较白蛋白在所述lgg患者组和所述gbm患者组中的统计学差异。
17.进一步,所述步骤4中分别比较每两个组所述gbm患者的os具体为使用mann-whitney u检验分别比较每两个组所述gbm患者的os,获得高中性粒细胞、高nlr、低淋巴细胞、低白蛋白、低lmr和低agr的所述gbm患者组均表现出较短的os。
18.进一步,所述步骤4中分别比较每两个组所述gbm患者的os具体为根据每个所述血液炎症指标及所述血液炎症指标的比例分别绘制每两个组kaplan-meier生存曲线比较每两个组所述gbm患者的os,获得高nlr、低lmr、低agr和低白蛋白的所述gbm患者组均表现出较短的os,中性粒细胞、淋巴细胞、血小板和plr在各对应两个组所述gbm患者的os无显著差异。
19.进一步,还包括如下步骤:
20.步骤5,采用cox单因素和多因素回归模型评估nlr、lmr和agr在gbm患者组中的预后价值,进一步确定nlr、lmr和agr具有gbm独立的预后价值。
21.进一步,还包括如下步骤:
22.步骤6,将nlr、lmr和agr两两结合及三者结合,评估组合后的血液炎症标志物的预后价值,获得agr-nlr评分,agr-lmr评分和lmr-nlr评分具有独立的预后价值。
23.进一步,还包括如下步骤:
24.步骤7,kps(卡式功能状态评分),术后是否接受放疗和/或化疗,肿瘤的切除程度三者与agr-nlr评分,agr-lmr评分和lmr-nlr评分在gbm中具有独立的预后价值,分别构建列线图来预测所述gbm患者组的0.5年,1年及1.5年的生存概率,使用c指数(harrell’s concordance指数)来评价三个所述列线图的预测准确性,使用内部验证的验证曲线(calibration curve)来评价三个所述列线图的预测值与实际观察值之间的一致性,使用时间依赖性roc(受试者工作特征)曲线及auc(时间依赖性roc曲线下面积)来评价三个所述列线图预测生存概率的准确性;获得包含有agr-nlr评分的所述列线图的预测准确性最高。
25.本发明的另一技术方案如下:
26.一种gbm生存率计算系统,其特征在于,包括数据采集模块,数据计算模块,数据比对模块和数据分析模块;
27.所述数据采集模块,其用于采集gbm患者的血常规及肝功能数据,获取血常规及肝功能数据中的血液炎症指标;
28.所述数据计算模块,其用于计算所述血液炎症指标的比例;
29.所述数据比对模块,其用于将所述血液炎症指标和所述血液炎症指标的比例,分
别与上述确定具有gbm预后价值的血液炎症标志物的方法中获取的血液炎症指标的最佳截断值和血液炎症指标的比例的最佳截断值进行比较,确定所述血液炎症指标和所述血液炎症指标的比例分别属于高值或低值;
30.数据分析模块,其用于根据所述血液炎症指标和所述血液炎症指标的比例分别属于高值或低值,结合上述确定具有gbm预后价值的血液炎症标志物的方法中的分析结果,计算所述gbm患者的生存率。
31.本发明的有益效果是:提供一种术前gbm生存率计算系统,以评估gbm患者的临床结局,为术前指导gbm患者的个体化治疗方案提供支撑。
32.在上述技术方案的基础上,本发明还可以做如下改进。
33.进一步,所述血液炎症指标包括中性粒细胞、淋巴细胞、单核细胞、白蛋白和球蛋白;所述血液炎症指标的比例包括nlr、lmr和agr;所述nlr、lmr和agr的最佳截断值分别为2.0,2.3和1.7;所述分析结果为当所述nlr为高值、所述lmr为低值或所述agr为低值时,所述gbm患者的生存率差。
附图说明
34.图1为本发明一种确定具有gbm预后价值的血液炎症标志物的方法的方法流程图;
35.图2为本发明一种确定具有gbm预后价值的血液炎症标志物的方法的血液炎症指标及血液炎症指标的比例的最佳截断值图;
36.图3为本发明一种确定具有gbm预后价值的血液炎症标志物的方法的第一生存曲线图;
37.图4为本发明一种确定具有gbm预后价值的血液炎症标志物的方法的第二生存曲线图;
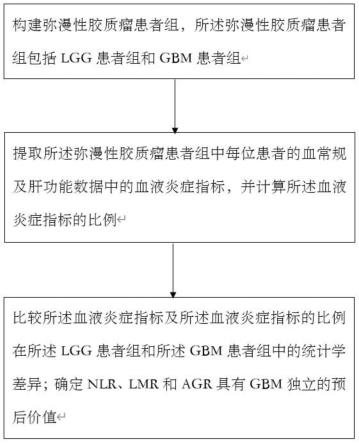
38.图5为本发明一种确定具有gbm预后价值的血液炎症标志物的方法的nlr、lmr和agr三者相关性示意图;
39.图6为本发明一种确定具有gbm预后价值的血液炎症标志物的方法的第三生存曲线图;
40.图7为本发明一种确定具有gbm预后价值的血液炎症标志物的方法的列线图;
41.图8为本发明一种确定具有gbm预后价值的血液炎症标志物的方法的时间依赖性roc曲线图;
42.图9为本发明一种gbm生存率计算系统的系统原理框图。
具体实施方式
43.以下结合附图对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
44.如图1所示,一种确定具有gbm预后价值的血液炎症标志物的方法,包括如下步骤:
45.步骤1,构建弥漫性胶质瘤患者组,所述弥漫性胶质瘤患者组包括lgg患者组和gbm患者组;
46.步骤2,提取所述弥漫性胶质瘤患者组中每位患者的血常规及肝功能数据中的血液炎症指标,并计算所述血液炎症指标的比例;其中,所述血液炎症指标包括中性粒细胞、
淋巴细胞、血小板、单核细胞、白蛋白及球蛋白;所述血液炎症指标的比例包括nlr、plr、lmr、agr;
47.步骤3,比较所述血液炎症指标及所述血液炎症指标的比例在所述lgg患者组和所述gbm患者组中的统计学差异;获得所述gbm患者组较所述lgg患者组具有更高的中性粒细胞、nlr和plr,更低的淋巴细胞、lmr和agr,无显著差异的血小板、单核细胞和白蛋白;提示中性粒细胞、nlr、plr、淋巴细胞、lmr和agr为具有gbm区分意义的血液炎症标志物,确定nlr、lmr和agr具有gbm独立的预后价值。
48.炎症是癌症的一个标志,治疗前血液炎症指标和血液炎症指标的比例可以非常容易地从血液常规检测中获得,采用统计学分析方法从血液炎症指标和血液炎症指标的比例中确定具有gbm预后价值的血液炎症标志物,以评估gbm患者的临床结局,为术前指导gbm患者的个体化治疗方案提供理论支撑。
49.本发明实施例2所述确定具有gbm预后价值的血液炎症标志物的方法,在实施例1的基础上,还包括如下步骤:
50.步骤4,识别出所述gbm患者组的中性粒细胞、淋巴细胞、血小板、白蛋白、nlr、plr、lmr和agr的最佳截断值,基于每个所述最佳截断值将所述gbm患者组各划分为两个组,分别比较每两个组所述gbm患者的os,进一步确定nlr、lmr和agr为具有gbm独立的预后价值的血液炎症标志物。
51.本发明实施例3所述确定具有gbm预后价值的血液炎症标志物的方法,在实施例1或2的基础上,所述步骤3包括如下步骤:
52.步骤31,对所述血液炎症指标和所述血液炎症指标的比例进行正态性检验及方差齐性分析,获得白蛋白符合正态分布以及方差齐性,中性粒细胞、淋巴细胞、血小板、单核细胞、nlr、plr、lmr和agr均是非正态分布;
53.步骤32,使用mann-whitney u检验比较中性粒细胞、淋巴细胞、血小板、单核细胞、nlr、plr、lmr和agr在所述lgg患者组和所述gbm患者组中的统计学差异;
54.步骤33,使用非配对t-检验比较白蛋白在所述lgg患者组和所述gbm患者组中的统计学差异。
55.本发明实施例4所述确定具有gbm预后价值的血液炎症标志物的方法,在实施例2或3的基础上,
56.所述步骤4中分别比较每两个组所述gbm患者的os具体为使用mann-whitney u检验分别比较每两个组所述gbm患者的os,获得高中性粒细胞、高nlr、低淋巴细胞、低白蛋白、低lmr和低agr的所述gbm患者组均表现出较短的os。
57.本发明实施例5所述确定具有gbm预后价值的血液炎症标志物的方法,在实施例2至3任一实施例的基础上,
58.所述步骤4中分别比较每两个组所述gbm患者的os具体为根据每个所述血液炎症指标及所述血液炎症指标的比例分别绘制每两个组kaplan-meier生存曲线比较每两个组所述gbm患者的os,获得高nlr、低lmr、低agr和低白蛋白的所述gbm患者组均表现出较短的os,中性粒细胞、淋巴细胞、血小板和plr在各对应两个组所述gbm患者的os无显著差异。
59.本发明实施例6所述确定具有gbm预后价值的血液炎症标志物的方法,在实施例2至5任一实施例的基础上,还包括如下步骤:
60.步骤5,采用cox单因素和多因素回归模型评估nlr、lmr和agr在gbm患者组中的预后价值,进一步确定nlr、lmr和agr为具有gbm独立的预后价值的血液炎症标志物。
61.本发明实施例7所述确定具有gbm预后价值的血液炎症标志物的方法,在实施例2至6任一实施例的基础上,还包括如下步骤:
62.还包括如下步骤:
63.步骤6,将nlr、lmr和agr两两结合及三者结合,评估组合后的血液炎症标志物的预后价值,获得agr-nlr评分,agr-lmr评分和lmr-nlr评分具有独立的预后价值。
64.本发明实施例8所述确定具有gbm预后价值的血液炎症标志物的方法,在实施例7的基础上,还包括如下步骤:
65.步骤7,kps,术后是否接受放疗和/或化疗,肿瘤的切除程度三者与agr-nlr评分,agr-lmr评分和lmr-nlr评分在gbm中具有独立的预后价值,分别构建列线图来预测所述gbm患者组的0.5年,1年及1.5年的生存概率,使用c指数来评价三个所述列线图的预测准确性,使用内部验证的验证曲线来评价三个所述列线图的预测值与实际观察值之间的一致性,使用时间依赖性roc曲线及auc来评价三个所述列线图预测生存概率的准确性;获得包含有agr-nlr评分的所述列线图的预测准确性最高。
66.本发明实施例9所述gbm生存率计算系统,包括数据采集模块,数据计算模块,数据比对模块和数据分析模块;
67.所述数据采集模块,其用于采集gbm患者的血常规及肝功能数据,获取血常规及肝功能数据中的血液炎症指标;
68.所述数据计算模块,其用于计算所述血液炎症指标的比例;
69.所述数据比对模块,其用于将所述血液炎症指标和所述血液炎症指标的比例,分别与实施例2所述确定具有gbm预后价值的血液炎症标志物的方法中获取的血液炎症指标的最佳截断值和血液炎症指标的比例的最佳截断值进行比较,确定所述血液炎症指标和所述血液炎症指标的比例分别属于高值或低值;
70.数据分析模块,其用于根据所述血液炎症指标和所述血液炎症指标的比例分别属于高值或低值,结合实施例1至8任一所述确定具有gbm预后价值的血液炎症标志物的方法中的分析结果,计算所述gbm患者的生存率。
71.提供一种术前gbm生存率计算系统,以评估gbm患者的临床结局,为术前指导gbm患者的个体化治疗方案提供支撑。
72.本发明实施例10所述gbm生存率计算系统,在实施例9的基础上,所述血液炎症指标包括中性粒细胞、淋巴细胞、单核细胞、白蛋白和球蛋白;所述血液炎症指标的比例包括nlr、lmr和agr;所述nlr、lmr和agr的最佳截断值分别为2.0,2.3和1.7;所述分析结果为当所述nlr为高值、所述lmr为低值或所述agr为低值时,所述gbm患者的生存率差。
73.具体实施例:
74.步骤1,通过电子病历系统检索武汉大学中南医院神经外科2016年1月到2019年5月所有的弥漫性胶质瘤患者,并且根据如下纳入、排除标准最后确定了共187名弥漫性胶质瘤患者,其中有52名2级神经胶质瘤患者和47名3级神经胶质瘤患者,此99名患者为lgg患者组,另外88名4级胶质母细胞瘤患者为gbm患者组。
75.纳入标准:1).年龄≥18岁;2).所有患者的诊断通过组织学证实;3).所有患者的
临床信息及手术前的血常规及肝功能数据是可获得的;
76.排除标准:1).患者在手术前接受了化疗(包括激素的使用)和/或放疗;2).患者既往有其它恶性肿瘤病史或慢性炎症性疾病(包括自身免疫性疾病和感染);3).患者是复发胶质瘤;4).患者在围手术期死亡。
77.所有患者的资料的获取及处理分析均严格遵守赫尔辛基宣言。本研究已获得武汉大学中南医院伦理委员会的批准,每个患者均签署了书面的知情同意书。最后一次的随访时间为2020年8月31日。
78.步骤2,所有187名弥漫性胶质瘤患者的人口统计学和临床信息被提取出来,包括性别,确诊时的年龄,肿瘤的部位,肿瘤的级别,idh1的突变状态,mgmt启动子甲基化水平,kps,肿瘤的切除程度(全切gtr≥95%,次全切str<95%)及术后是否接受放疗和/或化疗。
79.所有187名弥漫性胶质瘤患者的血常规及肝功能数据同样被提取出来,包括中性粒细胞、淋巴细胞、血小板、单核细胞、白蛋白及球蛋白,这些血液炎症指标的比例同样被计算出来,包括nlr、plr、lmr、agr。os被定义为手术日期至死亡日期或最后一次随访日期。
80.所有187名弥漫性胶质瘤患者的临床和病理特征如表1所示,平均年龄为50.3岁(范围21-81),在gbm患者中,69.3%的患者为非全切除,56.8%的患者术后接受了放疗和/或化疗,存在idh1突变和mgmt启动子甲基化的gbm患者分别只有4例(4.5%)和33例(37.5%)。
81.表1.患者的临床和病理特征
[0082][0083][0084]
步骤3,对血液炎症指标和血液炎症指标的比例进行正态性检验及方差齐性分析,获得白蛋白符合正态分布以及方差齐性,中性粒细胞、淋巴细胞、血小板、单核细胞、nlr、plr、lmr和agr均是非正态分布;使用mann-whitney u检验比较中性粒细胞、淋巴细胞、血小板、单核细胞、nlr、plr、lmr和agr在lgg患者组和gbm患者组中的统计学差异;使用非配对t-检验比较白蛋白在lgg患者组和gbm患者组中的统计学差异。
[0085]
获得gbm患者组较lgg患者组具有更高的中性粒细胞、nlr和plr,更低的淋巴细胞、lmr和agr,无显著差异的血小板、单核细胞和白蛋白,如表1所示;提示中性粒细胞、nlr、plr、淋巴细胞、lmr和agr为具有gbm区分意义的血液炎症标志物,确定nlr、lmr和agr具有gbm独立的预后价值。
[0086]
步骤4,由于血液炎症指标及血液炎症指标的比例都是连续性变量,使用x-tile软件(version3.6.1,http://medicine.yale.edu/lab/rimm/research/software.aspx)确定血液炎症指标及血液炎症指标的比例的最佳截断值。如图2所示,中性粒细胞、淋巴细胞、血小板、白蛋白的最佳截断值分别为4.7(109/l),2.3(109/l),208(109/l)、35.7(g/l);nlr、plr、lmr和agr的最佳截断值分别为2.0、213.0、2.3和1.7。根据每个最佳截断值将gbm患者组各划分为两个组,分别比较每两个组gbm患者的os。首先使用mann-whitney u检验分别比较每两个组gbm患者的os,获得高中性粒细胞、高nlr、低淋巴细胞、低白蛋白、低lmr和低agr的gbm患者组的os较短,如表2所示;接下来,根据每个血液炎症指标及血液炎症指标的比例分别绘制每两个组kaplan-meier生存曲线比较每两个组gbm患者的os,获得在gbm患者中,高nlr(p=0.005)有更糟糕的os,而高的lmr(p=0.006),agr(p=0.002)或白蛋白(p=0.006)则有更佳的os,如图3所示。中性粒细胞(p=0.057),淋巴细胞(p=0.224)、血小板(p=0.311),和plr(p=0.290)与os无显著性关系,如图4所示。进一步确定nlr、lmr和agr具有gbm独立的预后价值。
[0087]
表2.gbm患者os——基于外周血液炎症指标的截断值
[0088][0089]
步骤5,cox单因素和多因素分析显示,除了kps,放化疗和切除程度,nlr、lmr和agr也显著与生存相关,高nlr(》2.0)和低lmr(《2.3)是gbm患者预后不良的指标,而高plr(》213.0)则不是。术前nlr的最佳截断值为4.0在gbm的研究中最常用,已经证明与gbm患者的胶质瘤分级和生存期差相关。本发明数据表明,术前nlr较低的最佳截断值2.0的可作为gbm生存的潜在预测因子。如表3所示。
[0090]
表3.gbm患者os的单因素的多因素分析
[0091][0092]
此外,斯皮尔曼相关系数试验表明,nlr或lmr与agr无明显的关联,而nlr和lmr之间只有微弱的相关性(r=-0.613,p《0.01),如图5。较意外地是,分析没有显示mgmt启动子甲基化或idh1突变与存活率有显著关联。单因素分析表明,白蛋白是与生存相关的显著变量,但多因素分析则未能显示出显著的预后意义。
[0093]
步骤6,由于nlr、lmr和agr可能通过不同的机制影响肿瘤进展,结合这些标志物可能提供更全面的生存预测工具。因此,通过纳入nlr、lmr和agr的任意两个或全部三个变量,构建了四个预后评分系统agr-nlr、agr-lmr、lmr-nlr和lmr-nlr-agr评分。系统中的得分由与不良生存相关的变量状态的存在或不存在决定,即高nlr(》2.0)、低lmr(《2.3)或低agr(《1.7)。对于agr-nlr、agr-lmr和lmr-nlr评分,系统分为3组:0分(两个变量均不存在)、1分(两个变量之一存在)和2分(两个变量均存在)。lmr-nlr-agr评分系统分为4组:0分(三个变量均不存在)、1分(三个变量任一存在)、2分(三个变量中任两个存在)、3分(三个变量均存在)。各评分系统os的数据如表4所示。
[0094]
表4.gbm患者os-基于不同的评分系统
[0095][0096]
kaplan-meier生存曲线分析显示,agr-nlr、agr-lmr、lmr-nlr,lmr-nlr-agr评分与os相关显著,p值分别为p《0.001,p《0.001,p=0.003,p《0.001,如图6所示。
[0097]
多因素分析的结果表明,对于agr-lmr和lmr-nlr评分,1分组和2分组与不利的os有关;在agr-nlr评分中,只有2分组与较差的os相关;在lmr-nlr-agr评分中,1分组、2分组和3分组都不是生存结局的预测因素;如表5所示。
[0098]
表5.gbm患者os的单因素和多因素分析-基于评分系统
[0099]
[0100]
步骤7,基于多因素分析结果,确定了几个独立的预后因素,包括kps、放化疗、切除程度、agr-nlr评分、agr-lmr评分和lmr-nlr评分。kps,放化疗,切除程度三者与agr-nlr评分,agr-lmr评分和lmr-nlr评分在gbm中具有独立的预后价值,分别构建列线图来评估这些变量对gbm患者0.5、1和1.5年总生存率的预测价值。
[0101]
在纳入agr-nlr评分的列线图中,kps对预后的影响最大,其次是agr-nlr评分、放化疗和切除程度。该列线图生存预测模型c指数为0.874,具有较好的预测生存率的准确性。预测0.5、1和1.5年生存率的列线图的boot-strapped校准图即内部验证的验证曲线在理想模型中表现良好,如图7a,表明该列线图预测的有效性。
[0102]
在纳入agr-lmr评分的列线图中,kps对预后的影响最大,其次是agr-lmr评分、切除程度和放化疗。该列线图生存预测模型c指数为0.867,具有较好的预测生存率的准确性。预测0.5、1和1.5年生存率的列线图的boot-strapped校准图在理想模型中表现良好,如图7b,表明该列线图预测的有效性。
[0103]
在纳入lmr-nlr评分的列线图中,kps对预后的影响最大,放化疗和lmr-nlr评分对风险评分的权重相似,其次是切除程度。该列线图生存预测模型c指数为0.866,具有较好的预测生存率的准确性。预测0.5、1和1.5年生存率的列线图的boot-strapped校准图在理想模型中表现良好,如图7c,表明该列线图预测的有效性。
[0104]
在三个列线图中,含agr-nlr评分的列线图的c指数最高,显示出预测生存的准确性方面的微弱优势。同样,如图8所示,时间依赖性roc曲线分析也表明,纳入agr-nlr评分的auc值在预测0.5年、1年或1.5年时最高,分别为0.703、0.708和0.738,预测准确性最高。
[0105]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1