一种用于检测muc1粘蛋白的荧光适配体传感器及其应用方法
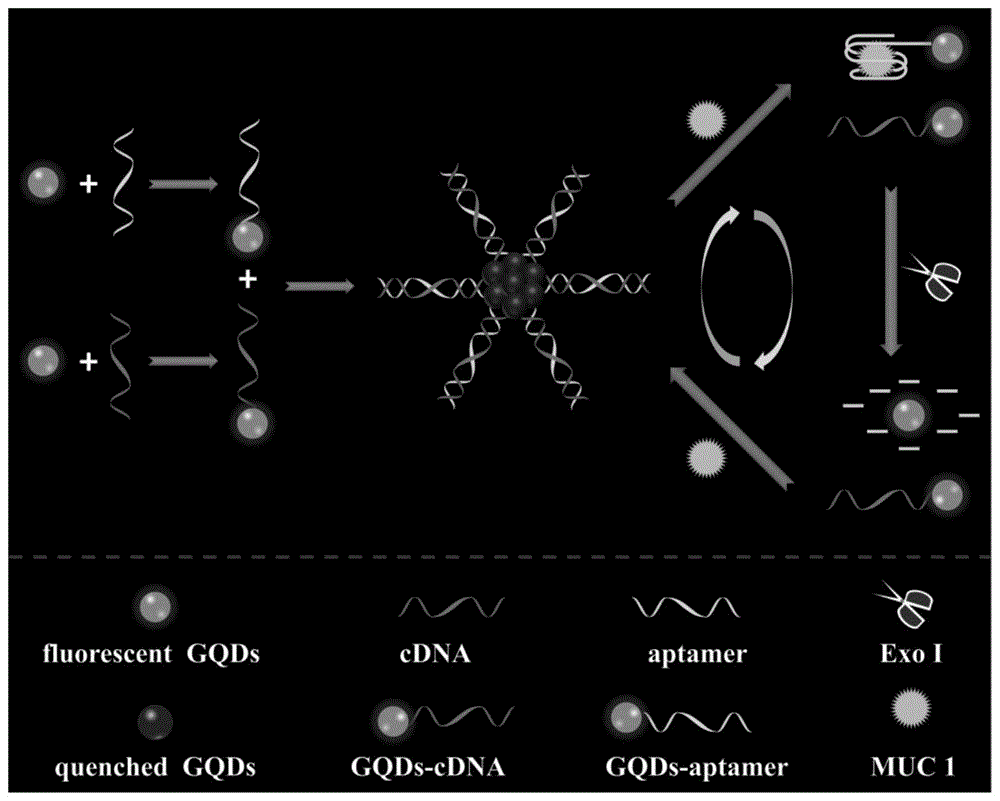
本发明属于分析化学领域,具体涉及一种用于检测muc1粘蛋白的荧光适配体传感器及其应用方法。
背景技术:
癌症是全球范围内最可怕的疾病,死亡率高,发病早期无明显症状。虽然近几十年来诊断技术不断提高,但癌症的早期诊断仍然面临着巨大的挑战。对血液或其他体液中肿瘤生物标志物的灵敏检测为癌症的早期诊断提供了一种有效的诊断方法。粘蛋白是一种糖蛋白,主要由粘多糖组成,常见于膝关节滑液中。粘蛋白的表达,特别是muc1粘蛋白(muc1),与多种癌症有关。因此,用超灵敏、高选择性的分析方法提高muc1粘蛋白的检测水平,对癌症的早期诊断具有重要意义。适配体是单链dna或rna寡核苷酸,具有很高的特异性,可与不同的靶标结合,用于开发多种生物传感器。自从发现针对muc1的适配体以来,利用表面增强拉曼散射(sers)、化学发光(ecl)、电化学阻抗谱(eis)、方波伏安法(swv)和荧光等技术,已广泛构建了用于muc1检测的适体传感器。尤其是基于适配体的荧光传感器,由于其高结合力、良好的灵敏度和特异性以及在均相检测中的结构开关特性,已成为生物传感器领域的研究热点并被广泛应用。
技术实现要素:
有鉴于此,本发明提供一种用于检测muc1粘蛋白的荧光适配体传感器及其应用方法。利用核酸适配体结构转换策略调控石墨烯量子点的聚集状态,并结合核酸外切酶ⅰ(exoⅰ)辅助调控靶标循环,从而调控荧光信号的淬灭和恢复来检测muc1粘蛋白。
本发明具体提供了如下的技术方案:
1、一种用于检测muc1粘蛋白的荧光适配体传感器,由三种组分组成,组分1是表面修饰有muc1粘蛋白的适配体dna1的石墨烯量子点1,组分2是表面修饰上与muc1粘蛋白的适配体dna1互补的探针dna2的石墨烯量子点2,组分3是核酸外切酶ⅰ;将石墨烯量子点1和石墨烯量子点2共混,因适配体dna1和探针dna2的杂交作用使石墨烯量子点聚集,发生激子能量转移,导致石墨烯量子点的荧光猝灭,加入目标检测物muc1粘蛋白,muc1粘蛋白与适配体dna1发生特异性结合,形成muc1粘蛋白/适配体复合结构,引起原本聚集的石墨烯量子点发生解聚而重新分散,体系荧光恢复,再加入核酸外切酶ⅰ,muc1粘蛋白/适配体复合结构中的适配体dna1被降解,释放的muc1粘蛋白进一步与下一个适配体dna1结合,参与下一个循环,使恢复的荧光强度进一步增强,提高体系对muc1粘蛋白检测的灵敏度。
进一步,所述的适配体dna1结构为5’-nh2-(ch2)6-gcagttgatcctttggataccctgg-3’;所述的探针dna2结构为5’-ccaggggggggttttttggaactgc-(ch2)6-nh2-3’。
进一步,所述的第一组石墨烯量子点和第二组石墨烯量子点等质量共混,所述的适配体dna1和探针dna2等摩尔量。
2、上述用于检测muc1粘蛋白的荧光适配体传感器的应用方法,包括以下步骤:
(1)通过dna杂交使石墨烯量子点聚集,荧光信号猝灭:首先利用te缓冲液通过离心溶解muc1粘蛋白的适配体dna1以及与适配体dna1互补的探针dna2;然后通过水热法合成石墨烯量子点,并在两组石墨烯量子点表面分别修饰上muc1粘蛋白的适配体dna1和与适配体互补的探针dna2,随后将修饰有不同dna的两组石墨烯量子点等量混合,通过dna杂交引起石墨烯量子点发生聚集,荧光信号猝灭;
(2)muc1粘蛋白的荧光检测:在步骤(1)中加入核酸外切酶ⅰ,随后将不同标准浓度的muc1粘蛋白加入到上述荧光猝灭的溶液中,37℃下孵育一段时间,设定荧光分光光度计激发发射波长及入射发射狭缝,取孵育好的反应溶液加入到适应比色皿中检测,得出不同浓度的muc1粘蛋白对应的荧光强度,并绘制出曲线;
(3)荧光检测muc1粘蛋白:把含有muc1粘蛋白的样品加入到对应的荧光信号猝灭的石墨烯量子点溶液中,37℃下孵育一段时间后,设定与步骤(2)一样的荧光检测条件,取孵育好的反应溶液加入到适应比色皿中检测,得出muc1粘蛋白的荧光强度,根据步骤(2)muc1粘蛋白的浓度与荧光强度的关系曲线,得出待测样品中muc1粘蛋白的浓度。
进一步,步骤(1)中te缓冲液组成为40mmtris,2mmedta,ph=7.4。
进一步,步骤(2)中所述的核酸外切酶ⅰ的用量为20-40u。
进一步,步骤(2)中荧光分光光度计激发发射波长为315nm,入射发射狭缝为5nm,发射光谱检测范围为350-600nm;muc1粘蛋白的标准浓度为0-10nm。
进一步,步骤(1)的具体步骤为:
1)向合成的石墨烯量子点溶液中加入n-羟基琥珀酰亚胺和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,调节溶液ph到5,反应一段时间后,调节溶液ph到7.4;
2)将步骤1)得到的溶液分为两份,分别加入适配体dna1溶液和探针dna2溶液,室温下再反应一段时间;
3)将步骤2)得到的修饰有不同dna的石墨烯量子点溶液等质量混合,室温下孵育一段时间后,使石墨烯量子点聚集,体系荧光信号猝灭。
上述步骤1)所述的反应时间为30min,步骤2)所述的反应时间为2h。
上述步骤2)所述的适配体dna1和探针dna2的浓度均为100μm;所述的石墨烯量子点溶液:n-羟基琥珀酰亚胺:1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐:适配体dna1溶液:探针dna2溶液的配比为10ml:(20-25)mg:(18-20)mg:24μl:24μl。
进一步,所述的核酸外切酶ⅰ的用量为30u。
本发明的有益效果在于:采用水热法合成了分散性良好,粒径均匀的石墨烯量子点,并在其表面分别修饰上muc1粘蛋白的适配体dna1以及与其互补序列cdna,将这两种石墨烯量子点进行混合,通过dna杂交使石墨烯量子点聚集,发生激子能量转移,导致石墨烯量子点荧光信号猝灭;随后加入目标检测物muc1粘蛋白,其与核酸适配体dna特异性结合,结构发生转变,与互补序列cdna脱离,引起石墨烯量子点聚集体解组装而重新分散,体系荧光强度恢复。过程简单易行、绿色环保、成本低、灵敏度高、特异性好,并成功用于人类血清的加标回收。为了提高荧光传感器检测的灵敏度和降低检测限,本发明引入核酸外切酶ⅰ辅助信号放大策略。核酸外切酶ⅰ具有从3’端向5’端方向水解单链核酸的外切酶活性,而在目标检测物muc1粘蛋白不存在情况下,核酸外切酶ⅰ并不会起到降解核酸的效果。所以,核酸外切酶ⅰ的选用,在满足不会产生背景信号的同时可以大大提高对muc1粘蛋白的检测能力。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图:
图1为本发明的一种用于检测muc1粘蛋白的荧光适配体传感器对muc1粘蛋白检测的示意图;
图2为石墨烯量子点的高分辨透射电镜照片;
图3为石墨烯量子点尺寸分布图;
图4为dna功能化前后石墨烯量子点红外变化谱图;
图5为dna功能化前后石墨烯量子点紫外变化谱图;
图6为实验可行性分析结果;
图7为实验动力学分析结果;
图8为无exoⅰ情况下,加入不同浓度muc1粘蛋白后体系荧光强度发射曲线;
图9为无exoⅰ情况下,不同muc1粘蛋白浓度和荧光强度对应关系绘制的拟合曲线;
图10为有exoⅰ情况下,加入不同浓度muc1粘蛋白后体系荧光强度发射曲线;
图11为有exoⅰ情况下,不同muc1粘蛋白浓度和荧光强度对应关系绘制的拟合曲线;
图12为同一浓度不同底物下的特异性柱状图;
表1为本发明所述的荧光传感器在实际人类血清中的加标回收;
具体实施方式
下面结合附图,对本发明的优选实施例进行详细的描述。
实验原理如图1所示,当将muc1粘蛋白适配体(aptamer)修饰的石墨烯量子点gqds-aptamer和互补的探针cdna修饰的石墨烯量子点gqds-cdna混合之后,通过dna的杂交使得石墨烯量子点聚集,发生激子能量转移,从而使石墨烯量子点的荧光信号猝灭(quenchedcqds)。而后加入目标检测物muc1粘蛋白,其与核酸适配体dna特异性结合,适配体dna结构发生转变,与探针cdna脱离,引起石墨烯量子点聚集体解组装而重新分散,体系荧光强度恢复(fluorescentcqds)。在核酸外切酶ⅰ(exo1)作用下,形成的muc1粘蛋白/适配体复合结构中的适配体dna被降解,释放的muc1粘蛋白进一步与下一个适配体结合,参与下一个循环,从而使恢复的荧光强度进一步增强,提高了体系对muc1粘蛋白检测的灵敏度。
实施例1合成氧化石墨烯
以天然石墨粉为原料,将4.6ml98%的h2so4加入位于冰浴中的圆底烧瓶中。然后,在冰浴中连续搅拌15min,小心地加入0.2g石墨粉和0.1gnano3,缓慢地添加0.6gkmno4。将温度升高到35℃,并在此温度下保持30min。向上述体系中加入9.2ml蒸馏水,继续升温至98℃,搅拌30min,最后向体系中加入28ml蒸馏水和2ml30%h2o2的混合物,停止反应。过滤所得溶液,用蒸馏水洗涤收集的产品,直到过滤溶液的ph值为中性,最后冷冻干燥得到产物。
实施例2制备2-4nm的石墨烯量子点
50mg氧化石墨烯用98%h2so4和68%hno3的混合酸(3:1)分散,温和超声(500w,40khz)下氧化2h,然后蒸馏水稀释处理。然后,使用0.22μm微孔膜过滤氧化产物并将其重新分散在40ml蒸馏水中。将悬浮液转移到高压反应釜(50ml)中并在180℃下加热12h。自然冷却至室温后,通过0.22μm微孔膜过滤黑色悬浮液,并保留棕色过滤溶液。将获得的过滤溶液在透析袋(保留分子量:3500da)中进一步透析3天。最后,通过冷冻干燥得到石墨烯量子点产物。通过高分辨透射电镜对石墨烯量子点的表征结果如附图2所示,尺寸主要分布在2-4nm,如附图3。
从图2中可以看出,合成的石墨烯量子点尺寸均匀,且分散性良好。
从图3中可以看出,合成的石墨烯量子点尺寸范围为2.5-5.0nm,平均为3.5nm。
实施例3对探针dna进行预处理
首先利用te缓冲液离心溶解粉末状muc1粘蛋白适配体dna1以及与其互补的探针dna2,溶解后的dna1和dna2浓度均为100μm。
te缓冲液ph=7.4,缓冲液组成为40mmtris,2mmedta;muc1粘蛋白适配体dna结构为5’-nh2-(ch2)6-gcagttgatcctttggataccctgg-3’;互补的探针cdna结构为5’-ccaggggggggttttttggaactgc-(ch2)6-nh2-3’,由上海sangon生物技术有限公司合成并分装。使用前加入缓冲液离心溶解,离心速度为4000rpm,时间1min。
实施例4制备dna功能化的石墨烯量子点探针
将石墨烯量子点溶解于10mlpbs缓冲液中(0.1mg/ml),调节ph值至5。依次加入edc(19mg)和nhs(22mg)激活gqds的羧基,并在室温下搅拌30min。然后,在将ph值调节至7.4后,将溶液分为两等份。将20μl氨基修饰的muc1aptamer(100μm)加入上述其中一份活化后的溶液中,在室温下连续搅拌缩合反应2h,得到gqds-aptamer。同样的方法,制备gqds-cdna,并在4℃下保存。通过附图4和附图5中石墨烯量子点在dna功能化前后红外和紫外的变化,说明石墨烯量子点表面成功修饰有dna。
从图4中可以看出,石墨烯量子点表面修饰有探针dna后的红外光谱图(4-b)中相对于石墨烯量子点(4-a)出现991cm-1和941cm-1处的新峰,正好对应于dna磷酸盐骨架中p-o和p=o特征振动,尤其是1681cm-1处的酰胺键的特征振动证明成功探针dna成功修饰在石墨烯量子点表面。
从图5中可以看出,相对于氧化石墨烯(5-b)和石墨烯量子点(5-a),石墨烯量子点表面修饰过探针dna后,在260nm处出现dna特征吸收峰(5-c),说明探针dna成功修饰在石墨烯量子点表面。
实施例5一种用于检测muc1粘蛋白的荧光适配体传感器的可行性分析
当表面修饰有互补序列dna的石墨烯量子点共混后,86.1%的荧光被猝灭;加入muc1后仅有28.34%的荧光恢复,而exoⅰ的加入,可以使荧光强度恢复到初始荧光强度的91.57%。结果见附图6。
从图6中可以看出,石墨烯量子点聚集之前均具有较高的荧光强度(6-a,6-b),通过dna杂交使石墨烯量子点聚集后荧光被猝灭(6-c),muc1粘蛋白的加入使聚集的石墨烯量子点发生解聚,荧光得到恢复(6-d),而核酸外切酶ⅰ的加入使muc1粘蛋白得到了循环利用,从而大大增强了检测信号(6-e)。
实施例6实验条件优化
本发明分别对实验中石墨烯量子点荧光猝灭和恢复时间以及exoⅰ浓度进行了优化,在等体积的gqds-aptamer溶液和gqds-cdna溶液混合均匀后,设计了孵育时间分别为10min、20min、30min、40min、50min、60min、70min后检测反应液荧光强度;通过实验结果分析本发明选择最优实验条件:荧光猝灭时间为60min;在无exoⅰ情况下荧光恢复时间为80min;有exoⅰ时,荧光恢复时间为60min,结果见附图7。设计了exoⅰ浓度分别为0u,10u,20u,30u,40u,50u,通过实验结果分析,本发明选择exoⅰ最佳浓度为30u。
从图7可以看出,将两组表面修饰不同探针dna的石墨烯量子点共混60min后,体系荧光强度被最大程度猝灭(7-a),在exoⅰ不存在的情况下,加入muc1粘蛋白后体系荧光恢复时间为80min(7-b),而exoⅰ的存在使得同样得muc1粘蛋白浓度下体系荧光恢复时间缩短为60min。
实施例7无exoⅰ情况下muc1粘蛋白检测实验.具体实验步骤如下:
a:取200μl的gqds-aptamer溶液和等体积的gqds-cdna溶液,在室温下混合均匀,孵育1h,使石墨烯量子点发生聚集,体系荧光信号猝灭;
b:将一批不同浓度的muc1(浓度分别为0nm,1nm,3nm,5nm,10nm,20nm,40nm,60nm,80nm和100nm)分别加入上述猝灭溶液中,再加入pbs,得到总体积为500μl,孵育1h后进行荧光测定。根据不同muc1粘蛋白浓度和荧光强度对应关系绘制曲线,检测范围0-100nm,线性范围0-40nm,关系式为y=28.25cmuc1(nm)+351.28,检测限为0.339nm。结果见附图8和附图9。
从图8中可以看出,同样条件下,0-100nm范围内,随着待测物中muc1粘蛋白浓度的增加,体系的荧光强度递增。
从图9中可以看出,随着待测物中muc1粘蛋白浓度的增加,体系荧光强度递增,当浓度超过100nm后荧光增幅降低,所以检测范围为0-100nm;从插图中可以看出,0-40nm范围内,对muc1粘蛋白的检测,荧光强度随着muc1粘蛋白浓度的增加具有很好的线性关系,所以检测线性范围为0-40nm。
实施例8有exoⅰ情况下muc1粘蛋白检测实验
具体实验步骤如下:
a:取200μl的gqds-aptamer溶液和等体积的gqds-cdna溶液,在室温下混合均匀,孵育1h,使石墨烯量子点发生聚集,体系荧光信号猝灭;
b:将一批不同浓度的muc1(浓度分别为0nm,0.01nm,0.05nm,0.1nm,0.3nm,0.5nm,1nm,2nm,3nm,5nm,10nm和20nm)和一定浓度的exoⅰ(30u)分别加入上述猝灭溶液中,再加入pbs,得到总体积为500μl,孵育1h后进行荧光测定。根据不同muc1粘蛋白浓度和荧光强度对应关系绘制曲线,结果见附图10和附图11。检测范围0-10nm,线性范围0-1nm,关系式为y=841.43cmuc1(nm)+358.43,检测限为7.8pm,比无酶存在条件下提高了43倍。
从图10中可以看出,同样条件下,0-20nm范围内,随着待测物中muc1粘蛋白浓度的增加,体系的荧光强度递增。
从图11中可以看出,随着待测物中muc1粘蛋白浓度的增加,体系荧光强度递增,当浓度超过20nm后荧光基本上达到最大值,所以检测范围为0-20nm;从插图中可以看出,0-1nm范围内,对muc1粘蛋白的检测,荧光强度随着muc1粘蛋白浓度的增加具有很好的线性关系,所以检测线性范围为0-1nm。
实施例9特异性实验
在猝灭溶液中,加入50nm的muc1粘蛋白以及相同浓度的肌红蛋白(myo),牛血清白蛋白(bsa)和癌胚抗原(cea),在设定条件下检测反应溶液中荧光强度。其结果如图4,可以看出本发明特异性很好。
5.实际人类血清的加标回收
新鲜人血液样本由解放军总医院提供,并进行必要的处理以获得血清样本。首先,加入乙腈(乙腈与血液的体积比为1.5:1)分离新鲜人血样品,并在室温下以10000rpm离心5min以去除大分子和蛋白质。然后,所有上清血清样品用pbs进行100倍稀释,并在分析前调整至ph=7.4。将不同浓度的muc1加入人血清样品中,得到标准样品,随后的荧光检测操作与上述程序类似。测得的荧光强度,根据公式y=841.43cmuc1(nm)+358.43,计算得出muc1粘蛋白的浓度并与实际加入浓度进行对比分析,结果如表1所示,从表中可以看出,该传感器的回收率处于91.1%-107.8%的合理范围内,表明该方法在实际样品操作中具有很好的准确度和可操作性。
表1荧光传感器在实际人类血清中的加标回收实验
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!