唾液酸化糖链的血清鉴定试剂在制备用于诊断肝脏疾病的试剂中的用途
1.本发明涉及肿瘤分子诊断技术领域,涉及唾液酸化糖链的血清鉴定试剂在制备用于诊断肝脏疾病的试剂中的用途,尤其涉及一组与血清n糖末端唾液酸相关的糖链作为乙肝相关肝癌、非乙肝相关肝癌及肝硬化的潜在标志物及其检测方法。
背景技术:
2.乙型肝炎病毒(hbv)是世界上最常见的慢性感染之一,估计有2.57亿慢性感染者,是世界范围内导致肝癌的主要原因。hbv感染可长期刺激肝脏细胞并形成慢性炎症,这种慢性炎症的状态可以潜移默化的促进肝脏纤维化,促进早期肝细胞癌的发生,进而推动肿瘤的发展、侵袭和转移。
3.在世界范围内,肝癌是导致男性癌症相关死亡的第二大原因,每年有74.5万人死亡,是第六大常见癌症,发病率不断上升(每年约有80万新病例)。根据肝癌发病的相关原因,可将肝癌分为乙肝相关肝癌和非乙肝相关肝癌,评判标准为肝癌患者体内是否存在有乙型肝炎病毒感染。肝癌在早期无特殊症状出现,因此极难被及时发现,通常患者出现肝癌相关症状在中晚期,而中晚期肿瘤具有很强的侵袭和迁移能力,不利于治疗。肝癌的预后和病情的分期关系密切,分期越早,患者的预后越好,生存期越长。对于早期的肝癌,给予根治性手术切除,患者的5年生存率可以达到50%~60%左右。对于中期不能手术切除的肝癌患者,可以选择介入、消融、放化疗以及靶向治疗,5年生存率仅有20%左右。如果肝癌发展到晚期,出现全身的扩散,生存期非常短,大约6个月。因此急需寻找新的肝癌肿瘤标志物用于早期诊断肝癌,提高肝癌患者的总体生存率。
4.蛋白质糖基化修饰是最重要的蛋白质翻译后修饰之一,蛋白质功能的实现多与糖基化修饰密切相关。糖基化对于蛋白质的折叠、运输、定位起着重要作用,并参与受体激活、信号转导等诸多重要的生物进程。研究表明,糖基化修饰改变是肿瘤发生发展的共同特征。特征寡糖结构与特征寡糖连接的糖蛋白和糖脂已经成为重要的肿瘤标志物。目前临床许多肿瘤血清诊断生物标志物如ca19
‑
9(消化道肿瘤)、ca242、ca72
‑
4和cea(胃癌、结直肠癌)、afp(肝癌)、ca15
‑
3和cea(乳腺癌)、ca12
‑
5和ca72
‑
4(卵巢癌)、scc和cea(宫颈癌)等均为肿瘤发生后机体分泌的糖链或糖蛋白产物。而且,越来越多的研究人员关注将多糖作为疾病标记物这一研究前沿,基于质谱的对人血清的多糖鉴定已经发现了多个有潜力的癌症生物标记物。唾液酸是n
‑
糖基化修饰的重要组成部分,唾液酸作为复合糖的组成部分镶嵌于所有细胞表面以及大多数脊椎动物糖蛋白和糖脂分子的末端最外侧,通过α2,3
‑
和α2,6
‑
键作为封端残基。研究表明,特征连接唾液酸表达的显著上调或下调变化与恶性肿瘤的发生、发展、侵袭、转移和预后不良等相关,有的作为肿瘤标志物或预后标志物,也可能成为肿瘤免疫治疗的靶点。
5.因此,寻找唾液酸相关的肝癌肿瘤标志物,使其能将乙肝相关肝癌、非乙肝相关肝癌、肝硬化和健康人区分便尤为重要。
技术实现要素:
6.本发明所要解决的技术问题是克服现有技术的不足和缺陷,提供唾液酸化糖链的血清鉴定试剂在制备用于诊断肝脏疾病的试剂中的用途,具体为一组肝癌肿瘤相关的肿瘤标志物,为肝癌肿瘤的早期诊断提供新的方法。
7.为了解决上述问题,本发明提出以下技术方案:
8.唾液酸化糖链的血清鉴定试剂在制备用于诊断肝脏疾病的试剂中的用途,其中,所述的唾液酸化糖链选自:
9.α2,6唾液酸化糖链hex5hexnac3neuac1;
10.α2,6唾液酸化糖链hex4hexnac4neuac1dhex2与α2,3唾液酸化糖链hex4hexnac4neuac1dhex2;以及
11.α2,3唾液酸化糖链hex4hexnac5neuac1dhex1中的一种或其任意组合;
12.所述的诊断肝脏疾病选自肝癌诊断、区分乙肝相关肝癌及非乙肝相关肝癌、以及肝硬化诊断。
13.在一个具体的实施方案中,所述的血清经固相唾液酸衍生化方法处理。
14.在一个具体的实施方案中,所述的血清为来自哺乳动物的血清;优选地,所述的哺乳动物为人。
15.在一个具体的实施方案中,所述的鉴定试剂为质谱鉴定试剂。
16.在一个更具体的实施方案中,通过将健康人、肝硬化患者、乙肝相关肝癌和非乙肝相关肝癌患者血清中n
‑
糖末端的唾液酸按照唾液酸连接的不同方式区分,区分方式为不同连接方式对应不同的衍生化途径,使不同连接方式的唾液酸分子质量不同。利用基质辅助激光解吸电离
‑
飞行时间质谱(maldi
‑
tof)进行血清全n
‑
糖分析,获得与唾液酸相关的肝硬化标志物和肝癌肿瘤标志物。
17.在一个具体的实施方案中,通过比对不同类型血清样本中同一唾液酸化糖链相对强度或组合相关若干糖链相对强度组成某一计算方式,使相对强度或相对强度组合在不同类型血清样本中存在显著性差异,其中在肝癌组和非肝癌组对比中显示出显著性差异的是maldi
‑
tof数据中2226峰所指代α2,6糖链hex5hexnac3neuac1,在乙肝相关肝癌组和非乙肝相关肝癌组对比中显示出显著性差异的是maldi
‑
tof数据中2614峰(α2,6)和2586峰(α2,3)所代指糖链hex4hexnac4neuac1dhex2的强度比值,在肝硬化组和健康人组中对比显示出显著性差异的是maldi
‑
tof数据中2661峰所指代α2,3糖链hex4hexnac5neuac1dhex1。
18.进一步地,相对于健康人对照及肝硬化患者,在肝癌患者血清中,α2,6唾液酸化糖链hex5hexnac3neuac1的表达量升高。
19.进一步地,相对于非乙肝相关肝癌患者,在乙肝相关肝癌患者血清中,α2,6唾液酸化糖链hex4hexnac4neuac1dhex2与α2,3唾液酸化糖链hex4hexnac4neuac1dhex2的比例升高。
20.进一步地,相对于健康人对照,在肝硬化患者中,α2,3唾液酸化糖链hex4hexnac5neuac1dhex1的表达量升高。
21.另一方面,本发明提供了一种诊断肝脏疾病的诊断试剂,其包含α2,6唾液酸化糖链hex5hexnac3neuac1、α2,6唾液酸化糖链hex4hexnac4neuac1dhex2、α2,3唾液酸化糖链hex4hexnac4neuac1dhex2以及α2,3唾液酸化糖链hex4hexnac5neuac1dhex1的鉴定试剂中
的一种或其任意组合;所述的诊断肝脏疾病选自肝癌诊断、区分乙肝相关肝癌及非乙肝相关肝癌、以及肝硬化诊断。
附图说明
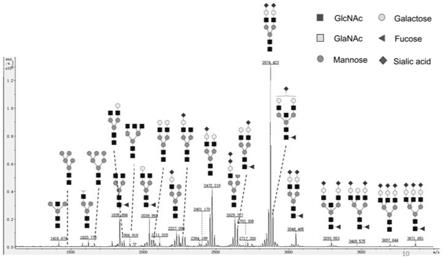
22.图1是血清过甲基化n
‑
聚糖注释maldi
‑
tof质谱图。
23.图2是clinprotools软件中利用qc算法模型计算出的用于肝癌组和非肝癌组分类的质谱峰。
24.图3是2226峰指代糖链hex5hexnac3neuac1作为潜在的肝癌肿瘤标志物在肝癌组和非肝癌组中的表达差异。
25.图4是clinprotools软件中利用qc算法模型计算出的用于乙肝相关肝癌组和非乙肝相关肝癌组分类的质谱峰。
26.图5是2614/2586峰强度比值作为潜在的乙肝相关肝癌肿瘤标志物在乙肝相关肝癌和非乙肝相关肝癌组中的表达差异。
27.图6是clinprotools软件中利用ga算法模型计算出的用于肝硬化组和健康人对照组分类的质谱峰。
28.图7是2661峰指代糖链hex4hexnac5neuac1dhex1作为潜在的肝硬化标志物在肝癌组和非肝癌组中的表达差异。
具体实施方式
29.下述非限制性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何方式限制本发明。下述实施例中,如无特殊说明,所使用的实验方法均为常规方法,所用材料、试剂等均可从化学试剂公司购买。
30.实施例1:利用唾液酸特异性衍生法区分唾液酸不同连接方式并通过maldi
‑
tof质谱分析寻找肝癌肿瘤标志物。
31.获取如表1所示血清样本,来自于上海东方肝胆医院的临床血清样本进行特征唾液酸候选标志物的筛选,所有实验均获得伦理学批准且受试者知情。所有获得的血清样本均由上海东方肝胆医院进行采集并完成病人样本信息备注。
32.表1
33.样本组编号非乙肝相关肝癌1
‑
15乙肝相关肝癌16
‑
30肝硬化患者31
‑
40健康人对照41
‑
50
34.将非乙肝相关肝癌和乙肝相关肝癌(编号1
‑
30)的30例样本血清归为肝癌组,将肝硬化患者和健康人对照(编号31
‑
50)的20例样本血清归为非肝癌组。接下来采用固相唾液酸衍生化方法处理肝癌组和非肝癌组血清,衍生化方法来源于anal.chem.2017,89,2353
‑
2360。
35.具体检测过程如下:
36.1:释放血清中n
‑
聚糖
37.释放血清中n
‑
聚糖采用的是novoprotein关于pngaesf酶试剂盒pe011。
38.(1)pngasef酶试剂盒中所用试剂:蛋白变性缓冲液、10%np
‑
40、pngasef酶反应缓冲液、pngasef酶。
39.(2)取1.5ml ep管,对应编号加入2μl血清,2μl蛋白变性缓冲液,16μl超纯水。100℃金属浴10min。
40.(3)等待冷却后,2000rpm离心20s,向管中加入4μl的pngasef反应缓冲液,4μl的np
‑
40,2μl的pngasef,10μl超纯水。37℃烘箱过夜。
41.2:捕获游离n
‑
聚糖
42.捕获游离n
‑
聚糖采用的是日本住友株式会社blotglyco试剂盒bs
‑
45403z。
43.(1)根据试剂盒要求,取试剂盒内反应管及收集管,将反应管套在收集管内。向收集管内加入50μl blotglyco酰肼珠悬液,2000rpm离心1min,弃收集管中废液。
44.(2)向反应管中加入180μl体积比为2%的乙酸/乙腈,加入步骤1中37℃过夜的样本溶液。
45.(3)保持反应管盖打开,80℃金属浴直至反应管中溶液完全蒸发。
46.(4)向反应管中加入200μl 2m盐酸胍溶液,2000rpm离心1min,弃收集管中废液,重复3次;向反应管中加入200μl超纯水,2000rpm离心1min,弃收集管中废液,重复3次;向反应管中加入200μl体积比为1%的三甲胺/甲醇,2000rpm离心1min,弃收集管中废液,重复3次。将上述离心重复过程定义为洗珠子,之后用洗珠子代替上述过程。
47.3:封闭未连接n
‑
聚糖的酰肼基团
48.(1)向反应管中加入150μl体积比为10%的乙酸酐/甲醇。
49.(2)室温下静置30min,2000rpm离心1min,弃收集管中废液。
50.(3)向反应管中加入200μl 10mm hcl溶液,洗珠子3次;向反应管中加入200μl甲醇溶液,洗珠子3次;向反应管中加入200μl dmso溶液,洗珠子3次。
51.4:第一步酰胺化
52.(1)配制第一步酰胺化反应试剂:将0.09585g的1
‑
(3
‑
(二甲基氨基)丙基)
‑3‑
乙基碳二亚胺盐酸盐、0.067565g的1
‑
羟基苯并三唑一水合物、0.19114g异丙胺盐酸盐,加入1ml的dmso中。
53.(2)向反应管中加入100μl第一步酰胺化反应试剂,将反应管放入震荡加热器中,设置25℃,800rpm,1h。反应后2000rpm离心,弃收集管中废液。
54.(3)向反应管中加入200μl甲醇溶液,洗珠子3次;向反应管中加入200μl1%甲胺水溶液,洗珠子3次;向反应管中加入200μl甲醇溶液,洗珠子3次;向反应管中加入200μl dmso溶液,洗珠子3次。
55.5:第二步酰胺化
56.(1)配制第二步酰胺化反应试剂:将0.260195g的1h
‑
苯并三唑
‑1‑
基氧基三吡咯烷基六氟磷酸盐、0.06752g的甲胺盐酸盐、150μl的n
‑
甲基吗啉,加入850μl的dmso中。
57.(2)向反应管中加入100μl第二步酰胺化反应试剂,将反应管放入震荡加热器中,设置25℃,800rpm,1h。反应后2000rpm离心,弃收集管中废液。
58.(3)向反应管中加入200μl甲醇溶液,洗珠子3次;向反应管中加入200μl超纯水,洗珠子3次。
59.6:n
‑
聚糖收集
60.(1)向反应管中加入180μl体积比为2%的乙酸/乙腈,加入20μl超纯水。
61.(2)保持反应管盖打开,80℃金属浴直至反应管中溶液完全蒸发。
62.(3)将反应管套在新的收集管中,向反应管内加入50μl超纯水,2000rpm离心1min,将收集管中液体转移至8ml玻璃试管中,在温和的氮气流下干燥至收集管中溶液完全干燥。
63.7:全甲基化
64.(1)将约0.5g的氢氧化钠颗粒放入研钵中,然后加入1ml dmso,快速充分研磨至氢氧化钠颗粒成为匀浆状;
65.(2)使用巴斯德玻璃移液器,将少量(200μl
‑
300μl)浆液加到玻璃试管中;
66.(3)加300μl碘甲烷,盖上管盖,在完全避光的环境下室温剧烈混合1h;
67.(4)通过在恒定搅拌下缓慢滴加水来淬灭反应,直至观察到泡腾停止;
68.(5)加入1ml氯仿,加水至5ml,剧烈混合后静置分层,弃上层水层;
69.(6)重复步骤(5)8次;
70.(7)将氯仿层转移至新的1.5ml ep管中,在温和的氮气流下干燥剩余的氯仿层。
71.8:maldi
‑
tof质谱检测
72.用15μl 50%甲醇水溶液复溶样品,基质是20mg/ml dhb
‑
10%meoh(含1mm氯化钠),点靶为0.4μl样品+0.4μl基质,检测模式为正离子反射模式。maldi
‑
tof谱图如图1所示,经过比对,可以找到64种糖链峰,且峰型与其他研究者类似。
73.9:clinprotools分析潜在的生物标志物峰
74.(1)对maldi
‑
tof质谱原始数据进行基本工作流程“峰值统计计算”,此工作流程包括光谱重新校准和平均光谱计算、峰值选取和峰值计算以及峰值统计计算;
75.(2)对经过“峰值统计计算”的数据进行下一基本工作流程“模型生成”,该工作流程包括光谱重新校准和平均光谱计算、峰值计算和基于所选分类算法的模型生成。模型列表中存在的所有模型或选定模型的某些数据可以使用相应的命令显示在模型列表报表或模型报表中。使用“模型生成”菜单中的“新建模型”命令,将模型参数集添加到“模型”列表视图中。为此,选择分类算法qc并开始模型计算。经过qc算法计算后形成qc模型,如图2所示,clinprotools通过分析得出一系列潜在的生物标志物峰。
76.结果如图3所示,对qc模型中提示的质谱峰进行鉴定及分析,发现在肝癌组和非肝癌组中,质谱峰2226,即糖链hex5hexnac3neuac1表达量存在显著性差异,因此确定2226峰可作为区别肝癌组和非肝癌组的标志物,同时可作为潜在的肝癌诊断标志物。
77.实施例2:利用唾液酸特异性衍生法区分唾液酸不同连接方式并通过maldi
‑
tof质谱分析寻找乙肝相关肝癌肿瘤标志物。
78.根据表1,将编号1
‑
15号归为非乙肝相关肝癌组,16
‑
30号归为乙肝相关肝癌组,同样接下来采用固相唾液酸衍生化方法处理肝癌组和非肝癌组血清。
79.检测过程如实施例1
80.clinprotools分析潜在的生物标志物峰,在“模型生成”基本工作流程中,选择分类算法ga并开始模拟计算。经过ga算法计算后形成ga模型,如图4所示,clinprotools通过分析得出一系列潜在的生物标志物峰。
81.结果如图5所示,与实施例1不同,在乙肝相关肝癌和非乙肝相关肝癌组中,单独一
个峰的相对强度无法作为潜在的乙肝相关肝癌标志物,因此从ga模型提示的用于乙肝相关肝癌组与非乙肝相关肝癌组分类的质谱峰中,选取2614峰和2586峰,这两个峰指代同一个糖链即hex4hexnac4neuac1dhex2,由于唾液酸不同连接方式,在maldi
‑
tof质谱中m/z存在差异,因此2614峰与2586峰的比值表示糖链hex4hexnac4neuac1dhex2的α2,6连接唾液酸与α2,3连接唾液酸之比,该比值在乙肝相关肝癌组与非乙肝相关肝癌组中存在显著性差异,同时该比值可作为潜在的乙肝相关肝癌诊断标志物。
82.实施例3:利用唾液酸特异性衍生法区分唾液酸不同连接方式并通过maldi
‑
tof质谱分析寻找肝硬化标志物。
83.根据表1,将编号31
‑
40号归为肝硬化组,41
‑
50号归为健康人对照组,同样接下来采用固相唾液酸衍生化方法处理肝硬化组和健康人对照组血清。
84.检测过程如实施例1
85.clinprotools分析潜在的生物标志物峰,在“模型生成”基本工作流程中,选择分类算法ga并开始模拟计算。经过ga算法计算后形成ga模型,如图6所示,clinprotools通过分析得出一系列潜在的生物标志物峰。
86.结果如图7所示,对ga模型中提示的质谱峰进行鉴定及分析,发现在肝硬化组和健康人对照组中,质谱峰2661,即糖链hex4hexnac5neuac1dhex1表达量存在显著性差异,因此确定2661峰可作为区别肝硬化组和健康人对照组的标志物,同时可作为潜在的肝硬化诊断标志物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1