钠离子电池阴极材料表面残碱含量的检测方法与流程
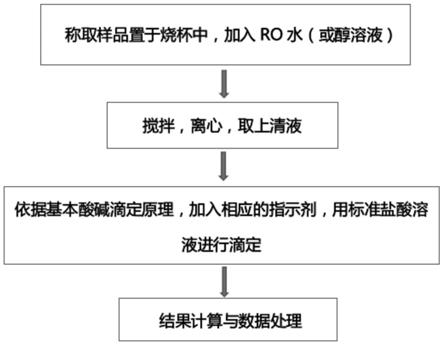
1.本发明涉及钠离子电池阴极材料检验技术领域,尤其涉及钠离子电池阴极材料表面残碱含量的检测方法。
背景技术:
2.钠离子电池材料在生产过程中考虑到钠元素的流失,材料生产过程中往往会加入过量钠盐,导致材料烧结后钠盐残留,主要以碳酸钠和氢氧化钠形式存在,简称残碱。如果钠离子电池阴极材料的碱性过高,在加工过程中会导致材料易吸水受潮,在搅浆过程中黏度增加,容易形成果冻状,导致加工性能变差;另外,碳酸钠在高电压下分解是电池胀气的原因之一,从而带来安全方面的隐患;表面碱性化合物还会形成不可逆的容量损失,同时恶化循环性能,所以必须控制材料的碳酸钠等残碱的含量。而对残碱的检测则是一项基础工作,必不可少。在实际应用中一般采用酸碱化学滴定的方法进行检验,检验的物质主要是碳酸钠和氢氧化钠。
3.由于钠离子电池阴极材料在水中的稳定性差,用传统方法测试将无法完全得到想要的结果。
技术实现要素:
4.本发明的目的在于提供钠离子电池阴极材料表面残碱含量的检测方法,提高对钠离子电池阴极材料表面残碱检测的准确性。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.本发明提供了钠离子电池阴极材料表面残碱含量的检测方法,包括以下步骤:
7.分别配制标定指示剂、标准酸性溶液、滴定指示剂;
8.用工作基准试剂及标定指示剂标定标准酸性溶液后计算标定后的标准酸性溶液的浓度;
9.测量残碱的含量。
10.进一步的,所述标定指示剂是由体积比为2~4:1~2的溴甲酚绿乙醇溶液与甲基红乙醇溶液配制得到。
11.进一步的,所述溴甲酚绿乙醇溶液的浓度为1~2g/l,所述甲基红乙醇溶液的浓度为2~3g/l。
12.进一步的,所述标准酸性溶液为盐酸的标准溶液,所述盐酸的标准溶液是由8~10ml分析纯盐酸定容至1000ml得到的。
13.进一步的,所述工作基准试剂为无水碳酸钠溶液。
14.进一步的,标定标准酸性溶液的步骤为:在无水碳酸钠溶液中加入9~11滴标定指示剂,用标准酸性溶液滴定无水碳酸钠溶液由绿色变为暗红色,煮沸后继续滴定至暗红色,平行三次。
15.进一步的,所述无水碳酸钠溶液的浓度为0.035~0.040mol/l,无水碳酸钠溶液的
体积为46~55ml。
16.进一步的,所述滴定指示剂是由体积比为3~5:4~6:1~2的甲酚红乙醇溶液、甲基红乙醇溶液和亚甲基蓝水溶液配制得到。
17.进一步的,所述甲酚红乙醇溶液的浓度为1~2g/l,甲基红乙醇溶液的浓度为2~3g/l,亚甲基蓝水溶液的浓度为1~2g/l。
18.进一步的,所述残碱为氢氧化钠和/或碳酸钠。
19.进一步的,氢氧化钠含量的测量方法为:取待测液,加入7~10滴滴定指示剂后呈蓝色,用标定后的标准酸性溶液滴定至亮绿色,记录变色点消耗标定后的标准酸性溶液的体积为v1。
20.进一步的,氢氧化钠含量的测量公式为:w
naoh
%=v1×
c
×
m1×
100/(m1×
1000);
21.其中c为标定后的标准酸性溶液的摩尔浓度、m1为氢氧化钠的摩尔质量、m1为浸出液高速离心后对应钠离子电池阴极材料的质量。
22.进一步的,碳酸钠含量的测量方法为:取待测液,加入7~10滴滴定指示剂后呈蓝色,用标定后的标准酸性溶液滴定至绿色记录消耗的体积为v2,继续滴定至暗红色记录消耗的体积为v3。
23.进一步的,碳酸钠含量的测量公式为:w
na2co3
%=(v3‑
v2)
×
c
×
m2×
100/(m2×
1000);
24.其中c为标定后的标准酸性溶液的摩尔浓度、m2为碳酸钠的摩尔质量、m2为浸出液高速离心后对应钠离子电池阴极材料的质量。
25.本发明的有益效果:
26.通过实验本发明所述的检测方法,可以准确检测钠离子电池阴极材料表面残碱的含量,并且操作简单,使用方便。
附图说明
27.图1为根据本发明实施例1所述的钠离子电池阴极材料表面残碱含量的检测方法的流程图;
28.图2为现有技术中用酸碱滴定法检测钠离子电池阴极材料表面残碱含量中消耗盐酸的量及电极电压的关系图。
具体实施方式
29.本发明提供了钠离子电池阴极材料表面残碱含量的检测方法,包括以下步骤:
30.分别配制标定指示剂、标准酸性溶液、滴定指示剂;
31.用工作基准试剂及标定指示剂标定标准酸性溶液后计算标定后的标准酸性溶液的浓度;
32.测量残碱的含量。
33.在本发明中,所述标定指示剂是由体积比为2~4:1~2的溴甲酚绿乙醇溶液与甲基红乙醇溶液配制得到,体积比优选为3:1。
34.在本发明中,所述溴甲酚绿乙醇溶液的配制方法为:称取0.10~0.20g溴甲酚绿溶于95%乙醇溶液中,并用95%乙醇溶液稀释至100ml即得。
35.在本发明中,所述溴甲酚绿乙醇溶液的浓度为1~2g/l,优选为1.5g/l。
36.在本发明中,所述甲基红乙醇溶液的配制方法为:称取0.20~0.30g甲基红溶于95%乙醇溶液中,并用95%乙醇溶液稀释至100ml即得。
37.在本发明中,所述甲基红乙醇溶液的浓度为2~3g/l,优选为2.5g/l。
38.在本发明中,所述标准酸性溶液的h
+
的摩尔浓度为0.020~0.20mol/l,优选为0.050~0.180mol/l;所述标准酸性溶液为盐酸的标准溶液,所述盐酸的标准溶液是由8~10ml分析纯盐酸定容至1000ml得到的,优选为取9ml分析纯盐酸用水定容至1000ml得到。
39.在本发明中,所述工作基准试剂为无水碳酸钠溶液,无水碳酸钠含量为99.95%~100.05%。
40.在本发明中,标定标准酸性溶液的步骤为:在无水碳酸钠溶液中加入9~11滴标定指示剂,用标准酸性溶液滴定无水碳酸钠溶液由绿色变为暗红色,煮沸后继续滴定至暗红色,平行三次,加入的标定指示剂优选为10滴。
41.在本发明中,所述无水碳酸钠溶液的浓度为0.035~0.040mol/l,优选为0.038mol/l;所述无水碳酸钠溶液的体积为46~55ml,优选为50ml。
42.在本发明中,所述滴定指示剂是由体积比为3~5:4~6:1~2的甲酚红乙醇溶液、甲基红乙醇溶液和亚甲基蓝水溶液配制得到,体积比优选为4:5:1。
43.在本发明中,所述甲酚红乙醇溶液的配制方法为:称取0.10~0.20g甲酚红溶于95%乙醇溶液中,并用95%乙醇溶液稀释至100ml即得。
44.在本发明中,所述甲酚红乙醇溶液的浓度为1~2g/l,优选为1.5g/l。
45.在本发明中,所述甲基红乙醇溶液的配制方法为:称取0.20~0.30g甲基红溶于95%乙醇溶液中,并用95%乙醇溶液稀释至100ml即得。
46.在本发明中,所述甲基红乙醇溶液的浓度为2~3g/l,优选为2.5g/l。
47.在本发明中,所述亚甲基蓝水溶液的浓度为1~2g/l,优选为1.5g/l。
48.在本发明中,所述残碱优选为氢氧化钠和/或碳酸钠。
49.在本发明中,氢氧化钠含量的测量方法为:取待测液,加入7~10滴滴定指示剂后呈蓝色,用标定后的标准酸性溶液滴定至亮绿色,记录变色点消耗标定后的标准酸性溶液的体积为v1。
50.在本发明中,所述待测液为取10.00g样品混合于90.00g纯水或无水乙醇中,经过离心分离得到的上清液,所述纯水优选为蒸馏水、ro水或up水中的一种。
51.在本发明中,所述取待测液的量为10~20g,优选为15g。
52.在本发明中,氢氧化钠含量的测量公式为:w
naoh
%=v1×
c
×
m1×
100/(m1×
1000);
53.其中c为标定后的标准酸性溶液的摩尔浓度、m1为氢氧化钠的摩尔质量、m1为浸出液高速离心后对应钠离子电池阴极材料的质量。
54.在本发明中,碳酸钠含量的测量方法为:取待测液,加入7~10滴滴定指示剂后呈蓝色,用标定后的标准酸性溶液滴定至绿色记录消耗的体积为v2,继续滴定至暗红色记录消耗的体积为v3。
55.在本发明中,碳酸钠含量的测量公式为:w
na2co3
%=(v3‑
v2)
×
c
×
m2×
100/(m2×
1000);
56.其中c为标定后的标准酸性溶液的摩尔浓度、m2为碳酸钠的摩尔质量、m2为浸出液
高速离心后对应钠离子电池阴极材料的质量。
57.在本发明中,所述标定后的标准酸性溶液的摩尔浓度c的计算公式为:c=m
×
1000/(v
×
m);
58.其中,m为无水碳酸钠的质量,v为消耗的标准酸性溶液的体积,m为无水碳酸钠的摩尔质量。
59.上述公式的应用过程中需要调整单位的一致性,w的单位为%,v1、v2和v3的单位为ml,c的浓度单位为mol/l,m1、m2的单位为g/mol,m1、m2的单位为g。
60.下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
61.实施例1
62.钠离子电池阴极材料表面残碱
‑
氢氧化钠含量的检测:
63.s1:取10.00g样品置于250ml烧杯中,加入无水乙醇溶剂90.00g,加入型号为b528的聚四氟乙烯磁子,室温搅拌10min,转速为500r/min;将上述溶液倒入50ml的离心管中,高速离心,8000r/min,离心5min,取其上清液,得到待测液备用。
64.s2:标准酸性溶液的配制:用量筒量取9ml分析纯盐酸,用水定容到1000ml的容量瓶中,摇匀。
65.s3:标定指示剂的配制:1g/l的溴甲酚绿乙醇溶液(95%)和2g/l的甲基红乙醇溶液(95%),按3:1体积比混合配制,摇匀。
66.s4:标准酸性溶液的标定:称取0.2g于280℃灼烧至恒重的无水碳酸钠,溶于50ml纯水中,加10滴标定指示剂,用配好的盐酸标准溶液进行滴定,无水碳酸钠溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再次呈现暗红色,平行三次;
67.s4.1:计算标定后的标准酸性溶液的浓度:c=m
×
1000/(v
×
m),其中,m为无水碳酸钠的质量,v为消耗的标准酸性溶液的体积,m为无水碳酸钠的摩尔质量。
68.s5:滴定指示剂的配制:1g/l的甲酚红乙醇溶液(95%)、1g/l的甲基红乙醇溶液(95%)和2g/l的亚甲基蓝水溶液按4:5:1体积比混合配制,摇匀。
69.s6计算氢氧化钠的含量:取待测液10g,加入9滴滴定指示剂后呈蓝色,用标定后的标准酸性溶液滴定至亮绿色,记录变色点消耗标定后的标准酸性溶液的体积为v1,带入计算公式:
70.w
naoh
%=v1×
c
×
m1×
100/(m1×
1000),其中,c为标定后的标准酸性溶液的摩尔浓度、m1为氢氧化钠的摩尔质量、m1为浸出液高速离心后对应钠离子电池阴极材料的质量。
71.钠离子电池阴极材料的浸出处理也会在一定程度上影响最终结果,在实践过程中发现随着搅拌时间的加长,总碱含量呈上升趋势,下表在不同搅拌时间下测得的残碱含量。
72.测量结果如下:
[0073][0074]
由以上结果可知,搅拌时间从5min
‑
10min
‑
20min,随着搅拌时间的延长,r1(naoh)含量逐渐增大,但变化不是特别明显,表明材料表面残留的碱已经全部溶于溶剂中;综合考
虑检测效率和保证材料表面碱性物质的溶解完全,最终选择测量结果的峰值作为最后的检测值。
[0075]
实施例2
[0076]
钠离子电池阴极材料表面残碱
‑
碳酸钠含量的检测:
[0077]
s1:取10.00g样品置于250ml烧杯中,加入蒸馏水90.00g,加入型号为b528的聚四氟乙烯磁子,室温搅拌10min,转速为500r/min;将上述溶液倒入50ml的离心管中,高速离心,8000r/min,离心5min,取其上清液,得到待测液备用。
[0078]
s2
‑
s5步骤与实施例1中相应步骤相同。
[0079]
s6:计算碳酸钠的含量:取待测液10g,加入10滴滴定指示剂后呈蓝色,用标定后的标准酸性溶液滴定至绿色记录消耗的体积为v2,继续滴定至暗红色记录消耗的体积为v3。
[0080]
代入计算公式:w
na2co3
%=(v3‑
v2)
×
c
×
m2×
100/(m2×
1000);
[0081]
其中c为标定后的标准酸性溶液的摩尔浓度、m2为碳酸钠的摩尔质量、m2为浸出液高速离心后对应钠离子电池阴极材料的质量。
[0082]
测量结果如下:
[0083][0084]
由上表可以看出,搅拌时间从1min
‑
3min
‑
5min
‑
10min
‑
20min,随着搅拌时间的延长r2(na2co3)逐渐增大,但5min后变化不是特别明显,表明材料表面残留的碱已经全部溶于溶剂中。综合考虑检测效率和保证材料表面碱性物质的溶解完全,最终选择测量结果的峰值作为最后的检测值。
[0085]
对比例1
[0086]
通过现有的锂电池正极材料表面残碱含量的检测方法对钠离子电池阴极材料表面残碱含量进行测定,采用水作为溶剂时,由于材料晶格中的钠会和水中的氢离子发生互换,生成氢氧化钠,用盐酸进行酸碱滴定,实验时消耗了大量的盐酸,仍然没有达到等当点,此时的计算值已经超过20%,如图2所示,其结果严重失真,因此按照锂电的方法无法获得钠离子电池阴极材料表面残碱的含量。
[0087]
验证例
[0088]
用氢氧化钠标准溶液和碳酸钠工作基准试剂配制已知浓度的混合溶液,按照实施例1和实施例2的方法检测其溶液中氢氧化钠和碳酸钠的含量。计算结果如下表所示:
[0089]
[0090][0091]
通过以上数据可知测得氢氧化钠和碳酸钠含量接近理论值,且结果在允许误差范围内。因此本检测方法的测量准确度高。
[0092]
由以上实施例可知,本发明提供了精确计算钠离子电池阴极材料表面残碱含量的检测方法,通过本申请所述的检测方法,可以精确检测钠离子电池阴极材料表面残碱的含量,该方法操作简单,使用方便。
[0093]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1