一种区分高良姜素及其同分异构体黄芩素的方法
1.本发明涉及一种区分方法,具体地说是一种四氮杂十四环二烯镍配合物[nil](clo4)2催化的非线性化学体系对高良姜素与黄芩素的区分方法,属于定性分析化学领域。
背景技术:
[0002]
高良姜素及其同分异构体黄芩素均是天然黄酮类化合物。此类天然黄酮类化合物的抗氧化作用已被广泛应用于延缓衰老、治疗心脑血管疾病中。高良姜素是一种从高良姜的根茎中提取的天然黄酮化合物,是高良姜中重要的药用成分。天然植物高良姜作为中药,收版于历版《中国药典》,其味辛、性热、能温胃散寒、理气止痛,常用于脘腹冷痛、胃寒呕吐,改善微循环等。文献报道,高良姜具有抗氧化、抗血栓等作用。体外肿瘤细胞模拟实验证明其对多种肿瘤细胞增值具有抑制作用。黄芩素主要存在于黄芩中,具有降低血管阻力,改善脑血循环、增加脑血流量及抗血小板凝集的作用。临床用于脑血管病后瘫痪的治疗。由于高良姜素及其同分异构体黄芩素分子式相同、结构相近,因此使得他们的一些物理和化学性质也相似,且两者的外观也极为相似,导致两者难以区分,给其定性分析也带来了困难。其结构如式(ι)所示。目前已经报道的定量检测高良姜素及其同分异构体黄芩素的方法主要有薄层色谱法、气相色谱法、分光光度法、高效液相色谱法。但区分二者的区分方法还未被报道出来,因此寻找一种区分效果好且操作简便快速、结果容易判断的定性分析方法就显得十分必要。
[0003]
ꢀꢀꢀ
(ι)高良姜素
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
黄芩素结构式 1 高良姜素和黄芩素的结构。
技术实现要素:
[0004]
本发明旨在为高良姜素及其同分异构体黄芩素提供一种新颖且方便快捷的区分方法,即应用[nil](clo4)2催化的非线性化学振荡体系对高良姜素及其同分异构体黄芩素的区分方法,本区分方法是基于该配合物催化的非线性化学振荡体系对高良姜素及其同分异构体黄芩素的敏锐响应而开发的一种电化学振荡体系法。具体地说,是将相同浓度待区分样品(高良姜素与黄芩素的溶液)分别加入到两组振荡体系中,根据待区分样品对振荡体系的振荡图谱峰形影响不同,实现对待区分样品的定性分析:若加入待区分溶液后,出现抑制现象,并且在抑制期内电位持续增大,则所加入的待区分样品溶液为高良姜素;若加入待区分溶液后,出现抑制现象,并且在抑制期内电位增大过程不持续,中间形成一个电位不变的“平台”或者形成一个由于电位略微下降后再上升而造成的“凹台”,则所加入的待区分样
1966, p. 534.2.gang hu, panpan chen, wei wang, lin hu, jimei song, lingguang qiu, juan song, e1ectrochimica acta, 2007, vol. 52, pp. 7996
‑
8002.3. lin hu, gang hu, han
‑
hong xu, j. ana1. chem. , 2006, vol. 61, no. 10, pp. 1021
‑
1025.4.胡刚, 中国科学技术大学博士论文, p25
‑
27,合肥,2005年。
[0011]
2) 由l
·
2hclo4制备[nil](clo4)2:将11g ni(ac)24h2o与21g的l
·
2hclo4置于500ml三颈瓶中,使其溶于250ml甲醇,热水浴加热回流3小时,最后出现黄色沉淀,过滤、将滤液在热水浴中浓缩至原体积l/2,放置过夜,充分结晶,得到黄色晶体。将黄色晶体转移至布氏漏斗并用甲醇洗涤,在热的乙醇
‑
水溶液中重结晶,真空干燥,可得8g[nil](clo4)2亮黄色晶体。
[0012]
参考文献:1. n. f. curtis, j. chem. soc. dolton tran. , 1972, vol. 13, 1357.2. 胡刚, 中国科学技术大学博士论文, p42
‑
43, 合肥, 2005年。
[0013]
本区分方法与现有技术的区别在于,本发明应用“h2so
4 ‑
kio3‑
[nil](clo4)2‑
丙二酸
‑
h2o
2”非线性化学振荡体系作为区分溶液,以高良姜素及其同分异构体黄芩素对该区分溶液的振荡图谱峰形影响不同,实现对高良姜素及其同分异构体黄芩素区分。
[0014]
高良姜素及其同分异构体黄芩素,在区分溶液(非线性振荡体系)中的可检测的浓度范围为1.0
×
10
‑5‑
2.75
×
10
‑5mol/l。
[0015]
上述待区分溶液可区分的浓度范围是经实验确定的最优浓度范围。在该浓度范围内,高良姜素及其同分异构体黄芩素的样品溶液对该区分溶液产生的影响差异十分明显,易于观察分析,容易实现区分。另外,区分溶液(振荡体系)中各组分的浓度范围如表1所示,经过多次实验得到的区分溶液(振荡体系)的最佳溶液如表2所示:表1:振荡体系中各组分的浓度范围
硫酸(mol/l) kio3(mol/l)[nil](clo4)2(mol/l)丙二酸(mol/l)h2o2(mol/l)0.0074375
‑
0.0074650.02812
‑
0.02825 0.002
‑
0.0030.13175
‑
0.1318751.5369
‑
1.5375
表2:振荡体系中各组分的最佳浓度
硫酸(mol/l)kio3(mol/l)[nil](clo4)2(mol/)丙二酸(mol/l)h2o2(mol/l)0.00743750.0281250.0027 0.131751.5375
具体实验步骤如下:参比电极(甘汞电极)和工作电极(pt电极)插入区分溶液(振荡体系)中,它们通过放大器(instrument amplifier)连接到数据采集器,再连接至电脑,打开电脑中logger lite程序对采集时间和取样速度进行设置后,迅速点击开始键从而对溶液进行电位监测,得到所采集的e
‑
t曲线(电位值随时间变化的曲线)即化学电位振荡图谱(此时尚未加入待测试样),以作空白对照。向两组与空白对照实验中的各组分浓度相同的区分溶液中,在振荡产生的任意一个稳定的电位最低点处,分别迅速加入待区分样品的溶液,根据待区分样品对振荡体系的振荡图谱峰形的影响不同,实现对待区分样品的定性分析。即:在向振荡体系中加入待区分样品的溶液后,根据待区分样品溶液在抑制期内电位是否持续增大,实现对待区分样品的定性分析。
[0016]
化学电位振荡图谱的基本参数包括:振荡振幅:在振荡过程中从一个最低电位到下一个最高电位之间的电位差值。
[0017]
振荡周期:在振荡过程中从一个最低(高)电位到下一个最低(高)电位所需时间。
[0018]
最高电位:稳定振荡时体系出现的电位最高点。
[0019]
最低电位:稳定振荡时体系出现的电位最低点。
[0020]
抑制期 (t
in
):从加入待测液振荡受到抑制开始,到振荡重新恢复所需时间。
附图说明
[0021]
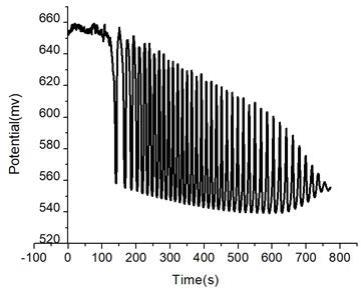
图1是实施例1中,未加入待区分样品时,区分溶液(振荡体系)的振荡图谱。
[0022]
图2是实施例1中,加入 1.0
×
10
‑5mol/l高良姜素溶液后,振荡体系所获得的振荡响应图谱。
[0023]
图3是实施例1中,加入 1.0
×
10
‑5mol/l黄芩素溶液后,振荡体系所获得的振荡响应图谱。
[0024]
图4是实施例2中,未加入待区分样品时,区分溶液(振荡体系)的振荡图谱。
[0025]
图5是实施例2中,加入 2.0
×
10
‑
5 mol/l 高良姜素溶液后,区分溶液(振荡体系)的振荡图谱。
[0026]
图6是实施例2中,加入 2.0
×
10
‑
5 mol/l黄芩素溶液后,区分溶液(振荡体系)的振荡图谱。
[0027]
图7是实施3中,未加入待区分样品时,区分溶液(振荡体系)的振荡图谱。
[0028]
图8是实施例3中,加入2.75
×
10
‑5mol/l 高良姜素溶液后,区分溶液(振荡体系)的振荡图谱。
[0029]
图9是实施例3中,加入 2.75
×
10
‑5mol/l黄芩素溶液后,区分溶液(振荡体系)的振荡图谱。
具体实施方式
[0030]
实施例1:本实施例按如下步骤验证本发明高良姜素及其同分异构体黄芩素的区分方法的可行性:(1) 配制溶液首先用98%的浓硫酸和蒸馏水配制0.025mol/l的硫酸作为储备液,然后用0.025mol/l的硫酸溶液分别配制0.15mol/l的碘酸钾溶液、0.03mol/l的[nil](clo4)2溶液、1.70mol/l的丙二酸溶液、4.5mol/l的过氧化氢溶液。向50ml小烧杯中依次加入11.9ml 0.025mol/l硫酸溶液、7.5ml 0.15mol/l碘酸钾溶液、3.6ml 0.03mol/l [nil](clo4)2溶液、3.1ml 1.70mol/l丙二酸溶液和13.9ml 4.5mol/l过氧化氢溶液,以保证“h2so
4 ‑ꢀ
kio
3 ‑ꢀ
[nil](clo4)
2 ‑
丙二酸
ꢀ‑ꢀ
h2o
2”非线性化学振荡体系中各组分的浓度为硫酸0.0074375mol/l、碘酸钾0.028125mol/l、[nil](clo4)
2 0.0027mol/l、丙二酸0.13175mol/l、过氧化氢1.5375mol/l;同时以蒸馏水作溶剂,分别配制0.01mol/l 高良姜素、黄芩素的溶液。
[0031]
(2) 振荡图谱
振荡体系的振荡图谱由装有logger lite程序的计算机记录,图1是在典型浓度下(硫酸0.0074375mol/l、碘酸钾0.028125mol/l、[nil](clo4)
2 0.0027mol/l、丙二酸0.13175mol/l、过氧化氢1.5375mol/l),上述区分溶液未加入待测试样的振荡图谱,以作空白对照。向两组各组分浓度与上述浓度相同的区分溶液中,分别加入40
µ
l 0.01mol/l的高良姜素及其同分异构体黄芩素的溶液,使得其在区分溶液中的浓度均为1.0
×
10
‑5mol/l,当时间处在第6个电位最低点时,所获得的振荡响应图谱分别如图2、图3所示。
[0032]
(3) 区分异构体由于高良姜素及其同分异构体黄芩素的性质不同,高良姜素及其同分异构体黄芩素对振荡体系的影响不相同。将图2、图3分别与图1相比较可知,高良姜素溶液的加入,出现抑制现象,并且在抑制期内电位持续增大;黄芩素溶液的加入,出现抑制现象,并且在抑制期内电位增大过程不持续,中间形成一个电位不变的“平台”。由上述实验可知,通过比较高良姜素及其同分异构体黄芩素对图谱的影响不同,实现对高良姜素及其同分异构体黄芩素的区分。
[0033]
取事先配制的两个0.01mol/l待区分的高良姜素及其同分异构体黄芩素的溶液(但两者尚未区分),将其分别标记为样品1、样品2;配制两组各组分浓度与上述浓度相同的振荡溶液,分别采集相应的振荡图谱,并在第5个电位最低点处分别加入40
µ
l 0.01mol/l的样品1、样品2,使得它们在区分溶液中的浓度为1.0
×
10
‑5mol/l。
[0034]
分析比较可知:样品1的加入,出现抑制现象,并且在抑制期内电位持续增大(振荡图谱与图2相对应、与图3不对应);样品2的加入,出现抑制现象,并且在抑制期内电位增大过程不持续,中间形成一个电位不变的“平台”(振荡图谱与图3相对应、与图2不对应)。因此,样品1是高良姜素的溶液、样品2是黄芩素的溶液,从而实现了对高良姜素及其同分异构体黄芩素溶液的区分。
[0035]
实施例2:本实施例按如下步骤验证本发明高良姜素及其同分异构体黄芩素的区分方法的可行性: (1) 配制溶液首先用98%的浓硫酸和蒸馏水配制0.025mol/l的硫酸作为储备液,然后用0.025mol/l的硫酸溶液分别配制0.15mol/l的碘酸钾溶液、0.03mol/l的[nil](clo4)2溶液、1.70mol/l的丙二酸溶液、4.5mol/l的过氧化氢溶液。向50ml小烧杯中依次加入11.9ml 0.025mol/l硫酸溶液、7.5ml 0.15mol/l碘酸钾溶液、3.6ml 0.03mol/l [nil](clo4)2溶液、3.1ml 1.70mol/l丙二酸溶液和13.9ml 4.5mol/l过氧化氢溶液,以保证“h2so
4 ‑ꢀ
kio
3 ‑ꢀ
[nil](clo4)
2 ‑
丙二酸
ꢀ‑ꢀ
h2o
2”非线性化学振荡体系中各组分的浓度为硫酸0.0074375mol/l、碘酸钾0.028125mol/l、[nil](clo4)
2 0.0027mol/l、丙二酸0.13175mol/l、过氧化氢1.5375mol/l。
[0036]
同时以蒸馏水作溶剂,分别配制0.01mol/l 高良姜素、黄芩素的溶液。
[0037]
(2) 振荡图谱振荡体系的振荡图谱由装有logger lite程序的计算机记录,图4是在典型浓度下(硫酸0.0074375mol/l、碘酸钾0.028125mol/l、[nil](clo4)
2 0.0027mol/l、丙二酸
0.13175mol/l、过氧化氢1.5375mol/l),上述区分溶液未加入待测试样的振荡图谱,以作空白对照。向两组各组分浓度与上述浓度相同的区分溶液中,分别加入80
µ
l 0.01mol/l的高良姜素及其同分异构体黄芩素的溶液,使得其在区分溶液中的浓度均为2.0
×
10
‑5mol/l,当时间处在第6个电位最低点时,所获得的振荡响应图谱分别如图5、图6所示。
[0038]
(3) 区分异构体由于高良姜素及其同分异构体黄芩素的性质不同,高良姜素及其同分异构体黄芩素对振荡体系的影响不相同。将图5、图6分别与图4相比较可知,高良姜素溶液的加入,出现抑制现象,并且在抑制期内电位持续增大;黄芩素溶液的加入,出现抑制现象,并且在抑制期内电位增大过程不持续,中间形成一个电位不变的“平台”。由上述实验可知,通过比较高良姜素及其同分异构体黄芩素对图谱的影响不同,实现对高良姜素及其同分异构体黄芩素的区分。
[0039]
取事先配制的两个0.01mol/l待区分的高良姜素及其同分异构体黄芩素的溶液(但两者尚未区分),将其分别标记为样品3、样品4;配制两组各组分浓度与上述浓度相同的振荡溶液,分别采集相应的振荡图谱,并在第6个电位最低点处分别加入80
µ
l 0.01mol/l的样品3、样品4,使得它们在区分溶液中的浓度为2.0
×
10
‑5mol/l。
[0040]
分析比较可知:样品3的加入,出现抑制现象,并且在抑制期内电位持续增大(振荡图谱与图5相对应、与图6不对应);样品4的加入,出现抑制现象,并且在抑制期内电位增大过程不持续,中间形成一个电位不变的“平台”(振荡图谱与图6相对应、与图5不对应)。因此,样品3是高良姜素溶液、样品4是黄芩素溶液,从而实现了对高良姜素及其同分异构体黄芩素溶液的区分。
[0041]
实施例3:本实施例按如下步骤验证本发明高良姜素及其同分异构体黄芩素的区分方法的可行性:(1) 配制溶液首先用98%的浓硫酸和蒸馏水配制0.025mol/l的硫酸作为储备液,然后用0.025mol/l的硫酸溶液分别配制0.15mol/l的碘酸钾溶液、0.03mol/l的[nil](clo4)2溶液、1.70mol/l的丙二酸溶液、4.5mol/l的过氧化氢溶液。向50ml小烧杯中依次加入11.9ml 0.025mol/l硫酸溶液、7.5ml 0.15mol/l碘酸钾溶液、3.6ml 0.03mol/l [nil](clo4)2溶液、3.1ml 1.70mol/l丙二酸溶液和13.9ml 4.5mol/l过氧化氢溶液,以保证“h2so
4 ‑ꢀ
kio
3 ‑ꢀ
[nil](clo4)
2 ‑
丙二酸
ꢀ‑ꢀ
h2o
2”非线性化学振荡体系中各组分的浓度为硫酸0.0074375mol/l、碘酸钾0.028125mol/l、[nil](clo4)
2 0.0027mol/l、丙二酸0.13175mol/l、过氧化氢1.5375mol/l。
[0042]
同时以蒸馏水作溶剂,分别配制0.01mol/l 高良姜素、黄芩素的溶液。
[0043]
(2) 振荡图谱振荡体系的振荡图谱由装有logger lite程序的计算机记录,图7是在典型浓度下(硫酸0.0084375mol/l、碘酸钾0.0245mol/l、[nil](clo4)
2 0.000865mol/l、丙二酸0.15mol/l、过氧化氢1.45mol/l),上述区分溶液未加入待测试样的振荡图谱,以作空白对照。向两组各组分浓度与上述浓度相同的区分溶液中,分别加入110
µ
l 0.01mol/l的高良姜
素及其同分异构体黄芩素的溶液,使得其在区分溶液中的浓度均为2.75
×
10
‑5mol/l,当时间处在第6个电位最低点时,所获得的振荡响应图谱分别如图8、图9所示。
[0044]
(3) 区分异构体由于高良姜素及其同分异构体黄芩素的性质不同,高良姜素及其同分异构体黄芩素对振荡体系的影响不相同。将图8、图9分别与图7相比较可知,高良姜素溶液的加入,出现抑制现象,并且在抑制期内电位持续增大;黄芩素溶液的加入,出现抑制现象,并且在抑制期内电位增大过程不持续,中间形成一个由于电位略微下降后再上升而造成的“凹台”。由上述实验可知,通过比较高良姜素及其同分异构体黄芩素对图谱的影响不同,实现对高良姜素及其同分异构体黄芩素
‑
的区分。
[0045]
取事先配制的两个0.01mol/l待区分的高良姜素及其同分异构体黄芩素的溶液(但两者尚未区分),将其分别标记为样品5、样品6;配制两组各组分浓度与上述浓度相同的振荡溶液,分别采集相应的振荡图谱,并在第6个电位最低点处分别加入110
µ
l 0.01mol/l的样品5、样品6,使得它们在区分溶液中的浓度为2.75
×
10
‑5mol/l。
[0046]
分析比较可知:样品5的加入,出现抑制现象,并且在抑制期内电位持续增大(振荡图谱与图8相对应、与图9不对应); 样品6的加入,出现抑制现象,并且在抑制期内电位增大过程不持续,中间形成一个由于电位略微下降后再上升而造成的“凹台”(振荡图谱与图9相对应、与图8不对应)。因此,样品5是高良姜素的溶液、样品6是黄芩素的溶液,从而实现了对高良姜素及其同分异构体黄芩素溶液的区分。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1