一种离子色谱法测定电子级溴化氢中氯离子的方法与流程
1.本发明涉及定量测定电子级溴化氢中痕量氯离子的方法,尤其涉及一种离子色谱法测定电子级溴化氢样品中痕量氯离子含量的方法,属于分析化学领域。
背景技术:
2.电子级溴化氢是半导体领域不可或缺的一种原材料,主要用于8寸及12寸芯片制造工艺中的多晶硅刻蚀,是芯片先进制程的核心气体之一。电子级溴化氢中的杂质容易导致晶片内电路功能的损坏,使得集成电路失效并且影响几何特征的形成,因此对溴化氢中的氯离子的检测是生产过程中的一个必要的环节。电子级溴化氢中氯离子的检测尚无有效的分析方法。传统的氯离子检测方法主要有:一、电位滴定法,以饱和甘汞电极为参比电极,以银电极为指示电极,用硝酸银标准溶液滴定,从而计算出氯离子的含量,该方法测定范围5~150mg/l,适用于较高含量的氯离子检测,且硝酸银与溴化氢同样会产生浅黄色沉淀,消耗硝酸银,方法不适用于溴化氢中氯离子的测定;二、傅里叶变换红外光谱法,需要以已知低浓度的氯化氢标气为准,建立标准谱图,同时搭载mct检测器,需要随时补充液氮,操作较为复杂,且目前市场上未见ppm级的氯化氢标准气体,测试无法保证结果的可靠性。
技术实现要素:
3.本发明的目的是提供一种离子色谱法测定电子级溴化氢中氯离子的方法,该方法操作简单,重复性好,且灵敏度高。
4.为达到上述目的,本发明是通过以下技术方案实现的:一种离子色谱法测定电子级溴化氢中氯离子的方法,包括以下步骤:
5.(1)配制分析cl
‑
标准溶液,得到浓度和峰面积的工作曲线;
6.(2)对溴化氢样品进行预处理,将电子级溴化氢用高纯水吸收,吸收液用碱液调节ph值至4~10,用离子色谱仪进行分析,确定电子级溴化氢中的氯离子含量。
7.进一步的,一种离子色谱法测定电子级溴化氢中氯离子的方法,包括以下步骤:
8.(1)配制cl
‑
标准溶液,进行离子色谱分析,得到不同浓度下的cl
‑
的峰面积,以氯离子的浓度为横坐标,峰面积为纵坐标绘制工作曲线;
9.(2)溴化氢样品预处理:溴化氢采样管上串联三个洗气瓶,第一个为缓冲瓶,第二个和第三个分别为装有100ml高纯水的吸收瓶。取样管线与缓冲瓶及吸收瓶连接前,先用高纯氮气吹扫;控制溴化氢流速为2~4g/min,使溴化氢气源钢瓶重量减少与吸收瓶增重一致,保证溴化氢样品被完全吸收。待两只吸收瓶共增重80~110g时,关闭溴化氢气源,采用高纯氮气吹扫管路10min,记录天平最终增量。吸收完毕,合并得到的溴化氢吸收液;所述溴化氢的吸收量优选为90~100g。
10.(3)加入碱液,调整溴化氢溶液ph值为4~10,移取溶液至容量瓶内,加入高纯水定容,高纯水与混合溶液的体积比优选为100∶1,制得待测溶液。所述碱液优选氢氧化钠、氢氧化钾的水溶液或氨水,更优选氨水;所述氨水质量浓度优选20%~22%,其氨水的加入量为
90~120ml,优选100~110ml;所述ph值优选5~9,更优选为6~8。
11.(4)电子级溴化氢中cl
‑
含量的测定
12.用离子色谱分析仪,对待测溶液进行检测,得到电子级溴化氢中痕量cl
‑
检测的色谱图,同时根据外标法对待测溶液中cl
‑
进行定量,得到电子级溴化氢中cl
‑
的含量。
13.离子色谱分析仪所用的淋洗液为碳酸钠和碳酸氢钠的混合溶液,碳酸钠的浓度优选为1.8mmol/l,碳酸氢钠溶液的浓度优选为1.7mmol/l。
14.离子色谱分析仪的色谱柱为高容量色谱柱,柱箱温度为35℃,进样量为50μl。
15.所述高纯水中氯离子含量小于1ppb,碱液中氯离子含量小于10ppb。
16.本发明的有益效果:
17.本发明的离子色谱法测定电子级溴化氢中痕量氯离子的方法,操作简单,准确度高,重复性好,能有效测定电子级溴化氢中氯离子含量,适用于电子级溴化氢产品的质量控制,满足检测需求。与现有的傅里叶变换红外光谱法分析相比,不需要氯化氢标准气体,提高了氯离子测定的准确度,且测试结果重复性好,能准确测定痕量氯离子含量。
附图说明
18.图1为氯离子标准色谱图。
19.图2为氯离子的浓度和峰面积工作曲线,其中h=
‑
0.0824+0.0140q r=0.9995。
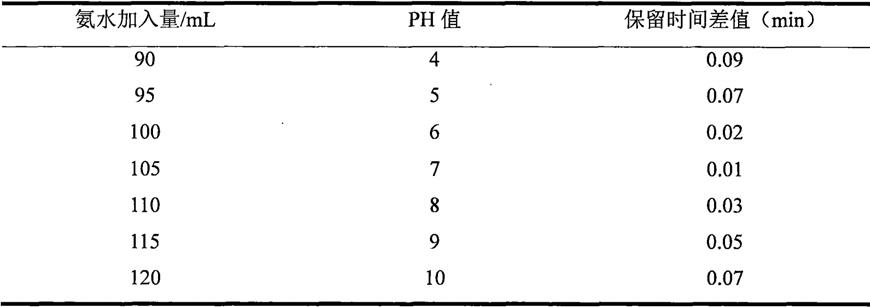
20.图3为电子级溴化氢中氯离子色谱图。
具体实施方式
21.下面结合实施例进一步描述本发明,本发明的优点和特点将会随着描述而更加清楚。但是应理解所述实施例仅是范例,不对本发明的范围构成任何限制。
22.1.仪器和试剂
23.883 basic ic plus离子色谱仪;0.22μm一次性针式过滤器;柱箱温度35℃;99.999%电子级溴化氢;碳酸钠(基准试剂);碳酸氢钠(基准试剂);硫酸(优级纯);氯离子标液(100μg/ml);氨水(电子级);溴化氢流速:1.0ml/min。
24.2.溶液的配制
25.淋洗液:准确称取0.3816g na2co3和0.286g nahco3溶解后,用超纯水准确定容2000ml,经0.45μm滤膜抽滤,震荡抽滤瓶无气泡溢出后超声脱气1min,得到1.8mmol/lna2co3+1.7mmol/lnahco3;
26.标准溶液的配制:量取100μg/ml的标准溶液各5ml、4ml、3ml、2ml、1ml、0.5ml、0.2ml分别置于50ml容量瓶中,并用高纯水定容至刻度,得到10μg/ml、8μg/ml、6μg/ml、4μg/ml、2μg/ml、1μg/ml、0.1μg/ml系列标准溶液。
27.重复性溶液的配制:准确移取0.2ml标准工作溶液,加入49.8ml空白溶液,即可得到加标0.1μg/ml的cl
‑
溶液。
28.3.cl
‑
标准溶液的分析
29.线性关系:对步骤(1)的得到的标准溶液,依次从低浓度到高浓度的顺序进样,得到浓度和峰面积的线性方程,得到cl
‑
的线性方程为h=
‑
0.0824+0.0140q,线性相关系数为0.9995,如图2所示。
30.实施例1
31.1.1进样速度的确定
32.为保证溴化氢被高纯水完全吸收,同时保证吸收效率,通过改变溴化氢的进样速度保证吸收效率及结果准确性。
33.采样管上串联三个洗气瓶,第一个为缓冲瓶,第二个和第三个分别为装有100ml高纯水的吸收瓶。取样管线与缓冲瓶及吸收瓶连接前,先用高纯氮气以10~20l/min的流量吹扫。打开溴化氢钢瓶阀门,调节减压阀,控制溴化氢进样速度分别为2、3、4g/min。待天平增重100g,关闭溴化氢钢瓶阀,采用高纯氮气吹扫管路10min,记录天平增重量,同时记录钢瓶重量。
34.通过实验发现,溴化氢进样速度为2~4g/min时,吸收液增重与钢瓶重量减少量一致,溴化氢完全被高纯水吸收,总吸收时间为25~50min,在1小时内可检测出氯离子含量,保证分析准确性及分析效率。
35.1.2样品吸收量的确定
36.为保证溴化氢被高纯水完全吸收,同时保证吸收效率,通过改变溴化氢的吸收量保证吸收效率及结果准确性。
37.采样管上串联三个洗气瓶,第一个为缓冲瓶,第二个和第三个分别为装有100ml高纯水的吸收瓶。取样管线与缓冲瓶及吸收瓶连接前,先用高纯氮气以10~20l/min的流量吹扫。打开溴化氢钢瓶阀门,调节减压阀,控制溴化氢进样速度为3g/min。待天平增重80、90、110g时,关闭溴化氢钢瓶阀,采用高纯氮气吹扫管路10min,记录天平增重重量,同时记录钢瓶总重及减少量。
38.通过实验发现,当天平增重为80~110g时,吸收液增重和钢瓶重量减少量一致,高纯水可以完全吸收该重量溴化氢。
39.1.3氨水加入量对色谱分析的影响
40.将吸收液合并,取7份同样的样品溶液分别加入90、95、100、105、110、115、120ml 21%(质量分数)的电子级氨水,分别测其ph值为4、5、6、7、8、9和10,移取5ml溶液至250ml容量瓶内,加入高纯水定容,制得待测溶液。对7种不同ph值的待测溶液进行分析,发现ph值为4~10的样品溶液中氯离子的保留时间和标准溶液中氯离子的保留时间均十分接近,氯离子保留时间与标准溶液保留时间的差值见表1。其中ph值=7分析谱图如图3所示。
41.表1氯离子保留时间与标准溶液保留时间的差值表
[0042][0043]
1.4电子级溴化氢中氯离子的测定
[0044]
1.4.1样品的前处理
[0045]
(1)用2只250ml吸收瓶,共吸收电子级溴化氢的质量为101.20g;
[0046]
(2)合并吸收液后,加入105ml氨水反应;
[0047]
(3)精确移取5ml(2)中的样品溶液,置于500ml容量瓶中,用高纯水稀释并定容至刻度,得到待测溶液。
[0048]
1.4.2电子级溴化氢中cl
‑
含量的测定
[0049]
以1.8mmol/l碳酸钠溶液和1.7mmol/l碳酸氢钠溶液为淋洗液,高容量色谱柱,柱箱温度35℃,进样量为50μl的离子色谱条件下,对待测溶液(进行检测,得到电子级溴化氢中痕量cl
‑
检测的色谱图,见附图3,同时根据外标法对待测溶液中cl
‑
进行定量,得到电子级溴化氢中cl
‑
的含量,见表2。在待测溶液中加入0.1μg/ml的cl
‑
标准溶液,进行加标回收率实验,回收率结果见表2。
[0050]
表2电子级溴化氢中cl
‑
含量及加标回收率
[0051]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1